低氧环境下甲状腺乳头状癌细胞中期因子表达的调节机制研究
李吉 张建辉 谢中意 李君强
在中国,甲状腺癌确诊患者每年新增约20%。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的甲状腺癌类型,占所有甲状腺癌病例的75%~85%[1],多发于女性,好发于20~55 岁年龄段。多数PTC进展缓慢,患者预后良好,但仍有少数患者出现淋巴结转移甚至血道传播[2]。某些特定基因如鼠类肉瘤滤过性毒菌致癌同源体B1 V600E 突变[3]、缺氧诱导因子(hypoxia inducible factor,HIF)1-α 的异常激活等,可诱导PTC 发生且导致患者预后恶化[4],因此明确肿瘤相关基因及其作用机制可为PTC 诊疗、预后评估提供有价值的信息。研究发现,HIF1-α 不仅能够诱导ABC转运蛋白等蛋白将化疗药物排出细胞,介导产生耐药性[5],且能够激活CD10、半乳糖凝集素3(galectin-3,gal3)等效应分子,进一步调节PTC 细胞系的增殖和能量代谢途径等[5-6]。低氧环境下肿瘤细胞能够分泌各种细胞因子,其中中期因子(Midkine)可诱发肿瘤微环境中的免疫抑制信号,增强癌细胞的血管生成和增殖活性[7],但具体调节机制仍有待明确。本研究旨在探讨低氧环境下PTC 细胞中CD10、gal3 等蛋白的表达情况和相应的分子生物学意义,阐述其对Midkine 表达的调节机制。
1 材料与方法
1.1 材料
1.1.1 细胞及培养条件 人PTC 细胞系BCPAP 与TPC1 购于国家实验细胞资源共享服务平台,接种至含10%FBS 的DMEM 培养基。正常培养条件为37 ℃、5%氧气(O2)、5%二氧化碳(CO2)。缺氧培养条件为37 ℃、1%O2、5%CO2。
1.1.2 主要试剂 lipofectamine 2000 转染试剂盒(批号:11668030)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:23225)购自美国ThermoFisher公司;HIF1-α、CD10、gal3、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(批号分别为ab179483、ab256494、ab209344 和ab9485)均购自美国abcam 公司;兔抗辣根过氧化物酶、鼠抗辣根过氧化物酶(批号为A0208 和A0216)购自上海碧云天生物技术有限公司;双荧光素报告酶试剂盒(批号:E1910)购自美国Promega 公司;ELISA 检测试剂盒(批号:EH319RB)购自美国invitrogen 公司。HIF1-α小发夹RNA(short hairpin RNA,shRNA)序列为5'-GAAACTCTTCCAAGCAATTTT-3'、CD-10 的编码基因膜金属肽内切酶(membrane metalloendopeptidase endonuclide,MME)shRNA 序列为5'- CTAAGGTCTATCAAGTCAATC-3'、gal3 的编码基因人可溶性半乳糖凝集素3(lectin galactoside binding soluble-3,LGALS3)shRNA 序列为5'-TGCCTCGCATGCTGATAACAA-3',均由美国sigma 公司合成;HIF1-α cDNA、CD10 cDNA、gal3 cDNA、CD10 启动子、gal3 启动子均由华大基因公司合成。二甲基乙二酰氨基乙酸(dimethyloxallyl glycine,DMOG)购自美国selleckchem 公司,批号:S7483。二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国sigma 公司,批号:67-68-5。
1.2 方法
1.2.1 不同培养条件下细胞HIF1-α、CD10 与gal3 蛋白表达的检测 采用Western blot 法。取BCPAP 和TPC1 分为常氧组与缺氧组,常氧组正常培养,缺氧组缺氧培养。两组细胞均培养24 h 后使用RIPA 裂解液冰上裂解30 min,根据BCA 蛋白定量试剂盒方法检测总蛋白;将蛋白转至PVDF 膜上,并使用5% BSA 室温封闭1 h,4 ℃过夜;标记相应的一抗,抗体稀释比例均为1∶1 000;室温孵育30 min 后标记相应的二抗,稀释比例为1∶5 000;使用ECL 发光液检测蛋白灰度值。以GAPDH 为对照,检测细胞中HIF1-α、CD10、gal3 蛋白相对表达量。
1.2.2 DMOG 对缺氧组细胞HIF1-α、CD10 与gal3 表达的影响 取缺氧培养的BCPAP 和TPC1 分为DMOG 组和对照组,DMOG 组加入5 μl/孔1 mmol/L DMOG,对照组每孔使用等体积DMSO,培养24 h。参照1.2.1 采用Western blot 法计算两组细胞HIF1-α、CD10、gal3 蛋白相对表达量。
1.2.3 不同缺氧时间下细胞HIF1-α、CD10 与gal3 蛋白表达的检测 BCPAP 和TPC1 细胞分别在低氧环境下培养0、2、4、6、12 与24 h。取出细胞,参照1.2.1 采用Western blot 法计算各组HIF1-α、CD10、gal3 蛋白相对表达量。
1.2.4 转染HIF1-α shRNA 对CD10 与gal3 蛋白表达的影响 取正常培养的BCPAP 和TPC1,各分为实验组和对照组,实验组转染HIF1-α shRNA,对照组转染HIF1-α shRNA 的乱码序列,培养48 h。参照1.2.1 采用Western blot 法检测各组细胞中HIF1-α、CD10 和gal3 蛋白相对表达量。
1.2.5 HIF1-α 与CD10、gal3 靶向性预测及验证 取正常培养的BCPAP 和TPC1 细胞各分为4 组。MME 沉默实验中,空白组转染不含启动子序列的空载质粒,对照组转染携CD10 启动子质粒,HIF1-α 组共转染携CD10 启动子和HIF1-α cDNA 质粒,实验组共转染携CD10 启动子和CD10 cDNA 质粒。LAGLS3 沉默实验中,空白组转染不含启动子序列的空载质粒,对照组转染携gal3 启动子质粒,HIF1-α 组共转染携gal3启动子和HIF1-α cDNA 质粒,实验组共转染携gal3启动子和gal3 cDNA 质粒。各组细胞均培养48 h。采用双荧光素报告酶法。取各组细胞用PBS 清洗2 次,加入裂解缓冲液常温摇床震荡裂解15 min;依次加入加入荧光素报告酶反应液Ⅱ和stop&glo 液,测定各质粒荧光值,进行HIF1-α 与CD10、gal3 的靶向性验证。
1.2.6 基因相关性分析 使用GEOmetadb 包完成GEO数据库的检索,确定备选数据集为GSE60542(n=92),使用GEOquery 包下载该数据集,经log2 转换进行标准化处理;使用cor.test()函数计算HIF1-α 和MME、LGALS3 之间的Pearson 相关系数,并使用plot()函数绘制散点图。
1.2.7 转染细胞HIF1-α、CD10 和gal3 蛋白表达的检测 取正常培养的BCPAP 和TPC1 各分为4 组,对照组转染空载体,MME 敲低组转染携MME shRNA 质粒,LGALS3 敲低组转染携LGALS3 shRNA 质粒,实验组共转染MME shRNA 和LGALS3 shRNA 质粒,低氧条件下培养48 h。采用Western blot 法检测各组细胞中HIF1-α、CD10 和gal3 蛋白相对表达量。
1.2.8 不同缺氧时间和转染细胞Midkine 表达的检测 采用ELISA 法。BCPAP 和TPC1 细胞分别在低氧环境下培养0、2、4、6、12 与24 h。1.2.7 中各组细胞培养48 h。取细胞上清液500 μl,4℃、6 000 r/min 离心5~10 min ,取上清液。参照ELISA 检测试剂盒说明书方法,使用酶标仪检测450 nm 下的吸光度。根据标准曲线计算上清液Midkine 水平。
1.3 统计学处理 使用R(4.0.5)统计软件。计量资料两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。使用Pearson 相关分析计算基因间的关联性。P<0.05 为差异有统计学意义。
2 结果
2.1 不同培养条件下细胞HIF1-α、CD10 和gal3 蛋白表达的比较 相比常氧组,缺氧组细胞HIF1-α、CD10与gal3 蛋白相对表达量均显著上升,差异均有统计学意义(均P<0.01),见图1A。相比对照组,DMOG 组HIF1-α、CD10 与gal3 蛋白表达水平也显著上升,差异均有统计学意义(均P<0.01),见图1B。
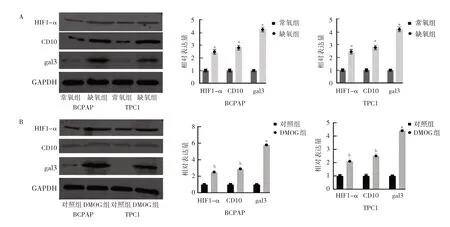
图1 不同培养条件下细胞HIF1-α、CD10 和gal3 蛋白表达的比较(A:缺氧对蛋白表达的影响;B:DMOG 对蛋白表达的影响)
2.2 不同缺氧时间下细胞HIF1-α、CD10 与gal3 蛋白表达的变化 细胞中HIF1-α、CD10 和gal3 蛋白表达总量呈现时间依赖性,均随着低氧诱导时间增加而增加,见图2。

图2 不同缺氧时间下细胞HIF1-α、CD10与gal3蛋白表达总量的变化(A:BCPAP;B:TPC1)
2.3 转染HIF1-α shRNA 细胞CD10 和gal3 蛋白表达的比较 相比对照组,实验组细胞中CD10 和gal3 蛋白相对表达量均显著降低,差异均有统计学意义(均P<0.01),见图3。

图3 转染HIF1-α shRNA 细胞CD10 与gal3 蛋白表达的比较(A:蛋白电泳图;B:CD10、gal3 蛋白表达的比较)
2.4 HIF1-α 与CD10、gal3 的靶向性检测 相比空白组,其他各组荧光素酶相对活性均显著提高(均P<0.01);提示HIF1-α cDNA 可通过直接与CD10 和gal3启动子结合增强两者的转录表达,见图4。

图4 HIF1-α 与CD10、gal3 的靶向性检测(A:BCPAP;B:TPC1)
2.5 HIF1-α 与MME、LGALS3 mRNA 的相关性分析在mRNA 水平上可观察到HIF1-α 与MME 和LGALS3表达的相关系数分别为0.43 和0.58,均呈正相关(均P<0.01),见图5。

图5 基因相关性分析(A:HIF1-α 与LGALS3 mRNA 表达的相关性;B:HIF1-α 与MME mRNA 表达的相关性)
2.6 转染细胞HIF1-α、CD10 和gal3 蛋白表达的比较 相比对照组,MME 敲低组CD10 蛋白相对表达量显著下降,LGALS3 敲低组gal3 蛋白相对表达量显著下降,实验组CD10 和gal3 蛋白相对表达量均显著下降,差异均有统计学意义(均P<0.01),见图6。

图6 转染细胞HIF1-α、CD10 和gal3 蛋白表达的比较(A:BCPAP 蛋白电泳图;B:各组BCPAP 中蛋白表达的比较;C:TPC1 蛋白电泳图;D:各组TPC1 中蛋白表达的比较)
2.7 不同缺氧时间和转染细胞Midkine 表达的比较随缺氧时间延长,细胞中Midkine 表达水平升高,见图7A。低氧培养48 h 后,MME 敲低组、LGALS3 敲低组细胞中Midkine 表达水平相比对照组显著降低,实验组Midkine 表达水平进一步下降,差异均有统计学意义(均P<0.01),见图7B。

图7 不同缺氧时间和转染细胞中Midkine 表达水平的比较(A:不同缺氧时间下细胞Midkine 表达水平;B;不同转染细胞Midkine表达水平)
3 讨论
临床发现绝大多数实体肿瘤呈现缺氧微环境,在实体肿瘤中,缺氧环境主要表现为脉管系统70~150 μm范围内O2由于肿瘤增殖而被快速消耗,因此肿瘤组织中的缺氧与内部异常的血管增生、肿瘤细胞对O2需求的大幅增加高度相关[8]。缺氧带来的影响主要为糖酵解途径的改变,包括HIF1-α、葡萄糖转运蛋白1(glucose transporter-1,GLUT-1)、磷酸葡萄糖异构酶表达、磷酸甘油酸激酶1 等糖酵解途径酶表达的异常,从而诱导肿瘤细胞出现高糖酵解率,在这一过程中HIF1-α发挥着至关重要的作用。HIF1-α 广泛参与PTC 中的多条关键信号通路,如通过诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)促进血管生成[9],通过GLUT-1 介导肿瘤细胞的厌氧代谢[10],通过碳酸酐酶IX(Carbonic anhydrase IX,CA-9)调节细胞内pH[11],通过p21、p27 等蛋白调节细胞周期[12]。近年来,HIF1-α 对细胞外基质的重塑以及对细胞迁移能力的调节日趋成为研究热点,低氧环境下肿瘤细胞能够通过调节特定蛋白如基质金属蛋白酶(matrix metalloproteinase,MMP)-1、MMP-9 的表达[13],或是特定细胞因子如Midkine 的表达来激活免疫抑制信号,阻断免疫微环境中CD8+、M1 巨噬细胞等效应性免疫细胞的浸润,进而诱发“冷肿瘤”的形成,严重削弱抑癌药物作用[14]。因此明确低氧环境下肿瘤细胞的关键效应分子,对寻找肿瘤发生、发展过程的潜在诊疗靶点十分必要。
DMOG 是具有细胞渗透和竞争性的脯氨酰羟化酶抑制剂,可导致HIF1-α 的积聚和稳定,本研究使用缺氧与DMOG 模拟缺氧相结合培养细胞,结果发现BCPAP 与TPC1 细胞系受DMOG 刺激后,gal3、CD10 的表达均显著上升,且对低氧环境呈现时间依赖性。在PTC 患者中,gal3 与Midkine 表达相关,且与患者预后、肿瘤转移密切相关[15]。Midkine 是一种肝素结合生长因子,最初由于在小鼠胚胎发生过程中高度表达而受到关注[16],作为一种在肿瘤中大幅上升的可溶性分泌蛋白,Midkine 不仅可通过肉瘤家族基因(sarcoma family of genes,Src)/有丝分裂原激活蛋白激酶(mitogenactivated protein kinase,MAPK)/ 磷脂肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)通路影响肿瘤细胞的增殖,缺氧状态下,Midkine 还可与HIF1-α 结合介导缺氧状态下的血管生成[17-18]。已有报道表明CD10广泛参与免疫抑制因子如IL-6、IL-8 的分泌[19-20],在大多数恶性肿瘤中CD10 表达上调,且与肿瘤分期呈现正相关[21],肿瘤微环境中的缺氧条件被认为是CD10表达上调的关键原因之一[22]。gal3 是一种结构独特的糖蛋白,广泛参与纤维化、炎症、癌症等多种疾病背景,在细胞表面的免疫突触中结合T 细胞抗原受体,抑制T 细胞的早期激活[23-24],而在细胞内gal3 可通过结合B 细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)结合抑制细胞凋亡[25],但尚无相关研究证实CD10 与Midkine 之间的关联。本研究双荧光素报告酶实验证实HIF1-α 可结合到CD10 与gal3 的启动子上,并直接调节CD10 与gal3 的转录水平,检测CD10、gal3敲低细胞系中Midkine 表达量变化可知,随着CD10、gal3 的表达沉默,Midkine 的表达亦显著下降,表明CD10、gal3 可在低氧环境下,诱导PTC 细胞系中Midkine 的表达。即在低氧环境中,HIF1-α 可通过直接调控CD10、gal3 表达进而调节Midkine 的表达[26]。但小分子抑制剂或抗体阻断HIF1-α 诱导的CD10、gal3的表达,及Midkine 的表达抑制以及相应的细胞功能变化等,还有待进一步研究。
综上所述,本研究发现HIF1-α 可通过调控CD10、gal3 影响Midkine 表达,为进一步的诊疗靶点开发构筑了生物学基础。

