维生素D 调控Kupffer 细胞极化在非酒精性脂肪性肝病防治中的作用
罗雯静 董显文 赵巧素 郭雯莹 柳惠未 叶桦
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是与胰岛素抵抗密切相关的遗传-环境-代谢应激性临床病理综合征,被认为是代谢综合征的肝脏表现[1]。作为人体必需的维生素之一,维生素D除了调节骨代谢和钙磷代谢,还具有非经典效应,包括调节免疫、抗氧化、抗凋亡、抗炎和抗纤维化等作用[2]。多项流行病学研究显示血清低水平维生素D 是NAFLD 发生、发展的独立危险因素,然而补充维生素D 对NAFLD 的保护作用及其中的机制尚未明确[3-6]。Kupffer 细胞是肝脏炎症-免疫调控的关键细胞,具有高度的可塑性和异质性,可在不同的微环境信号作用下分化为不同的表型,即经典活化的M1 型(classically activated macrophages,CAM)和替代活化的M2 型(alternative activated macrophages,AAM)[7]。Kupffer 细胞表型和功能改变在NAFLD 的发生、发展中具有重要作用[8]。本研究拟通过高脂饮食建立NAFLD 小鼠模型并给予维生素D 补充治疗,探讨维生素D 调控Kupffer 细胞极化在影响NAFLD 进程中的作用。
1 材料和方法
1.1 实验动物和主要试剂 30 只健康雄性4~6 周龄野生型C57BL/6 小鼠(SPF 级)购自中国维通利华实验动物技术有限公司;普通饲料(SPF 级小鼠维持饲料,批号:1010001)购自中国协同生物工程有限公司;高脂饲料(60%脂肪热量饲料,批号:D12492)购自中国SYSE Bio 公司;D-Hanks 液、DMEM 培养液、FBS 购自美国Gibco 公司(批号分别为14170112、12430054、16000-044);Ⅰ型和Ⅳ型胶原酶(批号分别为C0130、C5138)购自美国Sigma公司;Percoll分离液(批号:sc-500790A)购自美国Santa Cruz 公司;活性维生素D-1,25(OH)2D3(批号:HY-10002)购自美国MedChemExpress 公司,以PBS 为溶媒配制成0.5 mg/L 溶液;Trizol 试剂、逆转录试剂盒、PCR 试剂盒购自日本Takara 公司;兔抗鼠单克隆抗体购自英国Abcam 公司(批号分别为ab28481、ab128870、ab184032、ab234111)。PCR 引物由中国上海生工生物工程股份有限公司合成。
1.2 动物分组和模型建立 30 只C57BL/6 小鼠按照随机数字表法分为3 组,每组10 只。对照组予正常饮食(普通饲料)喂饲,高脂饮食组予高脂饮食(高脂饲料)喂饲,维生素D 补充组予高脂饮食喂饲并给予活性维生素D-1,25(OH)2D3,20 μg/kg,隔日灌胃;3 组小鼠均饲养16 周。每组取5 只小鼠以4%水合氯醛腹腔注射麻醉后颈椎脱臼法处死,获取肝组织液氮冷冻或4%甲醛溶液固定待测;另5 只小鼠行胶原酶原位灌注获取Kupffer 细胞:各组小鼠以4%水合氯醛腹腔注射麻醉,分离门静脉,24 G 留置针穿刺插管固定,予DHanks 液灌注至肝脏呈土黄色后改为含0.025%Ⅰ型胶原酶和0.050% Ⅳ型胶原酶的DMEM 溶液灌注20 min,分离肝脏,置于灌注液中消化10 min,以100 μm 无菌筛网过滤获得细胞悬液,密度梯度离心获得细胞团,4%台盼蓝染色检测细胞存活率,调整细胞密度至4×106/ml,用含12% FBS 的DMEM 培养液置于37 ℃、5%CO2恒温培养箱内培养1 h,洗去未贴壁细胞,余贴壁细胞即为原代Kupffer 细胞,更换培养液继续培养6 h。
1.3 指标测定
1.3.1 肝组织病理学检查 取各组小鼠肝组织标本,石蜡包埋,常规切片,HE 染色,光学显微镜下观察肝组织病理学表现。
1.3.2 小鼠肝组织脂质代谢基因、原代Kupffer 细胞M1/M2 极化基因mRNA 表达的检测 采用real-time PCR 法。取各组小鼠肝组织、各组小鼠原代Kupffer 细胞,以Trizol 试剂提取总RNA,根据逆转录试剂盒说明书方法逆转录合成cDNA。分别检测肝组织脂质合成基因固醇调节元件结合蛋白1C(sterol-regulatory element binding protein 1C,SREBP1C)和脂肪酸合酶(fatty acid synthase,FASN)、脂质分解基因脂酰辅酶A 氧化酶(acyl-CoA oxidase,ACOX)1 和肉碱棕榈酰转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)、Kupffer 细胞M1 极化基因诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)2、TNF-α、IL-6 和M2 极化基因精氨酸酶(arginase, Arg)1、甘露糖受体C2(mannose receptor c type 2,Mrc2)、IL-10 mRNA 表达水平。引物序列见表1。Real-time PCR 的反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40 个循环,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,用2-ΔΔCt法计算目的基因mRNA 的相对表达水平。

表1 引物序列
1.3.3 小鼠肝组织脂质代谢蛋白表达的检测 采用Western blot 法。取各组小鼠肝组织,裂解液提取组织蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿法电转至聚偏氟乙烯膜,5%脱脂牛奶封闭2 h,分别加入兔抗鼠SREBP1C 单克隆抗体、兔抗鼠FASN 单克隆抗体、兔抗鼠ACOX1 单克隆抗体、兔抗鼠CPT1A 单克隆抗体,兔抗鼠GAPDH 单克隆抗体,4 ℃孵育过夜,加入辣根过氧化物酶偶联的羊抗兔第二抗体,室温孵育1 h,以电化学发光剂显色,置暗盒X 线曝光,常规显影、定影。采用Image J 软件计算分析蛋白相对表达水平。
1.4 统计学处理 使用GraphPad Prism 9 统计软件,计量资料两两比较采用非配对t检验,所有统计检验均采用双侧检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组小鼠肝脏脂肪变性情况的比较 肝组织HE染色显示,高脂饮食组小鼠肝组织呈现大量的空泡样脂肪变性,以大泡性脂肪变为主;维生素D 补充组小鼠肝组织脂肪空泡数量减少,以小泡性脂肪变为主,见图1(插页)。
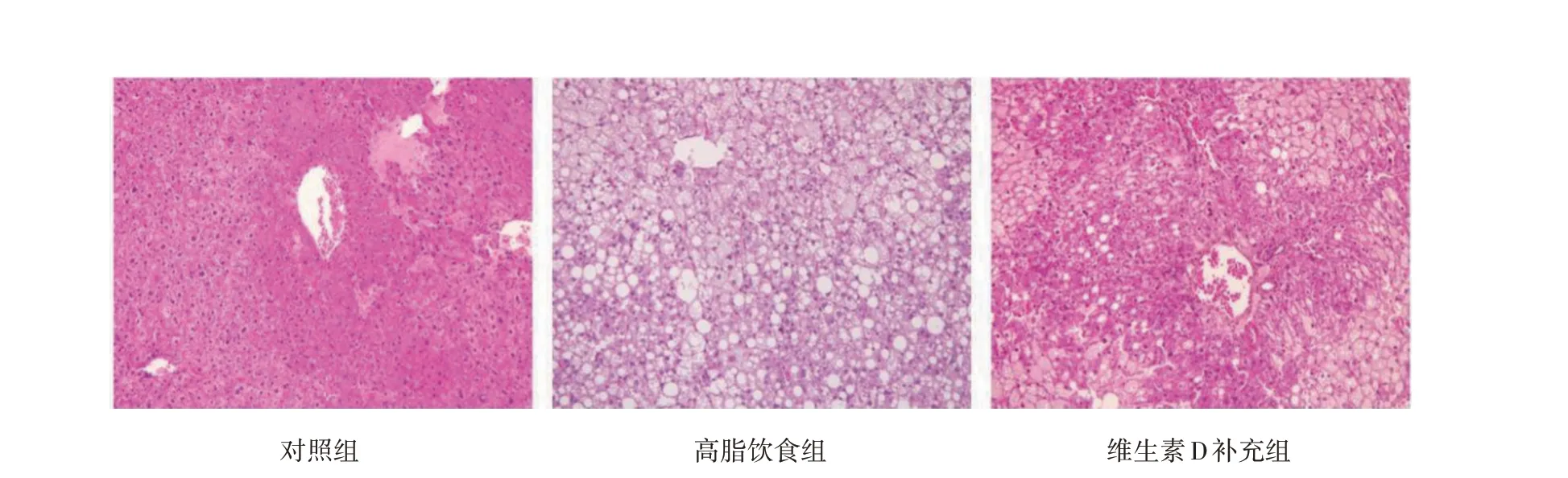
图1 3 组小鼠肝脏组织病理学HE 染色结果
2.2 3 组小鼠肝脏脂质代谢基因mRNA 表达的比较相比对照组,高脂饮食组小鼠肝组织SREBP1C、FASN、ACOX1 和CPT1A mRNA 相对表达水平均明显升高;相比高脂饮食组,维生素D 补充组小鼠肝组织SREBP1C、FASN、ACOX1 和CPT1A mRNA 相对表达水平均明显降低,差异均有统计学意义(均P<0.05),见图2。
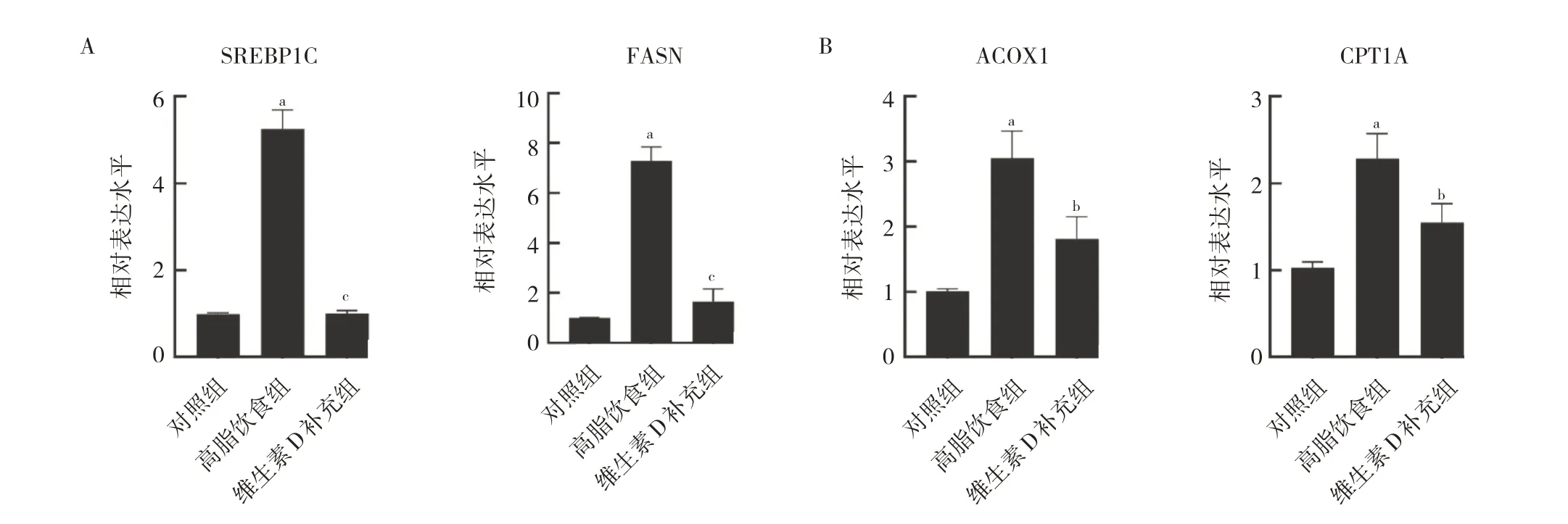
图2 3 组小鼠肝脏脂质代谢基因mRNA 表达的比较(A:脂质合成基因mRNA 相对表达水平比较;B:脂质分解基因mRNA 相对表达水平比较)
2.3 3 组小鼠肝脏脂质代谢蛋白表达的比较 相比对照组,高脂饮食组小鼠肝组织SREBP1C、FASN、ACOX1 和CPT1A 蛋白相对表达水平均明显升高;相比高脂饮食组,维生素D 补充组小鼠肝组织SREBP1C、FASN、ACOX1 和CPT1A 蛋白相对表达水平均明显降低,差异均有统计学意义(均P<0.05),见图3。

图3 3 组小鼠肝脏脂质代谢蛋白表达的比较(A:蛋白电泳图;B:4 种蛋白相对表达水平比较)
2.4 3 组小鼠Kupffer 细胞M1/M2 极化基因表达的比较 相比对照组,高脂饮食组小鼠Kupffer 细胞iNOS2、TNF-α、IL-6、Arg1、Mrc2 和IL-10 mRNA 相对表达水平均明显升高;相比高脂饮食组,维生素D 补充组小鼠Kupffer 细胞iNOS2、TNF-α、IL-6 和IL-10 mRNA 相对表达水平均明显降低,差异均有统计学意义(均P<0.05),见图4。

图4 3 组小鼠Kupffer 细胞M1/M2 极化基因mRNA 表达的比较(A:M1 极化基因mRNA 相对表达水平比较;B:M2 极化基因mRNA相对表达水平比较)
3 讨论
NAFLD 是一种除外乙醇摄入和其他明确损肝因素所致的肝脏异常脂质沉积为主要特征的临床病理综合征,是与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤,其疾病发展谱包括非酒精性单纯性脂肪肝(nonalcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)及其相关的肝硬化和肝细胞癌[9]。近年来中国NAFLD 发病率呈逐年上升趋势,一项新近的流行病学研究显示中国成人NAFLD 患病率高达30%[10]。
血清维生素D 水平与NAFLD 关系密切。研究发现血清低水平维生素D 是加重NAFLD 脂肪变性、炎症和纤维化的独立危险因素[3-4]。肝功能正常的NAFLD成人体内维生素D 呈低水平状态,而血清高水平维生素D 则显著降低NASH 的患病风险,可见血清维生素D 水平可作为独立的代谢特征来预测NAFLD 的严重程度[11-13]。维生素D 可能对NAFLD 具有保护作用,但维生素D 补充治疗在NAFLD/NASH 患者中是否获益仍然存在争议[5-6],且其中的机制鲜有探讨。本研究通过高脂饮食建立小鼠NAFLD 模型并给予维生素D 补充治疗,结果发现补充维生素D 明显改善NAFLD 肝脏脂肪变性,为补充维生素D 延缓NAFLD 发生、发展提供实验基础。
NAFLD 发病机制可用“二次打击”学说来解释:动物体内胰岛素抵抗可引起循环胰岛素水平及游离脂肪酸水平升高,脂质代谢发生异常,导致肝细胞内脂质过量沉积;而过量沉积的脂质会发生氧化应激,从而造成线粒体功能障碍,产生炎性介质并引起肝细胞炎症[14]。可见肝脏脂质代谢紊乱是NAFLD 发生、发展的基础,细胞内脂质合成增多、氧化分解代谢不足是肝细胞脂肪变性的主要原因[15]。SREBP1C 是参与调控脂肪酸、TG 和合成胆固醇的关键转录因子,可激活下游靶基因,增强多种脂肪酸合成基因的表达,如FASN[16]。肝细胞线粒体通过β-氧化分解游离脂肪酸,这一过程的限速酶主要包括ACOX1、CPT1A[15]。本研究发现高脂饮食的小鼠补充维生素D 后,NAFLD 肝脏脂质合成和分解代谢水平降低,这可能正是既往多项临床实验中NAFLD 患者接受维生素D 补充治疗疗效增加的原因,后续研究可关注药物干预方式、剂型、剂量等以提高其对改善NAFLD 脂质代谢紊乱的作用。
Kupffer 细胞是定居于肝脏的巨噬细胞,主要位于肝窦,在生理条件下具有调节肝内炎症及免疫平衡的作用。NAFLD 形成过程中,脂质代谢失衡,过度积累的脂肪酸通过多种信号通路激活Kupffer 细胞,后者通过产生各种细胞因子和炎症介质参与肝损伤的发生与发展[17]。巨噬细胞可针对不同刺激信号作出应答,并分化成为具有不同功能的表型细胞即极化,其极化类型主要包括经典活化的M1 型和替代活化的M2型。M1 型巨噬细胞由脂多糖(lipopolysaccharide,LPS)、IFN-γ 或TNF-α 等诱导活化,其活化标志包括iNOS2、TNF-α、IL-6 等,与炎症反应的启动和维持有关;M2 型巨噬细胞由IL-4、IL-13、IL-10 或免疫复合物等诱导活化,其活化标志包括Arg1、Mrc2、IL-10 等,与炎症反应的缓解、组织重塑和免疫调节有关[18]。既往研究表明,高脂饮食诱导的NAFLD 小鼠Kupffer 细胞主要表现为促炎的M1 型极化[19]。Maina 等[20]通过胆碱甲硫氨酸缺乏饮食诱导建立小鼠NASH 模型,研究发现肝脏巨噬细胞M1 型偏倚是NAFLD 向NASH 进展的重要因素。因此,Kupffer 细胞极化转变与NAFLD 的发生、发展密切相关。此外,近期研究显示不同极化表型的巨噬细胞可直接影响肝细胞脂质代谢,其中M1 型巨噬细胞可能通过促进分泌炎性细胞因子以增强肝细胞脂质合成代谢从而增加脂质沉积[21]。本研究发现补充维生素D 后NAFLD 小鼠Kupffer 细胞M1 型极化被抑制。由此推测维生素D 可能通过逆转高脂饮食诱导的Kupffer 细胞M1 极化表型来减少肝脏脂质合成代谢,从而缓解NAFLD 肝脏脂肪变性。
综上所述,补充维生素D 改善NAFLD 肝脏脂肪变性,可能与抑制Kupffer 细胞M1 型极化进而影响肝脏脂质代谢水平有关。补充维生素D 治疗为发展NAFLD 防治手段提供新方向。

