葛根素对LPS诱导的RAW264.7细胞炎症反应的作用机制研究
孙辉 刘翠玲 姚静 何秋婷 谢月 梁奇

〔摘要〕 目的 探討葛根素(puerarin, PUE)在脂多糖(lipopolysaccharide, LPS)诱导的RAW264.7巨噬细胞中的抗炎作用,并揭示其分子机制。方法 采用CCK-8比色法分别设置不同浓度的LPS和PUE,观察对RAW264.7细胞活性的影响,筛选出合适的LPS造模浓度及PUE的给药浓度。将细胞分为正常对照组、模型组(1 μg/mL)、PUE给药组(12.5、25、50 μmol/L)。Griess法检测一氧化氮(nitric oxide, NO)释放量;ELISA法检测肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)和白细胞介素-6(interleukin-6, IL-6)的含量;qRT-PCR法检测环氧化酶-2(cyclooxygenase-2, COX-2) mRNA水平;Western blot法检测诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、COX-2、p-IκBα、p-p65蛋白表达水平。结果 与正常对照组比较,不同浓度的LPS诱导24 h,RAW264.7细胞存活率降低,但对细胞增殖无影响(P>0.05),PUE在浓度100 μmol/L及以下时对RAW264.7细胞增殖也无影响(P>0.05);与模型组相比,PUE给药组(12.5、25、50 μmol/L)NO、TNF-α、IL-1β及IL-6的释放量显著降低(P<0.01),COX-2的蛋白及mRNA表达水平显著降低(P<0.05),iNOS、p-IκBα、p-p65的蛋白表达水平呈浓度依赖性降低(P<0.01)。结论 PUE的体外抗炎作用机制与抑制核因子κB(nuclear factor-κB, NF-κB)信号通路相关。
〔关键词〕 葛根素;脂多糖;RAW264.7细胞;炎症;一氧化氮;一氧化氮合酶;NF-κB信号通路
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.008
Anti-inflammatory effects and mechanisms of Puerarin on LPS-induced RAW264.7 macrophages
SUN Hui, LIU Cuiling, YAO Jing, HE Qiuting, XIE Yue, LIANG Qi*
Bao'an TCM Hospital of Guangzhou University of Chinese Medicine, Shenzhen, Guangdong 518101, China
〔Abstract〕 Objective To explore the anti-inflammatory potential of Puerarin (PUE) in lipopolysaccharide (LPS)-induced RAW264.7 macrophages and reveal its potential molecular mechanisms. Methods The effects of different concentrations of LPS and PUE on the viability of RAW264.7 cells were determined by CCK-8 colorimetric method, and the appropriate LPS modeling concentration and PUE administration concentration were screened. Cells were divided into normal control group, model group (1 μg/mL), and PUE administration group (12.5, 25, 50 μmol/L); Griess assay was used to assess the nitric oxide (NO) concentration; tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and interleukin-6 (IL-6) content was measured by ELISA; cyclooxygenase-2 (COX-2) mRNA levels were detected by qRT-PCR; the protein expression levels of inducible nitric oxide synthase (iNOS), COX-2, p-IκBα, and p-p65 were determined by Western blot. Results Compared with the normal control group, the survival rate of RAW264.7 cells decreased after 24 h of LPS induction at different concentrations, and there was no effect on cell proliferation (P>0.05), PUE has no significant cytotoxic effects at or below the concentrations of 100 μmol/L (P>0.05); Compared with the model group, PUE administration group (12.5, 25, 50 μmol/L) displayed favorable inhibitory effects on the release level of NO, TNF-α, IL-1β and IL-6 (P<0.01), and the protein and mRNA expression levels of COX-2 significantly decreased (P<0.05) in LPS-induced RAW264.7 cells, and it is the same for the expression levels of iNOS, p-IκBα, p-p65 (P<0.01). Conclusion The anti-inflammation mechanisms of PUE is related with nuclear factor-κB (NF-κB) signaling pathway.
〔Keywords〕 puerarin; lipopolysaccharide; RAW264.7 cells; inflammation; nitric oxide; inducible nitric oxide synthase; NF-κB signaling pathway
炎症是机体对有害刺激(如病原体、受损细胞或刺激物)的复杂生物反应。炎症反应导致疼痛、发热、瘙痒、红胀,甚至诱发过敏、哮喘及肿瘤等[1-2]。炎症介导的关键因子核因子κB(nuclear factor-κB, NF-κB)是Toll样受体(Toll-like receptor, TLR)通路中的重要信号分子。这些因子的调节被广泛认为是抑制各种炎症的良好策略。更具体地说,NF-κB是促炎基因转录调节的一个重要因素,如白细胞介素-6(interleukin-6, IL-6)、一氧化氮(nitric oxide, NO)诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和环氧化酶-2(cyclooxygenase-2, COX-2),也是NF-κB激活所必需的[3-4]。因此,NF-κB活化与炎症性疾病密切相关,针对NF-κB的抗炎药物的开发备受关注。
中药葛根是解表退热的代表性药物之一,广泛应用于治疗临床炎症性疾病,如发热[5]、疼痛[6-10]及类风湿关节炎[11-12]等。葛根素(puerarin, PUE)是葛根的主要有效成分,虽然其抗炎活性已有报道[13],但是PUE的抗炎活性所涉及的细胞机制仍有待阐明。本研究通过将PUE作用于脂多糖(lipopolysaccharide, LPS)诱导的RAW264.7巨噬细胞炎症模型,研究PUE抗炎症反应的作用及机制,为其进一步的开发及临床应用提供实验依据。
1 材料
1.1 细胞及药品
小鼠RAW264.7巨噬细胞购自中国科学院武汉分院细胞库。PUE(上海诗丹德标准服务技术有限公司,批号:110752-202013,纯度≥98%);LPS(美国Sigma-Aldrich公司,批号:#028M4094V)。
1.2 主要试剂
CCK-8试剂盒(北京兰杰柯科技有限公司,批号:21266840);胎牛血清(德国Nobimpex公司,批号:A115-500);DMEM培养基、PierceTM BCA蛋白检测试剂盒(上海赛默飞世尔科技公司,批号:8122524、WK342259);UltraSYBR Mixture PCR试剂盒(北京康为世纪生物科技股份有限公司,批号:CW2601M);cDNA反转录试剂盒(上海翌圣生物科技股份有限公司,批号:H8203980);iNOS(上海Abcam公司,批號:ab178945);COX-2(批号:37843)、p-IκBα(批号:2859S)、IκBα(批号:4814S)、p65(批号:8242S)及p-p65(批号:3033S)均购自美国Cell Signaling Technology公司。
1.3 主要仪器
CO2细胞培养箱、高速冷冻离心机(上海赛默飞世尔科技有限公司,型号:371、Sorvall ST 16R);蛋白电泳仪(上海伯乐生命医学产品有限公司,型号:Bio-Rad 1658029);化学发光荧光成像仪(上海天能科技有限公司,型号:5200Multi);医用低温保存箱(青岛海尔特种电器有限公司,型号:HYC-198S);洁净工作台(苏州安泰空气技术有限公司,型号:SW-CJ-2FD)。
2 方法
2.1 细胞培养及传代
RAW264.7细胞在37 ℃下于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM中培养,细胞在37 ℃、5% CO2空气环境中生长。待细胞密度长至90%时进行传代,用细胞刮刀将贴壁细胞刮下,然后吹匀使细胞成单个悬浮状态,再转移至15 mL离心管,1000 r/min(离心半径8 cm),离心5 min,弃上清液,加入新的培养基重悬,按照1∶3进行接种。
2.2 细胞分组及细胞存活率检测
取对数生长的细胞,按照1×106个/mL接种于6孔板,设置正常对照组、模型组(0.01、0.1、1、10 μg/mL)、PUE给药组(7.5、12.5、25、50、100 μmol/L)。待细胞贴壁过夜,正常对照组加入新鲜培养基,PUE给药组加入不同浓度PUE,每组设3个复孔,培养24 h;每孔加入20 μL CCK-8,放入细胞培养箱内继续孵育4 h,用酶标仪测定在450 nm处的吸光度(OD)值,计算细胞存活率。
2.3 细胞上清液中NO释放量的检测
取对数生长期的细胞,按照1×106个/mL接种于96孔板,设置正常对照组、模型组(1 μg/mL)、PUE给药组(12.5、25、50 μmol/L),待细胞贴壁过夜,PUE给药组加入PUE预处理0.5 h,除正常对照组,其余各组加入LPS(1 μg/mL)培养24 h。吸取各组细胞上清液50 μL,与Griess试剂混合,并在室温下孵育15 min。使用NaNO2作为标准,在540 nm波长处测定NO浓度。
2.4 细胞上清液中炎性细胞因子的检测
取对数生长期的细胞,按照1×106个/mL接种于6孔板,分组及处理同“2.3”,收集细胞上清液,按照ELISA试剂盒说明书定量检测培养基中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)、IL-6的含量。
2.5 COX mRNA水平的检测
细胞分组及给药方法同“2.3”,收集细胞,使用TRIzol试剂提取总RNA,应用逆转录试剂盒制备cDNA。所有引物均由上海Invitrogen公司合成,使用Primer-BLAST(www.ncbi.nlm.nih.gov/tools/primer-blast)平台设计COX-2、GAPDH引物序列(见表1)。使用RT-PCR试剂盒在罗氏LightCycler480实时系统(德国Roche Diagnostics公司)中进行qRT-PCR分析。
2.6 iNOS、COX-2、NF-κB信号通路蛋白表达的检测
细胞分组及给药方法同“2.3”,待细胞贴壁过夜,各給药组加入PUE预处理0.5 h,除正常对照组,其余各组加入LPS(1 μg/mL)培养30 min,收集细胞,加入含有磷酸酶抑制剂和蛋白酶抑制剂的裂解液冰浴裂解30 min,在4 ℃条件下12 753 r/min离心15 min,离心半径8 cm;收集上清后,按照BCA蛋白定量试剂盒说明进行蛋白定量,吸取部分蛋白液与5×蛋白质上样缓冲液混匀,97 ℃金属浴煮5 min,通过10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)分离蛋白质提取物,并转移至PVDF膜。脱脂奶粉封闭2 h,再加入iNOS、COX-2、p-IκBα、IκBα、NF-κB/p65、p-p65抗体稀释液,4 ℃孵育过夜。用TBST洗涤3次,并与在封闭溶液中稀释的过氧化物酶偶联的二抗在室温下孵育2 h,洗涤后,使用ECL发光液检测蛋白质。
3 结果
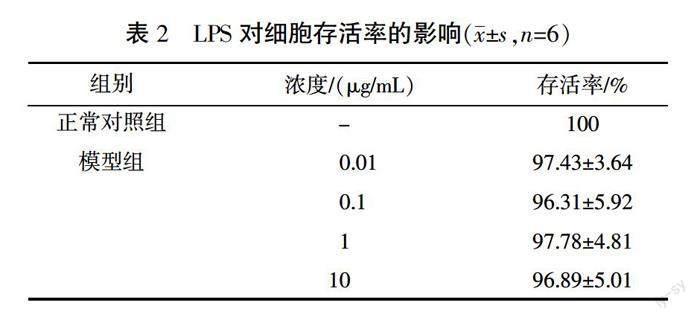
3.1 LPS对RAW264.7细胞活性的影响
为了评估LPS对RAW264.7细胞的细胞毒性作用,将细胞与不同浓度的LPS(0.01、0.1、1、10 μg/mL)孵育24 h。CCK-8结果显示,与正常对照组比较,在24 h内,LPS的浓度为0.01、0.1、1、10 μg/mL时,RAW264.7细胞存活率降低,但差异无统计学意义(P>0.05),说明各浓度下LPS对细胞无毒性或毒性不明显。详见表2。
3.2 PUE对RAW264.7细胞活性的影响
为了评估PUE对RAW264.7细胞的细胞毒性作用,将细胞与不同浓度的PUE(7.5、12.5、25、50、100 μmol/L)孵育24 h。CCK-8结果显示,与正常对照组比较,在24 h内,PUE给药组浓度为7.5、12.5、25、50、100 μmol/L时,RAW264.7细胞存活率逐渐降低,但差异无统计学意义(P>0.05),说明各浓度下PUE对细胞无毒性或毒性不明显。详见表3。最后,选择12.5、25、50 μmol/L作为PUE的给药浓度,用于进一步研究。
3.3 LPS对RAW264.7细胞中炎症因子表达的影响
与正常对照组比较,除模型组(0.01 μg/mL)外,其余3个浓度(0.1、1、10 μg/mL)均可明显诱导RAW264.7细胞产生炎症因子TNF-α、IL-1β和IL-6(P<0.05),并呈现一定的浓度依赖关系。但由于1 μg/mL和10 μg/mL浓度之间诱导炎症因子水平差异无统计学意义(P>0.05),故选择1 μg/mL的LPS作为造模浓度。详见表4。
3.4 PUE对LPS诱导的RAW264.7细胞中炎症因子表达的影响
与正常对照组比较,模型组上清液中的TNF-α、IL-1β和IL-6水平明显升高(P<0.05);与模型组比较,PUE给药组上清液中TNF-α、IL-1β和IL-6的水平呈浓度依赖性降低(P<0.05)。详见表5。
3.5 PUE对LPS诱导的RAW264.7细胞中NO和iNOS表达的影响
与正常对照组比较,模型组中NO的产生以及iNOS的表达明显升高(P<0.05);与模型组比较,PUE给药组LPS诱导的RAW264.7中NO的产生以及iNOS的蛋白表达水平降低(P<0.05)。详见表6、图1。
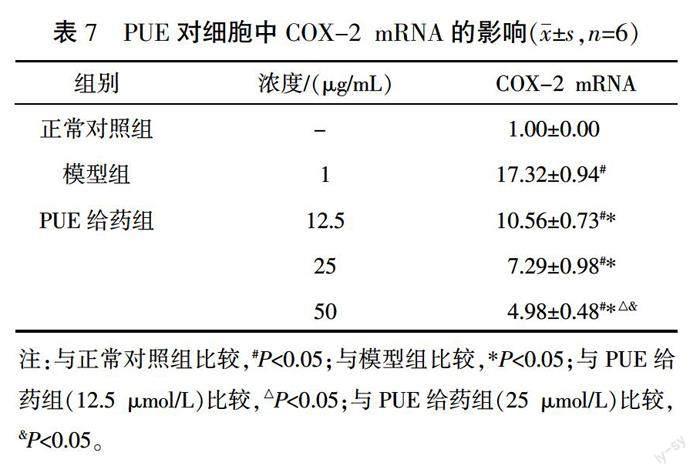
3.6 PUE对LPS诱导的RAW264.7细胞中COX-2表达的影响
与正常对照组比较,模型组中COX-2的mRNA和蛋白表达明显升高(P<0.05);与模型组相比,PUE给药组COX-2的mRNA和蛋白表达明显降低(P<0.05)。详见图2、表7。
3.7 PUE对NF-κB信号通路的影响
与正常对照组比较,模型组NF-κB信号通路中p-p65和p-IκBα表达明显增加(P<0.05);与模型组相比,PUE给药组p-p65和p-IκBα水平呈浓度依赖性降低(P<0.05)。详见图3。
4 讨论
炎症是病原体、受损细胞或刺激物攻击机体产生的基本防御机制。炎症反应有多种生理目的,如宿主防御、组织修复反应和稳态恢复。然而,这种反应会产生病理后果,导致炎症组织损伤、化生和稳态设定点的改变。因此,机体需要对炎症反应进行适当的调节。一些有害刺激,如病原体、受损细胞或刺激物可刺激机体产生NO,但过量产生NO会在巨噬细胞中诱导慢性炎症反应[14]。慢性NO过量产生也涉及其他负面的细胞生理功能,如DNA损伤和诱变[15]。在本研究中,PUE抑制LPS刺激的RAW264.7细胞中NO的产生。其次,PUE还以剂量依赖的方式抑制LPS诱导的iNOS蛋白水平升高。这些结果表明,PUE可能是一种潜在的抗炎化学物质。前列腺素(prostaglandin, PG)是来源于花生四烯酸的类脂化合物。NO、iNOS和PG维持体内平衡功能并介导致病机制,包括炎症反应。由促炎刺激物、细胞因子、激素和生长因子诱导的COX-2是炎症中PG形成的重要来源[16-18]。COX-2酶抑制剂被开发用于治疗与关节炎相关的炎症[19-20]和疼痛[21-22]。促炎细胞因子往往会通过诱发机体产生发热、炎症、组织破坏或全身炎症使疾病恶化。IL-6是一种关键的炎症细胞因子,在诱导下游炎症反应中起着重要作用。在这项研究中,我们发现PUE抑制LPS诱导的TNF-?琢、IL-1?茁和IL-6的上调。PUE处理以剂量依赖的方式减少LPS诱导的NO释放。此外,PUE下调LPS诱导的iNOS、COX-2、p-IκBα、p-p65的表达。NF-κB可与κB的抑制剂IκBα结合,当给予诱导炎症反应的刺激时,NF-κB被IκBα降解激活,并导致其易位到细胞核中,以促进炎症基因的表达,包括iNOS、COX-2和IL-6。
综上所述,体外实验表明PUE可能是一种具有潜在抗炎作用的天然活性化合物,可以抑制炎症因子的产生以及炎症反应,这种抑制作用可能与调控NF-κB信号通路密切相关。本研究结果可为PUE用于治疗相关炎症性疾病以及进一步的研究利用提供科学参考。
参考文献
[1] LOPEZ B, MAISONET T M, LONDHE V A. Alveolar NF-κB signaling regulates endotoxin-induced lung inflammation[J]. Experimental Lung Research, 2015, 41(2): 103-114.
[2] PFLUG K M, SITCHERAN R. Targeting NF-κB-inducing kinase (NIK) in immunity, inflammation, and cancer[J]. International Journal of Molecular Sciences, 2020, 21(22): 8470.
[3] LIN Y Q, LUO T Y, WENG A L, et al. Gallic acid alleviates gouty arthritis by inhibiting NLRP3 inflammasome activation and pyroptosis through enhancing Nrf2 signaling[J]. Frontiers in Immunology, 2020, 11: 580-593.
[4] HIRANO T, HIRAYAMA D, WAGATSUMA K, et al. Immunological mechanisms in inflammation-associated colon carcinogenesis[J]. International Journal of Molecular Sciences, 2020, 21(9): 3062.
[5] 管詠梅,龚丽霞,姜 鄂,等.葛根及其主要成分安全性研究进展[J].中华中医药学刊,2022,40(3):12-18.
[6] 朱 京,刘桂荣.张志远运用葛根经验[J].中医杂志,2022,63(2): 111-114.
[7] 张文培.葛根汤在老年病临床治疗中的应用进展研究[J].内蒙古中医药,2021,40(12):124-125.
[8] 田利军,郭宇松,刘 星,等.葛根汤联合针刺治疗青少年颈椎生理曲度异常所致颈源性头痛疗效及对患者脑血管功能状况的影响[J].陕西中医,2020,41(7):875-877,910.
[9] 樊俐慧,张 伟,王志刚,等.基于《伤寒杂病论》探讨葛根的量效关系及用药规律[J].中医临床研究,2021,13(21):28-30.
[10] 史晨旭,杜佳蓉,吴 威,等.葛根化学成分及药理作用研究进展[J].中国现代中药,2021,23(12):2177-2195.
[11] 娄 磊.葛根汤联合肾着汤对类风湿性关节炎患者疗效及免疫功能的影响[J].河北医药,2022,44(6):926-929.
[12] 杨小又,张丽萍,李 涛,等.李兆福教授运用桂枝加葛根汤治疗类风湿关节炎合并外感风寒经验[J].风湿病与关节炎,2020,9(11): 34-35,51.
[13] 孔令娟,计小清,刘 岩,等.葛根素通过调控AMPK/GSK-3β/β-catenin信号通路缓解糖尿病大鼠心肌损伤[J].中药材,2023(2):474-478.
[14] LEE Y M, KIM D S. The extraction solvent influences the anti-inflammatory effects of jakyakgamcho-Tang in lipopolysaccharide-stimulated macrophages and mice with gouty arthritis[J]. International Journal of Molecular Sciences, 2020, 21(24): 9748.
[15] ZHAO W R, SHI W T, ZHANG J, et al. Tribulus terrestris L. extract protects against lipopolysaccharide-induced inflammation in RAW 264.7 macrophage and zebrafish via inhibition of Akt/MAPKs and NF-κB/iNOS-NO signaling pathways[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 2021: 6628561.
[16] 陈诗洁,黄浏姣.电针对缺血脑组织Survivin、COX-2表达及二者相关性影响的研究[J].湖北中医药大学学报,2022,24(4):5-9.
[17] LI T T, HAI L L, LIU B, et al. TLR2/4 promotes PGE2 production to increase tissue damage in Escherichia coli-infected bovine endometrial explants via MyD88/p38 MAPK pathway[J]. Theriogenology, 2020, 152: 129-138.
[18] 任天琦,刘泽霖,胡 海,等.甘草甜素对膝关节骨性关节炎大鼠软骨细胞凋亡及PTEN/AKT/COX-2信号通路的影响[J].贵州医科大学学报,2022,47(7):785-790,795.
[19] STILLER C O, HJEMDAHL P. Lessons from 20 years with COX-2 inhibitors: Importance of dose-response considerations and fair play in comparative trials[J]. Journal of Internal Medicine, 2022, 292(4): 557-574.
[20] WANG Q R, YE C Q, SUN S K, et al. Curcumin attenuates collagen-induced rat arthritis via anti-inflammatory and apoptotic effects[J]. International Immunopharmacology, 2019, 72: 292-300.
[21] ZHANG J Z, CHEN X Y, WU Y J, et al. Identification of active compounds from yi nationality herbal formula Wosi influencing COX-2 and VCAM-1 signaling[J]. Frontiers in Pharmacology, 2020, 11: 568585.
[22] GONZ?魣LEZ-BARNADAS A, CAMPS-FONT O, MART?魱N-FAT?魣S P, et al. Efficacy and safety of selective COX-2 inhibitors for pain management after third molar removal: A meta-analysis of randomized clinical trials[J]. Clinical Oral Investigations, 2020, 24(1): 79-96.
〔收稿日期〕2022-11-25
〔基金項目〕广东省粤深青年联合基金项目(2019A1515111192)。
〔第一作者〕孙 辉,男,硕士研究生,研究方向:中药药理研究。
〔通信作者〕*梁 奇,男,主任中药师,E-mail:liangqi70@gzucm.edu.cn。

