黄鳝细胞质动力蛋白3基因的克隆及其在性逆转中的功能分析
连子童,夏雪平,李 忠,田海峰,蒋钦杨,胡乔木
(1.广西大学动物科学技术学院,南宁 530004;2.中国水产科学研究院长江水产研究所,武汉 430223)
黄鳝(Monopterusalbus)隶属硬骨鱼纲(Osteichthyes)辐鳍亚纲(Actinopteryii)合鳃目(Synbranchiformes)合鳃亚目(Synaphobranchoidei)合鳃科(Synbranchidae)黄鳝属(Monopterus),属于温热带淡水鱼类,广泛分布于亚洲东部和南部,在国内盛产于长江流域的湖北、江西、湖南和四川等地[1]。黄鳝为先雌后雄型雌雄同体鱼类,在性腺发育中存在性逆转现象[2-4],第一次产卵后,卵巢结构逐渐退化精巢结构逐渐出现[5]。原始精原细胞开始发育形成精小囊,此时性腺内存在未退化卵巢结构与发育阶段精巢结构,该发育时期为间性发育阶段[6-8]。近年来随着黄鳝人工繁育技术的突破,解决了以捕捉野生苗种进行养殖的问题,稳定优质的种苗输出使黄鳝成为长江流域重要的养殖特优水产品之一。由于黄鳝养殖产业的逐步发展壮大,对其亲本的培育显得尤为重要。在集约化养殖中,2年龄黄鳝作为母本,每尾平均怀卵约800枚,产卵后发生性逆转,在一定程度上限制了黄鳝产卵量。对黄鳝性逆转基因的研究,解析性逆转机制,为培育不发生性逆转的雌鳝奠定基础。
细胞质动力蛋白是一种微管运动蛋白,包括两类:dynein-1和dynein-2,dynein-1是一种蛋白复合物,参与有丝分裂过程中的膜运输、细胞器动力学和染色体分离过程[9],dynein-1包括2条重链、2~3条中间链、两个轻中间链以及一些轻链亚基,包括dynein轻链(dynll1),roadblock(dynlrb1和dynlrb2)和Tctex家族(dynlt1,dynlt3)[10]。dynlt3与性腺发育及多种功能有关,包括有丝分裂、精子运动、染色体分离及mRNA胞内运输等[11]。近期研究表明,dynlt3具有组织表达特异性[12],DIBELLA等[13]对dynlt3在哺乳动物减数分裂中作用研究时发现,dynlt3在卵母细胞减数分裂过程中染色体对齐和同源染色体分离发挥重要作用。
动力蛋白轻链Tctex-type 3(dynlt3)基因最初在T单倍型的小鼠睾丸中发现[14-15],dynlt3在精子尾部鞭毛动力蛋白和胞质动力蛋白中均有存在[16-17]。dynlt3在染色体分离过程中具有重要作用,人类细胞有丝分裂过程中,dynlt3参与染色体聚集过程;小鼠卵母细胞减数分裂过程中,染色体对齐过程同样需要dynlt3参与。KING等[18]使用靶向破坏,在小鼠中灭活了dynlt3基因,缺陷型雄鼠表现出精子发生异常、精子活力下降、由子宫进入输卵管的能力下降,推测dynlt3基因可能在雄性性腺发育及精子发生中发挥重要作用。
本实验以雌、雄、间性发育黄鳝为研究对象,分析不同组织、不同发育时期性腺、甲基睾丸酮处理性腺及Zebularine处理性腺原代细胞后dynlt3基因表达模式变化,为黄鳝性逆转机制解析奠定基础。
1 材料与方法
1.1 实验材料
黄鳝取自湖北省仙桃市忠善黄鳝苗种繁育专业合作社,取样前饥饿处理24 h,麻醉剂MS-222(500 mg/L,5 min)麻醉实验黄鳝,分别采集雌、间、雄性黄鳝性腺各3组,每组3~4尾。采集肝、脾、肠、脑、肌肉、皮肤、肾脏、心脏组织于RNAstore Reagent中,每组采集1龄黄鳝3~4尾,用于RNA提取。
60日龄黄鳝幼苗100尾随机分为四组,在室温下分别饲养于(230 mm×165 mm×80 mm)水箱中,水箱中注水量为2 000 mL,每日换水两次并投喂红虫浆饵料。甲基睾酮(methyltestosterone,MT)经无水乙醇溶解至500、1 000、1 500 mg/L,每次换水后添加400 μL MT至终浓度为100、200、300 μg/L,处理2个月。取样前暂停处理24 h,MS-222(500 mg/L)麻醉处理5 min后采集性腺,性腺样品分为两份,一份保存于4%多聚甲醛(pH 7.5)用于制作组织切片,另一份保存于RNAstore Reagent用于RNA提取。
1.2 生物信息学分析
将扩增得到的dynlt3基因cDNA片段测序验证,在NCBI数据库中在线软件(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi;www.ncbi.nlm.nih.gov/structure)预测开放阅读框和保守区。利用在线工具ProtParam(https://www.expasy.org/resources/protparam)对黄鳝DYNLT3蛋白进行理化性质预测;利用在线工具PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/SMART)分析DYNLT3的蛋白二级结构;利用在线工具SWISS-MODEL(https://swissmodel.expasy.org/)预测DYNLT3蛋白三级结构;利用MEGA 7.0软件采用NJ法(neighbor-joining method)构建黄鳝与其它物种的DYNLT3氨基酸系统进化树。使用在线工具WebLogo3、MEME(http://weblogo.threeplusone.com/;https://meme-suite.org/meme/tools/meme)预测氨基酸保守序列,比对黄鳝与其它脊椎动物的DYNLT3氨基酸序列进行同源性分析。
1.3 总RNA提取与反转录
取40 mg组织于PBS中冲洗,剪碎组织样品,按TRIzol Reagent说明书提取总RNA,并检测RNA浓度,琼脂糖电泳检测RNA完整性。按反转录试剂盒(TaKaRa)说明书,对总RNA进行反转录,反转录后的cDNA于-20 ℃保存备用。
1.4 Zebularine处理原代性腺细胞
收集1龄左右黄鳝卵巢组织,用PBS(含10%双抗)冲洗性腺。将性腺剪碎,至组织块大小为1~2 mm3左右,将处理后的组织块用70目细胞筛过筛处理为原代单细胞。将原代单细胞悬液随机分置四组,于6孔细胞培养板中培养,加入完全培养基(10%双抗,10%胎牛血清,DMEM高糖培养基)27 ℃贴壁6~12 h。将Zebularine用DMSO稀释至100 μmol/L,实验组分别加入50、100、200 mg Zebularine稀释液,对照组加入10 μL DMSO,27 ℃孵育12 h,收集原代细胞。用细胞、组织RNA柱式提取试剂盒(诺唯赞)提取细胞RNA。
1.5 实时荧光定量PCR
选EF-1α作内参基因,cDNA作模板,每组3个重复。遵照2×T5 Fast qPCR Mix的使用说明,配成10 μL反应体系。反应在Quant Studio 5实时定量PCR系统上进行,2-△△CT法计算相对表达量;所得数据在统计软件SPSS 22.0进行单因素方差分析(One-Way ANOVA)和Duncan′s法多重比较分析。
1.6 切片原位杂交
设计引物(表1)以cDNA为模板通过PCR技术对探针片段进行扩增,按胶回收试剂盒(TaKaRa)说明书,对扩增产物进行胶回收,检测RNA完整性与浓度,通过T7体外转录试剂盒(Thermo Fisher Scientific)制备探针。

表1 引物序列Tab.1 primers sequences
雌、间、雄性黄鳝性腺切片各两组,使用二甲苯、各浓度梯度乙醇溶液对切片进行脱蜡处理;对脱蜡后的切片进行4% PFA-PBS固定、HCl处理、10 μg/mL蛋白酶K消化处理。加入预杂交液(含tRNA、肝素),70 ℃预杂交2~5 h;加入预杂交液(含反义RNA探针100~200 ng),70 ℃过夜;50%预杂交液(无tRNA和肝素),50% 2×SSC,70 ℃,15 min;0.2×SSC,70 ℃,2×30 min;1×MAB(100 mmol/L马来酸,150 mmol/L NaCl,pH 7.5)室温5 min。室温用Blocking Buffer(10%山羊血清,2% BMB,1×MAB)封闭4 h。抗体杂交:加Blocking Buffer 500倍稀释的抗体(Roche Applied Science,Germany),4 ℃过夜,PBST室温冲洗样品。按照BCIP/NBT碱性磷酸酯酶显色试剂盒(碧云天)说明书进行显色处理;显色理想后PBS冲洗终止显色。
2 结果与分析
2.1 黄鳝dynlt3基因序列分析
采用RT-PCR和RACE技术,克隆获得dynlt3全长1 082 bp,5′UTR 119 bp,3′UTR 609 bp,开放阅读框354 bp,编码117 aa(图1A)。利用在线工具ProtParam对黄鳝DYNLT3蛋白进行理化性质预测,结果显示DYNLT3分子式为C656H1011N177O216S11,相对分子质量为15 169,理论等电点为4.53,在哺乳动物网状细胞、酵母以及大肠杆菌体内的半衰期分别为30 h、>20 h、>10 h,不稳定系数为39.81,脂肪系数为71.82,总平均亲水性为-0.253,属于不稳定亲水蛋白。利用在线工具CD-Search分析DYNLT3蛋白在第23至第114位氨基酸区域为动力蛋白轻链(DLC)类域超家族保守域[dynein light chain(DLC)-like domain superfamily,cl41776],利用在线工具SWISS-MODEL预测DLC蛋白的三级结构(图1A)。
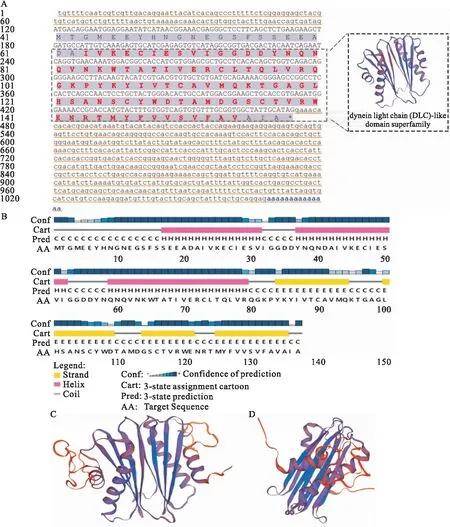
图1 黄鳝dynlt3基因cDNA序列与氨基酸序列及其蛋白结构域分析与三级结构预测Fig.1 cDNA sequence and deduced amino acid sequence of dynlt3 gene in M.albus;DYNLT3 protein domain analysis and tertiary structure prediction of M.albusA:dynlt3基因cDNA序列与推导的氨基酸序列。黄线代表5′UTR与3′UTR区域,紫色区域为其编码的氨基酸序列;B:黄鳝DYNLT3蛋白二级结构示意图;C、D:DYNLT3蛋白3D视图。
PSIPRED在线工具预测结果显示蛋白的二级结构包含37.96%的α-螺旋,29.20%的β-折叠,32.85%的无规则卷曲(图1B),利用在线工具SWISS-MODEL通过同源建模法预测DYNLT3蛋白的三级结构(图1C、D),GMQE估计分数为0.56(在0到1之间)表明预测三级结构模型准确性较高,可以作为DYNLT3蛋白结构模型参考;QMEAN估计分值为-3.56(在0~4之间)表明该模型结构具有良好的一致性,一致度达到54.63%即模型的准确度可以达到95%以上,参考性较高。
2.2 黄鳝DYNLT3氨基酸序列比对与进化树分析
使用在线工具WebLogo3对DYNLT3氨基酸序列与其他物种氨基酸序列进行对比预测氨基酸保守序列,DYNLT3相对保守,其编码蛋白序列在第32-114 aa存在保守区域,与在线工具CD-Search分析相同(图2A)。利用在线工具MEME比对黄鳝与其它脊椎动物DYNLT3氨基酸序列同源性分析,得出排名前三氨基酸序列及其所在氨基酸序列相对位置,且该结构域在黄鳝与其它脊椎动物的氨基酸序列中仅存在几个氨基酸的差异(图2B、C)。
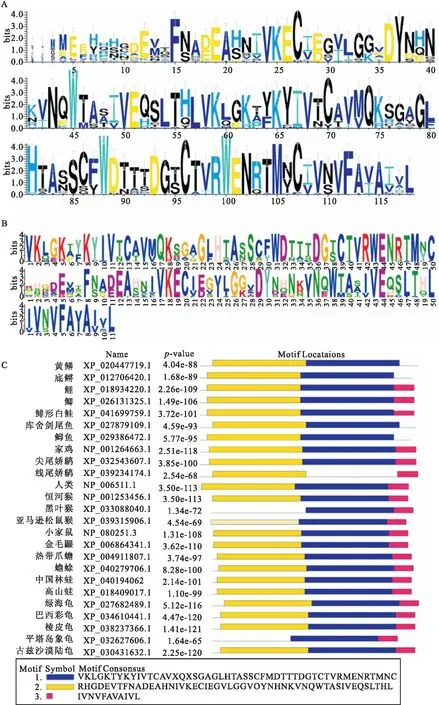
图2 DYNLT3氨基酸序列多重比较及其保守序列及氨基酸序列相对位置Fig.2 Multiple comparison of DYNLT3 amino acid sequences;The conserved amino acid sequence of DYNLT3 and its relative position in the amino acid sequence
在黄鳝DYNLT3氨基酸序列与GenBank中已知物种的氨基酸序列进行比对分析基础上,使用MEGA 7.0软件构建黄鳝与其他物种间分子系统进化树,结果显示黄鳝与底鳉(Fundulusheteroclitus)、鲤(Cyprinuscarpio)、鲫(Carassiusauratus)等聚为一大支;哺乳类、鸟类和爬行类聚为一支;两栖类聚为独立一支(图3)。且黄鳝DYNLT3氨基酸序列与底鳉亲缘关系最近,该结果符合物种一般进化规律。

图3 基于黄鳝与不同物种DYNLT3氨基酸序列的NJ进化树分析Fig.3 NJ phylogenetic tree analysis based on DYNLT3 amino acid sequences of M.albus and different species
2.3 黄鳝dynlt3基因组织表达分析
通过RT-PCR对黄鳝dynlt3基因进行不同组织的表达分析,结果显示dynlt3在黄鳝肌肉和脑具有较高表达,心脏次之,在皮肤、脾脏、肾脏以及胃中表达中等,在肠、肝和卵巢有较低表达且差异显著(图4A);dynlt3基因在黄鳝性腺不同发育阶段表达结果显示,dynlt3在雌性卵巢至间性早期黄鳝性腺中表达量无显著性差异,间性后期与雄性睾丸中表达量无显著性差异,但显著高于卵巢与间性早期表达量(图4B)。

图4 dynlt3基因在黄鳝不同组织、不同性腺发育时期中的表达Fig.4 Expression of dynlt3 gene at different gonad development stages in different tissues of M.albus图中不同字母表示各组织之间差异显著(P<0.05);Sk:皮;He:心;In:肠;Mu:肌肉;Li:肝;Sp:脾;Ki:肾;Ov:卵巢;Br:脑;St:胃。
2.4 黄鳝dynlt3基因组织表达定位
通过原位杂交技术对黄鳝卵巢、间性性腺、精巢细胞中dynlt3的表达定位分析。结果显示使用正义RNA探针杂交性腺中未检测到dynlt3的阳性信号(图5A),使用反义RNA探针原位杂交的性腺中可检测到蓝紫色阳性信号。在II时期卵巢中dynlt3基因主要在卵母细胞细胞质中表达(图5B);间性性腺组织中dynlt3基因主要在精原细胞和初级精母细胞中表达(图5C);精巢组织中可在精原细胞与初级精母细胞中检测到dynlt3基因表达(图5D)。

图5 黄鳝dynlt3基因在不同发育阶段性腺中的表达定位Fig.5 The expression and location of dynlt3 in gonads at different developmental stagesA:对照组;B:卵巢;C:间性发育时期;D:精巢;Ch:染色质;FM:滤泡膜;N:细胞核;Nu:核仁;Oo II:II时相卵母细胞;Oo III:III时相卵母细胞;PSG:初级精母细胞;SG:精原细胞;Va:液泡;YG:卵黄颗粒;YM:卵黄块;Yp:卵黄小板。
2.5 MT处理后卵巢结构变化及Zebularine处理原代性腺细胞dynlt3表达模式分析
将2月龄黄鳝采用MT处理2个月后,HE切片结合显微镜观察,结果表明经MT处理后卵巢组织结构发生明显退化,主要表现为II时相卵母细胞退化且数量减少,卵膜与卵质明显分离,卵巢结缔组织间出现空泡结构(图6A)。MT处理2月后,退化卵巢中dynlt3基因的表达量降低,且与对照组表达量存在显著差异(图6B)。
取1龄黄鳝卵巢,将性腺组织处理为单细胞,进行原代性腺细胞培养。向培养基中添加Zebularine进行去甲基化处理后,dynlt3基因在不同浓度梯度Zebularine处理原代细胞中表达无显著性差异(图6C)。
3 讨论
本研究成功克隆了dynlt3基因,全长1 082 bp,5′UTR 119 bp,3′UTR 609 bp,开放阅读框354 bp,编码117 aa。通过在线工具SMART分析黄鳝DYNLT3蛋白序列比对结果显示,DYNLT3蛋白在第32至第114位氨基酸区域为动力蛋白轻链(DLC)类域超家族保守域,在不同的家族成员之间具有高度的同源性。dynein轻链(DLC)-like结构域超家族是一类含有DLC结构域的蛋白质,该结构域具有反向平行的β-折叠与α-螺旋。含有DLC类结构域的蛋白包括细胞质dynein轻链DYNLL1和DYNLL2、动力蛋白轻链Tctex型DYNLT1和DYNLT3[10]等。
在鱼类的性别发育过程中存在天然的性逆转现象,黄鳝具有典型的“首雌特征”即先为雌性卵巢,卵巢发育完全后逆转为雄性精巢。目前对于黄鳝性逆转过程中差异表达基因的研究主要在呈现出性别二态性的基因,如cypl9a、foxl2、gdf9等基因。对于性逆转过程中其他差异表达基因研究较少。本研究从黄鳝卵巢、间性性腺、精巢转录组测序中获的差异表达基因dynlt3。检测dynlt3基因在不同组织中mRNA的表达情况,结果显示该基因在多个组织器官中都有表达,其中肌肉和脑中的表达量最高,肠、肝和卵巢中表达量较低。
通过对比不同性腺发育时期表达量结果显示,dynlt3基因在雌性发育时期与间性发育早期表达量较低,随着性腺逐渐向雄性性腺发育,基因表达量逐渐增加。RASHID等[19]对患弱精子症小鼠dynlt3表达水平研究表明,dynlt3表达水平与精子活力和形态呈显着正相关,dynlt3基因可能影响鞭毛的结构和功能。LI等[20]对差异表达的蛋白DYNLT1在精子细胞发育和鞭毛组装等阶段进行特异性富集分析,结果表明DYNLT1在精子尾部发育中发挥重要作用[20]。在间性后期与雄性发育时期黄鳝性腺中初级精母细胞开始逐渐发育为次级精母细胞和精子[21],因此,精巢中dynlt3基因表达水平是由精巢发育水平影响,综上推测dynlt3基因在性逆转过程及精子发育过程中发挥重要的作用。
甲基睾酮为天然雄激素睾酮的17-α位甲基衍生物,具有抗雌激素作用,抑制卵巢功能及子宫内膜生长。将MT添加到幼鲵饲料中可使雄性大鲵比例显著升高,表明饲喂添加性激素类似物可显著增加幼鲵发生性反转比例[22]。在使用性激素处理黄鳝实验中,注射MT未得到具有生殖能力的性逆转雄鱼,但MT可促进雌鳝卵母细胞退化[23]。本研究通过在水体中添加甲基睾酮抑制卵巢功能及性腺细胞发育,由HE染色结果可知,MT处理导致黄鳝生殖板周围形成大面积中空,生殖板出现明显增粗延长毛细血管丰富,且组织中出现卵膜与卵质分离现象。上述现象表明,MT处理可能促进卵巢退化,且生殖板周围出现中空小叶,但未见卵巢排卵,说明生殖板周围出现的中空是由于MT处理作用下雌性组织中II时相卵母细胞退化及雄性发育进程加速导致的。该结果与黄鳝外源性甲基睾酮实验结果相同[23],dynlt3基因在性腺组织中的表达相较于对照组呈显著性下降(P<0.05),推测该基因表达水平下降是由于MT处理使卵母细胞早期发育抑制引起的,综上所述,dynlt3基因在卵母细胞早期发育中发挥重要生物作用。
RNA原位核酸杂交又称RNA原位杂交组织化学或RNA原位杂交。该技术可在性腺组织结构保持不变的条件下,用标记的已知的RNA核苷酸片段,按核酸杂交中碱基配对原则,与待测组织中相应的基因片段相结合。通过原位杂交来对卵巢组织、间性性腺组织、精巢组织细胞中dynlt3基因的表达进行定位,结果显示在三组性腺组织中均存在阳性表达。在雌性组织中dynlt3基因主要在Ⅱ时相卵母细胞细胞质中表达,同时期对照组中未见阳性表达;在间性性腺中dynlt3基因主要在精原细胞和初级精母细胞中表达;雄性组织中dynlt3基因在初级精母细胞及次级精母细胞中表达明显。
Zebularine是一种DNA甲基化(DNA methylation)抑制剂,其作用机制可能是与DNA甲基转移酶(DNA methyltransferases)形成致密共价复合物阻止了Dnmt的释放,从而使DNA达到去甲基化状态[24-25]。本研究中通过对原代性腺细胞使用Zebularine处理,降低原代性腺细胞甲基化水平,对dynlt3基因表达模式进行分析。研究发现经Zebularine处理,dynlt3基因表达未呈现显著性差异,因此无法判断甲基化是否在dynlt3基因表达过程中的作用,甲基化修饰在dynlt3基因表达过程中发挥的作用还有待研究确定。

