大口黑鲈源鳗弧菌的分离鉴定
李媛媛,蔡 琰,张连英,孙金辉,包海岩,徐晓丽,3
(1.天津农学院,天津 300191;2.天津市水产研究所,天津 300221;3.全国水产技术推广总站,中国水产学会,北京 100125)
大口黑鲈(Micropterussalmoides)也称加州鲈,原产于北美洲密西西比河流域,20世纪70年代末由我国台湾地区引入,人工繁育成功后,引入广东开始养殖[1-3]。由于其具有生长迅速,抗逆性强,容易起捕,且肉质鲜美,营养丰富,无肌间刺等特点受到养殖者及消费者的青睐,目前在全国二十余个省、市、自治区均有养殖,其中以广东、福建大口黑鲈养殖业较为成熟,已形成苗种繁育、成鱼养殖、饲料供应、产品加工等较为完善的产业链[4-5]。鉴于大口黑鲈在淡水养殖鱼类中市场需求大、价格相对较高且稳定,养殖效益较好,近年来也成为北方地区盐碱水池塘养殖中最受青睐的名优鱼类品种。在市场需求的带动下,产量逐年上升,养殖从业者为追求高效益,普遍采用高密度养殖模式,水质管理与调控难度加大,细菌、病毒、寄生虫等病害高发,已报道的引起大口黑鲈疾病的病原包括大口黑鲈虹彩病毒(Largemouth bass virus,LMBV)、大口黑鲈弹状病毒(Micropterussalmoidesrhabdovirus,MSRV)、柱状黄杆菌(Flavobacteriumcohumnare)、维氏气单胞菌(Aeromonasveronii)、鰤鱼诺卡氏菌(Nocardiaseriolae)、腐皮镰刀菌(Fusariumsolani)以及括车轮虫(Trichodina)、斜管虫(Chilodonella)、日本鯴(Argulusjaponicus)等[1-3,5-9]。大口黑鲈病害在造成巨大的经济损失的同时,也易诱发水产品质量安全问题,严重阻碍产业健康发展。
2020年4月,天津市静海区某养殖场养殖的大口黑鲈出现以体表及肝脏出血为主要特征的疾病,病鱼短时间内出现大量死亡。为明确其病因,本研究取患病大口黑鲈进行病原分离,获得1株优势菌,人工感染实验确定其致病性,病原菌经生理生化特性、16S rRNA基因序列分析、特异性基因检测,鉴定其为鳗弧菌(Vibrioanguillarum),同时采用药敏纸片法筛选了病原敏感药物,以期为大口黑鲈鳗弧菌病的诊断和防治提供参考。
1 材料方法
1.1 实验材料
患病大口黑鲈采自天津静海区某养殖场,发病池塘为大口黑鲈精养池塘,每667 m2投放鱼种3 000尾。发病鱼体长25~30 cm,体表有明显的出血,发病池塘水温19.2 ℃,盐度2.2,pH为8.6。健康大口黑鲈取自天津蓝科水产养殖有限公司,体长(7±1)cm,体质量(4.0±0.4)g,暂养在75 L水族箱中,使用充气泵进行增氧,每日投饵2次,吸污1次,实验过程中养殖水温维持在20 ℃左右。
营养琼脂、脑心浸液(BHI)培养基、细菌生化鉴定管、药敏纸片均购自杭州滨和微生物试剂有限公司。PCR产物回收采用生工生物工程(上海)股份有限公司的柱式DNA胶回收试剂盒进行。
1.2 病原菌分离
取体表明显出血的濒死大口黑鲈,酒精消毒体表后无菌条件下进行解剖,观察病鱼内脏变化,采用灼烧后的接种环从病鱼肝、脾、肾处取少许组织,划线接种在BHI平板培养基上;28 ℃下培养24 h,筛选形态一致的优势菌落经进一步纯化培养,得到纯培养菌株并编码为2004301,保种待用。
1.3 人工感染实验
将健康大口黑鲈饲养在45 L玻璃缸内,分为7组,每组20尾,其中实验组6缸,分别注射不同浓度的菌株2004301的菌悬液,1缸为对照组。将菌株2004301于BHI液体培养基中培养20 h,以无菌含0.85% NaCl的生理盐水洗涤3次,调整菌悬液浓度为3×108、3×107、3×106、3×105、3×104、3×103cfu/mL,从大口黑鲈胸鳍下方注射入鱼腹腔,每尾注射100 μL,对照组注射相同量的生理盐水。注射后对实验鱼进行持续观察,每日正常投喂、换水吸污并记录大口黑鲈的发病及死亡情况,取人工感染发病的濒死大口黑鲈再次分离、纯化细菌。
1.4 病原菌鉴定
1.4.1 生理生化鉴定
将菌株2004301划线接种于营养琼脂培养基,28 ℃培养24 h,观察菌落特征,制作细菌滴片,革兰氏染色后观察细菌形态。应用法国生物梅里埃(biomerieux)公司的VITEK2 GN鉴定卡进行,参照《常见细菌系统鉴定手册》[10]进行细菌其他理化特性鉴定。
1.4.2 分子生物学鉴定
取纯培养的菌株2004301,悬浮于无菌蒸馏水中,沸水浴3 min,快速冷却后离心取上清为PCR反应模板。
菌株2004301的16S rRNA基因、hsp60基因序列扩增参照文献[2,11]中方法进行,扩增产物回收后由生工生物工程(上海)股份有限公司进行测序。特异性基因检测参照秦蕾等[12]、孙晶晶等[13]的方法进行。
向Gene Bank数据库分别提交菌株2004301的16S rRNA基因、hsp60基因序列,经NCBI 的Blast 检索系统进行同源性分析,筛选出同源性较高的菌株的基因序列并使用Clustal x 1.83软件比对。分别以16S rRNA基因、hsp60基因作为分子标记,使用系统发育分析软件Mega 5.2,根据邻接法(Neighbor-joining,NJ法)构建系统发育树,并利用Bootstraps检测置信度,自举数集1 000次。
1.5 药物敏感实验
用药敏纸片法检测菌株2004301对32种药物的敏感性,调整菌悬液浓度为0.5个麦氏比浊度,吸取100 μL菌液均匀涂布在MH平板培养基上,将药敏纸片用无菌镊子均匀贴在平板培养基表面,在28 ℃培养箱内培养24 h,记录每片药敏纸片的抑菌圈直径,并根据药敏纸片抑菌范围说明标准对实验结果进行判断。
2 结果
2.1 病原菌分离
发病大口黑鲈以体表出血为主要症状,病鱼活力差、不食,烂鳃,体表变黑,有不同程度的充血出血,鳞片脱落,以鳃盖下缘、胸鳍基部、腹鳍基部、腹部最为明显(图1a)。解剖可见脾脏肿大,肝脏充血发红(图1b)。镜检未发现寄生虫。
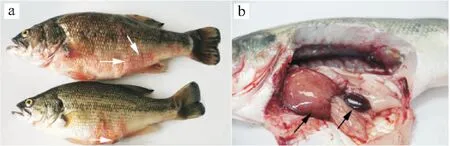
图1 病鱼典型症状Fig.1 Symptoms of diseased M.salmoides.
从病鱼肝脾肾均分离得到大量形态一致的菌落,纯化后编码2004301,在BHI固体培养基上培养24 h形成边缘光滑整齐、较扁平、不透明的、浅橘黄色的圆形菌落,在TCBS培养基上形成黄色菌落。菌体革兰氏染色阴性,稍弯曲短杆状,菌体长约1~2 μm,散在或成对存在,液体培养基中呈均匀浑浊生长,无荚膜,无芽孢(图2)。
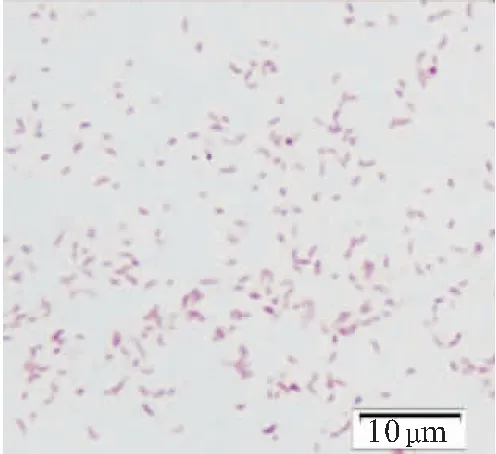
图2 菌株2004301的菌体形态Fig.2 Cell morphology of strain 2004301
2.2 病原致病性分析
采用腹腔注射方式验证菌株2004301的致病性,分别以不同浓度的纯培养的菌悬液感染健康大口黑鲈,菌株2004301表现出较强的致病性。感染第2天,注射浓度为3×108、3×107cfu/mL的两组实验鱼全部死亡,无明显症状;注射浓度为3×106cfu/mL的实验鱼死亡率为60%(图3);实验组鱼不食,独游,活动减弱,第5天注射浓度为3×105cfu/mL组死亡的实验鱼开始出现体表充血症状,解剖发现肝脏充血。从实验组濒死鱼中肝脏处再次进行细菌分离,得到大量菌落形态与菌株2004301一致的单菌落,革兰氏染色显示菌体形态亦与菌株2004301一致。对照组无任何症状,无一死亡。人工回归感染结果说明,菌株2004301是导致本次大口黑鲈发病死亡的病原菌。根据实验鱼的死亡结果(表1),按照改进寇氏法[14]计算菌株2004301对大口黑鲈(4 g)的半数致死量为5.3×104cfu/mL。依据SANTOS等[15]对鱼类致病菌毒力的划分标准,可以判断菌株2004301具有较强毒力。
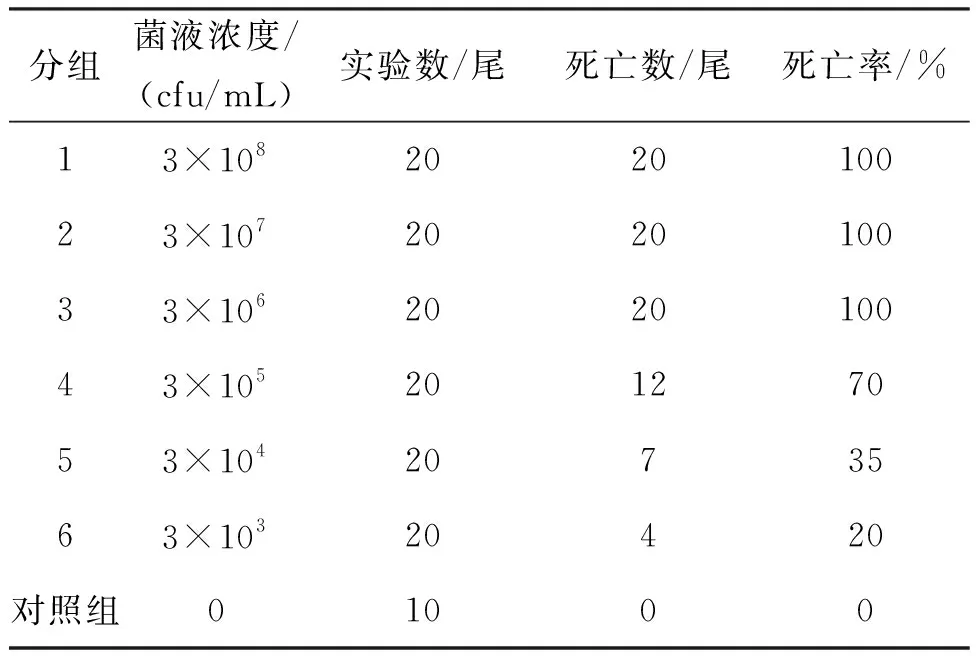
表1 菌株2004301的人工感染实验结果Tab.1 The results of artificial infection of strain 2004301
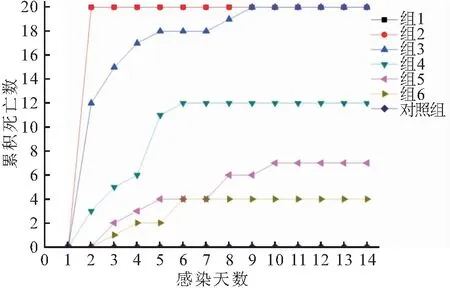
图3 菌株2004301人工感染实验结果Fig.3 The results of the infecion experiments of 2004301 strain
2.3 病原生理生化鉴定结果
菌株2004301可运动,氧化酶与接触酶阳性,发酵型,硝酸盐还原阳性,VITEK2 GN鉴定卡未鉴定出该菌。综合菌株2004301生理生化特性鉴定结果,与鳗弧菌较为一致(见表2),初步判定菌株2004301为鳗弧菌。
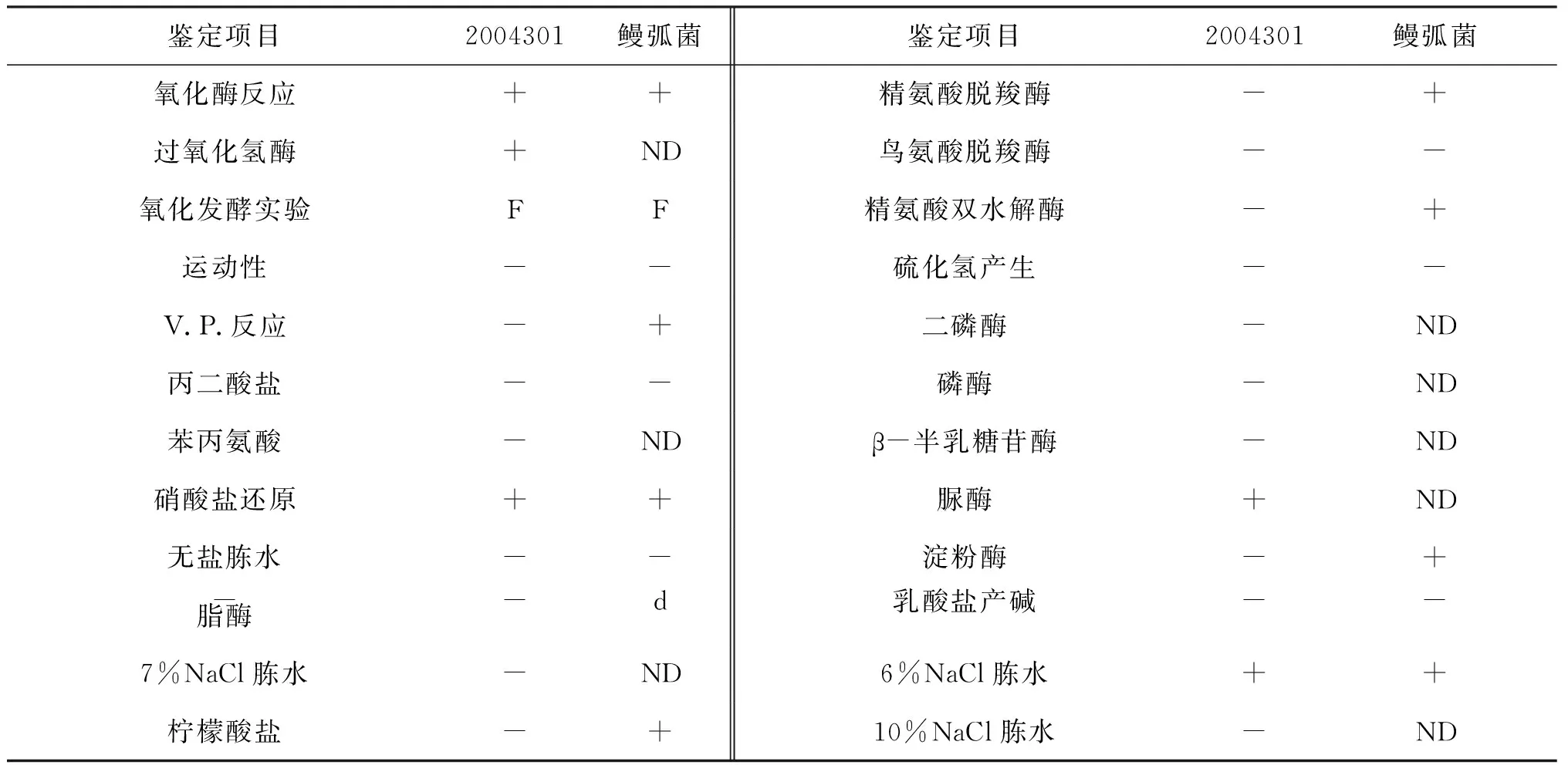
表2 菌株2004301和鳗弧菌的生理生化特征的比较Tab.2 Comparison of physiological and chemical characteristics of strain 2004301 and V.anguillarum
2.4 病原的分子生物学鉴定
采用细菌通用引物B27F和1492R扩增菌株2004301的16S rRNA基因,获得约1 500 bp的基因片段,上传至Gene bank数据库,登录号为OP389068。NCBI序列比对结果表明,菌株2004301与鳗弧菌(GQ205444.1、MH507181.1)的16S rRNA基因序列高度一致,基于NJ法构建的系统发育树结果显示,菌株2004301与鳗弧菌(GQ205444.1、MH50718.1、KF460456.1)聚为一支(图4)。
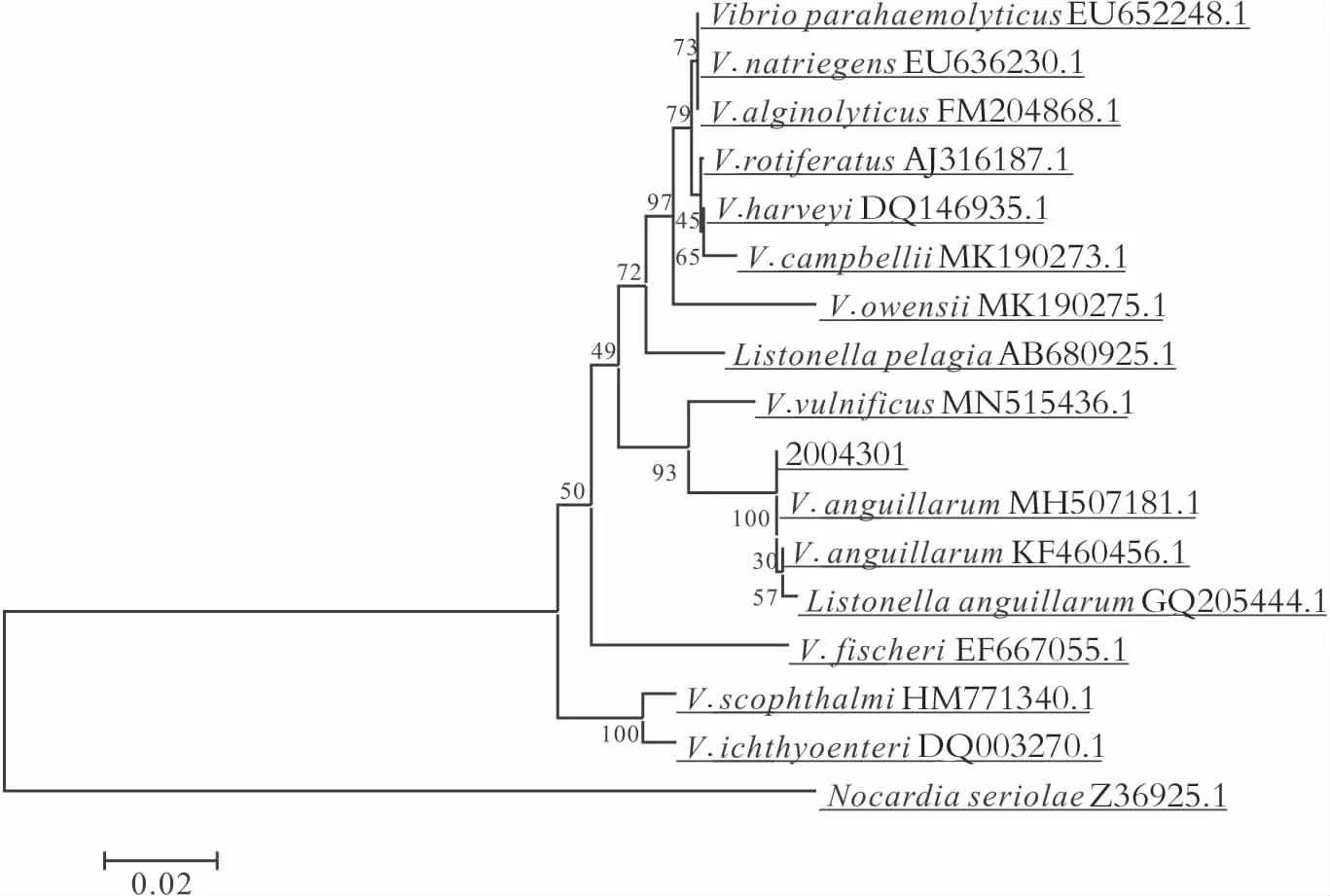
图4 基于16S rRNA基因构建的鳗弧菌系统发育树Fig.4 Phylogenetic tree of V.anguillarum based on 16S rRNA gene
为更准确地确定该菌的分类地位,采用引物(HSP60-P1:ACAACAGCAACGGTACTAGC;HSP60-P2:CAACTTTCACGATGCCAC)扩增该菌的hsp60基因,得到预期的约540 bp的目的片段(图5),测序序列上传至Gene bank数据库,登录号为OP422534,与Gen bank中已提交的弧菌hsp60基因序列进行比对分析,并构建2004301基于hsp60的系统发育树,结果显示2004301与鳗弧菌(CP023310.1、CP022468.1、AF230932.1、AM162559.1、CP022101.1、KV360391.1)聚为一支,置信度为100%(图6)。综合2004301的16S rRNA基因和hsp60的系统发育分析结果,结合菌株的形态及生理生化特性,鉴定菌株2004301为鳗弧菌。

图5 菌株2004301 hsp 60基因的扩增及PCR鉴定结果Fig.5 The results of strain 2004301 hsp 60 amplification and PCR identificationM:Marker DL2000;1,6:阴性对照;2:菌株2004301 tox R基因扩增;3:鳗弧菌tox R基因扩增;4:菌株2004301 emp A基因扩增;5:鳗弧菌emp A基因扩增;7:菌株2004301 hsp 60基因扩增。
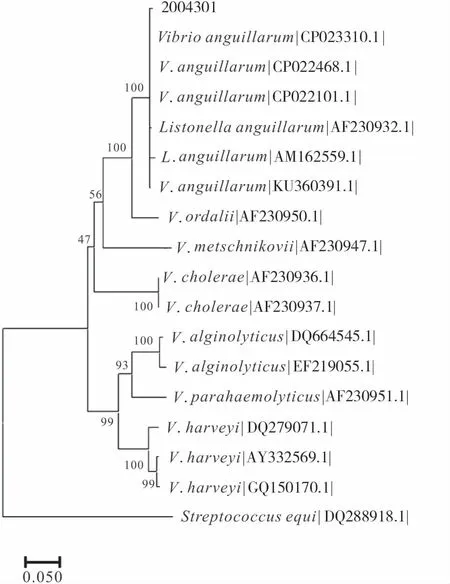
图6 基于hsp 60基因构建的鳗弧菌系统发育树Fig.6 Phylogenetic tree of V.anguillarum based on hsp 60 gene
采用鳗弧菌引物angF(正向引物序列为5′-CACCAACGAGCCTGAAGA-3′)和angR(5′-GGAGAGCCAGAATAGGTAAGAA-3′)扩增菌株2004301的toxR基因,得到预期大小为206 bp的碱基片段;利用鳗弧菌特异性引物对菌株2004301的empA基因进行扩增,获得了预期大小为248 bp的基因片段,见图5。进一步证实菌株2004301为鳗弧菌。
2.5 药敏实验
表3结果显示,菌株2004301对恩诺沙星、氟苯尼考、磺胺甲恶唑、链霉素、庆大霉素、氧氟沙星及环丙沙星敏感,对强力霉素、土霉素、万古霉素及头孢类药物不敏感,对强力霉素、痢特灵、四环素、诺氟沙星等中度敏感。
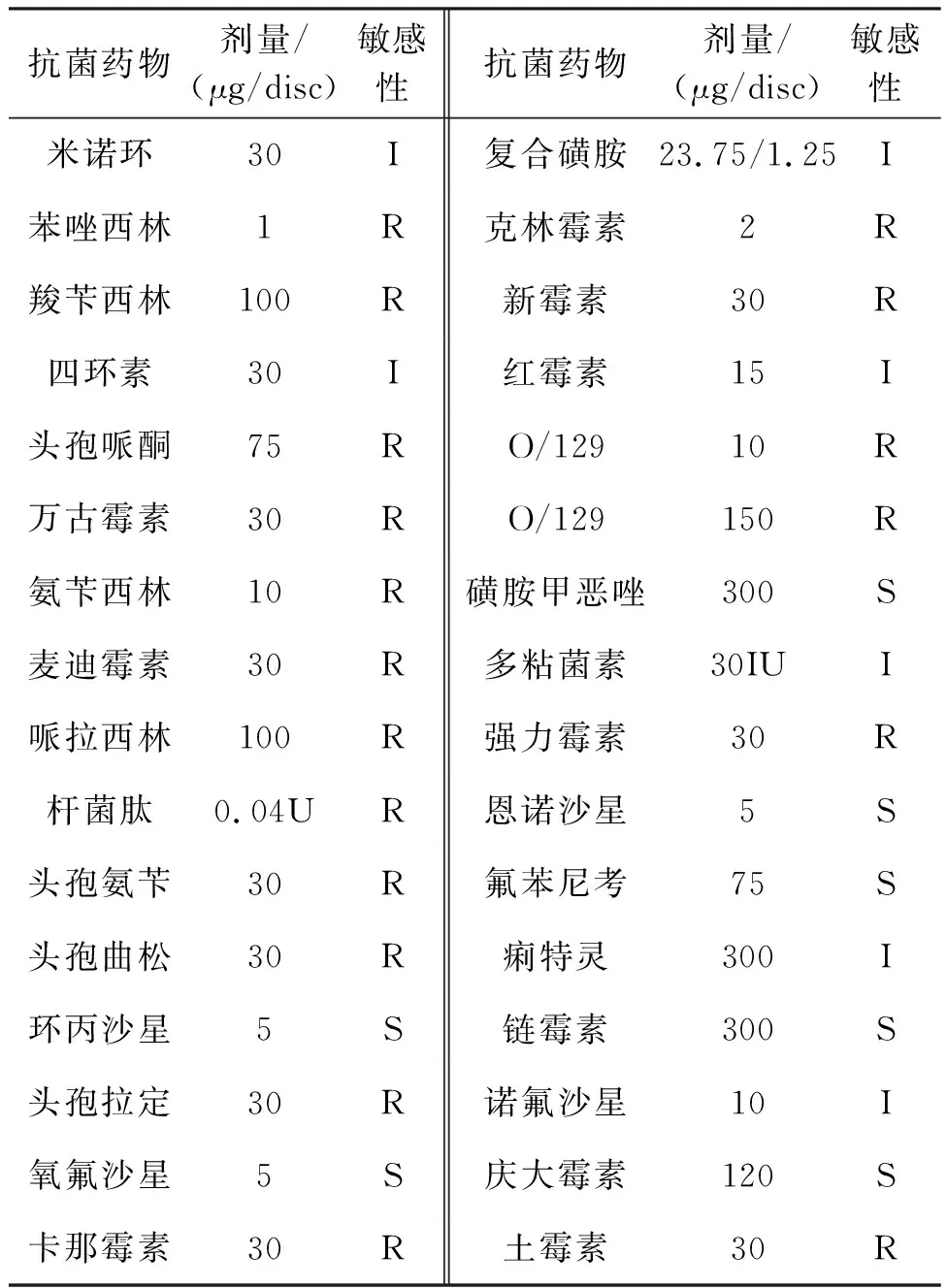
表3 菌株2004301的药物敏感性结果Tab.3 The results of sensitivity test to strain 2004301
3 讨论
鳗利斯顿氏菌也称鳗弧菌,是水产养殖动物的最常见的病原菌,1893年首次从“红疫”病的鳗鲡中分离到,1909年BERGEMAN首次命名为鳗弧菌。1985年由MACDONELL和COLWELL建议该菌由弧菌属归入利斯顿氏菌属,命名鳗利斯顿氏菌[16]。2011年THOMPSON等[17]利用多种分子生物学技术分析该菌基因组特征,提议将该菌恢复原先的分类,认为利斯顿氏菌属是弧菌属的同物异名,鳗利斯顿氏菌即为鳗弧菌,这一观点也得到了认可[18-20],故本研究采用鳗弧菌这一名称。作为欧洲现有记录中最早的鱼类病原菌,经过漫长的选择进化,鳗弧菌的宿主范围越来越广,致病性及环境适应性逐渐增强,现已知能够感染50多种海淡水养殖动物如半滑舌鳎(Cynoglossussemilaevis)、大菱鲆(Scophthalmusmaximus)、大口黑鲈以及中华绒螯蟹(Eriocheirsinensis)、牡蛎(Ostreidae)等,导致“弧菌病”,发病迅速,流行范围广,死亡率高,给养殖者造成巨大经济损失[21-22]。本次首次从养殖大口黑鲈体内分离到鳗弧菌,人工感染实验显示其半数致死量为5.3×104cfu/mL,具有较强毒力,为本次大口黑鲈病害的致病菌,进一步说明鳗弧菌的宿主广泛性及强致病性。
能够引起鱼类出现体表出血充血症状的病原较多,如诺卡氏菌(Nocardiaseriolae),维氏气单胞菌(Aeromonasveronii)、多种弧菌、鳗弧菌等[2,8,13-14],本研究菌株2004301生化特性对照伯杰氏细菌鉴定手册及已有报道中鳗弧菌的生化特性,发现菌株2004301与鳗弧菌较为一致,但VITEK2 GN鉴定卡未鉴定出该菌,分析可能为鉴定卡中培养液成分不适于该菌生长或鉴定卡对应的数据库中收录的该菌生化特性数据不全面。16S rRNA及hsp60为分子标记构建的系统发育树,均将菌株2004301与鳗利斯顿氏菌及鳗弧菌聚为一支,进一步验证了THOMPSON等[17]的观点,鳗弧菌即为鳗利斯顿氏菌;同时,以hsp60为分子标记的系统发育树,准确地将同种弧菌聚为一支,证实了hsp60基因可用作弧菌属细菌的种间分类。采用鳗弧菌toxR基因及empA基因的特异性引物也扩增得到预期大小的目的基因片段,证实菌株2004301即为鳗弧菌。
生产上对鳗弧菌引起的病害,主要的治疗措施仍为使用抗菌药物。在对鳗弧菌的药物敏感性研究方面,郭睿[23]从斜带髭鲷(Hapalogenysnitens)上分离的鳗利斯顿氏菌药物敏感性结果显示,该菌株对新生霉素、左氟沙星、奥氟沙星、氟苯尼考、恩诺沙星、诺氟沙星、罗红霉素等7种药物敏感,对四环素、利福平、强力霉素、氨苄西林等8种抗生素耐药;王庚申等[24]对养殖许氏平鲉中分离到的鳗利斯顿氏菌药敏筛选结果显示,该菌株对克拉霉素、氟罗沙星、萘啶酸、新生霉素、头孢唑肟等抗生素药物高度敏感,对红霉素、复方新诺明、阿奇霉素等药物中度敏感;对青霉素、头孢唑林、头孢拉定等多种药物具有抗性;姚学良等[22]从豹纹鳃棘鲈体内分离到的鳗利斯顿氏菌对48种抗生素的敏感性结果显示,对红霉素、强力霉素、四环素、头孢类等25种药物敏感,对恩诺沙星、罗红霉素、痢特灵等22种药物不敏感。本研究中菌株2004301对32种抗菌药物的敏感性实验结果表明,所分离到的菌株2004301对头孢类、万古霉素、强力霉素、新霉素、苯唑西林、氨苄西林、麦迪霉素、卡那霉素等17种药物耐药,对四环素、复合磺胺、呋喃唑酮等7种药物中度敏感,对沙星类药物、氟苯尼考等7种药物较为敏感,其耐药谱进一步扩大,提示对该菌进行耐药性监测及耐药基因研究的必要性。鉴于鳗弧菌不同分离株的药物敏感性差异,本研究结果仅可作为用药及耐药规律研究的参考,精准用药还应建立在对每次发病病原菌的分离及药敏实验基础之上。

