不同运动干预方式下运动强度对高尿酸血症的治疗相关研究进展
冯泽龙 薛政昊 陈德明

摘 要: 方法:梳理了国内外自2002年以来针对不同运动干预方式对高尿酸血症干预效果的研究文献,并从有氧运动、抗阻运动和有氧联合抗阻运动三种角度进行对比分析,探寻不同运动方式对高尿酸血症的治疗效果。目的:通过对比不同运动干预方式下的运动强度与高尿酸血症人群之间的关系,旨在探寻高尿酸血症患者运动干预的最佳方式和强度。结果:研究结果表明,规律性的步行和跑步等运动方式是高尿酸血症人群良好的运动干预手段。同时,不论采用何种运动方式,运动强度为70%VO 2max以下的中低强度都可以有效控制血清尿酸水平。
关键词: 高尿酸血症;运动方式;强度;无氧运动;嘌呤
中图分类号:G804
文献标识码:A
文章编号:1008-2808(2023)02-0088-09
Abstract: Methods: The research literature on the effects of different exercise interventions on hyperuricemia since 2002 at home and abroad was reviewed, and a comparative analysis was conducted from three perspectives: aerobic exercise, resistance exercise, and aerobic combined resistance exercise to explore the therapeutic effects of different exercise methods on hyperuricemia. Objective: To explore the best way and intensity of exercise intervention for patients with hyperuricemia by comparing the relationship between exercise intensity and hyperuricemia under different exercise intervention methods. Results: The research results show that regular exercise methods such as walking and running are good exercise interventions for people with hyperuricemia. At the same time, no matter what type of exercise is used, moderate to low intensities with exercise intensity below 70% VO 2max can effectively control serum uric acid levels.
Key words: Hyperuricemia; Exercise mode; Aerobic exercise; Anaerobic exercise; Purine
高尿酸血症(hyperuricemia,HUA)是一种危害人类健康的嘌呤代谢障碍性疾病。主要成因是作为人类嘌呤化合物的代谢终产物尿酸(UA),嘌呤代谢受障导致的UA的生成增多。空腹情况下异日两次空腹的血UA水平,男性≥416.5/umol/L(7.0mg/dL)女性≥357umol/L(6.0mg/dL)即为HUA [1-2] 。运动是HUA的主要辅助治疗手段。目前,HUA的干预手段分为药物治疗和非药物治疗。药物治疗主要使用别嘌呤醇和非布司他等黄嘌呤氧化酶抑制剂 [3] 。非药物治疗手段大多是为了维持健康的日常生活方式,包括控制体重、规律体育锻炼、饮食结构的调整、控制酒精的摄入量等 [4-5] 。针对HUA患者运动干预方式多为有氧运动形式,对于不同体质的HUA人群缺少运动方式的多样化。本文对近年来运动干预HUA人体试验研究进行分析,对比不同强度运动对HUA患者影响,进而总结更适用于HUA患者的运动强度。
以运动方式治疗手段为主的疗法,长期的运动,不仅能增强免疫力,也能加快新陈代谢以加速UA的排出来控制自身的血液中UA水平 [6] 。在临床当中取得了较好的治疗效果,并成为HUA的流行疗法。然而,尽管运动疗法的优势很多,但因个体差异的不同选择不同运动的治疗方式最终呈现的效果也不一样,《高尿酸血症/痛风患者实践指南》 [7] 明确指出,运动干预作为一种非药物治疗手段可应用于治疗HUA患者:体育运动对HUA及痛风患者非药物治疗效果显著中老年患者常伴有其他慢性疾病,伴随着年龄增长,运动能力降低,如何找到适用于患者自身的,且效果显著的运动方案,是值得医护及康复训练师思考的重点。本文通过文献中资料法通过知网、万方、pubmed、web of science等网站,针对HUA人群的运动干预治疗相关文献进行资料收集和总结,探讨有氧运動、抗阻运动和联合运动三种运动方式下不同运动强度干预HUA患者的治疗效果,并总结更适合于HUA患者的运动方式。为“健康中国2030”实现国民健康长寿,提高人民健康水平助力。
1 运动对高尿酸血症患者的影响
1.1 运动可降低患高尿酸血症的风险
体重超重与HUA密切相关,SUA水平较高的参与者更有可能超重和腰围异常。因此肥胖患者更容易诊断为HUA [8] 。Chen YT, Zhang NJ等 [9] 研究数据统计:男性470例为代谢健康型肥胖(MHO),女性1 567例为代谢不健康型肥胖(MUO)。对于代谢健康的女性参与者,超重的HUA患病率为与BMI正常组相似。多超重/肥胖与代谢健康和HUA患病率之间存在较强的相关性 [1] 。在HUA肥胖亚组的参与者中没有发现健康状况,代谢健康和肥胖的个人也应注意他们HUA的风险增加。
降低体重有助于改善SUA水平 [10] 。65岁以上的老年人体育活动,会减缓细胞的快速老化。高质量的体力活动而增加的蛋白质合成率更有可能降低HUA或比由于衰老而降低的蛋白质分解率,以及降低全因死亡和疾病的发病率 [11] 。身体活动的增加将减缓细胞的快速老化。同时,作为细胞分解产物核酸水平降低,使血液中的UA成分降低,从而降低HUA的风险 [12] 。因此,参加运动并降低体重可以很好的降低UA水平。
体力活动会增加能量消耗和葡萄糖消耗,从而使活跃的肌肉收缩,从而减少肥胖和胰岛素抵抗。体育活动本身似乎可以减少UA的释放以及嘌呤的分解。久坐的生活方式会由于身体倾斜而导致维持肌肉失去活动,这意味着比站立时消耗的能量更少。这表明肌肉中脂蛋白的失活以及葡萄糖使用量的减少,将导致胰岛素抵抗增加 [13] 。
一项关于体力活动与HUA之间关联的荟萃分析表明,参与低强度和中等强度体力活动的UA水平升高的风险降低12%,参与高强度体力活动的风险降低SUA水平的升高不会受到较高的酒精摄入量、高热量饮食、减少体力活动的影响 [14-15] 。SUA水平与BMI及代謝变量之间存在较强的相关性运动可以减缓HUA患者高血压发展的病理生理机制。在剧烈的运动之后,体内UA值水平还表现出短时间内递增趋势,这可能和激烈运动在很大程度上增强体内血清抗氧化能力有一定关系,参与体育活动并可以改善肥胖和胰岛素抵抗,增加能量消耗可以降低HUA的风险 [16] 。
1.2 运动会延长高尿酸血症患者的寿命
研究表明,HUA不仅会引发痛风,它还是一种独立风险因素,提高了人体患有慢性肾脏疾病、高血压症、动脉粥样硬化、糖尿病及高脂血症等病症的可能性,而且还加大了死亡风险 [17] 。在HUA的临床管理中,如果将体力活动与药物治疗进行比较,充分活动可能与服药一样有效。与药物治疗相比,运动既便宜又没有已知的副作用。体育活动对所有原因和心血管疾病死亡率都有好处。从事轻度、中度或剧烈体力活动的人群由心血管疾病导致的死亡率显著下降。经常参加体育活动有助于提高肌肉质量和收缩蛋白合成率 [18] ,降低因衰老引起的全因死亡率和发病率。相反,缺乏体力活动会导致腹部和内脏脂肪的增加,从而使相关代谢类疾病的风险增加 [19] 。一项多中心纵向研究显示 [20] ,HUA患者不运动(<1h/周)死亡率增加27%,其中男性平均预期生命减少4.3年,女性平均预期生命减少5~7年。而运动(≥7.5MET/hour/week)的HUA患者死亡率降低11%,预期寿命延长4~6年,说明适当的运动可以降低死亡风险,延长生命。
体育锻炼是一个有价值的因素,能够逆转与高SUA相关的27%的死亡率上升,而在高SUA的个体中,充分运动可以延长预期寿命4~6年,充分活动可能会克服高SUA和更多的危险。积极运动的人平均每天运动30min以上,每周坚持4天或更长时间,即周累计运动时间在150min。中级强度运动是当前很多机构所建议的运动强度。虽然这是一个值得追求的目标,但是那些锻炼量少的人,比如每天锻炼15min而不是30min以上,快走而不是慢跑,也减少了几乎所有由高SUA引起的死亡率增加 [21] 。
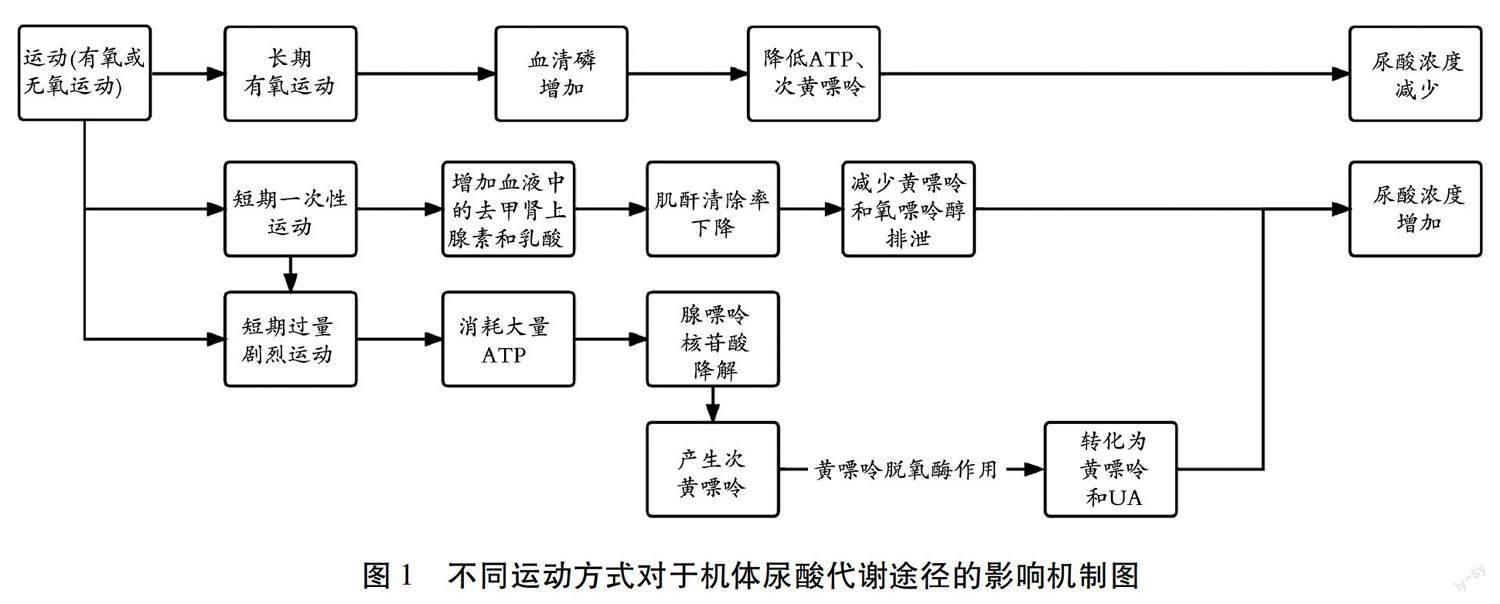
2 不同运动方式对于机体尿酸代谢途径的影响机制
运动对于机体UA代谢的益处已经得到广泛的认可,随着运动医学与生理学的研究不断深入其获得成果和效果等相关研究迅速发展,“运动是良医”的理念也与慢性病防治工作形成很好的交融,与基础类型的慢性病相比,针对于HUA患者的运动干预在方式选择上的讨论并不普遍,运动干预对于选择不同的运动形式和运动强度均会对SUA浓度产生不同的影响。
从短期或一次性的运动对UA浓度的影响来看,有氧运动和力量训练都会增加UA浓度的风险;运动增加血浆去甲肾上腺素浓度有助于减少尿黄嘌呤和氧嘌呤醇的排泄,羟嘌呤醇不能充分抑制运动引起的血浆中UA盐浓度的增加 [22] 。而剧烈运动会导致有氧代谢供能将无法满足能量需求,肌肉运动消耗三磷酸腺苷的速度大于运动肌肉产生和再供给的速度使嘌呤核苷酸降解,最终在运动肌肉中产生次黄嘌呤,这种物质具有罕见的黄嘌呤脱氢酶活性。黄嘌呤脱氢酶活性存在于肝脏和肠道中,次黄嘌呤被黄嘌呤脱氢酶转化为黄嘌呤和UA,UA是嘌呤代谢的最终产物,是机体在组织重塑和分解过程中正常产生的。
经过长期的运动也会提高ATP周转率,ATP代谢效率可能会极大地影响UA的产生 [23] 。血浆中UA、黄嘌呤和次黄嘌呤的浓度上升会增加肾对氧嘌呤的排泄并渗透到血液中,过量的ATP代谢为腺嘌呤,腺嘌呤最终转化为UA,使血SUA升高 [24] 。同时,运动由于无氧糖酵解而提高血中乳酸和去甲肾上腺素的浓度,血液重新分配,致肾血流量下降,低肌酐清除,从而影响肾脏UA的分解代谢 [25-26] 。从运动的长期效果来看:有氧运动可以明显降低UA浓度,而进行力量训练时UA浓度的变化更为敏感,但选择较低强度的力量训练不会引起UA浓度的明显变化也会有起到降低UA浓度的效果。
3 运动强度对尿酸的影响
研究证实运动干预可以对UA水平起到良好的调节作用。但对于HUA患者的运动干预方式仍存在争议。目前关于HUA的研究中的运动干预方式多以有氧运动为主,选择步行、慢跑、游泳等运动方式,帮助患者降低体内HUA水平、恢复生活能力 [27] 。有氧运动之所以被较为广泛的应用于HUA患者的运动处方中是由于早期学者普遍认为无氧运动会产生大量乳酸,从而影响机体UA代谢,不适合作为HUA患者的运动干预方式 [28] 。但随着研究的深入,越来越多的证据表明无氧运动训练也能够降低包括HUA在内的多种慢性疾病的风险。中低强度无氧运动并不会引发机体UA代谢障碍,因此无论是有氧运动还是无氧运动,运动强度是对SUA水平调节的关键 [29-30] 。
3.1 不同强度有氧运动对尿酸的影响
运动过程中通过有氧代谢使用氧以充分满足能量需求 [8] 。进行规律的有氧运动是临床上改善HUA的惯用疗法,HUA患者进行有氧运动的治疗效果受到廣泛的好评 [7] ,有氧运动可以增强体质,促进全身血液循环以及肌肉和组织对糖,脂肪,蛋白质的利用,从而加速UA的代谢,同时有氧运动还有助于减轻体重,肥胖会导致非酯化脂肪酸增多,从而影响黄嘌呤氧化酶等的活性扩充UA的合成。通过有氧运动减重,在一定程度上可使UA降低。有规律性的长期有氧运动可起到升高血液中的无机磷和降低血清腺苷的目的 [31] 。
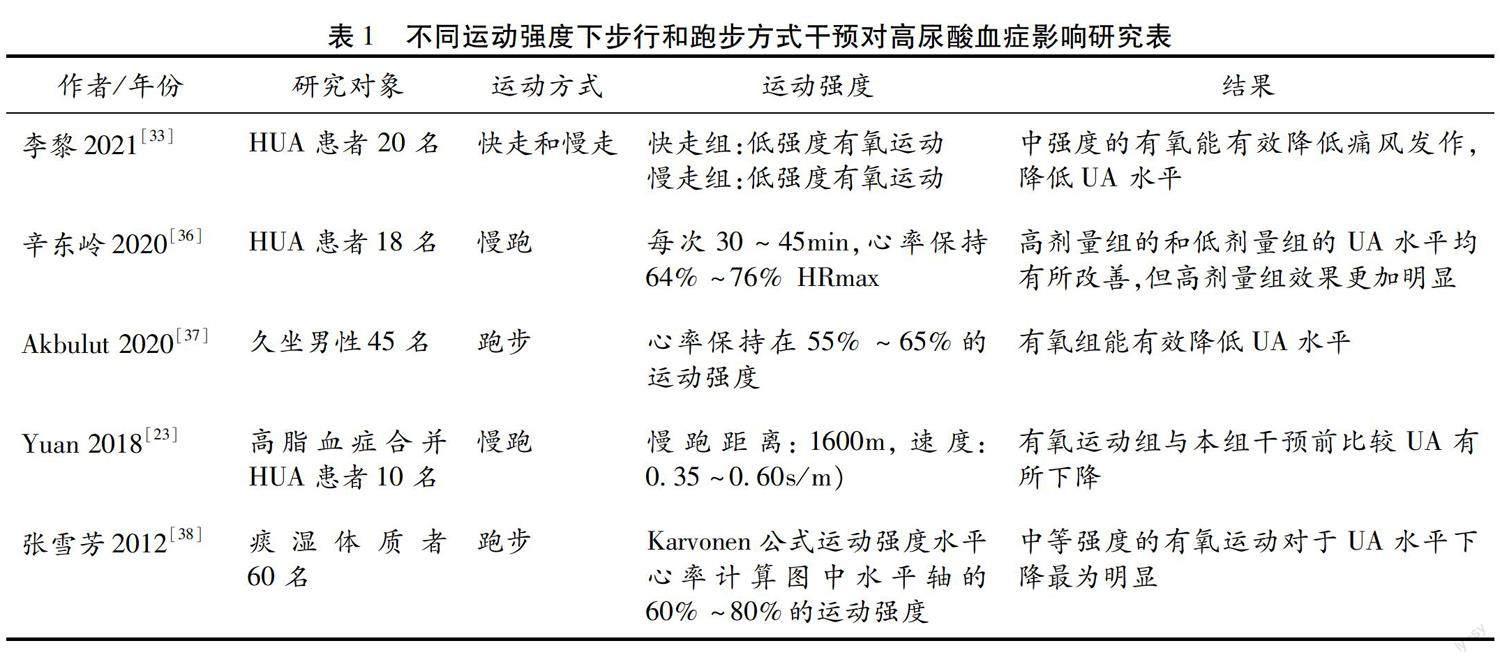
对于HUA患者来说,单次有氧运动时间的控制上最多应该不超过1h为宜,王秀梅等研究表明 [32] 对HUA患者进行心肺测试,制定每周5次、每次30min的个性化有氧锻炼处方。实验小组的SUA水平在运动干预8周后降低。张雪芳等人对痰湿体质者26人进行有氧运动,12周后空腹血糖、TC、TG、LDL-C、HDL-C、UA均有所下降。
针对每周的运动频率控制方面,有一项针对不同运动类型对HUA患者进行比较的研究发现运动形式选取每日10 000步的低强度有氧运动形式,结合每周5次的较高频率对患者UA值降低效果显著,这种方法更适用于没有运动习惯人群以及老年人 [33] 。刘振华 [34] 回顾性调查53名受试者,按照有氧运动频率分为高、低运动组,组数分别为18例和35例。其中高运动组个体成员的SUA浓度均低于低运动组个体,但无论是有氧运动还是抗阻训练都有提升SUA浓度的可能性,相比于运动形式,运动的强度对于UA影响更大,那么从长远角度考虑HUA患者降低UA的最佳方法是在提高运动频率的同时合理掌控运动强度 [35] 。
大多数氧运动方式推荐进行不同强度的步行和跑步的方式,因为此运动方式既简单又有效,而且不受场地的限制 [39] 。研究证实HUA患者进行中等强度的有氧训练能够有效降低SUA水平。Nishida [40] 经过为期1年的不同强度有氧运动后,SUA浓度降低最为明显的是中强度运动组。当HUA患者的运动频次过低,仅保持在每月1~2次时,其体内的UA值无明显变化,而以同样运动方式高频次进行训练的HUA患者在慢跑第45天左右保持每天训练的情况下SUA、血浆钙和三酰甘油均下降的同时血清磷水平提升,这与J Strength Cond Res等 [23] 的研究结果一致。他们报道,轻度至中度高血压患者在最大心率储备为60%~79%的男性中进行8周有氧运动,SUA降低41.8%。宋艳玲 [41] 等人研究观察53名男性受试者分为高运动组参加有氧运动>2年,每次30min以上和低运动组参加有氧运动<2年每次小于30min,发现高运动组血清总胆固醇(TC)/甘油三酯(TG)/低密度脂蛋白胆固醇(LDL-C)水平显著低于低运动组,高密度脂蛋白胆固醇(HDL-C)显著高于低运动组,说明长时间有规律的运动能有效降低老年人的血脂水平和SUA水平。长期有氧运动通过加速三磷酸腺苷(ATP)的周转率(表现为血清磷的浓度增加,血清ATP、腺苷和次黄嘌呤较运动前降低)使得血清UA水平降低,也表明ATP代谢加速,从而理想地减少UA的产生 [42] 研究显示久坐后进行中度有氧运动前后血清中ATP、ADP、AMP指标显著增加。
总的来说,长期有规律地进行适度的有氧运动的益处颇多,不但能够提高患者的运动热情度,通过运动认知水平的提高,改善饮食结构,抑制不健康生活行为。从而减少嘌呤的摄入,避免引起疾病的诱因,降低慢性病的发病率。更重要的是长期适度规律运动能有效地抑制SUA,降低血清ATP,从而促进人体新陈代谢,加速人体内循环使UA排出,达到恢复机体康健的目的。
3.2 不同强度无氧运动对尿酸的影响
无氧运动大部分是负荷强度高、瞬间性强的运动,包括抗阻训练或力量训练通常指身体克服阻力以达到肌肉增长和力量增加的过程 [43] 。
早期有日本学者在20世纪80年代所做研究表明有氧运动和无氧运动均对UA代谢有影响,无氧运动和有氧运动都是过多产生UA的主要诱因,但无氧运动还有助于UA的排泄,中高强度无氧运动会使嘌呤核苷酸的降解的同时造成大量乳酸堆积,而乳酸一定程度上会阻碍UA的正常排泄,肝脏中ATP细胞浓度的降低会激活AMP deaminase和5-核苷酸酶,导致肌苷酸和肌苷单磷酸的形成。这些物质依次迅速转化为次黄嘌呤、黄嘌呤和UA代谢为腺嘌呤,腺嘌呤最终转化为UA,从而导致血UA浓度升高 [23] ,这种从骨骼肌中释放的腺嘌呤核苷酸可以很好地为肝脏中增加UA的产生提供底物,这些机制从而导致SUA增加。在进行体育锻炼特别是长时间体育锻炼时,ATP的周转速度加快, 使得在运动过程中更容易达到无氧阈值,同时也是嘌呤核苷酸降解的加速阈值 [44-45] 。传统的抗阻力训练要求以重复次数直到力竭的强度进行,而会导致血UA水平升高的因素正是这种力竭性运动,因此传统力量训练不适合用于HUA患者或痛风患者 [46] 。
随着研究深入发现控制无氧运动的运动强度也可以很好的帮助HUA患者改善身体的UA水平。但运动强度超过了一定范围也会起到反向作用,Kaya等 [22] 的一项研究表明12周的力量训练自行车测功仪在70%的VO 2max下进行30min的运动增加了2型糖尿病患者的SUA。刘畅格 [47] 对12名男性进行跑步运动发现有氧供能无法满足能量需求,体内供能系统有氧代谢比例下降无氧代谢比例增加。并显示中高强度运动70%VO 2max为血尿酸极限运动负荷。Gozde在运动干预第2~3个月时将行走运动强度增加到60%~80%VO 2max后测得SUA水平高于训练前 [48] 。黄丽玲 [49] 等人的研究,针对13名职业运动员短期高强度训练后2天、4天、6天测得SUA水平显著提高,由此得出高强度的运动不适用于HUA患者。短期内不管是低强度(16~24RM)还是高强度(10RM)抗阻力运动后即刻和运动后第二天(17h)测得SUA数值都会上升推测发生了细微的肌纤维断裂破坏,导致肌肉内含有的嘌呤溶出细胞外被分解,与细胞破坏相关的SUA值的上升 [50] 。
3.3 不同强度有氧联合抗阻运动对尿酸的影响
对于HUA患者可采用有氧运动与无氧运动相结合的训练方式来干预UA值、尿素氮及肌酐水平,改善患者肺活量及最大摄氧量,从而提高患者的生活水平。也是推崇的运动方式,有氧联合抗阻运动方式让HUA患者拥有了更多的运动选择和运动趣味性。 [54] 一项研究选取38名HUA人员,运用高强度间歇训练结合有氧训练以85%~95%VO 2max运动4min,然后以50%~60%VO 2max运动3min,中间间歇3min,重复4组的方式发现能够降低HUA海勤人员的血UA水平、体脂肪含量及腰臀脂肪比,一定程度地增加骨骼肌质量。高宇等人选取8名HUA男性为研究,进行有氧联合抗阻训练持续12周,每周进行3~5次有氧运动,每周3次集中抗阻训练,SUA浓度较干预前降低了18%,治疗有效率显著提高 [55] 。
关于运动强度控制,在运动总量保持在中等强度是一个很好的选择 [5,56] 。一项研究男性在相同的总工作量下使用自行车测力仪,进行以下运动:轻度运动(VO 2max27.1%±0.8%),中度运动(VO 2max72.6%±2.5%)和力竭运动。轻度运动后SUA略有降低;中度运动后SUA有升高;力竭运动后SUA升高。因此适中强度的有氧,无氧结合训练有助于增强老年HUA患者肾脏对UA的排泄的能力。
Akbulut等人联合运动组在力量训练后进行20min,55%~65%VO 2max的跑步有氧训练,每周4天持续10周后发现SUA水平显著下降且其他生化指标改善程度要好于单独的跑步有氧运动 [37] 。提示有氧联合抗阻运动疗法能有效改善HUA患者的体质,降低SUA水平。由此可见,无论是有氧运动还是力量训练都可能提升血UA浓度,运动负荷对于UA影响比运动形式更大。
4 讨 论
4.1 运动方式
目前大多数运动干预方式习惯用于步行和跑步的有氧运动方式,因为更适用于没有运动经验人群,而且不分年龄和性别,同时也可以进行高频率的运动频率。长期中、低强度有氧运动可能是通过促UA排泄蛋白表达,缓解炎症反应、氧化应激、自噬等途径预防和改善肾损伤,保护肾功能,直接或间接达到降低SUA浓度的效果,在调控机体UA代谢和HUA防治中可能具有积极意义。因此,HUA患者在控制總体运动强度的前提下进行力量训练也是好的方法。对于有运动经验的HUA患者可采用有氧联合抗阻运动训练模式,能让HUA患者有更多的运动选择,提升了运动兴趣,同时还能改善更多的生化指标并兼顾了两种运动方式的优点。
4.2 运动强度
研究证实,体力活动与UA水平之间的关系可能取决于运动的强度。运动强度的不同对机体SUA浓度存在一定的影响,与运动方式相比,运动强度对UA浓度的影响更大,运动强度越大,UA浓度越高。以上文献显示运动干预为每周3~5次的运动频率,运动强度控制在最大心率的50%~65%区间不超过70%的运动强度能更好的控制好个人SUA水平,剧烈的运动和短时间高强度的运动会使身体的UA升高,过度剧烈的运动会导致的SUA升高不仅可能导致肾脏排泄减少或细胞外液体积收缩,而且还可能增加从活跃的骨骼肌中释放出来的UA前体的合成。有些学者认为强度较大的运动后机体中的UA值水平短期内呈现的上升趋势,这可能是因为剧烈的运动提高了机体中的血清抗氧化能力,产生大量乳酸,激活URAT1,有可能使肾脏的UA再吸收亢进,导致SUA值增加,HUA患者高强度抗阻力训练后的SUA值上升趋势可能与无氧运动结果产生的乳酸引起的UA排泄下降有关。因此不超过无氧阈值的肌肉锻炼就不会导致腺嘌呤核苷酸降解,适当的有氧锻炼对痛风和/或HUA患者有益,病情保持在无氧阈值以下,不会导致SUA和低黄嘌呤升高,这对痛风或HUA患者是有益的 [24,52] 。单次的剧烈运动可导致SUA水平短暂的升高 [24,56] 。说明体育活动强度是循环UA水平的重要调节因子。
4.3 运动频率
大部分以往研究都选择中低强度的运动,且每周进行最多5次最少3次,每次时间一般为30~60min/d,单次运动时间不超过一个小时,来保证身体得到充分活动,长时间有规律的进行运动可以使更多身体相关指标得到改善,同时也不易使身体积累疲劳使UA的水平产生负面影响而降低总体的干预效果。目前,存在用于锻炼剂量和强度,以预防或治疗HUA(没有统一的标准)。HUA患者训练后的主观感觉应是肌肉甚微酸胀,身体感觉微微出汗,没有极度的疲劳感,不影响第二天的日常生活和工作即可。此外,运动疗法的长期效果尚未得到证实,需要在未来的临床研究中进行验证。
5 结 论
HUA患者应根据自身的身体状态来选择可长期坚持有效的运动方式,有氧运动方式多为步行和跑步运动这也是一种既健康又经济有效的防治方法,能有效地帮助机体UA的代谢排出而且可以随时进行老少皆宜。有氧联合抗阻运动方式在保证安全有效的同时可以更好帮助HUA患者改善身体状况的运动方式,是一种受益程度很高的运动方式。在运动强度方面发现大多数学者在进行运动干预以使用70%VO 2max以下的中等或低等的运动强度在降低UA水平等方面均体现出很好的效果,同时还避免了由于乳酸堆积导致UA的副作用,每周3~5次,每次60分钟以内的运动量和频率适合大部分HUA患者的运动干预处方,对HUA患者的治疗有很好的病情控制。培养长期运动的习惯,改善患者不良的生活习惯,对HUA患者才会有更长期的益处。
参考文献:
[1] 薛政昊, 陈德明. 运动防治肥胖合并高尿酸血症患者研究现状与展望[J].哈尔滨体育学院学报, 2022, 40(5): 82-90.
[2] 马峥尧,郭玮,潘柏申,等.高尿酸血症患者血清尿酸水平与红细胞相关参数的相关性[J].检验医学,2019(6):486-490.
[3] 李世葵, 杜贤. 高尿酸血症与肾脏疾病关系的研究进展[J].世界最新医学信息文摘, 2020(84): 2.
[4] 陈德明, 牛衍龙. 糖尿病运动治疗方案中运动项目选择的研究[J].哈尔滨体育学院学报, 2014(2):87-96.
[5] 陈德明, 陈霄辉. 2型糖尿病运动治疗中的力量训练[J].哈尔滨体育学院学报, 2011, 29(2): 78-82.
[6] 张中菊, 王力宁. 高尿酸血症与肾脏疾病关系的研究进展[J].中国医药, 2019(3):471-473.
[7] 黄叶飞, 杨克虎, 陈澍洪, 等. 高尿酸血症/痛风患者实践指南[J].中华内科杂志, 2020(7):519-527.
[8] 韩文正. 12周抗阻训练结合有氧训练对单纯性肥胖成年男性的影响[D].成都:四川师范大学.
[9] CHEN Y, ZHANG N, SUN G, et al. Metabolically healthy obesity also has risk for hyperuricemia among Chinese general population: a cross-sectional study[J].Obesity research & clinical practice, 2016(10): S84-S95.
[10] ZHU Y, ZHANG Y, CHOI H K. The serum urate-lowering impact of weight loss among men with a high cardiovascular risk profile: the Multiple Risk Factor Intervention Trial[J].Rheumatology, 2010(12): 2391-2399.
[11] RODDY E, CHOI H K. Epidemiology of Gout[J].Rheumatic Disease Clinics of North America, 2014, 40(2): 155-175.
[12] MACARRóN-VICENTE J. Uric acid and evolution[J].Rheumatology (Oxford, England), 2010, 49(11): 2010-2015.
[13] BEY L, HAMILTON M T. Bey L, Hamilton MT. Suppression of skeletal muscle lipoprotein lipase activity during physical inactivity: A molecular reason to maintain daily low-intensity activity. J. Physiol. 551(Pt 2):673-82[J].Journal of Physiology, 2003, 551(2): 673-682.
[14] YUAN H, YU C, LI X, et al. Serum Uric Acid Levels and Risk of Metabolic Syndrome: A Dose-Response Meta-Analysis of Prospective Studies[J].J Clin Endocrinol Metab, 2015(11): 4198-4207.
[15] MERRIMAN T R. An update on the genetic architecture of hyperuricemia and gout[J].Arthritis Research & Therapy, 2015, 17(1).
[16] ASSAH F K, BRAGE S, EKELUND U, et al. The association of intensity and overall level of physical activity energy expenditure with a marker of insulin resistance[J].Diabetologia, 2008, 51(8): 1399-1407.
[17] 李謙华, 梁锦坚, 陈梁欣, 等. 年轻起病的痛风患者的临床特点及尿酸排泄特征分析[J].中华内科杂志, 2018(3):185-190.
[18] A C, DESOUZA, F L, et al. Regular aerobic exercise prevents and restores age-related declines in endothelium-dependent vasodilation in healthy men[J].Circulation, 2000.
[19] KARIMé G, JORGE F, LUIS M J. Physical Inactivity, Sedentary Behavior and Chronic Diseases[J].Korean Journal of Family Medicine, 2017, 38(3): 111-5.
[20] CHEN J H, WEN C P, WU S B, et al. Attenuating the mortality risk of high serum uric acid: the role of physical activity underused[J].Annals of the Rheumatic Diseases, 2015: 2034-2042.
[21] VILLEGAS R, XIANG Y B, CAI Q, et al. Prevalence and determinants of hyperuricemia in middle-aged, urban Chinese men[J].Metabolic Syndrome & Related Disorders, 2010, 8(3): 263-270.
[22] KAYA M, MORIWAKI Y, KA T, et al. Plasma concentrations and urinary excretion of purine bases (uric acid, hypoxanthine, and xanthine) and oxypurinol after rigorous exercise[J].Metabolism-clinical & Experimental, 2006, 55(1): 103-107.
[23] YUAN S, ZHANG Z W, LI Z L. Antacids side effect hyperuricaemia could be alleviated by long-term aerobic exercise via accelerating ATP turnover rate[J].Biomedicine & Pharmacotherapy, 2018, 99(3): 18-24.
[24] YAMANAKA H, KAWAGOE Y, TANIGUCHI A, et al. Accelerated purine nucleotide degradation by anaerobic but not by aerobic ergometer muscle exercise[J].Metabolism Clinical & Experimental, 1992, 41(4): 364.
[25] YAMAMOTO T, MORIWAKI Y, TAKAHASHI S, et al. Effect of norepinephrine on the urinary excretion of purine bases and oxypurinol[J].Metabolism-clinical & Experimental, 2001, 50(10): 1230-1233.
[26] YAMAMOTO T, MORIWAKI Y, TAKAHASHI S, et al. Effect of Lactate Infusion on Renal Transport of Purine Bases and Oxypurinol[J].Nephron, 1993, 65(1): 73-76.
[27] 曹雯, 孙洪平, 褚晓秋, 等. 生活方式干预与高尿酸血症[J].国际内分泌代谢杂志, 2017(3):172-173.
[28] GUIDELINES P A, STARTED G. Canadian Physical Activity Guidelines[J].2012.
[29] STAMATAKIS E, LEE I M, BENNIE J, et al. Does Strength-Promoting Exercise Confer Unique Health Benefits? A Pooled Analysis of Data on 11 Population Cohorts With All-Cause, Cancer, and Cardiovascular Mortality Endpoints[J].American Journal of Epidemiology, 2017.
[30] RIMM E B. A Prospective Study of Weight Training and Risk of Type 2 Diabetes Mellitus in MenWeight Training and Risk of Type 2 Diabetes[J].2012.
[31] YAN B, LIU D, ZHU J, et al. The effects of hyperuricemia on the differentiation and proliferation of osteoblasts and vascular smooth muscle cells are implicated in the elevated risk of osteopenia and vascular calcification in gout: An in vivo and in vitro analysis[J].Journal of Cellular Biochemistry, 2019.
[32] 王秀梅, 胡菱, 趙冬琰, 等. 心肺运动试验个体化有氧运动处方对不同年龄段高尿酸血症影响的研究[J].青海医药杂志, 2019(10): 10-12.
[33] 李黎, 梁伟欢, 黄巍峰, 等. 不同运动类型对社区高尿酸患者痛风发作率,尿酸水平,血清肌酐水平的影响[J].河北医药,2020,42(21):3214-3217.
[34] 刘振华, 严鹏飞, 刘陪沛, 等. 高龄老人有氧运动与血脂及尿酸关系的研究[J].人民军医, 2014, 57(8): 840-841.
[35] OGASAWARA M, HADANO S, KASUGAI A, et al. EFFECT OF THE DIFFERENCE OF EXERCISE INTENSITY ON THE CHANGES IN AMMONIA AND OXYPURINES[J].Japanese Journal of Physical Fitness & Sports Medicine, 1988, 37(1): 85-92.
[36] 辛东岭, 刘淑文, 戴剑松. 不同剂量运动对高尿酸血症影响的试验研究[J].科技资讯, 2020 (13):204-206.
[37] AKBULUT T. Responses of Uric Acid, Glucose, Thyroid Hormones and Liver Enzymes to Aerobic and Combined Exercises in University Students[J].Higher Education Studies, 2020, 10(1): 109-114.
[38] 张雪芳, 陆源源, 韩强, 等. 有氧运动干预对痰湿体质者血糖、血脂、血尿酸及体质量的影响[J].河北中医, 2012 (12):1774-1776.
[39] 刘文君, 李晓琳, 刘宇飞, 等. 有氧运动干预对肥胖儿童青少年炎症因子影响的Meta分析[J].哈尔滨体育学院学报, 2022, 40(6): 89-96.
[40] NISHIDA Y, IYADOMI M, HIGAKI Y, et al. Influence of physical activity intensity and aerobic fitness on the anthropometric index and serum uric acid concentration in people with obesity[J].Intern Med, 2011, 50(19): 2121-2128.
[41] 宋艳玲. 不同运动频次对高尿酸血症患者痛风发作率,血清肌酐水平,尿酸水平及尿pH值的影响[J].河北医药, 2020(21):3214-3217.
[42] MORITZ C, TEIXEIRA B C, ROCKENBACH L, et al. Altered extracellular ATP, ADP, and AMP hydrolysis in blood serum of sedentary individuals after an acute, aerobic, moderate exercise session[J].Molecular and Cellular Biochemistry, 2017,426(1-2): 55-63.
[43] FEIGENBAUM M S, POLLOCK M L. Prescription of resistance training for health and disease[J].Medicine & Science in Sports & Exercise, 1999, 31(1): 38.
[44] ITO A, KOGA Y, HADANO S, et al. Exercise-induced hyperuricemia(4) -Uric acid metabolism in sportsmen[J].Purine & Pyrimidine Metabolism, 1986, 10: 65-74.
[45] LAYEC G, TRINITY J D, HART C R, et al. In vivoevidence of an age-related increase in ATP cost of contraction in the plantar flexor muscles[J].Clinical Science, 2014.
[46] SáNCHEZ-LOZADA L, ANDRES-HERNANDO A, GARCIA-ARROYO F E, et al. Uric acid activates aldose reductase and the polyol pathway for endogenous fructose and fat production causing development of fatty liver in rats[J].Journal of Biological Chemistry, 2019.
[47] 劉畅格. 不同运动强度对男大学生血尿酸的急性影响; proceedings of the 第十二届全国体育科学大会, 中国山东日照, F, 2022[C].
[48] IN G, TASKIN H E, AL M, et al. Comparison of 12-week fitness protocols following bariatric surgery: aerobic exercise versus aerobic exercise and progressive resistance[J].Obesity surgery,2021,31(4):1475-1484.
[49] HUANG L L, HUANG C T, CHEN M L, et al. Effects of profuse sweating induced by exercise on urinary uric acid excretion in a hot environment[J].Chinese Journal of Physiology, 2010, 53(4): 254-261.
[50] SOUSA M R, SAAVEDRA F, NETO G R, et al. Resistance Training in Type 2 Diabetic Patients Improves Uric Acid Levels[J].Journal of Human Kinetics, 2014, 43.
[51] 李晓丁, 黄力平. 有氧运动和抗阻运动在痛风患者延续管理中的应用效果比较[J].山东医药,2021,61(35):72-75.
[52] 唐宇, 温永霞, 张文旭. 有氧运动联合力量训练对老年高尿酸血症患者的影响[J].中国老年保健医学, 2021(1):15-17
[53] FAELLI E, BISIO A, CODELLA R, et al. Acute and chronic catabolic responses to crossfit and resistance training in young males[J].International journal of environmental research and public health, 2020, 17(19): 7172.
[54] 傅婧, 黄育敏, 刘俊松. 高强度间歇训练对高尿酸血症海勤人员血尿酸及肌肉含量的影响[J].中华航海医学与高气压医学杂志, 2017, 24(5): 2.
[55] 高宇, 黄彩华. 12周有氧联合抗阻训练对血清尿酸水平的影响[J].福建体育科技, 2022(5):45-48.
[56] HADANO S, SAKAI S, OGASAWARA M, et al. EFFECTS OF EXERCISE INTENSITY ON PURINE CATABOLISM[J].Tairyoku kagaku Japanese journal of physical fitness and sports medicine,2010,37(3):225-233.

