川金解郁汤干预轻中度抑郁患者的疗效分析及代谢组学研究
孙文 肖江 郑欣宇 周绍明 杨萍
〔摘要〕 目的 分析川金解郁湯(Chuanjin Jieyu Decoction, CJJYD)对轻中度抑郁(mild to moderate depression, MTMD)患者干预前后的代谢物差异性及相关代谢物变化规律,为CJJYD治疗MTMD提供科学依据。方法 纳入湖南省脑科医院2020年1月至12月期间23名MTMD患者作为病例组(Dep组)、健康人21名作为对照组(CT组),Dep组予以CJJYD干预6周,早晚各服1剂,每次100 mL。采用汉密尔顿抑郁量表(Hamilton depression scale, HAMD)和抑郁自评量表(self-rating depression scale, SDS)评定疗效;超高效液相色谱-高分辨质谱联用技术分析干预前后血浆代谢物变化;采用多维度统计分析,筛选差异代谢物并进行分析。结果 MTMD患者经CJJYD干预后,HAMD和SDS评分明显降低(P<0.01)。与CT组相比,Dep组患者血浆中检测145个差异代谢物,涉及亚油酸代谢等38条代谢通路;Dep组经CJJYD干预后,患者血浆中检测46个差异代谢物,涉及烟酸和烟酰胺代谢等11条代谢通路。结论 MTMD患者经CJJYD干预后,抑郁症状得到改善,代谢组学有差异性代谢物,涉及亚油酸代谢、烟酸和烟酰胺代谢、精氨酸和脯氨酸代谢等代谢通路,可能为其抗抑郁的机制之一。
〔关键词〕 抑郁症;川金解郁汤;超高效液相色谱-高分辨质谱;差异代谢物;郁金;川芎
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.05.028
Clinical efficacy and metabolomics of Chuanjin Jieyu Decoction in treating mild to
moderate depression
SUN Wen, XIAO Jiang, ZHENG Xinyu, ZHOU Shaoming*, YANG Ping
1. Department of Psychiatry, Hunan Brain Hospital, Changsha, Hunan 410007, China; 2. School of Clinical Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To analyze differential metabolites and the associated metabolite change rules of Chuanjin Jieyu Decoction (CJJYD) in treating mild to moderate depression (MTMD) both before and after intervention, and to provide scientific bases for treating MTMD patients with CJJYD. Methods A total of 23 MTMD patients received in Hunan Brain Hospital from January to December 2020 were included as case group (Dep group). In addition, 21 healthy people were set as the control group (CT group). Dep group was treated with CJJYD for 6 weeks, with 1 dose of 100 mL in the morning and the same dose in the evening. The Hamilton depression scale (HAMD) and self-rating depression scale (SDS) were used to assess the efficacy, and ultra-high performance liquid chromatography-high resolution mass spectrometry (UPLC-MS) was taken to analyze the changes in plasma metabolites before and after treatment. Differential metabolites were screened and analyzed using mutil-dimensional statistical analysis. Results MTMD patients showed a significant lower HAMD and SDS scores after being treated with CJJYD (P<0.01). A total of 145 differential metabolites were detected in the plasma of Dep group compared to CT group, involving 38 metabolic pathways such as linoleic acid metabolism; 46 differential metabolites were identified in the plasma of Dep group after CJJYD intervention, involving 11 metabolic pathways such as niacin and nicotinamide metabolism. Conclusion Depression symptoms were alleviated in MTMD patients after CJJYD treatment. Differential metabolites were shown in metabolomics after CJJYT intervention, involving metabolic pathways such as linoleic acid metabolism, niacin and nicotinamide metabolism, and arginine and proline metabolism, which may be one of its anti-depression mechanisms.
〔Keywords〕 depression; Chuanjin Jieyu Decoction; ultra-high performance liquid chromatography-high resolution mass spectrometry; differential metabolites; Yujin (Radix Curcumae); Chuanxiong (Rhizoma Chuanxiong)
抑郁症是一种机制复杂且病因未明的精神疾病,临床表现以情绪低落、思维迟缓、认知功能损害、意志活动减弱和躯体症状为主,加重了家庭以及社会的负担[1]。中医学认为抑郁症发病主要与五脏功能失调、情志不畅有关,患者主要表现为由情志不舒、气郁不伸所致的心情抑郁、咽有梗阻、胸胁胀满、易怒善哭等一系列症状[2]。世界卫生组织估计,到2030年,抑郁症或将位列全球疾病负担首位[3]。使用常规西药治疗抑郁症在短期内是有效的,但不会延迟或阻止疾病的发展,且治疗效果具有不稳定、不良反应大和用药依从性差的缺点[4-5],故治疗抑郁症最紧迫的任务之一就是寻找到疗效高、不良反应小的新药[6]。
代谢组学可以直观地表征整体代谢特征[7],对生物身体内的每一个代谢产物开展定量分析,并找寻到其与病理生理变动的相对关系。本研究通过超高效液相色谱-高分辨质谱联用技术测定轻中度抑郁(mild to moderate depression, MTMD)患者经川金解郁汤(Chuanjin Jieyu Decoction, CJJYD)干预前后血浆代谢组学数据,利用多元统计分析方法,筛选出MTMD患者经CJJYD干预后相关的差异代谢物,进而分析与之相关的代谢通路变化规律,为临床应用CJJYD治疗MTMD提供科学依据。试从代谢组学的方向,解释湖南省腦科医院院内制剂CJJYD改善MDMT患者症状的机制。
1 资料与方法
1.1 研究对象
本研究将于2020年1月至12月在湖南省脑科医院就诊MTMD患者(Dep组)及体检正常对照(CT组)。Dep组纳入23名MTMD患者,CT组纳入21名健康对照。Dep组13名男性,10名女性,年龄15~45(24.67±8.56)岁;CT组13名男性和8名女性,年龄16~45(25.90±9.03)岁;两组受试者性别和年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究通过湖南省脑科医院伦理委员会准许(伦理批准号:2019-6-26),全部受试者在研究开始前都签定了知情同意书。
1.2 诊断标准
1.2.1 西医诊断标准 参照中国成人失眠伴抑郁焦虑诊治专家共识[8]诊断为MTMD:汉密尔顿抑郁量表(Hamilton depression scale, HAMD)评分7~24分[9]。
1.2.2 中医辨证标准 本试验的MTMD患者为肝郁气滞证,其诊断标准为:精神抑郁,胸胁胀满、情绪不宁,或咽中如有异物梗塞,或频发嗳气,善太息,脘痞,悲伤欲哭,舌苔薄白,脉弦[10]。
1.3 纳入标准
(1)符合中国成人失眠伴抑郁焦虑诊治专家共识MTMD的诊断标准[8];(2)HAMD评分7~24分[9]及抑郁自评量表(self-rating depression scale, SDS)评分50~69分[11];(3)年龄18~60岁;(4)患者及家属均签署了知情同意书,对整个实验流程均知情;(5)患者在参与试验前1个月内未使用任何抗精神病药物及中药的治疗。
1.4 排除标准
(1)受试者不能严格遵守研究要求;(2)有潜在自杀风险患者;(3)严重躯体疾病或脑器质性疾病;(4)严重的多器官功能障碍者;(5)社会功能受损严重;(6)伴发精神病症状(幻觉、妄想)。
1.5 主要仪器与试剂
Waters ACQUITY UPLC BEH Amide(2.1 mm×100 mm, 1.7 μm)液相色谱柱;超高效液相色谱仪(型号:Vanquish,赛默飞世尔科技公司);高分辨质谱仪(型号:Q Exactive HFX,赛默飞世尔科技公司)。乙酸铵(批号:631-61-8,SIGMA-ALDRICH)。
1.6 干预方法
CT组:对受试者不予任何干预处理。Dep组:予CJJYD干预。CJJYD方由川芎10 g,红景天15 g,郁金10 g,延胡索10 g,刺五加15 g,路路通8 g,土鳖虫5 g,蜈蚣2 g,地龙10 g,石菖蒲10 g组成,所有中药饮片均购自湖南君昊中药饮片科贸有限公司。用水煎煮,每日煎煮2次,早晚各服1剂,每次100 mL,疗程为6周。
1.7 样品采集及处理方法[12]
Dep组受试者在经CJJYD干预前采集一次静脉血,经CJJYD干预6周后采集一次静脉血,而CT组只需采集一次静脉血即可。采集受试者空腹肘静脉血10 mL(使用真空促凝采血管,采集时间为8:00),将采血管混匀,快速置于离心机中,温度4 ℃、3500 r/min(半径15 cm)离心15 min。移取样品100 μL至EP管中,随后加入萃取液400 μL[(甲醇∶乙腈=1∶1(V/V),含内标混合物)],颠倒混匀30 s,后冰水浴超声10 min,然后将离心管置于-40 ℃条件下,静置1 h。随后将其放置在离心机中,温度4 ℃、12 000 r/min(半径86 cm)离心15 min,取上清液至进样瓶中上机检验。全部样品另取相等上清液混合成质控样品(quality control, QC),上机检验。
1.8 行为学检测
HAMD和SDS评定的时间分别于干预前及干预后6周后。其中,HAMD评定量表由17个项目构成,每一个条目的分值为0~4分,总分0~68分。得分越高,抑郁程度越重[9]。SDS由20个条目构成,每一个项目分值为1~4分,总成绩20~80分。得分越高,抑郁程度越重[11]。
1.9 色谱条件及质谱条件
1.9.1 色谱条件 样品采集及处理方法[13]:流动相A为水相,含25 mmol/L乙酸铵和25 mmol/L氨水,流动相B为乙腈。采用梯度洗脱:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B。流动相流速0.5 mL/min,柱温30 ℃,样品盘温度4 ℃,进样体积2 μL。
1.9.2 质谱条件 分别采用正离子和负离子扫描模式对质谱分析数据进行收集,离子源主要参数如下,鞘气流速:50个Arb单位;辅助气体流速:10个Arb单位;毛细血管温度:320 ℃;碰撞能量:10、30、60 V;电喷雾电压:3.5 kV(+)或-3.2 kV(-)。
1.10 数据处理及统计学分析
采用SPSS 22.0进行数据处理。计量资料以“x±s”表示,满足正态性及方差齐性的采用两样本独立t检验,不满足正态性及方差齐性的采用Wilcoxon秩和检验,多组间进行比较采用单因素方差分析。以P<0.05为差异有统计学意义。完成峰识别、峰提取、峰对齐等工作。过滤单个峰值,保留空值不超过50%的峰面积数据,进行内部归一化处理[14]。在提取和处理数据后,进行多维统计分析[15]。单维统计分析包括火山圖、T检验、变异倍数(fold change, FC)分析。通过数据库BiotreeDB V2.1检索精确分子质量,经二级谱图匹配的方式对代谢物结构进行鉴定,Cutoff值设置为0.90。
2 结果
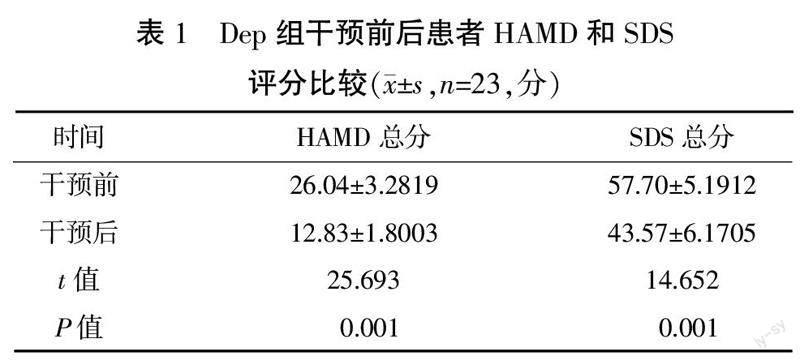
2.1 Dep组干预前后HAMD和SDS评分比较
与干预前比较,干预后Dep组HAMD和SDS评分明显降低(P<0.01)。详见表1。
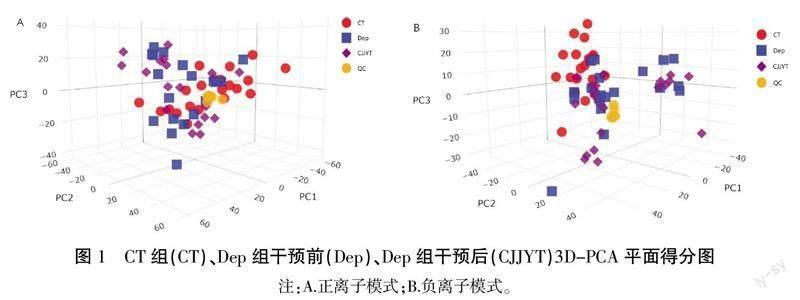
2.2 代谢组质量控制
QC在测试期间进行实时检测,以评价分析系统的稳定性并确保收集数据的质量。QC样本(黄色)在PCA图中聚集在一起,表明本项目仪器分析系统稳定,生成数据可信。详见图1。
2.3 多元变量统计分析
血浆的代谢谱信息通过液相质谱色谱联用技术获得,本研究采用PCA技术分析血浆的代谢谱以获得相应的散点图,结果表明,在PC1和PC2、PC3三维图上,CT组与Dep组干预前及Dep组干预后均存在明显的分离趋势。详见图1。
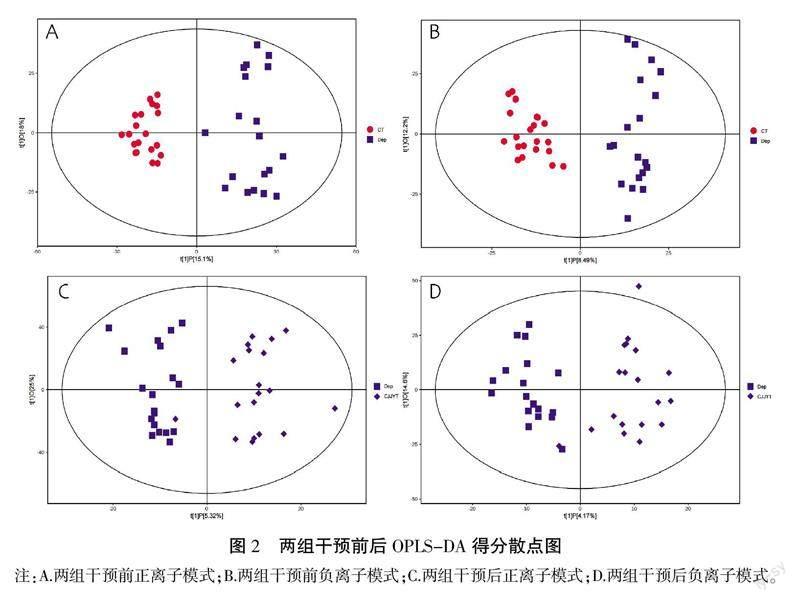
采用监督的模式识别方式,OPLS-DA分析在实现降维的同时考虑了分组信息,因此,它可以用于特征选择以及分类,去除与实验观察不相干的任意信息,最大程度地获取与实验操作有关的信息,寻找与两组差别有关的代谢物。也就是在代谢组学数据分析中,可以用于筛选不同组之间的差异代谢物。详见图2。
OPLS-DA模型去除实验数据的无关信息,但是建立的模型需要进行验证,本实验研究采用7倍交叉验证和置换检验对建立的模型进行检验。CT组与Dep组干预前的R2Y、Q2在正离子模式下分别为0.56、-1.07,负离子模式下分别为0.72、-1.01;Dep组干预前、Dep组干预后的R2Y、Q2在正离子模式下分别为0.65、-0.78,负离子模式下分别为0.77、-0.56。总体来说,模型具有良好的有效性。
2.4 差异代谢物筛选
通过OPLS-DA分析,每个代谢物可以得出一个VIP值,即变量重要性投影(variable importance in projection, VIP),VIP值越大,代表该物质对于区分两组所具有的贡献越大,通常将T检验的P<0.05结合VIP>1作为显著性差异代谢物的筛选标准。两组实验物质定量的比值——FC,用于评估CT组、Dep组干预前、Dep组干预后之间差异代谢物变化的显著性,FC>1则表示两组相比,代谢物上调。CT组与Dep组干预前比较,正离子模式下,D-丙氨酸、胆碱、丙烯酰胺等代谢物上调,负离子模式下,9-十六碳烯酸、花生四烯酸等代谢物上调。与Dep组干预前比较,Dep组干预后正离子模式下右旋脯氨酸、吡啶甲酸、苯甲醛等代谢物上调,负离子模式下十五酸等代谢物上调。反之,FC<1则表示两组相比,代谢物下调。CT组与Dep组干预前比较,正离子模式下海藻糖、腺嘌呤等代谢物下调,负离子模式下甘油醛、左旋葡聚糖等代谢物下调。与Dep组干预前比较,Dep组干预后正离子模式下二烯酸、7-酮基胆固醇等代谢物下调,负离子模式下邻苯二酚、琥珀酸半醛、琥珀酸等代谢物下调。详见图3。
为了对所筛选的差异代谢物的合理性进行评价,对获得的差异代谢物进行聚类分析[16],分别获得CT和Dep组干预前、Dep干预后的热图和s-plot图。在热图中,可以显著的观察到CT和Dep组干预前、Dep干预后分别分为两类,表明筛选的代谢物是合理的。详见图4—5。
2.4.1 CT组与Dep组干预前的差异代谢物 与CT组对比,Dep组干预前血浆中共筛选出145个差异代谢物,正离子模式和负离子模式下分别筛选出97个和48个差异代谢物。其中,D-丙氨酸、胆碱、1-苄氧基-3-吲哚甲醛、棕榈酰左旋肉碱、N-鸟氨酰基-L-牛磺酸等102个代谢物显著升高(P<0.05,P<0.01),海藻糖、腺嘌呤、甘油醛、吡咯烷酮羧酸等43个代谢物显著降低(P<0.05,P<0.01)。详见表2。
2.4.2 Dep组干预前后差异代谢物 与干预前比较,干预后Dep组血浆中共筛选出46个差异代谢物,正离子模式和负离子模式下分别筛选出37个和9个差异代谢物。其中,D-脯氨酸、2-异丙基苯基甲基氨基甲酸酯等33个代谢物显著升高(P<0.05,P<0.01),7-酮基胆固醇、13-羟基十八碳二烯酸等9种代谢物显著降低(P<0.05,P<0.01)。详见表3。
2.4.3 差异代谢物的代谢通路分析 筛选出差异代谢物后,对与代谢物相关的代谢通路进行筛选,从而找出其中关联性最高的关键代谢通路[17]。在权威数据库KEGG和PubChem中,对差异代谢物进行映射获得匹配信息后,在相应物种Homo sapiens(human)的通路数据库中进行代谢通路分析,结果信息以气泡图进行呈现。详见图6。正离子模式下,CT组与Dep组比较,共筛选出亚油酸代谢,精氨酸和脯氨酸的代谢,赖氨酸代谢,组氨酸代谢,甘油磷脂代谢等14条差异代谢通路(图6A)。Dep组干预后,共筛选出3条差异代谢通路,包括亚油酸代谢,烟酸和烟酰胺代谢,精氨酸和脯氨酸代谢(图6B)。负离子模式下,CT组与Dep组干预前比较,共筛选出牛磺酸和次牛磺酸代谢,花生四烯酸代谢,赖氨酸代谢、赖氨酸生物合成,氨酰t-RNA生物合成等24条差异代谢通路(图6C);Dep组干预后,共筛选出丙氨酸、天冬氨酸、谷氨酸代谢、丁酸甲酯代谢、柠檬酸循环、酪氨酸代谢等8条差异代谢通路(图6D)。正负离子模式检测下的各种代谢通路,主要涉及氨基酸代谢和能量代谢,其中,氨基酸代谢通路检测到的差异性代谢物最多。
3 讨论
抑郁症是临床常见的精神心理疾病之一,患者以心境障碍和焦虑障碍为主要特征,严重者可有自伤和自杀行为,且抑郁发作往往有复发倾向,影响人们的身心健康和生活质量。CJJYD是湖南省脑科医院的一种治疗抑郁症的中药方剂,其组成为川芎、红景天、郁金、延胡索、刺五加、路路通、土鳖虫、蜈蚣、地龙、石菖蒲。郁金具行气解郁、清气凝神之功。β-谷甾醇是郁金中主要包含的一种植物甾醇,根据研究发现,β-谷甾醇可以显著提高抑郁小鼠脑内5-羟色胺和去甲肾上腺素的水平,缓解小鼠抑郁样行为[18];川芎活血行气、通达解郁,可通过上调环磷腺苷效应元件结合蛋白-脑源性神经营养因子通路,增加脑源性神经营养因子的表达,改善脑卒中后抑郁大鼠的认知功能[19],二者合为君药。红景天益气活血、养心通脉,刺五加益气健脾、补肾安神,延胡索活血化瘀、疏肝行气,三者合为臣药。路路通祛风活络,助川芎活血行气之力;石菖蒲开窍豁痰、醒神益智,增郁金解郁宁神之功,二者共为佐药。土鳖虫破血逐瘀,蜈蚣通络止痛,地龙定惊通络,共为使药。10味药共同发挥抗抑郁的作用。MTMD患者口服CJJYD 6周后,其HAMD和SDS得分均低于干预前(P<0.01),说明CJJYD能够改善MTMD患者的抑郁症状。
本研究致力于讨论CJJYD干预MDMT的作用机制,在此项研究中,本研究团队应用非靶向治疗代谢组学技术,研究MTMD患者CJJYD干预前后血液中代谢物的变化趋势,筛选出合理的差异代谢物,找到与代谢物关联性最高的关键通路,探寻代谢物、代谢通路和生理病理机制的相对关系。在本研究中,QC检验验证了分析系统的稳定性,T检验和OPLS-DA模型紧密结合用以筛选出各组间显著的差异代谢物,聚类分析法证明了本研究中筛选出的差异代谢物是合理的。与CT组对比,Dep组的差异代谢通路主要聚集在亚油酸代谢、精氨酸和脯氨酸的代谢、赖氨酸代谢、组氨酸代谢、甘油磷脂代谢、牛磺酸和次牛磺酸代谢等通路上。谷氨酸是介导大多数中枢兴奋性神经传导的递质,脑内神经元中谷氨酸的合成、代谢和再摄取异常时介导的兴奋性毒性会造成脑内神经元损伤,与抑郁症的发生密切相关[20]。牛磺酸是机体内的一种极为重要的神经递质,其能通过明显减少促肾上腺皮质激素释放因子、促肾上腺皮质激素、皮质醇分泌来改善抑郁症的症状[21],慢性不可预知温和应激通过激活TLR4介导的炎症反应,诱发磷脂代谢紊乱,是抑郁症发生的机制之一[22],结合本研究结论,进一步验证以上代谢通路在抑郁症的发生中起着重要性的主导作用。Dep组经CJJYD干预后的差异代谢通路主要富集在亚油酸代谢、烟酸和烟酰胺代谢、精氨酸和脯氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、丁酸甲酯代谢、柠檬酸循环、酪氨酸代谢等通路上。谷氨酸可在谷氨酸脱羧酶的作用下生成γ-氨基丁酸(γ-aminobutyric acid, GABA),突触间隙里的谷氨酸和GABA被星形胶质细胞再摄取后进一步转化成谷胺和谷氨酸。GABA是一种体内重要的抑制性神经递质,焦虑、抑郁等情绪越严重,体内GABA含量减少越明显[23]。人类的部分边缘脑区,前额叶皮质中存有GABA能神经系统投影,这些脑区与情绪认知作用有密切的关系,谷氨酸代谢通路失调可能会影响边缘脑区、前额叶皮质的功能,这应该是抑郁症患者谷氨酸水平上升、GABA水平降低的主要原因之一[24]。已有研究发现[25],腐胺的抗抑郁功效在逼迫游泳试验和悬尾实验操作中被验证,这有可能是通过抑制NAMDR介导多胺位点,与NAMDR相互影响得到的结果。谷氨酰胺可以进入三羧酸循环,天冬氨酸参加精氨酸的生物合成[26],正丁酸甲酯是亮氨酸的中间代谢产物,可对肌肉蛋白质的生成和溶解进行调控[27],以上代谢通路主要涵盖氨基酸代谢和能量代谢,其中,氨基酸代谢途径检测出的差异代谢物较多。因而,CJJYD很有可能是通过氨基酸代谢通路使抑郁症患者的症状改善。
本研究所采用的方法能较为系统全面的筛选、鉴定出与CJJYD干预MDMT有关的代謝物和代谢通路,但是也存在一定的局限,如每组样本数比较小,未采用基因组学、蛋白组学验证CJJYD的疗效。因此,研究结论有利于论述CJJYD干预MDMT的有关机制,可以为临床治疗MDMT提供启发,但尚需大样本研究加以验证。
参考文献
[1] 阎路达, 周 鹏, 赖美琪, 等. 针刺联合低频rTMS治疗轻中度抑郁障碍共病失眠: 随机对照试验[J]. 中国针灸, 2023, 43(4): 374-378, 400.
[2]过伟峰, 曹晓岚, 盛 蕾, 等. 抑郁症中西医结合诊疗专家共识[J]. 中国中西医结合杂志, 2020, 40(2): 141-148.
[3] OPOKU ASARE K, TERHORST Y, VEGA J, et al. Predicting depression from smartphone behavioral markers using machine learning methods, hyperparameter optimization, and feature importance analysis: Exploratory study[J]. JMIR MHealth and UHealth, 2021, 9(7): e26540.
[4] 岳鸞依, 张永康. 失眠症伴抑郁、焦虑症状中西医论治的研究进展[J]. 新医学, 2023, 54(1): 26-29.
[5]潘 瑾, 王 墉, 高志礼, 等. 中医经典名方治疗抑郁症的研究进展[J]. 世界科学技术-中医药现代化, 2022, 24(7): 2809-2816.
[6] 王孟迪, 姚勤伟, 薛 涛, 等. 3种抗抑郁中药方作用比较研究[J]. 湖南中医药大学学报, 2021, 41(9): 1327-1333.
[7] 李 翔, 曾晓铃, 顾政平, 等. 基于代谢组学探讨电针对WKY抑郁大鼠的抗抑郁作用[J]. 世界科学技术(中医药现代化), 2022, 24(6): 2186-2194.
[8] 中华医学会神经病学分会, 中华医学会神经病学分会睡眠障碍学组, 中华医学会神经病学分会神经心理与行为神经病学学组. 中国成人失眠伴抑郁焦虑诊治专家共识[J]. 中华神经科杂志, 2020, 53(8): 564-574.
[9] DEMYTTENAERE K, KIEKENS G, BRUFFAERTS R, et al. Outcome in depression (Ⅱ): Beyond the Hamilton depression rating scale[J]. CNS Spectrums, 2021, 26(4): 378-382.
[10] 蒲红春, 李 仪. 灵龟八法合六字诀治疗肝郁气滞型抑郁症30例临床观察[J]. 湖南中医杂志, 2022, 38(5): 62-64, 108.
[11] 薛奕童, 李奎良, 张晶轩, 等. 不同抑郁程度个体的静息态脑电微状态特点研究[J]. 第三军医大学学报, 2021, 43(24): 2609-2617.
[12] 黄德华, 王力文, 宫文霞, 等. 基于血浆代谢组学和网络分析研究柴归颗粒的抗抑郁作用机制[J]. 药学学报, 2022, 57(5): 1420-1428.
[13] 张雅婷, 蔡 皓, 段 煜, 等. 基于代谢组学探究炮制与配伍对四逆散抗抑郁作用的贡献[J]. 中国中药杂志, 2021, 46(19): 4993-5004.
[14] SMITH C A, WANT E J, O'MAILLE G, et al. XCMS: Processing mass spectrometry data for metabolite profiling using nonlinear peak alignment, matching, and identification[J]. Analytical Chemistry, 2006, 78(3): 779-787.
[15] WIKLUND S, JOHANSSON E, SJ?魻STR?魻M L, et al. Visualization of GC/TOF-MS-based metabolomics data for identification of biochemically interesting compounds using OPLS class models[J]. Analytical Chemistry, 2008, 80(1): 115-122.
[16] 王文杰, 舒 升, 徐珊珊, 等. 基于血清代谢组学研究牛蒡苷元对大鼠脑缺血-再灌注损伤的保护作用及其分子机制[J]. 吉林大学学报(医学版), 2022, 48(5): 1116-1123.
[17] XIA J G, SINELNIKOV I V, HAN B, et al. MetaboAnalyst 3.0: Making metabolomics more meaningful[J]. Nucleic Acids Research, 2015, 43(1): 251-257.
[18] 马建福, 王 豆, 李 涛, 等. 郁金治疗卒中后抑郁的药理机制研究进展[J]. 中国实验方剂学杂志, 2022, 28(7): 276-282.
[19] 喻 斌, 阮 鸣, 许 立, 等. 川芎注射液通过cAMP-CREB-BDNF通路改善卒中后抑郁大鼠神经功能[J]. 中国药理学通报, 2022, 38(8): 1246-1251.
[20] 卢仁睿, 张 莉, 王慧慧, 等. 桃叶珊瑚苷对谷氨酸诱导的兴奋性神经毒性的抑制作用研究[J]. 中国现代应用药学, 2022, 39(24): 3197-3203.
[21] 张晓富, 闫晨静, 周 茜, 等. 牛磺酸对CUMS致抑郁小鼠的干预作用[J]. 中国食品学报, 2021, 21(6): 123-130.
[22] 吕 霞, 黄 丽, 张美琳, 等. 氟西汀调节TLR4/NF-κB/NLRP3炎症体信号通路改善CUMS大鼠抑郁样行为[J]. 天津医药, 2023, 51(2): 160-165.
[23] 廖继武, 王丝丝, 杨海华, 等. 抑郁症患者的血清谷氨酸及γ-氨基丁酸系统水平[J]. 中国心理卫生杂志, 2020, 34(2): 87-91.
[24] 颜 瑞. 抑郁症患者血清谷氨酸、γ-氨基丁酸的水平及其临床意义[J]. 国际精神病学杂志, 2022, 49(4): 609-611.
[25] ZOMKOWSKI A D E, SANTOS A R S, RODRIGUES A L S. Putrescine produces antidepressant-like effects in the forced swimming test and in the tail suspension test in mice[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2006, 30(8): 1419-1425.
[26] REN C X, LIU J, ZHOU J T, et al. Low levels of serum serotonin and amino acids identified in migraine patients[J]. Biochemical and Biophysical Research Communications, 2018, 496(2): 267-273.
[27] 赵恩光, 吴红梅, 蒋 劲, 等. 补充β-羟基-β-丁酸甲酯对改善老年肌肉衰减综合征效果的研究进展[J]. 医学综述, 2015, 21(15): 2803-2805.

