黑水虻抗菌肽HI-3对RAW264.7细胞免疫调控作用研究
许晓燕,孙虹霞,崔会程,胡紫媛,夏 嫱
(遵义医科大学珠海校区,广东珠海 519041)
昆虫抗菌肽是研究最早的一类抗菌肽,目前在抗菌肽数据库中已记录的昆虫抗菌肽种类已达310种,均具有广泛的功能。昆虫抗菌肽不仅具有抑菌、抑癌活性,还具有免疫调节活性。如从埃及伊蚊Aedesaegypti体内提取的抗菌肽AeaeCec 1-5(Linetal., 2018)、从双叉犀金龟Allomyrinadichotoma体内提取到的抗菌肽Allomyrinasin(Leeetal., 2019)、从蚂蚁毒液中提取的阳离子抗菌肽P17(Khaddoujetal., 2017),均具有良好的免疫调节作用。
黑水虻HermetiaillucensL.是世界性分布的重要资源昆虫,近年来随着黑水虻幼虫在处理畜禽粪便及厨余垃圾等方面的广泛应用(Zhangetal., 2021),其抗菌肽研究也越来越受重视。黑水虻抗菌肽不仅具有良好的抗菌(Danielaetal., 2019; Leeetal., 2020)、抗癌(Huetal., 2018)活性,其免疫调节活性也不容忽视。研究表明,黑水虻抗菌肽DLP2和DLP4不仅可以有效提高被多重耐药性金黄色葡萄球菌感染小鼠血清中IL-10、粒细胞-巨噬细胞集落刺激因子(GM-CSF)的表达,还能够抑制TNF-α、IL-6及巨噬细胞趋化蛋白(MCP)-1的表达(Lietal., 2017)。但是,关于黑水虻抗菌肽免疫方面的研究仅限于此,尚无全面的免疫调控作用研究。
巨噬细胞在免疫系统中占据重要地位,它们不仅可以启动免疫反应,还可作为效应细胞参与感染和炎症反应,在免疫调节中发挥着重要的作用,是免疫调节的重要靶细胞。小鼠巨噬细胞(RAW264.7)具有极强的黏附和吞噬抗原能力,是免疫学中常用的细胞株,近年来广泛用于氧化应激、免疫活性、炎症反应及其机制研究。
课题组前期自提的黑水虻抗菌肽HI-3不仅对自然界中存在较广的金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌及产气杆菌有较强的抑制作用,还可以有效抑制人鼻咽癌细胞(CNE2)和人结肠癌细胞(HCT-8)的体外增殖,且对正常细胞无显著影响(田忠, 2017; 高嘉敏, 2021)。本试验在课题组前期研究基础上,以RAW264.7细胞为模式细胞,研究黑水虻抗菌肽HI-3对RAW264.7细胞形态、增殖、吞噬、分泌NO和细胞因子以及氧化应激活性影响,以阐明抗菌肽HI-3对RAW264.7细胞免疫调控作用,为拓展黑水虻抗菌肽在免疫领域的应用研究提供理论依据。
1材料与方法
1.1 主要实验材料
1.1.1黑水虻抗菌肽HI-3
选取黑水虻5龄幼虫,采用大肠杆菌菌液针刺诱导法诱导其产生抗菌肽,培养24 h后断头取其血淋巴,利用反相高效液相色谱(RP-HPLC)分离纯化得抗菌肽HI-3,其纯度大于95%,分子量为5.98 kDa。
1.1.2细胞株
RAW264.7细胞株购自武汉普诺赛生命科技有限公司。
1.1.3主要试剂
DMEM培养液、青霉素-链霉素混合溶液、胎牛血清均购自美国GIBCO公司;CCK-8试剂盒购自日本同仁公司;脂多糖(LPS)购自上海源叶生物技术有限公司;BCA蛋白浓度测定试剂盒、高效RIPA组织/细胞裂解液、中性红细胞增殖及细胞毒性检测试剂盒、一氧化氮(NO)、丙二醛(MDA)检测试剂盒均购自上海碧云天生物技术有限公司;小鼠IL-6、IL-10、IL-1β、TNF-α检测试盒均购自武汉华美生物工程有限公司;超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)试剂盒购自南京建成生物科技有限公司。
1.1.4主要仪器
3K15冷冻高速离心机,购自德国SIGMA公司;HF90/HF240 CO2培养箱,购自上海力康生物医疗科技控股有限公司;BDS 300PH倒置相差显微镜,购自重庆奥特光学仪器有限公司;Multiskan Go全波段酶标仪,购自美国Thermo Fisher公司。
1.2 实验方法
1.2.1细胞培养
将RWA264.7细胞接种在含有10%胎牛血清和1%青霉素-链霉素混合溶液的DMEM完全培养液中,放入二氧化碳培养箱(37℃,5% CO2),培养24 h。
1.2.2构建细胞炎症模型的LPS浓度筛选
取对数生长期细胞,调整细胞密度为1×104个/mL,以每孔100 μL接种于96孔板,随机设计为阴性对照组和LPS组,培养24 h后弃掉上清,阴性对照组中每孔重新加入同体积的培养液,模型组中每孔加入同体积的不同浓度LPS溶液(终浓度为0.1、1、10、100 ng/mL),每组5个重复,24 h后光学显微镜下观察细胞形态,并收集细胞上清检测其NO浓度。根据实验结果选择适宜的LPS浓度,进行后续实验。
1.2.3抗菌肽HI-3对RAW264.7细胞形态的影响
按照1.2.1方法培养细胞,200 g/min离心3 min,弃上清,调整细胞密度为1×106个/mL,以每孔2 mL接种于6孔板随机设置阴性对照组、阳性对照组和实验组,每组5个重复。培养24 h后弃掉原培养液,阴性对照组加入1 mL新鲜培养液,阳性组加入1 mL含有LPS(1 ng/mL)的培养液,实验组分别加入1 mL含不同浓度抗菌肽HI-3(浓度依次为20、40、80、160、320 μg/mL)的培养液,放回培养箱继续培养24 h,光学显微镜下观察细胞形态变化并记录。
1.2.4抗菌肽HI-3对RAW264.7细胞增殖的影响
按照1.2.3方法进行细胞培养及实验分组,每组5个重复。加药后于96孔板培养RAW264.7细胞24 h后,弃去96孔板中培养液,加入110 μL含有CCK-8的无血清培养液,CCK-8与培养液的体积比为1∶10,继续培养1 h。于450 nm波长处检测各孔吸光度值(A值),依据公式计算细胞的增殖指数。
增殖指数=实验孔A值/空白孔A值
1.2.5抗菌肽HI-3对RAW264.7细胞吞噬功能的影响
按照1.2.4的方法完成铺板加药,每组5个重复,培养24 h后弃去原培养液,并用PBS清洗2次。各孔依次加入220 μL中性红染液与DMEM培养液的混合液(体积比为1∶10),放回培养箱中孵育4 h。弃去含有中性红染液的培养液,并用PBS清洗2次,随后加入200 μL中性红检测裂解液,放于摇床上裂解10 min。调整波长至540 nm,检测各个实验孔的A值,并依据公式计算吞噬指数。
吞噬指数=实验孔A值/空白孔A值
1.2.6抗菌肽HI-3对RAW264.7细胞生成NO的影响
按照1.2.3方法进行铺板加药,培养24 h后取50 μL细胞上清于96孔板中,每组设置5个重复,按照试剂盒说明书依次加入Griess Reagent Ⅰ和Griess Reagent Ⅱ,于540 nm波长处测定样本吸光度值,并根据标准曲线计算NO浓度。
1.2.7抗菌肽HI-3对RAW264.7细胞分泌细胞因子的影响
按照1.2.3步骤进行铺板加药,每组5个重复,培养24 h后取上清至2 mL的无菌EP管中,4℃、1 000 g/min,离心15 min,按照试剂盒说明书检测细胞上清液中TNF-α、IL-1β、IL-6、IL-10的含量变化,带入标准曲线计算相应的细胞因子浓度。
1.2.8抗菌肽HI-3对RAW264.7细胞抗氧化物活性的影响
按照1.2.3步骤进行铺板加药,每组5个重复,培养24 h后弃掉细胞上清液,并用PBS清洗3次,加入200 μL的RIPA裂解液,放于冰上裂解30 min,并将其收集于2 mL无菌EP管中,18 892 g/min,4℃冷冻离心10 min。将离心后的上清液放于冰上待用,并按照试剂盒说明书检测样品中SOD活力、MDA及T-AOC含量,具体公式如下:
(1)SOD活力(U/mL)=SOD抑制率÷50%×反应体系稀释倍数×样本测试前稀释倍数
(2)MDA含量(μmmol/mg)=样本MDA浓度/样本蛋白浓度
(3)T-AOC含量(mmol/g)=样本的Trolox摩尔浓度/蛋白浓度
1.3 统计学方法
采用GraphPad Prism 8.0分析软件进行数据统计与分析。两两比较采用t检验,两组间比较采用单因素方差分析,P<0.05表示具有统计学意义。
2 结果与分析
2.1 LPS浓度筛选
随着LPS浓度升高,NO浓度逐渐增高,当浓度达到1 ng/mL时,与阴性对照相比具有显著性差异,当LPS浓度达到10 ng/mL及以上时,细胞出现破碎甚至死亡,因而后续实验选用1 ng/mL LPS建立炎症模型(图1)。
2.2 抗菌肽HI-3对RAW264.7细胞形态的影响
20、40、80、160和320 μg/mL处理浓度抗菌肽HI-3作用于RAW264.7细胞24 h后,细胞形态与阴性对照组细胞形态(图2-A)相比差异不明显。表现为细胞圆润有光泽,细胞呈岛状分布,但略有伪足伸出(图2-B, F);但与LPS阳性对照组细胞形态相比差异明显,LPS阳性对照组细胞多数有伪足伸出,呈现棘形或者梭形等不规则形状,胞浆颗粒明显,细胞显著增大(图2-G),这是细胞被过度激活后的表现。结果说明,各处理浓度的抗菌肽HI-3对RAW264.7细胞形态均无显著影响。
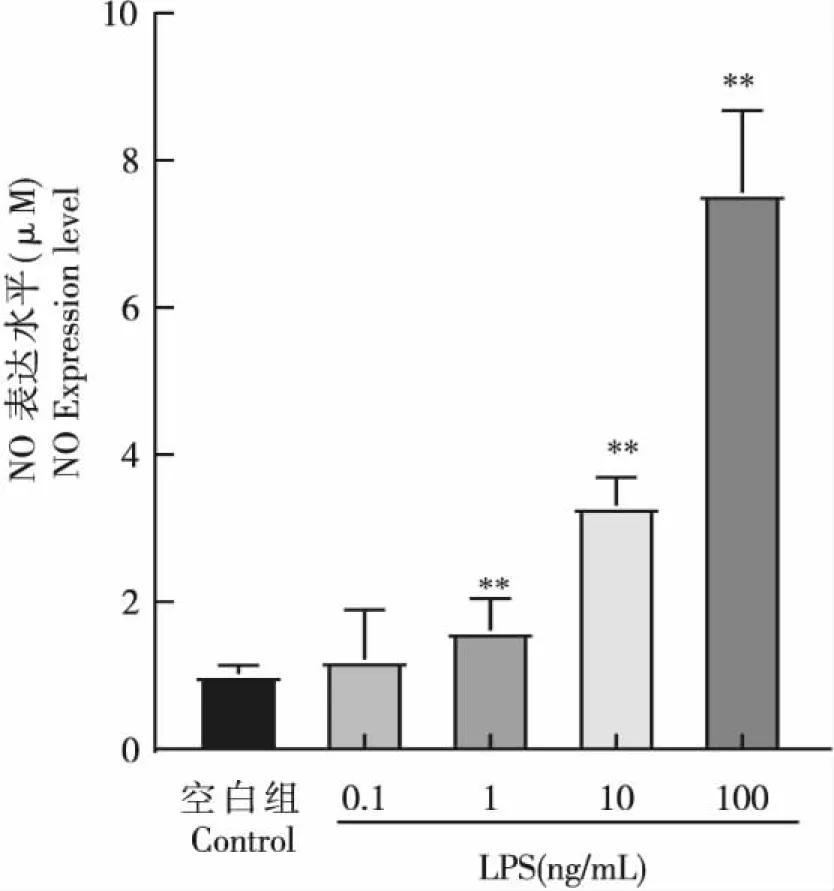
图1 不同浓度LPS对RAW264.7细胞产生NO的影响Fig.1 Effect of different concentrations of LPS on NO production in RAW264.7 cells
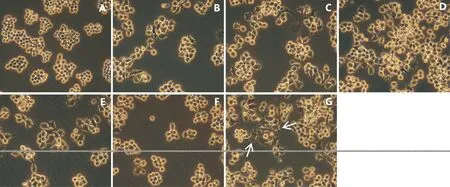
图2 抗菌肽HI-3对RAW264.7细胞形态的影响(400×)Fig.2 Effect of antimicrobial peptide HI-3 from black water fly larvae on the morphology of RAW264.7 cells (400×)注:A,阴性对照组;B,HI-3(20 μg/mL);C,HI-3(40 μg/mL);D,HI-3(80 μg/mL);E,HI-3(160 μg/mL);F,HI-3(320 μg/mL);G,LPS组(1 ng/mL)。Note: Negative control group; B, HI-3 (20 μg/mL); C, HI-3 (40 μg/mL); D, HI-3 (80 μg/mL); E, HI-3 (160 μg/mL); F, HI-3 (320 μg/mL); G, LPS group (1 ng/mL).
2.3 抗菌肽HI-3对RAW264.7细胞增殖的影响
在20~320 μg/mL处理浓度范围内,抗菌肽HI-3对RAW264.7细胞均无显著影响,细胞增殖指数均在0.94以上,与阴性对照组相比无显著性差异(P>0.05),与LPS阳性对照组相比增殖指数显著降低(P<0.01)(图3),说明抗菌肽HI-3对RAW264.7细胞无毒性,且对其增殖活力无显著影响。
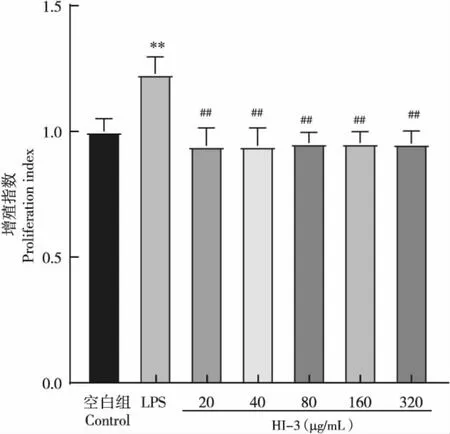
图3 抗菌肽HI-3对RAW264.7细胞增殖的影响Fig.3 Effect of antibacterial peptide HI-3 on the proliferation of RAW264.7 cells注:与阴性对照组相比:*P<0.05,**P<0.01;与LPS组(1 ng/mL)相比:# P<0.05,## P<0.01。下图同。Note: Compared with negative control group: *P<0.05, ** P<0.01; Compared with lipopolysaccharide group (1 ng/mL): # P<0.05, ##P<0.01.Same below.
2.4 抗菌肽HI-3对RAW264.7细胞吞噬功能的影响
20、40、80、160和320 μg/mL浓度下抗菌肽HI-3对RAW264.7细胞吞噬功能的影响研究结果表明,与阴性对照组相比,各处理浓度下HI-3均能极显著增强RAW264.7细胞的吞噬能力(P<0.01),且具有一定的浓度依赖性。当HI-3浓度达到320 μg/mL时,其对RAW264.7细胞的吞噬能力影响最强,但仍显著低于LPS阳性对照组(P<0.01),表明抗菌肽HI-3可以提升巨噬细胞的吞噬能力,但不会过度吞噬,具有一定的开发前景(图4)。
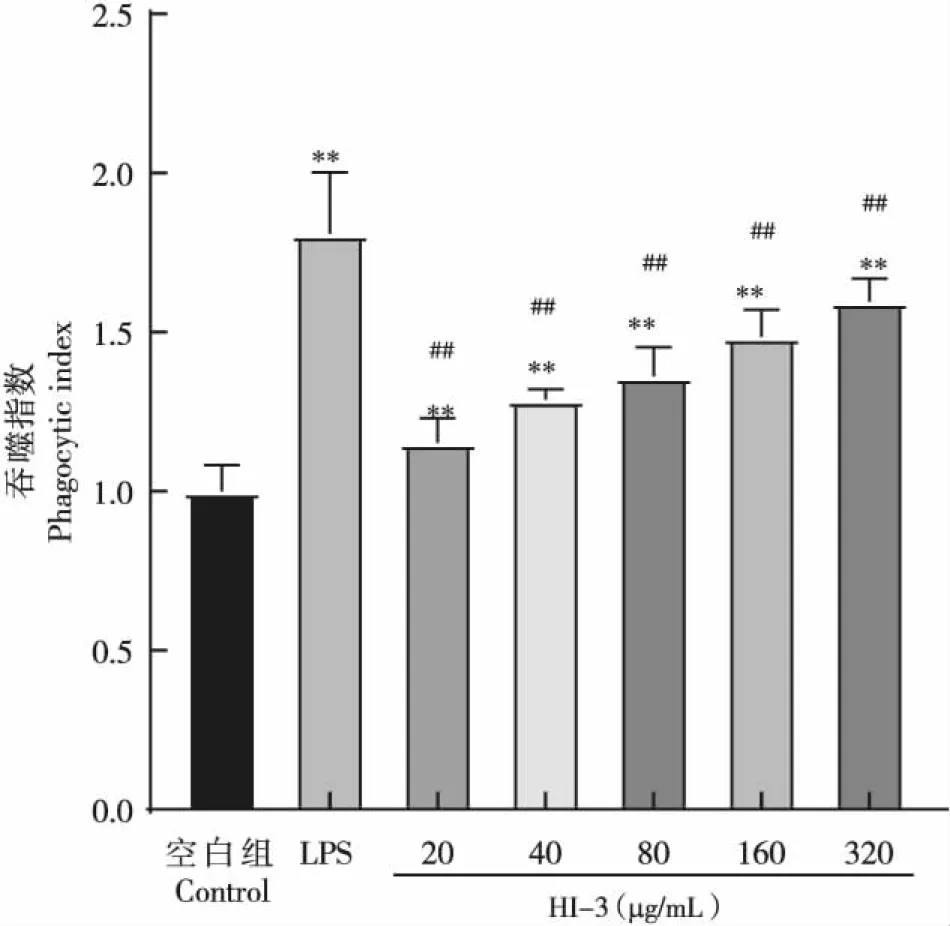
图4 抗菌肽HI-3对RAW264.7细胞吞噬功能的影响Fig.4 Effect of antibacterial peptide HI-3 on phagocytosis of RAW264.7 cells
2.5 抗菌肽HI-3对RAW264.7细胞生成NO的影响
不同浓度抗菌肽HI-3作用于RAW264.7细胞后细胞内NO的生成量随着HI-3浓度的增加而增加,但是160 μg/mL以下处理浓度组NO生成量与阴性对照组相比无显著性差异(P>0.05),仅在处理浓度达到160 μg/mL及以上时,才与阴性对照组相比显著增加(P<0.01),但仍极显著低于LPS阳性对照组的NO生成量(P<0.01)(图5)。
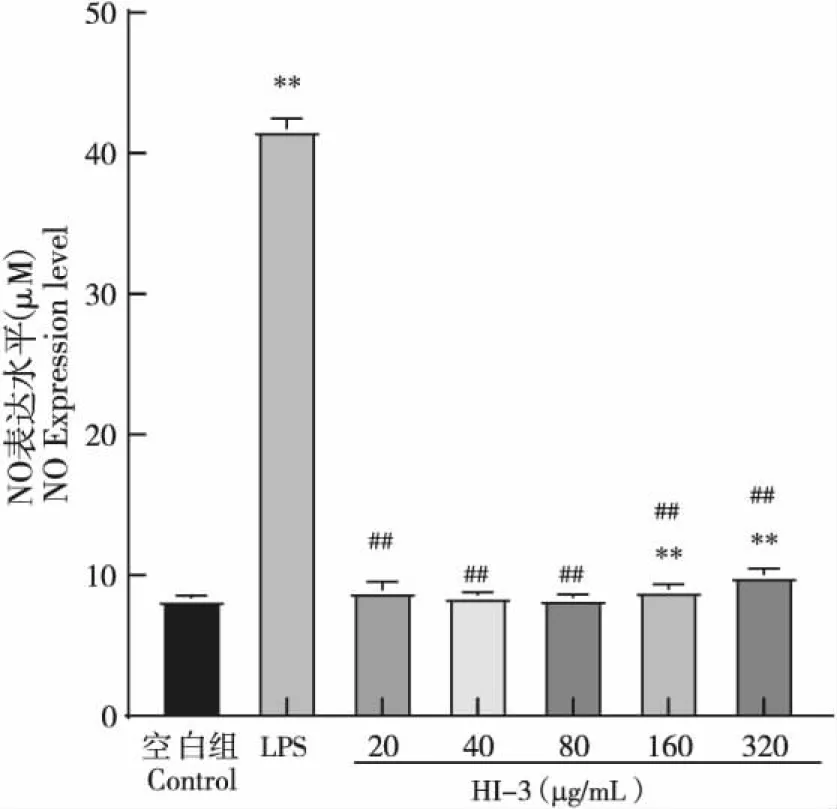
图5 抗菌肽HI-3对RAW264.7细胞产生NO的影响Fig.5 Effect of antimicrobial peptide HI-3 on NO of RAW264.7 cells
2.6 抗菌肽HI-3对RAW264.7细胞分泌细胞因子的影响
巨噬细胞通过分泌IL-6、TNF-α、IL-1β和IL-10等细胞因子,调节免疫细胞生长、分化和迁移。本研究采用ELISA试剂盒分别检测了20、40、80、160和320 μg/mL处理浓度下抗菌肽HI-3对RAW264.7细胞分泌细胞因子的影响。结果表明,随着HI-3浓度的增加RAW264.7细胞分泌的IL-6、TNF-α和IL-1β含量递增,当浓度达到40 μg/mL及以上时与阴性对照组细胞分泌细胞因子相比显著性增加(P<0.05),但显著低于LPS阳性对照组细胞的分泌量(P<0.05);而抑炎因子IL-10的分泌量呈递减趋势,20~80 μg/mL处理浓度的细胞分泌IL-10的含量与LPS阳性对照组相比显著增加,但仍显著低于阴性对照组细胞IL-10的分泌量(P<0.05)(图6)。
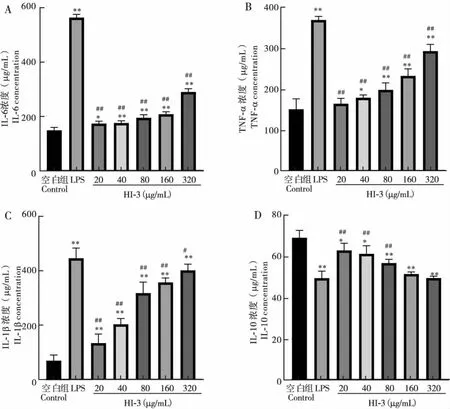
图6 抗菌肽HI-3对RAW264.7细胞分泌细胞因子的影响Fig.6 Effect of antimicrobial peptide HI-3 on cell factor of RAW264.7 cells注:A,IL-6;B,TNF-α;C,IL-1β;D,IL-10。Note: A, IL-6; B, TNF-α; C, IL-1β; D, IL-10.
2.7 抗菌肽HI-3对RAW264.7细胞抗氧化活性的影响
在40~320 μg/mL处理浓度范围内,随着抗菌肽HI-3浓度的增加,RAW264.7细胞内SOD活力和T-AOC活性均随之升高,并显著高于阴性对照组和LPS阳性对照组含量(P<0.01),如图7、图8所示;MDA含量与阴性对照组相比,仅在HI-3浓度达到320 μg/mL时,才显著高于阴性对照组的MDA含量(P<0.05),其余浓度产生的MDA含量与阴性对照组相比均无显著差异(P>0.05);但与LPS阳性组相比,各个处理浓度下产生的MDA均极其显著降低(P<0.01),见图9。说明HI-3能够显著提高RAW264.7细胞内SOD活力和T-AOC活性,且不产生脂质过氧化物,具有较好的抗氧化活性。
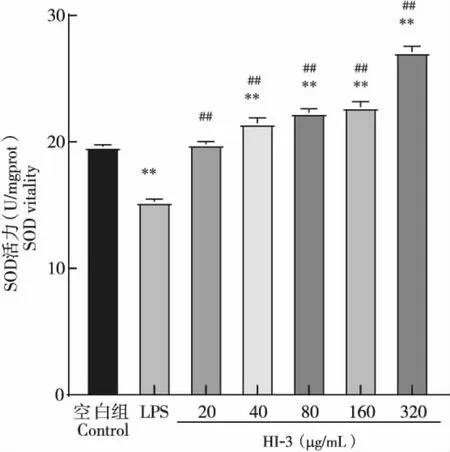
图7 抗菌肽HI-3对RAW264.7细胞SOD的影响Fig.7 Effect of antimicrobial peptide HI-3 on SOD of RAW264.7 cells
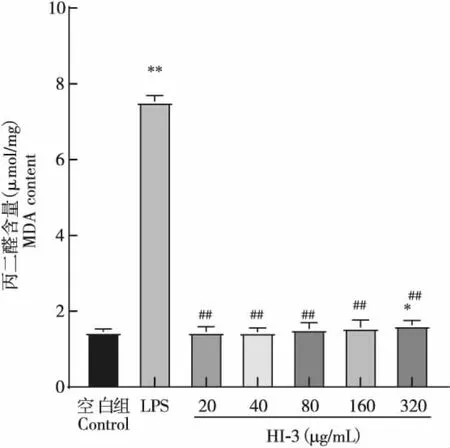
图8 抗菌肽HI-3对RAW264.7细胞MDA的影响Fig.8 Effect of antimicrobial peptide HI-3 on MDA of RAW264.7 cells
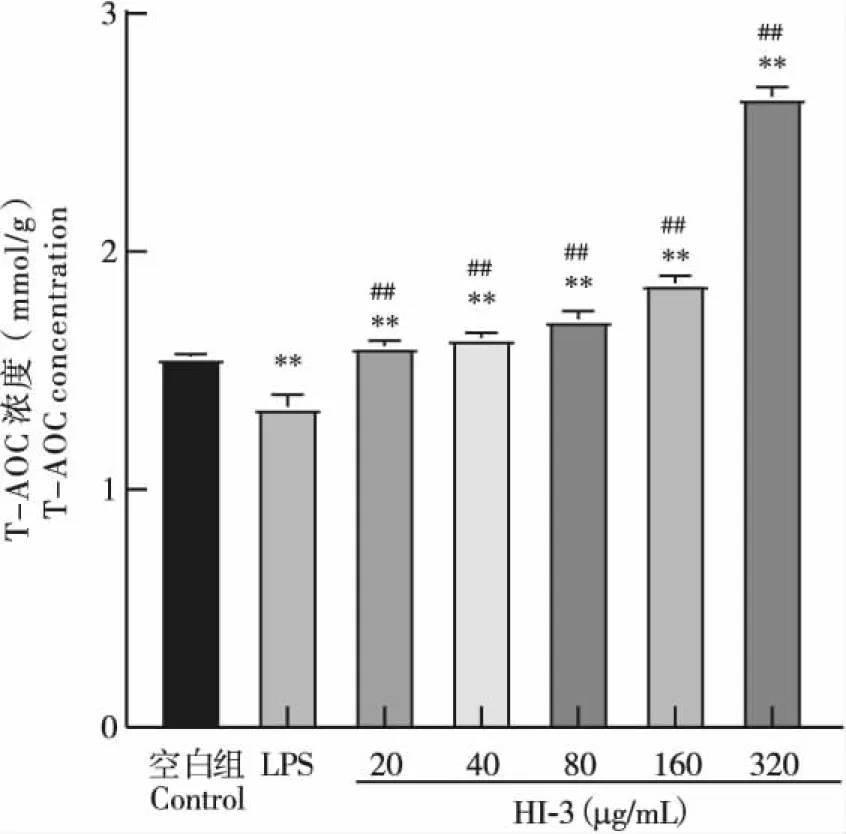
图9 抗菌肽HI-3对RAW264.7细胞T-AOC的影响Fig.9 Effect of antimicrobial peptide HI-3 on T-AOC of RAW264.7 cells
3 结论与讨论
巨噬细胞广泛分布于各种组织中,是生物体内最常见的免疫细胞,也是生物抵御病原体入侵的门户(Qiuetal., 2019; Yangetal., 2021)。本研究表明,黑水虻抗菌肽HI-3对RAW264.7细胞的正常生长和增殖均无显著影响,说明实验浓度范围内的抗菌肽HI-3对RAW264.7细胞无毒害作用。
吞噬作用是评价巨噬细胞活化能力的一个关键指标,在非特异性免疫防护中具有重要的作用。黑水虻抗菌肽HI-3能够有效增强RAW264.7细胞的吞噬能力,且吞噬能力随着抗菌肽浓度的增加而增强,但显著低于LPS阳性对照组细胞的吞噬能力。说明本研究各处理浓度HI-3均可显著刺激RAW264.7细胞,提高其吞噬功能,但不会过度吞噬,起到了一定的免疫调节作用。此结果与刁静静等研究绿豆肽浓度依赖性提高巨噬细胞的吞噬能力结果相一致(刁静静等, 2019)。
NO是生物体内一种重要的信号传导介质和效应分子,可参与多种生理活动,并与免疫系统关系密切(El-Haj and Bestle, 2017; Kotsiouetal., 2021)。各处理浓度抗菌肽HI-3均会刺激RAW264.7细胞少量分泌NO,且在高浓度时显著高于阴性对照组,但均极显著低于LPS阳性对照组,从而表明HI-3的处理在一定程度上提高了RAW264.7细胞的免疫调节能力,此结果与赵杰(2020)、叶蕾(2019)等人的研究结果相一致。在巨噬细胞中,NO的合成主要依赖于iNOS(Tenopoulouetal., 2020)。然而,本研究尚未涉及iNOS在NO分泌中的作用,还有待于后续进一步研究。
细胞因子在免疫应答中起着至关重要的作用。TNF-α参与免疫调节等多种生理病理反应,在诱导后会促进IL-6和IL-1β的分泌,增强免疫反应。IL-6具有促进T、B细胞增殖和分化的功能(Klimpel, 1980; Yasukawaetal., 1987),且其既是促炎因子也是抗炎因子。IL-1β不仅可以激活先天免疫细胞如B细胞,促使其分化为浆细胞参与体液免疫,同时也可促进巨噬细胞的抗原递呈能力,吸引中性粒细胞而引发炎症,进而增强免疫细胞的杀伤力(Bentetal., 2018)。本研究结果表明,HI-3作用于RAW264.7后,当浓度达到40 μg/mL及以上时3种细胞因子的分泌量均高于阴性对照组,表明40 μg/mL及以上浓度的HI-3可以有效地激活RAW26.7细胞免疫反应,引起上述细胞因子的分泌。并且,这种激活具有一定的浓度依赖性,在320 μg/mL时,激活能力最强,其细胞因子的分泌量达到最大,但又极显著低于LPS阳性对照组,表明HI-3可以发挥免疫激活能力,诱导炎性因子适当分泌,但又不引发炎症反应,从而避免了免疫系统被过度激活。这与王亚飞等发现鹰嘴豆肽可以激活RAW264.7细胞的免疫活性,促进IL-6、TNF-α和IL-1β的分泌进而发挥免疫增强功能相类似(王亚非等, 2021)。Yao等人亦发现鳗鲡肽可以以浓度依赖性的方式促进RAW264.7细胞分泌IL-6和TNF-α(Yaoetal., 2020)。IL-10是一种抑炎因子,可抑制炎症的过度反应,上调先天免疫,促进组织修复,维持组织稳态(Ouyangetal., 2019),但IL-10过度表达则会导致免疫抑制(Pealozaetal., 2016)。本研究中黑水虻抗菌肽HI-3可下调RAW264.7细胞分泌IL-10的能力,此结果与杨胜杰等研究核桃肽能够降低人单核细胞中IL-10的分泌量一致(杨胜杰等, 2019)。因此,抗菌肽HI-3可以通过调控细胞因子的分泌,进而影响巨噬细胞的免疫功能。
巨噬细胞在发挥免疫作用的过程中也会产生各种氧化物质如MDA和自由基,这些物质的出现会导致机体产生炎症损伤,诱发多种疾病。而抗氧化物质能够有效中和自由基,降低氧化物,维持机体稳态,从而间接起到免疫调节作用。其中,常见的抗氧化物质有SOD和T-AOC。SOD能够有效清除机体产生的过量自由基(Yaribeygietal., 2018),T-AOC是机体内衡量抗氧化物质多少的重要指标(Mazdaketal., 2020)。Wang等发现槲皮素能够有效提高斑马鱼Brachydaniorerio的SOD和T-AOC的活性,进而提高斑马鱼的免疫活性和抗氧化能力(Wangetal., 2020)。本研究发现抗菌肽HI-3亦能够显著提高RAW264.7细胞内SOD活力和T-AOC的含量,且具有一定的浓度依赖性,表明HI-3对细胞的抗氧化作用也在其免疫调节过程中发挥了作用。此外,HI-3对细胞内MDA含量影响的结果也显示HI-3不会在细胞内产生过多的脂质过氧化物,进一步避免了对细胞的氧化损伤。
上述研究表明,抗菌肽HI-3可以通过增强巨噬细胞吞噬功能、适量增加细胞内NO的合成、调节细胞因子分泌及增强细胞的抗氧化作用,从而达到对RAW264.7细胞的免疫调控作用;同时,HI-3又不会过度刺激巨噬细胞增殖,不引起炎症反应,具有良好的开发前景。

