基于网络药理学和分子对接技术探讨红花黄色素注射液治疗心肌缺血的作用机制∗
梁五林,崔 爽,张明倩,祝 娜,张硕峰,3,贾占红△
1 北京中医药大学中药学院,北京 102488; 2 中央民族大学药学院,北京 100081;3 西藏藏医药大学藏药系,西藏 拉萨 850030
目前,心血管疾病仍是全球范围内引起人们死亡和发病的主要原因,而缺血性心脏病与心血管疾病死亡率紧密相关,约占整个心血管疾病死亡的50%[1]。急性心肌梗死是心肌缺血(myocardial ischemia,MI)中较为严重的心血管疾病,梗死心肌恢复血流再灌之后进一步加重心肌损伤,诱导心肌细胞凋亡的现象被称为缺血再灌注损伤(ischemia reperfusion injury,IRI)[2]。IRI 涉及的病理因素包括氧化损伤、能量代谢障碍、Ca2+超载、线粒体损伤、炎症反应及细胞凋亡等[3-5]。MI及IRI是影响心血管疾病发病率、致死率、伤残率升高的最主要因素。
红花黄色素注射液(safflower yellow injection,SYI)是以红花为基础研制而成的中药注射剂,主要成分为羟基红花黄色素A(HSYA),经国家食品药品监督管理局批准用于治疗心绞痛等心脏病。HSYA 是红花的主要生物活性成分,是一种具有良好药用价值的天然色素,在干花中的含量为0.235%~2.074%,也 是 红 花 的 质 量 标 志 物[6]。HSYA 因其广泛的药理活性而受到关注,现代药理研究表明,HSYA 具有改善心脑血管疾病、缓解肝脏缺血损伤、肺急性损伤、抑制肺纤维化、抗肿瘤、调节代谢和保护内皮细胞等多种生物学作用[4]。本研究运用网络药理学和分子对接方法分析HSYA治疗MI的靶点和通路,为SYI治疗MI的临床应用提供理论依据。见图1。

图1 HSYA化学结构
1 数据库与软件
PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)、Targetnet数据库(http://targetnet.scbdd.com/)、CTD数据库(http://ctdbase.org/)、UniProt 数据库(https://www.uniprot.org/)、STITCH数据库(http://stitch.embl.de/)、ChEMBL数据库(http://www.ebi.ac.uk/chembl/)、GeneCards数据库(https://www.genecards.org)、OMIM 数据 库(https://omim.org)、STRING11.0 数 据 库(https://string-db.org)、DAVID 6.8 数 据 库(https://david.ncifcrf.gov/home.jsp)、RSCB PDB 数据库(https://www.rcsb.org/)、Venn 图在线绘制工具Venny2.1(https://bioinfogp.cnb.csic.es/tools/venny/)、在线作图平台Sanger Box(http://sangerbox.com/Tool/);分 析 软 件Cytoscape 3.7.2、分子对接软件包括PyRx、Auto DockTools-1.5.6、Open Babel GUI 及分子对接作图软件PyMol。
2 方法
2.1 HSYA 相关靶点的获取和筛选分别从Targetnet、CTD、STITCH、ChEMBL 等数据库中获取HSYA 相关靶点,使用UniProt 数据库将所得靶点进行校正,最终得HSYA活性成分的基因靶点。
2.2 Ml相关靶点获取以“Myocardial ischemia”为检索词,分别在人类基因数据库(the human gene database,GeneCards)和在线孟德尔人类遗传数据库(online mendelian inheritance in man,OMIM)获取MI 相关靶点,将所得靶点汇总并去除重复靶点。
2.3 获取HSYA与Ml共同靶点利用Venny 2.1在线分析工具对HSYA与MI相关靶点进行对比分析,以Venn图的形式展现HSYA与MI的交集靶点。
2.4 构建蛋白互作网路(protein-protein interaction,PPl)将HSYA-MI交集靶点导入STRING 11.0在线数据库,将研究物种设置为“Homosapiens”,Minimum required interaction score 为mediumconfidence>0.400,隐藏孤立的靶点蛋白,从而得到靶标之间的相互关系,保存为TSV 格式。再将其导入Cytoscape 3.7.2 软件绘制PPI,节点大小和颜色深浅反映degree值大小,degree 值越大,节点越大,颜色越深。
2.5 基因本体论功能富集分析(gene ontology,GO)和KEGG 富集分析(kyoto encyclopedia of genes and genomes,KEGG)将HSYA-MI 交集靶点导入DAVID 6.8 数据库,输入靶基因名称列表,限定物种为“Homosapiens”,将靶基因名修正为官方名称(official gene symbol),设定阈值P<0.05,进行GO功能富集分析和KEGG通路富集分析,将P值由小到大排序前20位的富集结果导入SangerBox在线作图平台进行可视化展示。
2.6 成分-靶标-通路网络构建筛选出KEGG 通路富集分析中P值由小到大排序前20 位的通路,通过查阅文献,再筛选出可能与治疗MI 有关的通路,找出富集在这些通路上的HSYA治疗MI的潜在靶标,将成分、靶标、通路输入Cytoscape 3.6.2软件,绘制出成分-靶标-通路网络图。
2.7 分子对接从RSCB PDB 数据库中获取“成分-靶标-通路”网络中度值较高的靶点和PPI 网络中的核心基因的3D 结构PDB 格式文件,运用PyMOL 软件移除靶蛋白中的水和配体;在PubChem中下载HSYA结构文件,并使用Open Babel GUL软件转换为mol2格式文件;使用PyRx软件对HSYA进行能量最小化处理,使用AutoDock Tools 1.5.6对蛋白分子进行加氢、计算电荷、设置原子类型等操作,并将蛋白和HSYA保存为pbdqt格式文件;在RyRx 中调用AutoDock Vina 算法进行模拟对接;使用PyMOL软件进行可视化分析。
3 结果
3.1 HSYA 相关靶点从Targetnet 中获得靶点54 个,从ChEMBL 中获得靶点25 个,从CTD 中获得靶点10个,从STITCH中获得靶点1个,结合Uniprot数据库确认及转换,无重复靶点,共得到90 个HSYA相关靶点,见表1。
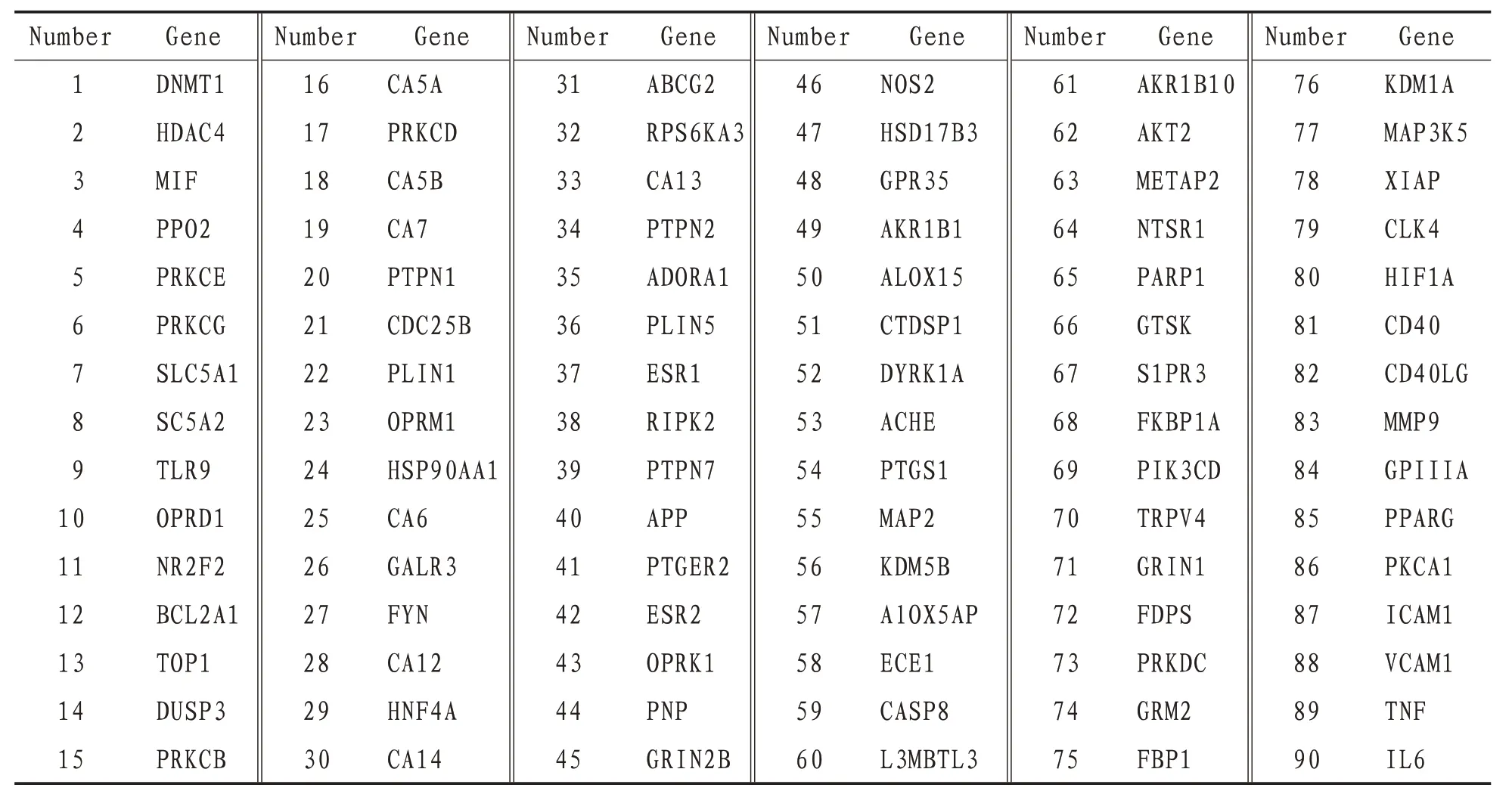
表1 HSYA潜在靶标信息
3.2 Ml 靶点获取从GeneCards 中获得MI 靶点2395 个,从OMIM 中获得MI 靶点556 个,去除重复靶点364个,最终获得MI靶点2587个。
3.3 HSYA 与Ml 共 同 靶 点HSYA 与MI 靶 点 融 合后获得54 个交集靶点,见表2,结果以Venn 图形式展示,见图2。

表2 HSYA与Ml交集靶点
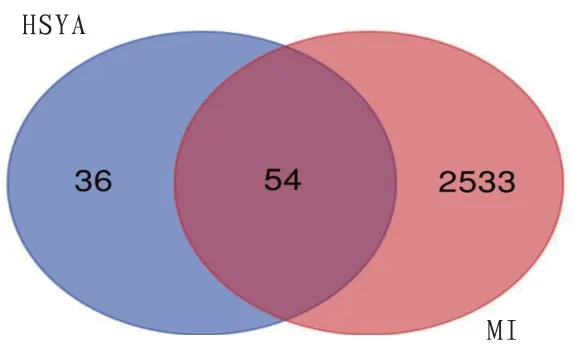
图2 HSYA与MI交集靶点韦恩图
3.4 PPl 网络PPI 网络中包含节点51 个,边线244 条,根据Degree 大小排序,其中排名前10 的靶标为白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor,TNF)、热休克蛋白90α家族A 类成员1(heat shock protein 90 alpha family class A member 1,HSP90AA1)、淀粉样前体蛋白(amyloid precursor protein,APP)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、半胱天冬氨酸蛋白酶8(caspase 8,CASP8)、雌激素受体1(estrogen receptor 1,ESR1)、过氧化物酶体增生激活受体γ(peroxisome proliferative activated receptor gamma,PPARG)、诱导型一氧化氮合酶(inducible nitric oxide synthase,NOS2)、细胞间黏附分子1(intercellular cell adhesion molecule 1,ICAM1),它们与HSYA治疗MI关系最密切,见图3及表3。
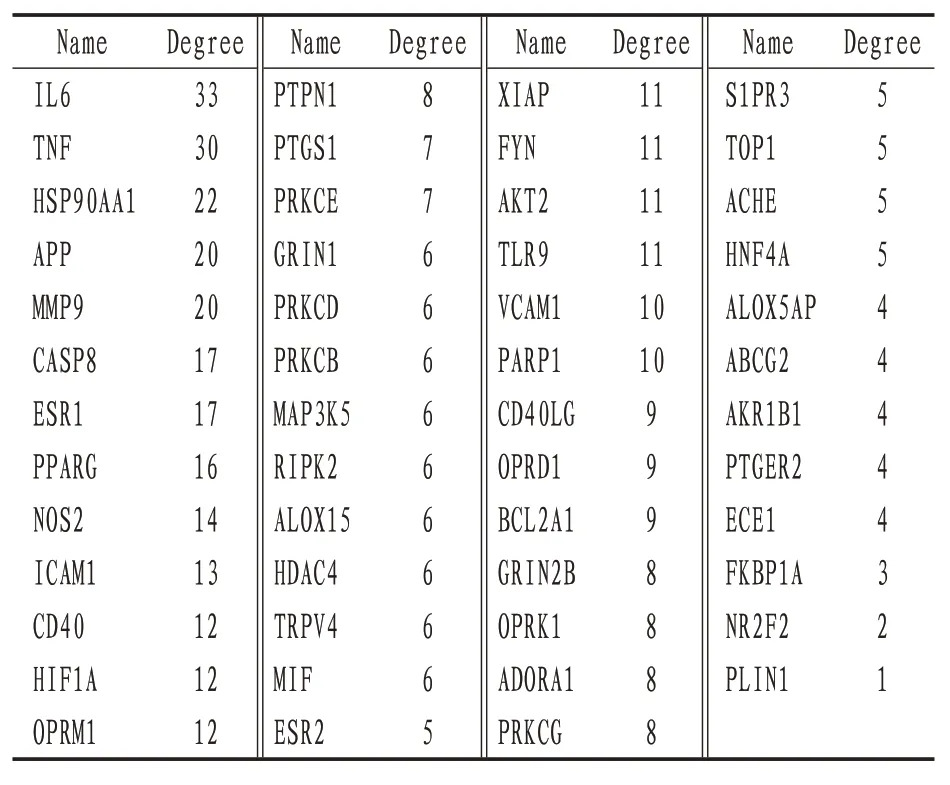
表3 HSYA潜在靶点拓扑分析值

图3 HSYA潜在靶标PPI网络
3.5 GO功能富集和KEGG通路富集分析
3.5.1 GO功能富集 将54个HSYA-MI交集基因导入DAVID数据库,通过GO功能富集分析得到GO条目392 个(P<0.05),其中323 个生物过程(biological process,BP)条目,23 个细胞组成(cellular component,cc)条目,46 个分子功能(molecular function,MF)条目,分别选取P值排名前20 位作可视化展示。其中生物过程主要包括:氮化合物代谢过程的正调控、DNA 模板转录的正调控,对有机物质、炎性、创伤的反应,细胞活化、增殖、凋亡调节,细胞因子调控及胞内信号转导等;细胞成分包括:质膜、细胞外基质、细胞外间隙、质膜小叶等;分子功能包括:相同的蛋白结合、脂质结合、启动子结合、蛋白激酶C 活性、类固醇激素受体活性、蛋白质丝氨酸/苏氨酸激酶活性、钙通道活性、钙依赖性蛋白激酶C 活性、蛋白质均二聚化活性等。见图4。
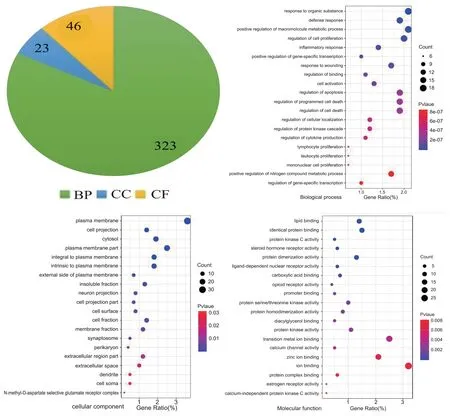
图4 HSYA-MI交集基因GO功能富集结果
3.5.2 KEGG通路富集 共得到通路17条(P<0.05),剔除与MI 关系不大的通路,共获得10 条通路,涉及癌症、免疫、炎症反应、血管内皮功能、凋亡等,分别是肿瘤信号通路、NOD 样受体信号通路、Toll样受体(Toll like receptor,TLR)信号通路、FcεRI 信号通路、病毒性心肌炎、FcγR 介导的吞噬作用、白细胞跨内皮迁移、自然杀伤细胞介导的细胞毒性、紧密连接及细胞凋亡,见图5及附图1—2。
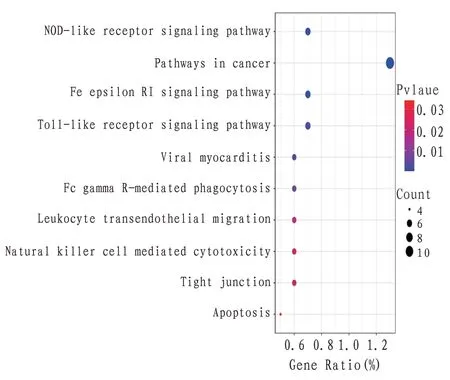
图5 HSYA-MI交集基因KEGG通路富集结果
附图1 肿瘤信号通路
附图2 凋亡信号通路
3.6 成分-靶标-通路网络图结合GO和KEGG富集分析结果,筛选出可能具有MI 作用的通路,并与HSYA的潜在靶标一一对应,构建HSYA-靶标-通路网络。网络图中包含39个节点,98条边线。对该调控网络进行拓扑分析发现,靶点的平均度值为3.1,介值中心度均值为0.0147;信号通路的平均度值为5.8,介值中心度均值为0.0207。筛选出度值及介值中心度均大于均值的靶点9 个、信号通路2 条,它们在HSYA 治疗MI 中发挥着关键作用。见图6及表4。
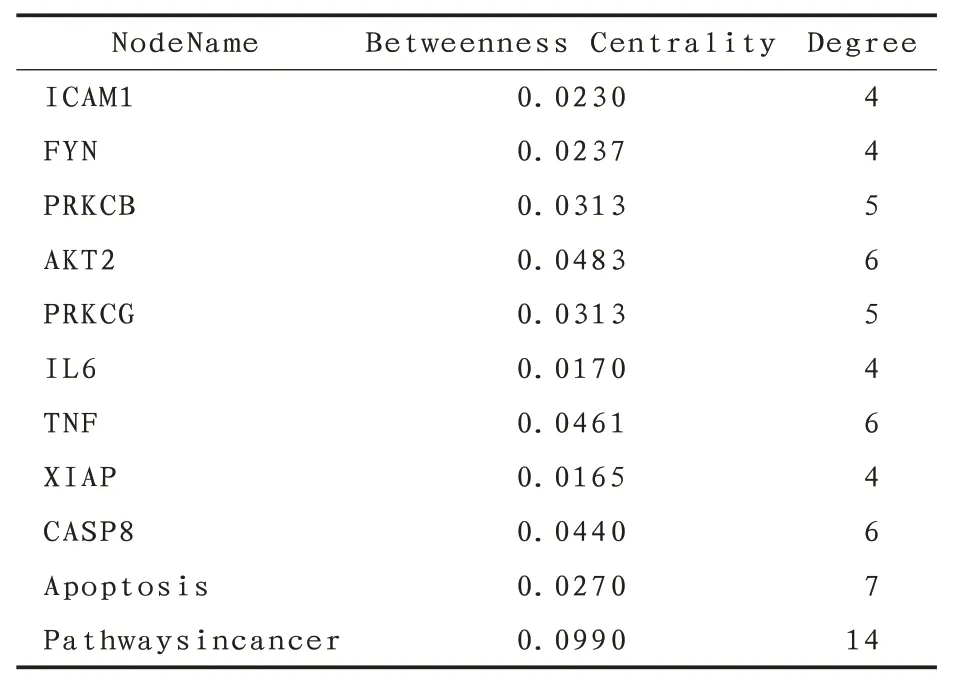
表4 网络图拓扑分析
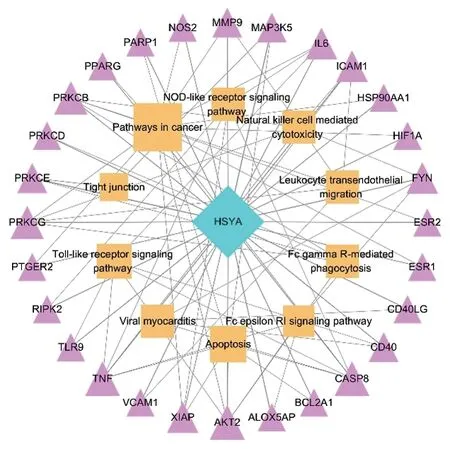
图6 HSYA-靶标-通路网络
4 分子对接结果
结合能小于0 说明配体与受体可以自发结合,且结合能量越低,配体与受体结合的构象越稳定,结合能≤-5.0kcal/mol 说明分子与靶点对接较好。将HSYA 与“成分-靶标-通路”网络中度值较高的靶点FYN、PRKCB、Akt2、PRKCG、XIAP 与PPI网络中排名前10 的靶点IL-6、TNF、HSP90AA1、APP、MMP9、CASP8、ESR1、PPARG、NOS2、ICAM1 进行分子对接,并对蛋白靶点的原配体进行分析,得到的数据进行热图分析(对接结果只保留每对分子对接的结合能绝对值最高的)。其中HSYA 与靶点IL-6、TNF、APP、MMP9、CASP8、ESR1、PPARG、ICAM1、PRKCB的结合能绝对值均大于原配体结合能的绝对值,且HSYA与各靶点的结合能均≤-5.0 kcal/mol,表明HSYA 与有效靶点具有较好的结合活性。将以上对接结果利用PyMOL 软件绘图,可得到HSYA与各靶点形成氢键的氨基酸残基和位置信息,见表5及图7—8。

表5 HSYA与各靶点形成氢键的氨基酸残基和位置信息
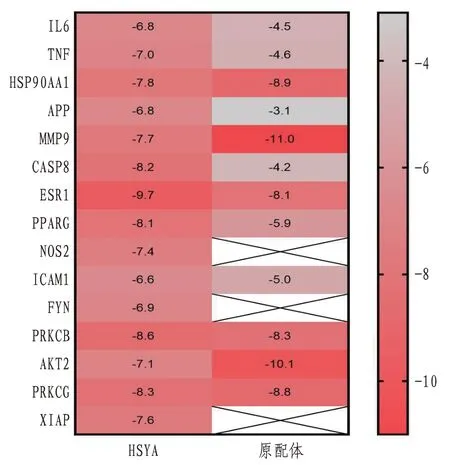
图7 分子对接数据热图分析(kcal/mol)
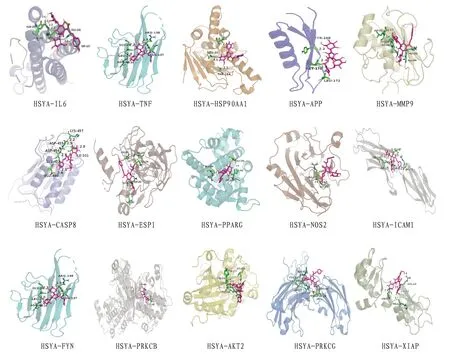
图8 分子对接模式
5 讨论
MI 是心脏所需血氧、能量失衡而导致的一种病理状态,冠状动脉粥样硬化是引起MI 的常见病因[5-6]。MI损伤的病理基础较为复杂,涉及多种基因、蛋白、致病因素等共同作用[7-8]。故本研究借助网络药理学和分子对接方法对SYI 主要成分、靶点、疾病的生物信息构建网络,进而探讨SYI 治疗MI的整体机制。
在PPI 网络图中,IL-6、TNF、HSP90AA1、APP、MMP9、CASP8、ESR1、PPARG、NOS2、ICAM1 等为核心靶点。TNF-α与IL-6 为常见的促炎因子,在心肌梗死模型中,TNF-α与IL-6释放增加,诱导局部炎症反应[9]。MI 可引起内皮功能障碍,表现为NO 产生受损,而NO 具有舒张血管、抑制炎症反应和血栓形成的作用[10-11]。MMP9 属于基质金属蛋白酶(matrix metalloproteinase,MMPs)家族,参与细胞外基质的分解,有研究表明抑制MMPs 表达可减弱与慢性充血、高血压、心肌梗死等疾病相关的心肌重塑[12]。此外,TNF-α 可通过增强包括MMP9 在内的MMPs 活性减少胶原蛋白合成,调节心脏成纤维细胞中的细胞外基质代谢[13]。故推测HSYA 也可通过抑制TNF-α表达降低MMP9 的活性,从而减轻MI 引起的心脏重塑。热休克蛋白(heat shock protein,HSP)又称应激蛋白,当机体处于高温、氧化应激、感染、缺血等状态时可被诱导表达,从而保护机体,有保护组织缺血再灌注免受损伤的作用[14]。HSP90AA1 为HSP90α家族A 类1 型,有研究表明,miR-1可负调控HSP90AA1,MI期间抑制miR-1和恢复HSP90AA1 的表达可减轻MI 损伤[15]。APP 为淀粉样前体蛋白,在MI 模型大鼠中,可溶性APP770(sAPP770)从内皮细胞和血小板中释放出来,且血浆sAPP 的增加先于心肌酶的释放,表明sAPP770可作为心肌梗死早期生物标志物的可能性[16]。PPARG 为核受体超家族成员,在动脉粥样硬化病变中,PPARG 高度表达,其激活可改善心血管细胞的炎症作用;PPARG还可调节内皮细胞中NOS的表达,从而增加NO 生物利用度[17-18]。半胱天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)家族为细胞凋亡的主要执行者,而CASP8 是死亡受体介导的凋亡途径(外源性途径)中的关键启动子。已有研究表明红花甲醇提取物可减少由LPS诱导的Caspase-8、BID 和t-BID等死亡受体蛋白表达,减少细胞凋亡[19]。故推测其中发挥抗凋亡的主要活性成分为HSYA,对MI发生时细胞的外源性凋亡途径有抑制作用。ESR1为雌激素受体1,通过编码核受体雌激素受体α(estrogen receptorα,ERα)与雌激素17-β-雌二醇相互作用发挥生物学功能。在MI 和MI 再灌注动物模型中,ERα激活可减少梗死面积和心肌细胞凋亡,减轻炎症反应和氧化应激,诱导血管舒张并增加新血管形成[20]。另外也有研究证实HSYA 可促进雌激素受体阳性细胞T47D 中ERα的表 达[21]。故 推 测 在MI 时,HSYA 可 作 用 于 心 脏ERS1,激活ERα发挥保护作用。通过以上核心靶标分析可知,HSYA 可能通过抑制炎性反应、细胞凋亡、心脏重塑、氧化应激,舒张血管,改善血管内皮功能,促进血管生成等多条途径治疗MI,改善MI损伤。
在KEGG 通路富集中,有10 条通路与HSYA 治疗MI 显著相关,且在“靶点-通路”网络图中,由拓扑分析可知肿瘤信号通路和凋亡通路相关度最高。其中肿瘤信号通路富集基因数量最多,包括多条下游信号通路,如Wnt信号通路、mTOR信号通路、PI3/Akt 信号通路、JAK/STAT 信号通路、MAPK信号通路、HIF-1 信号通路、VEGF 信号通路、Notch信号通路、p53 信号通路、TGF-β信号通路、钙信号通路等。HIF-1 是一种调节氧浓度稳态的转录因子,在缺氧状态下,HIF-1α可激活VEGF 信号通路促进血管生成,还可激活NOS2 转录,从而促进血管舒张[22]。TGF-β信号通路参与细胞和组织的生长、发育、分化。已有研究证明红花乙醇提取物可抑制TGF-β1/MMP9 以减轻高血压模型大鼠的心脏重塑[23]。Smads 为TGF-β重要的信号传导和调节分子,丹参酸可通过调节TGF-β1/Smad 信号通路抑制心肌纤维化[24]。故推测红花抗纤维化的作用可能与其主要成分HSYA 作用于TGF-β1/Smad 信号通路,抑制MMP9 表达有关。钙信号通路可调控动脉粥样硬化易感性及其炎症反应,在心血管疾病的发生发展中起重要作用[25]。p53 信号通路部分介导的心肌细胞凋亡在心肌梗死后的病理重塑和心力衰竭的进展中起至关重要作用,抑制p53水平可减少心肌细胞凋亡[26]。另外在凋亡通路中,HSYA 还可能通过作用于TNF、CASP8、XIAP、MAP3K5(ASK1)、AKT、PAPR 等靶点抑制细胞内源性、外源性及内质网应激诱导的凋亡。此外,Wnt信号通路、Notch 信号通路、MAPK 信号通路、PI3/Akt/mTOR、JAK/STAT 信号通路等也参与MI 再灌注损伤,起到保护性或促损伤性作用[27]。病毒性心肌炎的下游信号通路为T 细胞受体信号通路。T细胞受体(TCR)信号通路参与T 细胞激活,诱导细胞内信号级联反应。缺血后组织中CD4+T 细胞明显积聚,提示这些免疫细胞可能参与了I/R损伤的发病机制[28]。固有免疫的主要信号通路为NOD 样受体与TLR 信号通路。NOD 蛋白与下游的受体相互作用磷酸化,进而激活转录因子NF-κB,介导炎症介质表达[29]。TLR 能识别内源性与外源性“危险分子”,启动炎性免疫应答,TLR4在MI中对诱导炎症反应并激活下游信号(如NF-κB)起重要作用[30]。可见,SYI可通过多靶点、多通路治疗MI。
综上所诉,本研究通过网络药理学和生物信息学技术,初步探讨了SYI 治疗MI 的作用机制。同时基于分子对接技术初步模拟其可能的分子作用机制,或可为SYI 的后续研究提供新的思路与方法。但是本研究仅从网络药理学和分子对接的角度对SYI 治疗MI 的分子机制进行了探讨,具有一定局限性,还需要进一步的研究验证。

