快速康复外科护理理念对胃癌根治术老年患者营养状态、免疫功能及短期生存质量的影响研究
张 欣,曹文阁,张 綏
新乡市中心医院胸瘤一科,河南 新乡 453000
胃癌是临床消化道常见恶性肿瘤之一,全球约50%的新发病例发生在中国,其转移早、预后差,严重威胁我国人民的生命健康[1]。目前,临床常用的治疗手段是以根治性手术为主的综合治疗。随着医疗技术的发展,腹腔镜下胃癌根治术由于创伤小、术后康复快,得到了广大医疗学者的认可。且相关文献[2]证实,腹腔镜胃癌根治术术中操作更加细腻精准,可减少患者术中出血量,缩短其胃肠道恢复时间。快速康复外科护理理念(FTS)是以循证医学为依据,对患者围手术期措施进行优化,以减轻患者术后应激反应,缩短其胃肠道功能恢复时间[3]。胃癌根治术后患者机体免疫功能与营养状态相互影响,影响患者生存质量。有研究[4]表明,胃癌根治术后患者的淋巴细胞、营养状态水平均较低,与患者大多伴有一定消化道症状而影响营养物质的消化吸收有关。本研究旨在探讨FTS对胃癌根治术老年患者营养状态、免疫功能及短期生存质量的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2019年2月—2021年4月新乡市中心医院收治的94例行腹腔镜胃癌根治术老年患者作为研究对象,根据随机数表法分为参照组和研究组,每组各47例。参照组:男25 例,女22 例;年龄60~88 岁,平均年龄(74.39±4.28)岁;TNM分期[5]为Ⅰ期15例,Ⅱ期14例,Ⅲ期18例;肿瘤部位为胃窦18例,胃体13例,胃底16例;手术方式为近端切除12 例,远端切除19 例,全胃切除16 例。研究组:男24 例,女23 例;年龄61~89 岁,平均年龄(74.64±4.55)岁;TNM 分期为Ⅰ期15 例,Ⅱ期15 例,Ⅲ期17 例;肿瘤部位为胃窦15 例,胃体17 例,胃底15 例;手术方式为近端切除14 例,远端切除18 例,全胃切除15例。两组患者一般资料具有可比性(P>0.05)。本研究经医院医学伦理委员会批准通过。(1)纳入标准:①术前均经病理活检确诊为胃癌[6]。②年龄≥60 岁。③TNM 分期[5]<Ⅳ期。④经CT 检查无远处转移。⑤入组前未接受手术治疗。⑥预期存活3个月以上。⑦患者及其家属均签订知情同意书。(2)排除标准:①合并其他肿瘤性疾病。②存在胃癌根治术禁忌证。③合并其他胃肠道疾病。④免疫系统疾病。⑤合并心肝肾功能严重不全。⑥既往腹部手术史。⑦合并严重心肝肾功能不全。
1.2 方法
两组患者均接受同一组手术医生行腹腔镜胃癌根治术。
参照组给予常规护理,包括密切监测患者生命体征,准确记录输液量、留置尿管、观察术后伤口情况,进行术后被动活动、心理指导及饮食护理等。研究组在参照组的基础上给予FTS,具体如下。(1)术前。评估患者营养状况,告知患者病情,与患者建立良好护患关系,并向患者及其家属进行术前健康宣教,将治疗方案、术后可能发生的并发症及处理方案简单地向患者介绍,说明胃癌根治术及FTS理念的优越性,向患者重点介绍成功案例,增强患者治疗信心,充分调动患者配合治疗的积极性。术前1 h口服缓泻剂,避免胃肠道中过量粪便及气体,影响胃癌根治术的操作。术前6 h严格禁食,术前2 h给予患者10%葡萄糖酸钙口服溶液(江西川奇药业有限公司,国药准字:H20063563)100 mL,口服,麻醉成功后,为患者留置导尿管,根据胃腔扩张,决定是否放置鼻胃管,扩张解除复苏前,拔除鼻胃管。(2)术中。控制性输液在20 mL 以内,重视术中保温,使用温生理盐水,冲洗腹腔,预防性使用注射用头孢米诺钠(重庆天地药业有限责任公司,国药准字:H20153231,规格:0.5 g),密切关注患者生命体征,术中大部分患者不需留置腹腔引流管。评估后,若需要留置腹腔引流管,如无血性引流液或引流液减少,术后3 d 可拔除引流管。(3)术后。术后预防性使用头孢米诺钠3~5 d,术后2 h 内评估患者意识恢复情况,将患者头部偏向一侧,去枕平卧,术后24 h拔除导尿管。术后第1 d,指导患者饮用清流质食物20 mL,第2 d 根据患者情况,适当增加清流质的摄入量。术后第3 d,经口间断饮用肠内营养制剂,并逐步过渡到半流质饮食。确定康复治疗目标,在充分止痛后,鼓励患者进行早期活动,指导患者进行床上活动,并协助其床下活动。通常要求患者手术当天或术后1 d 开始进行简单的活动,如喝水、拿杯子、抬腿、翻身等,并按摩患者四肢,预防肢体萎缩。术后2 d或3 d鼓励患者下床活动,如独立上卫生间、走廊内缓慢行走等,早晚各1 次,每次30 min,并逐渐增加患者活动强度。指导患者独立使用自控镇痛泵,并定时评估患者疼痛程度。通过播放轻音乐、自我暗示等方式,分散患者注意力,以缓解其疼痛,进而缓解患者不良情绪,促进患者早日康复。对两组患者进行随访,于术后3个月评估临床疗效。
1.3 观察指标
(1)免疫功能。分别于术前、术后3 d 抽取患者空腹静脉血5 mL,离心后取上层血清,使用流式细胞仪(深圳迈瑞生物医疗电子股份有限公司,型号:BriCyte E6),采用流式细胞术,检测患者T 淋巴细胞群,主要包括CD8+、CD4+、CD4+/CD8+水平。(2)营养状态。于术前和术后3 d 使用上述分离血清方法,使用全自动生化分析仪(深圳市美思康电子有限公司,型号:iChem-520)进行操作。采用溴甲酚绿比色法检测白蛋白(ALB)水平。采用透射比浊法检测前清蛋白(PAB)水平。采用免疫散射比浊法检测转铁蛋白(TRE)水平。(3)短期生存质量。术后3个月通过电话随访及门诊复查,采用消化病生存质量指数(GLQI)[7],评估患者短期生存质量变化情况,量表主要包括社会功能、心理情绪、生理功能及主观症状等4个维度,36 个问题,内容主要包括“健康状况”“最近2周内不良反应发生情况”等,每个问题0~4分,总分0~144 分,总分越高,生存质量越高。(4)并发症发生情况。并发症主要包括肺部感染、吻合口瘘、肠梗阻及静脉血栓等。
1.4 统计学方法
采用SPSS 26.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术前、术后3 d免疫功能情况
术前,两组患者CD8+、CD4+、CD4+/CD8+水平比较,差异无统计学意义(P>0.05);术后3 d,两组患者CD8+水平均较术前降低,研究组CD8+水平低于参照组,两组患者CD4+、CD4+/CD8+均较术前升高,研究组CD4+、CD4+/CD8+均高于参照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者术前、术后3 d免疫功能情况(±s)
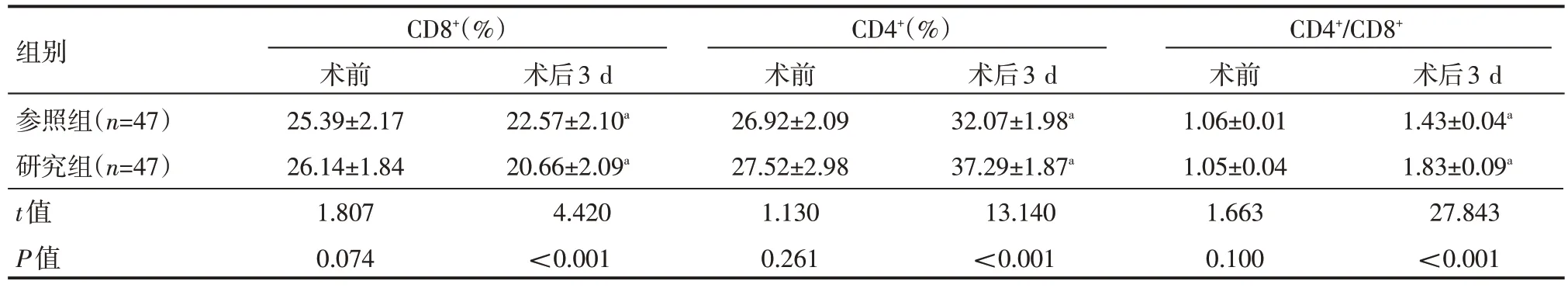
表1 两组患者术前、术后3 d免疫功能情况(±s)
a表示与同组术前比较,P<0.05。
组别参照组(n=47)研究组(n=47)t值P值CD8+(%)术前25.39±2.17 26.14±1.84 1.807 0.074术后3 d 22.57±2.10a 20.66±2.09a 4.420<0.001 CD4+(%)术前26.92±2.09 27.52±2.98 1.130 0.261术后3 d 32.07±1.98a 37.29±1.87a 13.140<0.001 CD4+/CD8+术前1.06±0.01 1.05±0.04 1.663 0.100术后3 d 1.43±0.04a 1.83±0.09a 27.843<0.001
2.2 两组患者术前、术后3 d营养状态情况
术前,两组患者ALB、PAB、TRE 水平比较,差异无统计学意义(P>0.05);术后3 d,两组患者ALB、PAB、TRE 水平均较术前降低,研究组ALB、PAB、TRE水平均高于参照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者术前、术后营养状态情况(±s)g/L
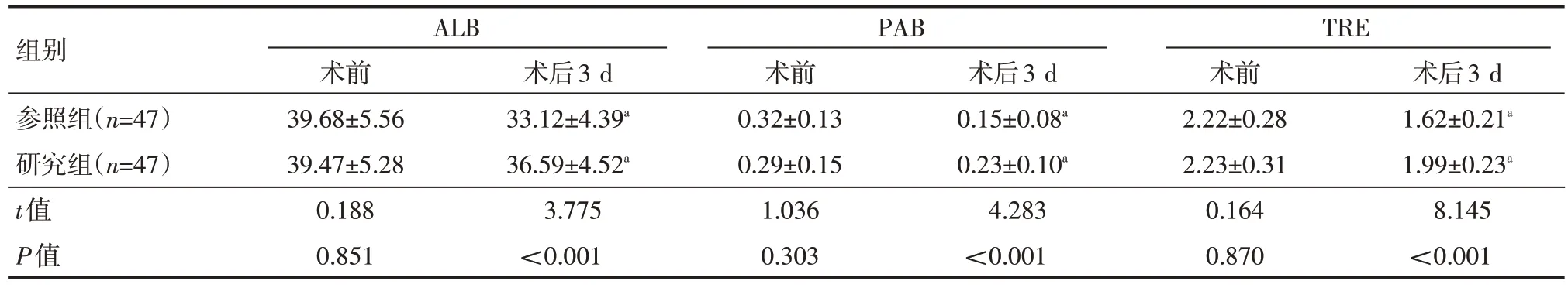
表2 两组患者术前、术后营养状态情况(±s)g/L
a表示与同组术前比较,P<0.05。
组别参照组(n=47)研究组(n=47)t值P值ALB PAB TRE术后3 d 1.62±0.21a 1.99±0.23a 8.145<0.001术前39.68±5.56 39.47±5.28 0.188 0.851术后3 d 33.12±4.39a 36.59±4.52a 3.775<0.001术前0.32±0.13 0.29±0.15 1.036 0.303术后3 d 0.15±0.08a 0.23±0.10a 4.283<0.001术前2.22±0.28 2.23±0.31 0.164 0.870
2.3 两组患者短期生存质量情况
研究组社会功能、生理功能、心理情绪、主观症状评分及总分均高于参照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者短期生存质量情况(±s)分

表3 两组患者短期生存质量情况(±s)分
组别参照组(n=47)研究组(n=47)t值P值社会功能10.59±3.55 13.48±3.67 3.880<0.001生理功能17.52±5.63 21.38±5.42 3.386<0.001心理情绪12.05±2.38 15.47±2.53 6.750<0.001主观症状59.81±7.63 68.95±8.80 5.380<0.001总分99.56±12.13 119.59±12.85 7.771<0.001
2.4 两组患者并发症发生情况
研究组并发症总发生率低于参照组,差异有统计学意义(P<0.05),见表4。
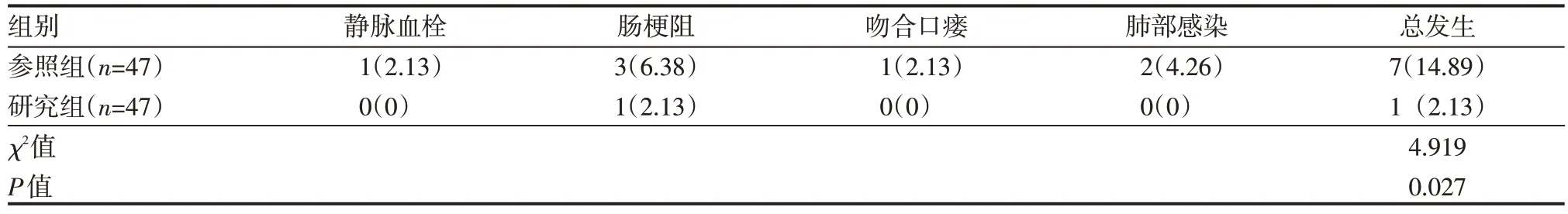
表4 两组患者并发症发生情况 例(%)
3 讨论
胃癌是发生于胃黏膜上皮细胞的恶性肿瘤,其发病多与患者的饮食习惯、幽门螺杆菌感染和遗传等因素有关[8]。目前,胃癌根治术是临床治疗胃癌的主要方式,腹腔镜下胃癌根治术是一种微创外科手术,对进展期胃癌患者有较好的治疗效果。对于老年胃癌患者而言,由于身体机能逐步衰退,免疫功能减弱,即便是创伤很小的手术,仍不可避免地会造成肠道细菌移位、解剖结构改变及内环境变化与损伤等情况,引发机体应激反应及免疫功能变化,进而影响患者生存质量[9]。常规护理虽然可取得一定效果,但仍存在较高局限性。FTS是90年代末由丹麦外科医师Kehlet提出的一种通过一系列有循证医学证据的优化干预措施,是通过降低患者围术期生理及心理创伤应激反应发生情况,达到快速康复目的的外科新理念。FTS以患者需求为中心,从多方面满足患者护理服务需求,以促进患者快速康复为最终目标,提高患者康复锻炼的配合度和依从性,从而有效缩短康复进程[10-11]。本研究结果显示,术后3 d,研究组CD8+水平低于参照组,CD4+、CD4+/CD8+水平均高于参照组,提示FTS可改善胃癌根治术患者机体免疫功能。机体抗肿瘤机制主要是通过T淋巴细胞参与的细胞免疫,CD4+/CD8+水平通常反映患者免疫功能的高低,其水平降低代表机体免疫功能下降。因此,维持T淋巴细胞数量的稳定可保障机体抗肿瘤细胞的能力,进而减少术后肿瘤复发转移的风险[12]。机体的营养不良会导致术后伤口愈合缓慢,甚至可能出现吻合口瘘等并发症,因此,改善患者营养状况对老年胃癌患者具有重要意义[13]。本研究结果显示,术后3 d,研究组ALB、PAB、TRE水平均高于参照组,提示对胃癌根治术老年患者实施FTS,可维持患者营养状态的稳定,以增强其组织愈合能力。术后胃肠功能恢复缓慢是影响老年胃癌患者生活质量的重要因素,而造成患者胃肠功能恢复缓慢的原因主要包括术后患者活动较晚及长期禁食禁水等。因此,FTS强调术后早期进行渐进式营养支持,以刺激肠黏膜,促进血管弹性及顺应性的恢复。此外,早期下床活动不仅有助于患者机体运动功能的恢复,对于改善患者心理情绪和生理功能也有积极作用[14]。本研究结果显示,研究组社会功能、生理功能、主观症状、心理情绪评分及总分均高于参照组,研究组并发症总发生率低于参照组,表明FTS能够显著提高胃癌根治术患者的短期生存质量,降低其并发症发生率。分析其原因在于,FTS倡导、鼓励患者在术后早期开展适量的有效活动,能够促进患者血液循环,以此增强其抵抗力,提高其免疫力,降低其术后并发症发生风险,提高患者生存质量,从而达到早期康复的目的。
综上所述,FTS应用于胃癌根治术老年患者中,能够改善患者免疫功能与营养状态,提高其生存质量,降低其并发症发生率。

