重组人白介素-29-Fc融合蛋白在HEK-293F细胞中的表达及体外抗肿瘤活性分析
闫甲丽,左群,祁芳冰,刘明杨,刘建伟,李素贞,柳森,王健
国药中生生物技术研究院有限公司第四研究室,北京 101111
白介素-29(interleukin-29,IL-29)也称干扰素λ1(interferon λ1,IFNλ1),是Ⅲ型干扰素家族成员之一。Ⅲ型干扰素包括λ1 ~4 4 个亚型[1],其中IL-29 作为先天性和适应性免疫应答的中间物发挥生物学作用,是最有效的Ⅲ型干扰素[2]。IL-29 的受体是由IL-10R2 和独特的IL-28R1 链组成的异源二聚体[3]。IL-29 与其受体结合,启动信号转导机制,发挥抑制肿瘤细胞生长[4-5]、抑制病毒复制[6-8]和调节免疫[9-11]的作用。IL-29 作为Ⅲ型干扰素的抗病毒作用机制及信号通路已研究较为透彻,但对肿瘤的抑制作用机制尚不明确。
Fc 融合蛋白是指利用基因工程技术将免疫球蛋白的Fc 段与某种具有生物学活性的效应蛋白分子(受体、酶、细胞因子、毒素、抗原肽和人工新合成的分子等)融合产生的新型蛋白[12-13]。蛋白单体在体内易被蛋白酶降解,由于相对分子质量较小,易被肾小球滤过而清除[14],IL-29 与其他重组蛋白单体药物相同,均在血浆中稳定性差、半衰期短。IL-29融合蛋白是否影响其抑制肿瘤体外增殖效应尚未见报道。
本研究在人胚肾293F(human embryonic kidney 293F,HEK-293F)细胞中表达了rhIL-29-Fc融合蛋白,并与实验室已有rhIL-29 进行对比。选取7 种肿瘤细胞(人小细胞肺癌NCI-H209、人非小细胞肺癌NCIH1975、人Burkkit 淋巴瘤Daudi、人食管癌EC109、人胰腺癌PANC-1、人结肠癌HCT-116 和人结肠癌HT-29 细胞),评价rhIL-29-Fc 融合蛋白对其是否具有体外增殖抑制效应,以期为IL-29蛋白抑制肿瘤细胞增殖的研究奠定基础。
1 材料与方法
1.1 菌株、质粒及细胞 大肠埃希菌(Escherichia coli,E.coli)DH5α(B101-02)菌株购自天根生化科技(北京)有限公司;载体UCOE(504867)购自美国Millopore公司;HEK-293F 细胞购自美国Invitrogen 公司;人结肠癌HT-29、人结肠癌HCT-116、人Burkkit 淋巴瘤Daudi、人非小细胞肺癌NCI-H1975、人小细胞肺癌NCI-H209、人食管癌EC109和人胰腺癌PANC-1细胞购自中国科学院细胞库。
1.2 主要试剂及仪器 T4 DNA 连接酶购自北京全式金生物技术股份公司;限制性内切酶NheⅠ(R0131S)和FseⅠ(R0588S)购自美国NEB公司;D15000+2000(MD116-02)购自天根生化科技(北京)有限公司;限制性内切酶BmtⅠ和FseⅠ购自美国NEB 公司;大提试剂盒购自美国AXYGEN 公司;胶回收试剂盒购自德国QIAGEN 公司;胰蛋白胨、酵母浸出液和脱脂奶粉购自美国BD 公司;琼脂粉购自上海捷瑞生物工程有限公司;琼脂糖、氨苄青霉素和TMB显色液均购自美国Sigma 公司;胶红购自美国BIOTUM 公司;脂质体转染试剂盒和293 细胞无血清培养基购自美国GIBCO公司;人IL-29 ELISA 试剂盒和HRP标记的羊抗鼠IgG购自英国Abcam公司;小鼠抗人IL-29/IFNλ1单抗购自美国R&D 公司;蛋白质marker 购自美国Thermo Scientific公司;12%蛋白预制胶购自美国Bio-Rad 公司;CCK-8 细胞凋亡检测试剂盒购自日本Dojindo 公司;rhIL-29 蛋白由国药中生生物技术研究院有限公司第四研究室制备;AKTA 系统、Protein A 预装柱购自美国GE公司。
1.3 实验动物 普通级日本大耳白兔,雌性,4周龄,体质量2.0 kg,共5 只,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2015-0001,动物使用许可证号:SYXK(京)2021-0059,动物质量合格证号:11400700287360。本实验均以科研为目的进行日本大耳白兔的养殖和使用,且按照《北京市实验动物福利伦理审查指南》相关规定进行(35892-2018)。
1.4 重组质粒的构建 IL-29 氨基酸序列由UniProt-KB:Q8IU54 获得,将200 个氨基酸转化为600 bp 鼠源化序列,加入本实验室常用Fc的697 bp序列,并在上游加入FseⅠ酶切位点,下游加入NheⅠ酶切位点,共计2 988 bp 的序列由北京君诺德生物技术有限公司合成。将合成的目的基因与载体UCOE经FseⅠ/NheⅠ双酶切切胶回收,以T4 DNA 连接酶室温连接10 min;转化E.coliDH5α 感受态细胞,37 ℃培养过夜;获得的单克隆菌株经扩大、提取质粒和酶切鉴定后,送北京君诺德生物技术有限公司测序,测序正确的质粒命名为UCOE-IL-29-Fc。
1.5 质粒瞬时转染 按照ExpiFectamine 293 Transfection Kits 试剂盒说明书进行操作。将质粒瞬时转染HEK-293F 细胞,并设对照质粒UCOE-EGFP,同时设未转染质粒的细胞作为阴性对照。第1 天开始取样,连续6 d,每次1 mL,956×g离心3 min,收集并分装上清及细胞,于-80 ℃冻存。荧光显微镜下观察转染24 h后细胞荧光蛋白表达情况。
1.6 rhIL-29-Fc融合蛋白的纯化 将收集的细胞培养液于2 550×g离心30 min;收集上清,经AKTA 系统进行Protein A 亲和层析,10 kD 超滤管浓缩纯化蛋白后,进行12%还原和非还原SDS-PAGE鉴定,用Image QuantTL软件分析目的蛋白纯度。
1.7 纯化rhIL-29-Fc 融合蛋白的Western blot 鉴定将纯化蛋白加入5×还原上样缓冲液,沸水煮5 min,3 770 ×g离心3 min 后,经12% SDS-PAGE 分离,湿转转印至PVDF 膜上,用含5%脱脂奶粉的PBS 37 ℃摇床封闭1.5 h;加入小鼠抗人IL-29/IFNλ1 单抗(1∶500 稀释),37 ℃摇床孵育1 h;加入HRP 标记的羊抗鼠IgG(1∶1 000 稀释),37 ℃摇床孵育1 h;滴加TMB 显色液,轻轻晃动,直至出现蓝色条带,用清水洗涤,置暗处晾干。
1.8 rhIL-29 和rhIL-29-Fc 融合蛋白半衰期的检测取1 只日本大耳白兔作为空白对照组(不进行任何处理,采血时间与实验组相同),其余4 只随机分为2 组,每组2 只,实验组1 经左耳皮下注射rhIL-29蛋白,实验组2 经左耳皮下注射rhIL-29-Fc 融合蛋白,0.5 mg/只;每隔2 h 经右耳静脉采血,分离血清,共采血4 次,检测血清中目的蛋白含量,按下式计算半衰期(t1/2)。
式中ke为清除曲线的斜率。
1.9 血清中rhIL-29蛋白含量的检测 具体操作按人IL-29 ELISA试剂盒说明书进行。96孔板内加入标准品或稀释后的待测样品,100 μL/孔,室温孵育1.5 h;洗板4次,加入IL-29抗体(1∶100稀释),100 μL/孔,室温孵育1 h;洗板4 次,加入HRP 标记的羊抗鼠IgG(1∶2 000 稀释),100 μL/孔,室温孵育1 h;洗板4次,加入TMB 显色液,100 μL/孔,室温避光显色15 min;加入终止液,50 μL/孔,终止反应。用酶标仪于450 nm波长处读取各孔A值(加入终止液后5 min内完成)。
1.10 rhIL-29 和rhIL-29-Fc 融合蛋白体外抑制肿瘤细胞增殖及半数抑制浓度(inhibitory concentration 50,IC50)的检测 具体操作按CCK-8 细胞凋亡试剂盒说明书进行。将rhIL-29 和rhIL-29-Fc 融合蛋白各设5个剂量(0.5、1、3、4和5 μg/mL)组,每组设5个平行孔,以1 × PBS 作为空白对照,完全培养基作为阴性对照。选取的7种肿瘤细胞分别为人结肠癌HT-29、人结肠癌HCT-116、人Burkkit 淋巴瘤Daudi、人非小细胞肺癌NCI-H1975、人小细胞肺癌NCI-H209、人食管癌EC109 和人胰腺癌PANC-1 细胞。按下式计算细胞生长抑制率(inhibition ratio,IR)。用SPSS 26 的Probit 分析功能对,响应频率为抑制率,观测值汇总为总数,协变量为浓度,转换选择对数底为10,模型选择logit,计算rhIL-29和rhIL-29-Fc融合蛋白对7种肿瘤细胞的增殖IC50。
1.11 统计学分析 采用SPSS 26.0和OriginPro 2016软件进行统计学分析,实验数据用均值± 标准差(xˉ± s)表示,肿瘤细胞抗增殖作用差异的组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒的鉴定 质粒UCOE-IL-29-Fc的双酶切产物经1%琼脂糖凝胶电泳分析,在1 000 ~2 000 bp之间可见目的条带,大小与理论值(1 325 bp)相符,见图1。测序结果与理论序列100%相同,表明质粒构建正确。

图1 质粒UCOE-IL-29-Fc的酶切(FseⅠ/NheⅠ)鉴定Fig.1 Restriction map of plasmid UCOE-IL-29-Fc(Fse I/Nhe I)
2.2 重组质粒的转染 对照质粒UCOE-EGFP 转染HEK-293F 细胞24 h 后,可见荧光蛋白表达,表明质粒UCOE-IL-29-Fc转染成功,见图2。
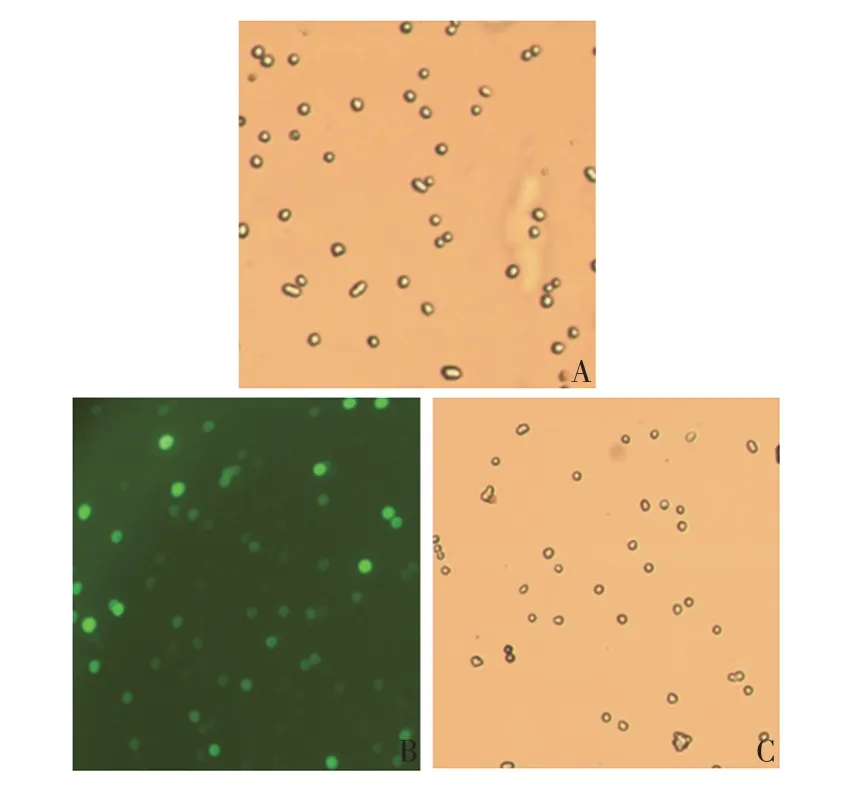
图2 质粒转染HEK293-F 细胞24 h 的荧光显微镜观察(×10)Fig.2 Fluorescence microscopy of HEK293-F cells transfected with plasmid for 24 h(×10)
2.3 纯化的rhIL-29-Fc融合蛋白的鉴定 纯化的rhIL-29-Fc 蛋白经12% SDS-PAGE 分析,在相对分质量40 000 ~55 000处可见还原目的条带,大小与还原目的蛋白理论值(53 000)相符;在相对分质量100 000 ~130 000 处可见非还原目的条带,大小与目的蛋白二聚体理论值(106 000)相符。见图3。表明HEK-293F细胞已成功表达rhIL-29-Fc蛋白。纯化的rhIL-29-Fc蛋白浓度为1.5 mg/mL,纯度为93%。
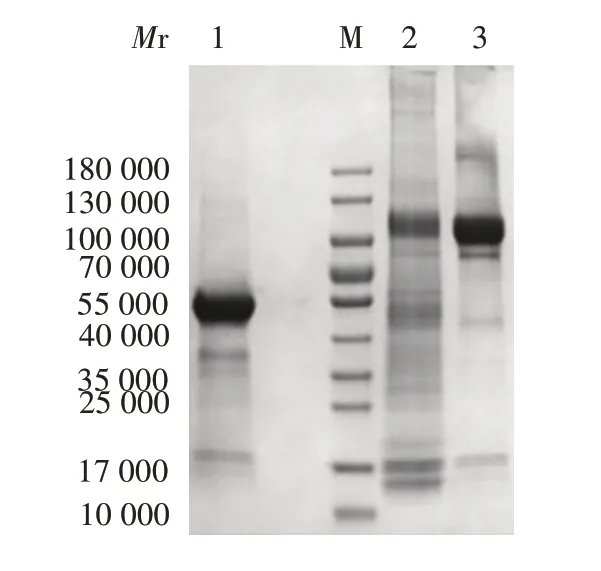
图3 纯化的rhIL-29-Fc蛋白的SDS-PAGE鉴定Fig.3 SDS-PAGE identification of purified rhIL-29-Fc protein
Western blot 分析显示,纯化的rhIL-29-Fc 蛋白可与小鼠抗人IL-29抗体特异性结合,在相对分子量约55 000处可见目的蛋白条带,大小与理论值(53 000)相符,见图4。
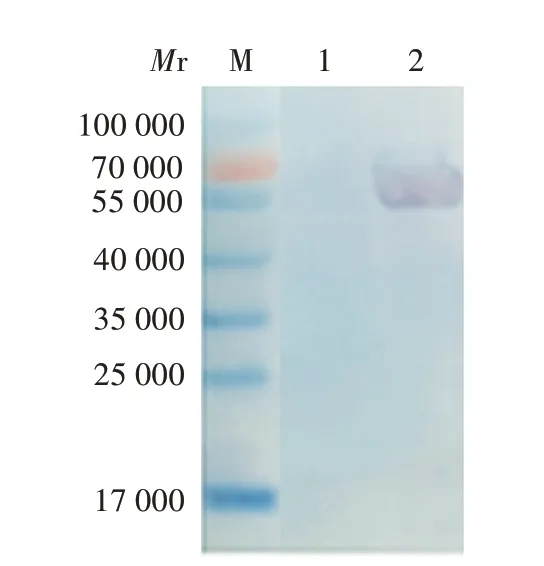
图4 纯化的rhIL-29-Fc融合蛋白的Western blot鉴定Fig.4 Western blot identification of purified rhIL-29-Fc fusion protein
2.4 rhIL-29 和rhIL-29-Fc 融合蛋白半衰期 根据各组吸光值绘制rhIL-29 和rhIL-29-Fc 蛋白在白兔体内的清除曲线,见图5,经计算,rhIL-29 和rhIL-29-Fc 蛋白半衰期分别为5和25 h。
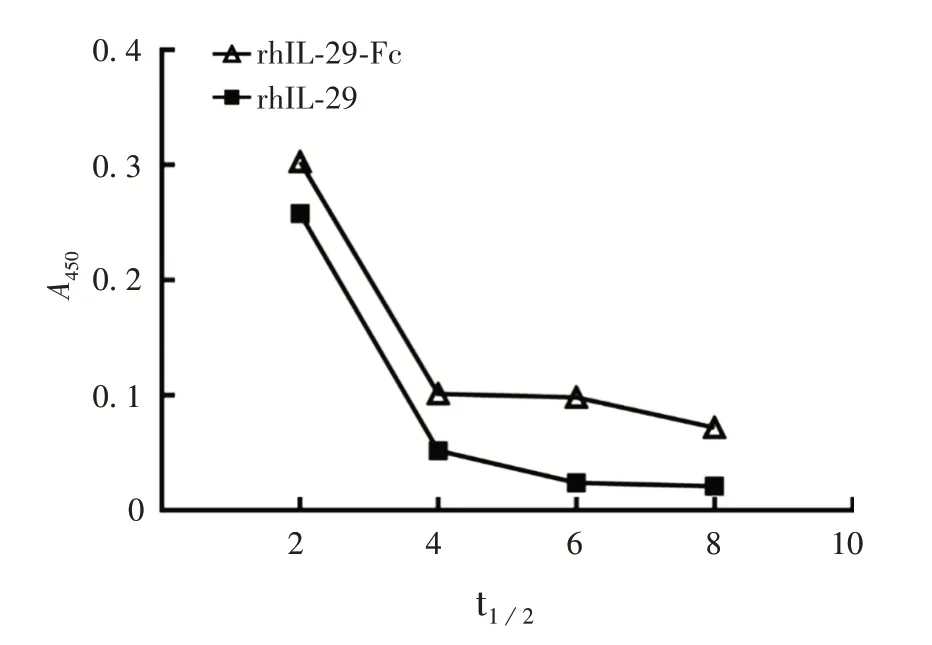
图5 rhIL-29 和rhIL-29-Fc 蛋白在大耳白兔中的药物代谢分析Fig.5 Pharmacokinetics analysis of rhIL-29 and rhIL-29-Fc proteins in white rabbits
2.5 rhIL-29 和rhIL-29-Fc 融合蛋白体外抑制肿瘤细胞增殖试验 rhIL-29 和rhIL-29-Fc 蛋白对7 种肿瘤细胞均显示出较明显的增长抑制效应,但对不同肿瘤细胞的增殖抑制率各有差异,且7 种肿瘤细胞的增长抑制率随着rhIL-29 和rhIL-29-Fc 蛋白浓度的增加而升高,尤其5 μg/mL 的rhIL-29-Fc 蛋白对Daudi 细胞的增长抑制率高达(61.67 ± 2.89)%,对NCI-H1975细胞的增长抑制率高达(64.33±3.51)%。见图6。
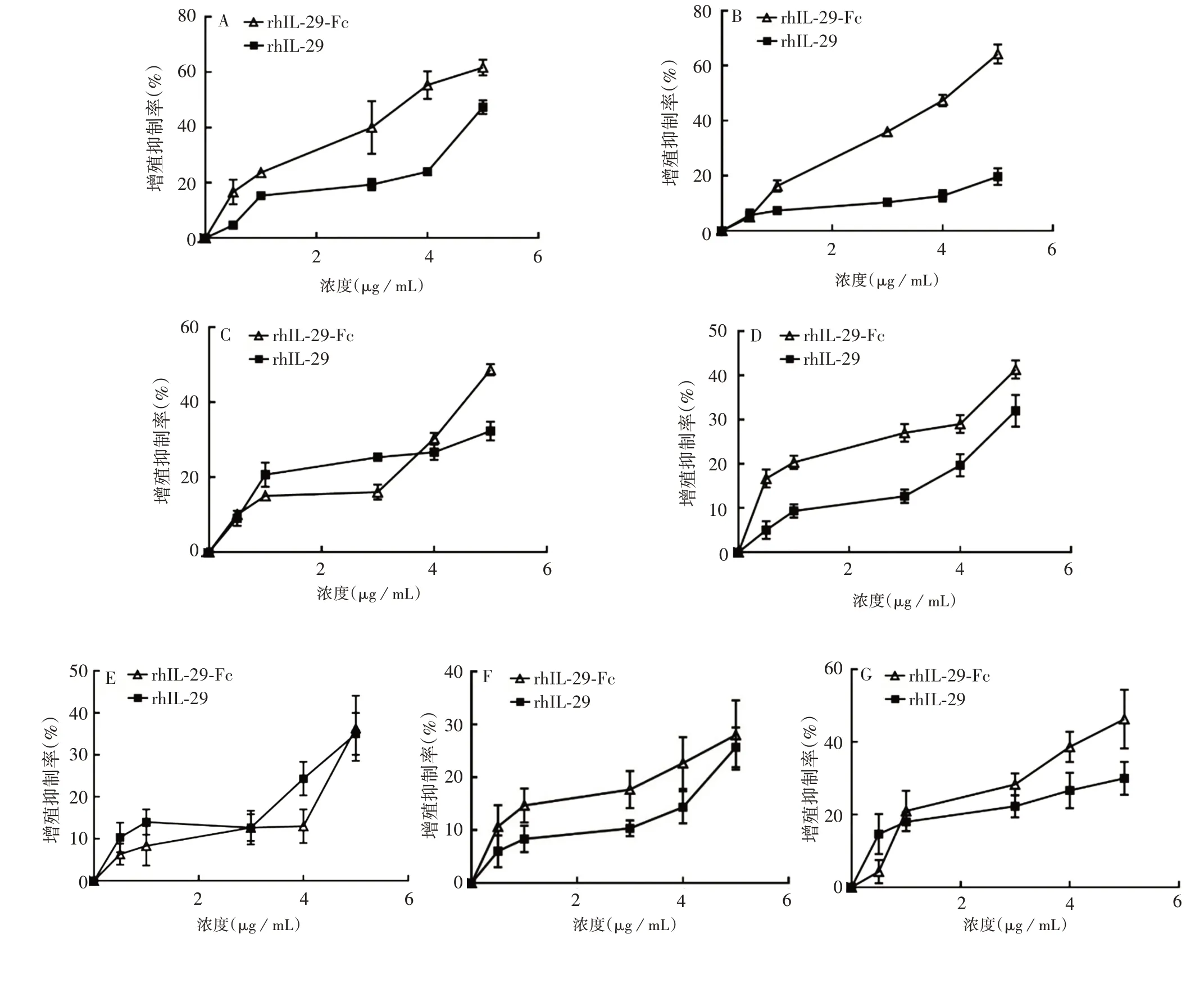
图6 不同浓度下rhIL-29和rhIL-29-Fc蛋白对7种肿瘤细胞的增殖抑制率(n=3)Fig.6 Proliferation inhibitory rate of different concentrations of rhIL-29 and rhIL-29-Fc proteins on 7 cancer cells(n=3)
在每个蛋白浓度下,rhIL-29-Fc 蛋白对Daudi 细胞的抗肿瘤细胞增殖效应均优于rhIL-29 蛋白(P均<0.05);除蛋白浓度0.5 μg/mL 外,rhIL-29-Fc蛋白对NCI-H1975 细胞的抗肿瘤细胞增殖效应优于rhIL-29 蛋白(P均<0.05);蛋白浓度为5 μg/mL时,rhIL-29-Fc 融合蛋白对HCT-116细胞的抗肿瘤细胞增殖效应优于rhIL-29 蛋白(P<0.05);在每个蛋白浓度下,rhIL-29-Fc 蛋白对HT-29 细胞的抗肿瘤细胞增殖效应均优于rhIL-29 蛋白(P均<0.05);蛋白浓度为4 μg/mL 时,rhIL-29-Fc 蛋白对NCI-H209 细胞的抗肿瘤细胞增殖效应优于rhIL-29蛋白(P<0.05);蛋白浓度为4 μg/mL时,rhIL-29-Fc融合蛋白对PANC-1细胞的抗肿瘤细胞增殖优于rhIL-29蛋白(P<0.05);蛋白浓度为4和5 μg/mL时,rhIL-29-Fc蛋白对EC109细胞的抗肿瘤细胞增殖效应均优于rhIL-29 蛋白(P均<0.05)。见表1。
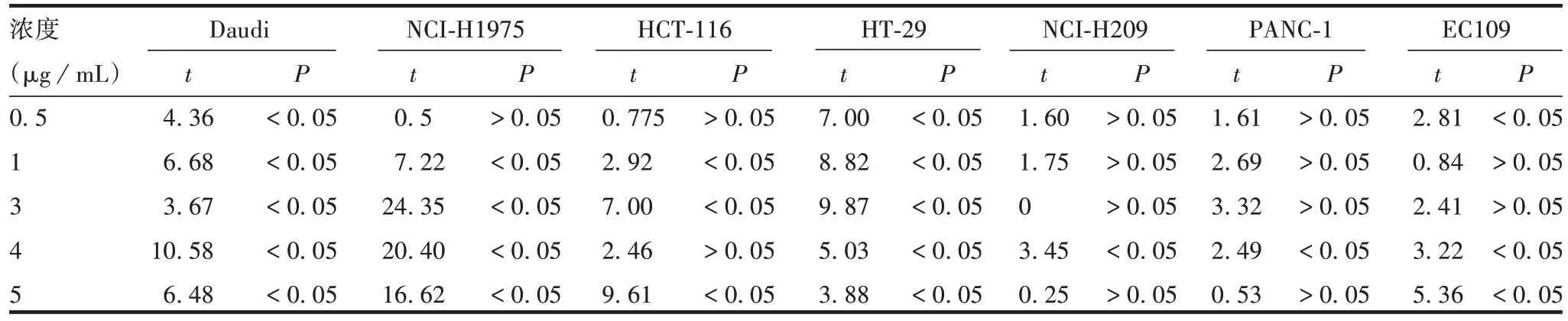
表1 rhIL-29和rhIL-29-Fc融合蛋白对7种肿瘤细胞抑制率的统计学分析Tab.1 Statistical analysis of inhibitory rate of rhIL-29 and rhIL-29-Fc fusion protein on 7 cancer cells
蛋白浓度为1和3 μg/mL时,rhIL-29蛋白对HCT-116 细胞的抗肿瘤细胞增殖效应均优于rhIL-29-Fc蛋白(P均<0.05);蛋白浓度为0.5 μg/mL时,rhIL-29 蛋白对EC109 细胞的抗肿瘤细胞增殖效应优于rhIL-29-Fc蛋白(P<0.05)。见表1。
rhIL-29-Fc 蛋白对NCI-H1975 细胞(蛋白浓度为0.5 μg/mL 时)、HCT-116 细胞(蛋白浓度为0.5 和4 μg/mL时)、NCI-H209细胞(除蛋白浓度为4 μg/mL时)、PANC-1 细胞(除蛋白浓度为3 μg/mL 时)和EC109 细胞(蛋白浓度为1 和3 μg/mL 时)的抗肿瘤细胞增殖效应均与rhIL-29 蛋白相当(P均>0.05)。见表1。
2.6 rhIL-29和rhIL-29-Fc融合蛋白对肿瘤细胞的IC50rhIL-29-Fc蛋白对Daudi、NCI-H1975、HCT-116和EC109细胞的IC50分别为3.47、3.93、9.44和6.30 μg/mL,rhIL-29蛋白则分别为8.75、93.34、31.71和60.07 μg/mL,表明Daudi、NCI-H1975、HCT-116 和EC109 细胞对rhIL-29-Fc 蛋 白更 敏 感。rhIL-29-Fc 和rhIL-29 蛋 白对HT-29 细胞的IC50分别为17.98 和16.94 μg/mL,表明两者对HT-29 细胞抑增殖作用相当。rhIL-29-Fc和rhIL-29蛋白对PANC-1细胞的IC50分别为54.06和42.82 μg/mL,表明HT-29 细胞对rhIL-29 蛋白更敏感。见表2。
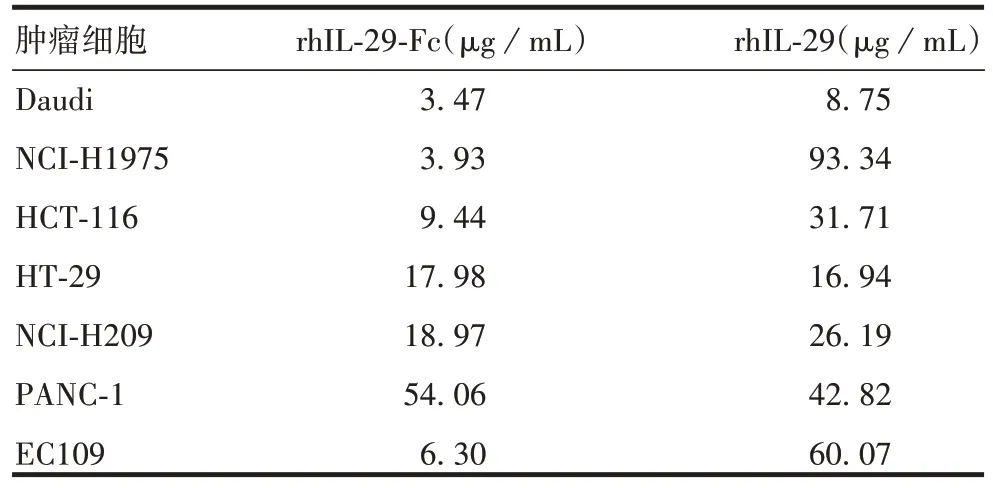
表2 rhIL-29和rhIL-29-Fc融合蛋白对7种肿瘤细胞的IC50Tab.2 IC50 of rhIL-29 and rhIL-29-Fc fusion protein on 7 cancer cells
3 讨论
IL-29 虽然在结构上与IL-10 家族成员相似,但其与受体结合后的信号传导途径却与Ⅰ型干扰素有实质性的重叠。IL-29 与Ⅰ型干扰素功能类似,但也有其独特的生物学活性,如抗病毒、抗肿瘤增殖和免疫调节功能[15]。IL-29 主要在上皮细胞中表达,由于其受体的分布具有组织特异性,导致其信号传导作用存在局限性。IL-29 比Ⅰ型干扰素安全、有效且副作用少[16-17],具有临床实用性。本实验选取了7种肿瘤细胞,包括NCI-H209、NCI-H1975、Daudi、EC109、PANC-1、HCT-116 和HT-29 细胞,结果发现,rhIL-29-Fc和rhIL-29蛋白均对7种肿瘤细胞显示出不同程度的体外增殖抑制效应;rhIL-29-Fc 融合蛋白对Daudi细胞的抗肿瘤细胞增殖效应优于rhIL-29,对除HT-29 和PANC-1 细胞外的其他5 种细胞的IC50均低于rhIL-29,表明rhIL-29-Fc 融合蛋白抗肿瘤活性高于rhIL-29。本实验为IL-29-Fc 融合蛋白抑制肿瘤细胞增殖的研究奠定了基础。IL-29 的直接抗肿瘤作用包括抑制细胞增殖和有丝分裂,同时促进细胞凋亡和细胞周期阻滞[18-20],另外宿主免疫和抗血管生成机制的参与也是IL-29 的重要抗肿瘤机制[21-22],但明确的机制尚待进一步研究。已证明IL-29 对黑色素瘤、纤维肉瘤、肺腺癌、乳腺癌和前列腺腺癌等具有抗肿瘤活性[23-27],关于IL-29 在临床肿瘤学中应用的研究不断出现,有望成为未来肿瘤治疗的新热点。
重组蛋白单体半衰期较短,GLP-1 在血浆中的半衰期仅为2 min,重组IL-2在体内半衰期仅6.9 min,而其他大部分活性蛋白单体半衰期基本约在1 d 以内[28]。本实验初步发现,rhIL-29 蛋白半衰期为5 h;rhIL-29-Fc融合蛋白半衰期为25 h,提高了近20 h。大量文献已证实,Fc 融合蛋白存在诸多优势:①Fc 融合蛋白通过融合形成大分子,增加了蛋白质的稳定性,减少被体内蛋白酶水解,降低药物被肾脏滤除[13,29];Fc段可与FcRn结合而防止被降解,即两者在体内酸性环境下结合,在pH 处于中性时,IgG 与FcRn 分离,并被释放至外周环境中,继续发挥作用,达到延长半衰期的作用[14,30]。Fc 融合蛋白的这种长期稳定性可增加药物进入靶点部位的可能性,减少用药频率,提高患者用药依从性。②Fc融合蛋白与FcRs(Fc受体)结合,通过抗体依赖的细胞毒作用、补体依赖的细胞毒作用和抗体依赖的细胞介导的吞噬作用等杀伤靶细胞,维持免疫系统稳定[31-32]。③从技术层面上看,Fc融合蛋白由于Fc段的存在,可通过免疫亲和层析法来进行纯化,一步纯化可使蛋白纯度达95%以上[33]。
本实验利用HEK-293F细胞成功制备了rhIL-29-Fc融合蛋白,能有效延长其半衰期;rhIL-29-Fc融合蛋白对7种肿瘤细胞均显示出不同程度的体外增殖抑制效应,为IL-29蛋白治疗肿瘤的研究和开发奠定了基础。

