皮内免疫部分剂量组分无细胞百白破-Sabin株脊髓灰质炎联合疫苗的免疫持久性
李婧妍,蔡路奎,马艳,温嘉纳,胡文著,廖宏玮,史荔,杨净思
1.中国医学科学院 北京协和医学院 医学生物学研究所,云南 昆明 650118;2.昆明市新发突发高致病性病原体疫苗研发和产业化企业科技创新中心,云南 昆明 650118
随着全球消灭脊髓灰质炎行动计划的推进,各国相关免疫规划已将脊髓灰质炎灭活疫苗(inactivated poliovirus vaccine,IPV)和口服脊髓灰质炎减毒活疫苗(oral live attenuated poliomyelitis vaccine,OPV)联合序贯免疫逐步转换为全程使用IPV[1]。目前,野毒株制备的IPV(wIPV)和Sabin 株制备的IPV(sIPV)产能无法满足全球需求[2-3]。因此,WHO建议通过减少常规免疫IPV 的针次、改用皮内免疫(intradermal,ID)、使用佐剂等方法减少抗原用量,以缓解该疫苗产能不足的情况[4-6]。皮内具有丰富的抗原提呈细胞,能够刺激启动T细胞反应,低剂量抗原进行ID 即可诱导等效全剂量肌肉注射(intramuscular,IM)的免疫反应[7-9]。2016年,印度成为第一个将ID部分剂量IPV(fIPV)引入常规免疫的国家[10]。
用IPV与脱毒后的白喉毒素(diphtheria toxin,DT)、破伤风毒素(tetanus toxin,TT)、百日咳毒素(pertussis toxin,PT)制备的联合疫苗(diphtheria-tetanus-acellular component pertussiss and inactivated poliovirus combined vaccine,DTaP-IPV)进行接种可减少疫苗接种针次,提高免疫接种依从性和覆盖率。中国医学科学院医学生物学研究所已研发出具有良好的安全性和免疫原性的组分无细胞百日破-Sabin 株脊髓灰质炎联合疫苗(diphtheria-tetanus-acellular component pertussis and Sabin-derived inactivated poliovirus vaccine,DTacP-sIPV)[11-13]。与目前已上市的国产共纯化百日咳疫苗比较,组分无细胞百日咳疫苗(acellular component pertussis,acP)具有纯度更高和质量更稳定的抗原组分[14]。以色列NanoPass technologies 公司研发的用于ID 的皮内注射微针MicronJet600 是由3 根长度为0.6 mm 的微针头组成,易于安装且操作简单,能直接将疫苗注射至真皮层[15-16]。前期研究开展了ID 部分剂量sIPV 的免疫原性研究,结果表明,ID 1/12 剂量含佐剂的sIPV 即可获得IM 全剂量sIPV 的相同免疫效果[17]。本研究采用MicronJet600对部分剂量DTacP-sIPV 进行ID,评价其免疫持久性,以期为ID 部分剂量DTacP-sIPV 的临床前研究和应用提供实验依据。
1 材料与方法
1.1 疫苗及菌株 DTacP-sIPV 由中国医学科学院医学生物学研究所自主研发并制备,百日咳杆菌菌株(BP-L1,2019 年)由该研究所分离获得(等位基因ptxA1、prn2、fhaB1、fim3A和ptxP3与当前流行菌株D420一致[18-19])。
1.2 主要试剂 DT、TT、PT、丝状血凝素(filamentous haemagglutinin,FHA)和百日咳黏附素(pertactin,PRN)均由中国医学科学院医学生物学研究所制备及保存;HRP 标记的兔抗大鼠IgG 购自美国Abcam 公司;单组TMB 底物显色液购自北京索莱宝科技有限公司;包姜氏琼脂培养基购自海博生物技术有限公司;炭琼脂培养基购自英国Oxoid公司;脱纤维羊血购自南京乐诊生物技术有限公司;其他试剂均为国产分析纯。
1.3 实验动物 SPF 级Wistar 大鼠,雌雄各半,1 月龄,体质量180~220 g,购自湖南天勤生物科技有限公司,动物饲养于无特定病原体环境中,动物使用许可证号为:SYXK(滇)K2019-0003。所有的动物实验均符合有关法律、制度、指导原则及赫尔辛基宣言的道德标准,已通过所在地动物实验伦理委员会批准(批准号为:DWSP201911022)。
1.4 动物分组及给药 将Wistar 大鼠随机分为4 组:1/5D ID、1/10D ID、全剂量IM及空白对照组,每组10只,雌雄各半。用0.9%氯化钠溶液将DTacP-sIPV按1∶5 和1∶10 的体积分数进行稀释,获得1/5 和1/10剂量的DTacP-sIPV,1/5D 及1/10D ID 组分别经大鼠后腿进行ID,每只大鼠左右腿各0.05 mL;全剂量IM 组经大鼠后腿IM 全剂量DTacP-sIPV,每只大鼠左右腿各0.25 mL;空白对照组分别经大鼠后腿进行ID PBS,每只大鼠左右腿各0.05 mL。于0、1、2 月共免疫3 次,末次免疫后12 个月经尾静脉采血,分离血清,-20 ℃保存。
1.5 脊髓灰质炎病毒中和抗体滴度的测定 各组大鼠血清经56 ℃灭活30 min,采用微量中和试验法检测抗脊髓灰质炎病毒Ⅰ、Ⅱ、Ⅲ型中和抗体滴度[11,20],能够保护50% Hep-2细胞不受100 CCID50攻击脊髓灰质炎病毒液感染的血清最高稀释度即为该血清的中和抗体滴度,中和抗体滴度≥1∶8判为阳性,计算抗体几何平均滴度(geometric mean titer,GMT)。
1.6 百白破血清IgG抗体滴度的测定 采用间接ELISA法检测大鼠血清中抗DT、TT、PT、FHA、PRN 的IgG抗体滴度,以阴性血清2.1 倍A450为判断终点,特异性抗体的终点滴度以最高稀释度的倒数表示[21],并计算GMT。免疫后抗体滴度比免疫前增长倍数≥4时判为血清阳转。
1.7 百日咳杆菌气雾攻击试验 将百日咳杆菌用含15%羊血和10%甘油的包姜氏琼脂培养基,于37 ℃培养6 d;用接种环收集菌苔至0.9%氯化钠溶液中,稀释至1011CFU/mL,用于气雾攻击试验。于末次免疫12 个月后,各组大鼠经雾化吸入百日咳杆菌气雾进行攻击,攻击时间为30 min[22]。气雾攻击后2、5及14 d,经大鼠尾静脉采全血300 μL,EDTA 抗凝,血球计数仪检测白细胞数;各时间点每组取4 只大鼠,经颈椎脱臼处死,无菌取肺组织及气管,加入1 mL 0.9%氯化钠溶液,研磨为匀浆液,用PBS 分别进行10、100、1 000倍稀释。用200 μL PBS冲洗小鼠鼻腔,收集鼻灌洗液。分别取稀释后的肺组织及气管匀浆液、鼻灌洗液各50 μL,涂布于6 cm 炭琼脂培养基血平皿中,37 ℃孵育4 d,计算菌落克隆形成数(colony-forming unit,CFU)。
1.8 统计学分析 应用GraphPad Prism 9.0 软件进行统计学分析及绘图,组间GMT、白细胞数量、CPV的比较采用方差(ANOVA)分析,组间阳性率比较采用Fisher检验,均以P<0.05为差异有统计学意义。
2 结果
2.1 脊髓灰质炎病毒中和抗体滴度 空白对照组脊髓灰质炎病毒中和抗体log2GMT 为4,阳性率为0。与全剂量IM 组比较,1/5D ID 组Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎病毒中和抗体log2GMT 差异无统计学意义(F分别为1.69、2.54、10.64,P均>0.05);1/10D ID 组Ⅲ型脊髓灰质炎病毒中和抗体log2GMT 显著降低(F= 10. 64,P<0.001),Ⅰ和Ⅱ型差异无统计学意义(F分别为1.69 和2.54,P均>0.05),见表1。与全剂量IM 组比较,1/5D 和1/10D ID 组脊髓灰质炎病毒Ⅰ、Ⅱ、Ⅲ型中和抗体阳性率差异均无统计学意义(P均>0.05),见表2。
表1 各组大鼠血清中抗脊髓灰质炎病毒中和抗体水平(log2GMT,,n=10)Tab. 1 Level of neutralizing antibody against poliovirus in serum of rats in each group(log2GMT,,n=10)
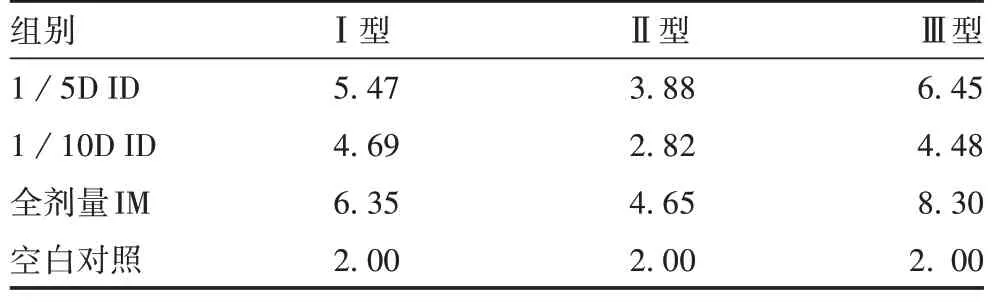
表1 各组大鼠血清中抗脊髓灰质炎病毒中和抗体水平(log2GMT,,n=10)Tab. 1 Level of neutralizing antibody against poliovirus in serum of rats in each group(log2GMT,,n=10)
组别1/5D ID 1/10D ID全剂量IM空白对照Ⅰ型5.47 4.69 6.35 2.00Ⅱ型3.88 2.82 4.65 2.00Ⅲ型6.45 4.48 8.30 2. 00
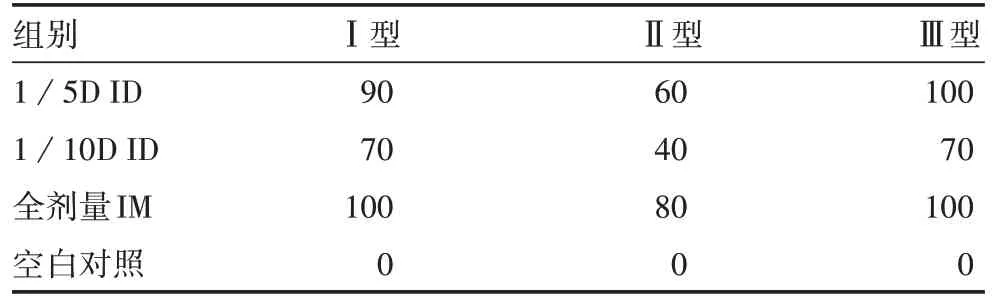
表2 各组大鼠血清中抗脊髓灰质炎病毒中和抗体阳性率(%)Tab. 2 Positive rate of neutralizing antibody against poliovirus in serum of rats in each group(%)
2.2 百白破血清IgG抗体的水平 空白对照组大鼠百白破血清抗体水平较低,log2GMT在5.74~7.64范围内。1/10D ID 组抗DT、TT、PT 的IgG 抗体log2GMT 均显著低于1/5D ID 组和全剂量IM 组(F分别为14.60、7.351 和5.584,P均<0.05),抗FHA 的IgG 抗 体log2GMT显著低于全剂量IM 组(F=5.29,P<0.05),抗PRN 的IgG 抗体log2GMT 显著低于1/5D ID 组(F= 3.41,P<0.05),见表3。空白对照组百白破IgG抗体阳性率均为0,其他各组均为100%。
表3 各组大鼠百白破血清IgG抗体水平(log2GMT,,n=10)Tab.3 Level of serum IgG antibodies against DTP in rats of each group(log2GMT,,n=10)

表3 各组大鼠百白破血清IgG抗体水平(log2GMT,,n=10)Tab.3 Level of serum IgG antibodies against DTP in rats of each group(log2GMT,,n=10)
组别1/5D ID 1/10D ID全剂量IM空白对照PT 16.74 15.84 16.94 6.04 FHA 17.44 16.64 17.74 6.74 PRN 15.94 14.54 15.34 5.74 DT 18.54 16.64 18.24 7.64 TT 17.34 16.34 17.74 5.94
2.3 百日咳杆菌气雾攻击后大鼠的白细胞数 与攻击后2 d比较,空白对照组大鼠经百日咳杆菌气雾攻击后5 d 的白细胞数明显升高(F=3.48,P<0.05),随后开始下降;其他组均随时间的延长保持平稳(F=0.14 ~1.30,P>0.05)。攻击后5 d,空白对照组大鼠白细胞数显著高于1/10D ID 和全剂量IM 组(F=5.046,P<0.05)。见图1。
2.4 百日咳气雾攻击后大鼠肺、气管、鼻的细菌定植情况 气雾攻击后,空白对照组大鼠肺部细菌载量明显高于其他3 组(F= 19. 00~206. 00,P<0.05),攻击后14 d 仍可检测到百日咳杆菌;除空白对照组外,其他3 组大鼠肺部细菌载量均于攻击后5 d 达峰值,14 d 时基本清除,各时间点组间差异无统计学意义(F=1.14~1.25,P>0.05)。空白对照组各时间点气管和鼻部细菌载量略高于其他组,但差异无统计学意义(F= 0.71~3.54,P>0.05);除空白对照组外,其他3 组大鼠气管和鼻部细菌载量较接近,差异均无统计学意义(F=0.75~3.41,P>0.05)。见表4。
表4 气雾攻击后各组大鼠肺部、气管及鼻灌洗液中百日咳杆菌细菌载量(lgCFU,,n=4)Tab. 4 B.pertussis loads in lung homogenate,tracheal homogenate and nasal lavage fluid of rats in each group after aerosol challenge(lgCFU,,n=4)
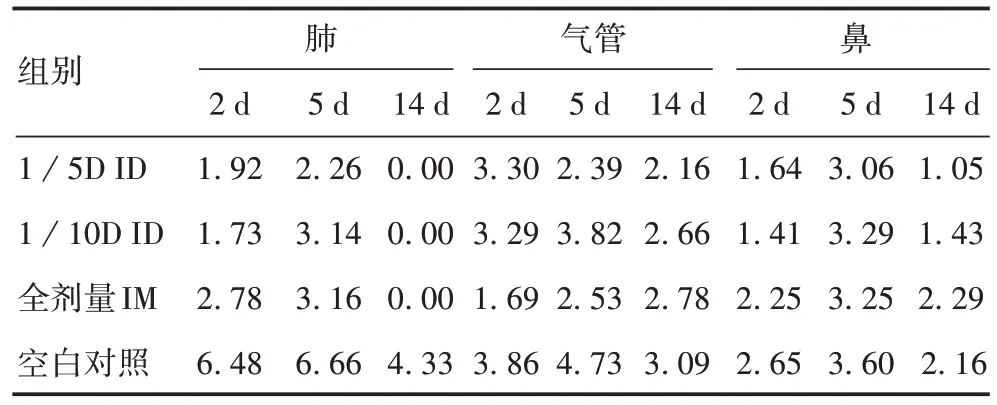
表4 气雾攻击后各组大鼠肺部、气管及鼻灌洗液中百日咳杆菌细菌载量(lgCFU,,n=4)Tab. 4 B.pertussis loads in lung homogenate,tracheal homogenate and nasal lavage fluid of rats in each group after aerosol challenge(lgCFU,,n=4)
组别1/5D ID 1/10D ID全剂量IM空白对照肺2 d 1.92 1.73 2.78 6.48 5 d 2.26 3.14 3.16 6.66 14 d 0.00 0.00 0.00 4.33气管2 d 3.30 3.29 1.69 3.86 5 d 2.39 3.82 2.53 4.73 14 d 2.16 2.66 2.78 3.09鼻2 d 1.64 1.41 2.25 2.65 5 d 3.06 3.29 3.25 3.60 14 d 1.05 1.43 2.29 2.16
3 讨论
多项研究证明,ID 可在降低疫苗抗原使用量的情况下,诱导良好的免疫应答反应[23-24],已完成ID 部分剂量DTacP-sIPV 免疫原性及安全性研究结果表明,基础免疫3 剂次后,ID 1/5D DTacP-sIPV 的免疫水平与IM 全剂量DTacP-sIPV 的免疫水平相近[18]。本研究结果表明,3 剂次ID 1/5D DTacP-sIPV 12 个月后,可维持较高的抗体滴度,疫苗各组分间无干扰作用,其中百白破组分的持续性免疫效果较好;脊髓灰质炎组分的中和抗体滴度均有所下降,需对其进行加强免疫,加强免疫效果有待后续进一步研究。3剂次ID 1/5D DTacP-sIPV 12个月后,各组分的GMT与全剂量IM 组DTacP-sIPV 差异无统计学意义(P>0.05),提示ID 1/5D DTacP-sIPV 可诱导较高水平的免疫应答,效果与全剂量IM 组DTacP-sIPV 相近。3 剂次免疫后12 个月,各免疫组百白破血清阳性率仍达100%,1/5D ID 组脊髓灰质炎病毒Ⅰ、Ⅱ、Ⅲ型中和抗体阳性率为90%、70%、100%,与全剂量IM 组比较,差异无统计学意义(P>0.05),1/10D ID组各型脊髓灰质炎病毒中和抗体阳性率降至40%~70%。有研究表明,单独ID sIPV 3 剂次后12 个月,全剂量IM 组脊髓灰质炎病毒中和抗体阳性率维持在80%以上,1/5D 组70%以上,1/10D 组50%以上[25],该结果与本研究相符。3 剂次基础免疫12 个月后,1/10D ID 组疫苗各组分抗体滴度及阳转率均低于1/5D ID 组及全剂量IM 组,1/5D ID 组末次免疫12 个月后的抗体水平及阳性率与全剂量IM 组差异无统计学意义(P>0.05),具有良好的免疫持久性。
大鼠百日咳杆菌气雾攻击试验结果发现,各疫苗组末次免疫12 个月后对百日咳杆菌攻击仍具有保护效果,其白细胞数量呈平稳状态,无明显变化(P>0.05)。空白对照组大鼠在百日咳杆菌气雾攻击后出现明显的百日咳感染症状,白细胞数量持续增加,在攻击后5 d 达峰值,随后下降(P<0.05);气雾攻击后大鼠肺部检测到百日咳杆菌,5 d 达峰值,14 d 仍未清除,肺部的百日咳杆菌菌落数显著高于其他各组(P<0.05);除空白对照组外,其他3 组大鼠在气雾攻击感染初期,肺、气管、鼻灌洗液可检测到少量百日咳杆菌定植,感染14 d 后百日咳杆菌基本被清除,3 组间差异无统计学意义(P>0.05),证明各组疫苗免疫12 个月后对百日咳仍具有较好的保护效果。
综上所述,ID 1/5D DTacP-sIPV 可诱导大鼠产生各组分相应的保护性抗体,且免疫效果及其免疫持久性与全剂量IM 相近,12个月后对百日咳杆菌攻击仍具有良好的保护效果。本研究为ID 部分剂量DTacP-sIPV免疫策略的制订提供了实验依据。

