siRNA干扰C-C趋化因子配体5对喉癌细胞生物学特性的影响
牛丽,韩瑞,贺龙,王瑛,郭慧娜,皇甫辉
1.山西医科大学第一临床医学院,山西 太原 030001;2.山西医科大学第一医院耳鼻咽喉头颈外科,山西 太原 030001;3.山西医科大学第一医院耳鼻咽喉头颈外科耳鼻咽喉头颈肿瘤山西省重点实验室,山西 太原 030001
喉癌作为头颈部最常见的恶性肿瘤之一,严重威胁人类健康。美国2020 年数据显示,本土新增病例12 370 例,其中3 750 例患者死于喉癌[1]。目前喉癌中鳞状细胞癌占比最高,约95%以上[2]。由于喉癌具有增殖快、侵袭强、远处转移等生物学特性[3],各环节易造成喉癌术后复发。靶向治疗作为近年治疗热点,对患者预后及生存有极大改善[4]。
siRNA主要用于沉默基因表达。与microRNA不同,siRNA是由外源性RNA分子引起的RNA干扰,通过与靶向mRNA 完全互补结合降解目的RNA[5]。通过siRNA 靶向目的基因,研究敲降该基因对喉鳞状细胞癌细胞生物学特性的影响,是目前相关研究的成熟方法。
C-C 趋化因子5(C-C chemokine ligand 5,CCL5)是聚集在17号染色体长臂上的几个趋化因子基因之一。趋化因子参与免疫调节和炎症过程[6-8]。根据成熟肽N-端半胱氨酸残基的排列,将超家族分为4 个亚家族。趋化因子是CC亚家族的一员,对血液单核细胞、记忆T 辅助细胞和嗜酸性粒细胞起趋化作用,可导致嗜碱性粒细胞释放组胺,启动嗜酸性粒细胞[9-11]。CCL5 在肿瘤形成中起到十分重要的作用,可促进肝纤维化导致肝脏恶化,进而促进肝癌形成[12];CHEN等[13]研究发现,CCL5 可能促使颊黏膜向鳞状细胞癌转化,导致癌变;研究还发现,CCL5 与多种肿瘤的增殖、侵袭、迁移、耐药等生物学特性密切相关[14-16]。本实验通过研究CCL5 对喉癌细胞TU177 生物学特性的影响,进一步探讨CCL5成为今后喉癌分子治疗靶点的可能性。
1 材料与方法
1.1 在线数据检索 从基因表达谱数据动态分析(Gene Expression Profiling Interactive Analysis,GEPIA)数据库(http://gepia.cancer-pku.cn index.html)中,在线检索CCL5在头颈鳞状细胞癌及正常组织中的表达情况:进入网站后点击GoPIA!→Expression DIY→Box Plot,Gene 中输入基因名,选择头颈鳞状细胞癌,其余默认,点击Plot即可。
1.2 细胞 喉癌细胞TU177 由耳鼻咽喉头颈肿瘤山西省重点实验室提供。
1.3 主要试剂及仪器 胎牛血清购自浙江天杭生物科技股份有限公司;DMEM 培养液购自武汉赛诺普生命科技有限公司;青链霉素混合液购自北京金克隆生物技术有限公司;Lipofectamine 3000 购自美国赛默飞世尔公司;CCK8试剂盒购自美国APExBIO 生物科技有限公司;细胞周期试剂盒、反转录试剂购自上海翊盛生物科技有限公司;Annexin V-FITC 凋亡检测试剂盒购自北京索莱宝科技有限公司;蛋白梯度预制胶(4% ~20%)、PCR 试剂购自北京聚合美生物科技有限公司;ECL化学发光液、兔抗CCL5(PB06-53)、MRP2(BA1667)、Bax(BA0315-2)多克隆抗体及HRP 标记的山羊抗兔IgG(BA1054)购自武汉博士德生物工程有限公司;β-actin pAb(AP0060)购自南京巴傲得生物科技有限公司;流式细胞仪购自美国艾森公司(NovaCyte系列)。
1.4 细胞培养 将TU177 细胞于37 ℃,5%CO2培养箱中培养,每隔1 ~2 d 传代1 次,待进入对数生长期开始后续试验。
1.5 siRNA 转染细胞 转染前1天细胞传代,当细胞密度达70%时,更换为无双抗培养基,进行转染。设实验组(siRNA)和对照组(NC),均参照lipofectamine 3000 说明书工作浓度进行操作:A 管为siRNA 或NC与opti-MEM 孵育5 min,B 管为Lipofectamine 3000 与opti-MEM 孵育5 min;将B 管加入A 管孵育15 min后,加至细胞板中,6 h后更换为完全培养基。siRNA序列正义链:5'-GCUGUCAUCCUCAUUGCUATT-3',反义链:5'-UAGCAAUGAGGAUGACAGCTT-3';NC正义链:5'-UUCUCCGAACGUGUCACGUTT-3',反义链:5'-ACGUGACACGUUCGGAGAATT-3'。由上海吉马制药技术有限公司合成。
1.6 RNA提取 在细胞板内加入Trizol,300 μL/孔,混匀,各孔分别吸至1.5 mL 无酶离心管中,静置5 min;加入氯仿,150 μL/管,剧烈振荡混匀30 s,室温静置3 ~5 min;4 ℃,12 000 ×g离心15 min;将上层水相移至新无酶管中,加入等体积异丙醇,混匀,-20 ℃过夜沉淀;4 ℃,12 000×g离心10 min;收集沉淀,加入150 μL 75%乙醇,12 000×g离心5 min;收集沉淀,重复上一步,加入10 μL 无酶水,光谱仪检测浓度。
1.7 RT-PCR法 将提取的RNA反转录为cDNA,以其为模板进行RT-PCR 检测。CCL5上游引物序列:5'-TCGCTGTCATCCTCATTGCTACTG-3',下游引物序列:5'-GGTTGGAGCACTTGCCACTGG-3';MRP2上游引物序列:5'-TCTTCAATAGCACCGACTATCC-3',下游引物序列:5'-TATTTGATGCATGGACGAAACC-3';Bax上游引物序列:5'-AAGAAGCTGAGCGAGTGTCT-3',下游引物序列:5'-GTTCTGATCAGTTCCGGCAC-3';18 s上游引物序列:5'-CCTGGATACCGCAGCTAGGA-3',下游引物序列:5'-GCGGCGCAATACGAATGCCCC-3'。引物由生工生物工程(上海)股份有限公司合成。反转录反应条件:25 ℃5 min;42 ℃30 min;85 ℃5min。PCR 反应条件:95 ℃预变性30 s;95 ℃变性3 s,60 ℃退火延伸34 s,共40 个循环;对融解曲线分析。采用2-ΔΔCt法分析相对表达量。
1.8 CCK8 法 将各组细胞以3× 103个/孔接种至96孔培养板中,待细胞贴壁后,收集0 ~4 d同一时间点细胞,每孔加入10 μL CCK8与100 μL完全培养基混合液,37 ℃孵育1 h;检测450 nm 处A值,按下式计算增殖率(%),并绘制生长曲线。
1.9 细胞划痕试验 6孔板背面每隔1 cm划线后,按5 × 105个/孔接种细胞,细胞密度达70%时进行转染,融合率达100%时进行划痕,PBS 洗涤3 次,加入无血清培养基,置37 ℃,5%CO2培养箱培养,0、24 h取样,拍照。按下式计算迁移率(%)。
1.10 流式细胞术 取对数生长期细胞,按5×105个/孔接种6孔板中,37 ℃,5%CO2条件下培养至正常生长阶段,进行转染,48 h后,收集细胞上流式细胞仪检测。
1.11 Western blot法 提取各组细胞总蛋白,40 μg/孔上样至(4% ~20%)蛋白梯度预制胶,经SDS-PAGE分离后,根据蛋白分子质量切胶,电转至PVDF膜上,10%脱脂牛奶室温封闭2 h;不同的PVDF 膜分别加入一抗(兔抗CCL5、MRP2、Bax 多克隆抗体均为1∶500 稀释,β-actin pAb 为1∶1 000 稀释);4 ℃孵育过夜;TBST 洗膜3 次,加入二抗(HRP 标记的山羊抗兔IgG,1∶1 000 稀释),4 ℃摇床孵育2 h;TBST 洗膜3次,化学发光检测,分析结果。
1.12 统计学分析 采用SPSS 25.0 软件进行统计学分析,图片由Graphpad Prism 8.0软件完成,细胞划痕试验及Western blot 结果经Image J 软件进行分析。以上实验结果满足正态分布均采用两独立样本t检验评估两组间差异,计量数据用均值± 标准差(x ± s)表示,如实验结果不满足正态分布,则采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1CCL5在头颈鳞状细胞癌中的表达 GEPIA 数据库显示,CCL5在头颈鳞状细胞癌中表达量明显高于正常组织(P<0.05),见图1。

图1 CCL5在头颈鳞状细胞癌与头颈正常组织中的表达Fig.1 CCL5 expression in HNSCC and head and neck normal tissues
2.2 siRNA 敲降效率 RT-PCR 结果显示,siRNA 具有较高的敲降效率,siRNA 和NC 组细胞相对表达量分别为(0.259 ± 0.020)和(1.003 ± 0.098),差异有统计学意义(t=12.898,P<0.01);Western blot结果显示,siRNA 可敲降CCL5,降低CCL5 表达,与NC 组相比差异有统计学意义(t= 22.656,P<0.001),见图2。

图2 siRNA干扰CCL5表达的Western blot检测Fig.2 Western blotting of CCL5 expression with siRNA interference
2.3 siRNA 干扰CCL5对TU177 细胞增殖活性的影响 CCK8 法结果显示,CCL5 可促进喉癌细胞TU177增殖,与NC 组相比差异均有统计学意义(t1~4d分别为11.667、8.090、9.808、4.794,P分别为<0.001、<0.01、<0.01、<0.01),见图3。

图3 CCL5对TU177细胞增殖活性的影响Fig.3 Effect of CCL5 on proliferation activity of TU177 cells
2.4 siRNA 干扰CCL5对TU177 细胞迁移的影响划痕试验结果显示,siRNA 和NC 组24 h 迁移率分别为(8.711 ± 6.262)%和(20.290 ± 8.934)%,差异有统计学意义(t=2.600,P<0.05),即siRNA干扰CCL5可抑制TU177 细胞24 h 的迁移能力,见图4。表明CCL5可能具有促进细胞迁移的功能。

图4 CCL5对TU177细胞迁移的影响(×100)Fig.4 Effect of CCL5 on migration of TU177 cells(×100)
2.5 siRNA 干扰CCL5对TU177 细胞周期及细胞凋亡的影响 流式细胞术结果显示,CCL5 与细胞周期无关,与NC组相比差异无统计学意义(tG0/G1期=0.499,P>0.05;tS期= 0.611,P>0.05;tG2/M期= 0.043,P>0.05),见图5。与NC 组相比,siRNA 干扰CCL5可促进细胞晚期凋亡(t= 3.940,P<0.05),未能明确促进早期凋亡(t=1.030,P>0.05),见图6。提示CCL5可抑制喉癌细胞晚期凋亡。
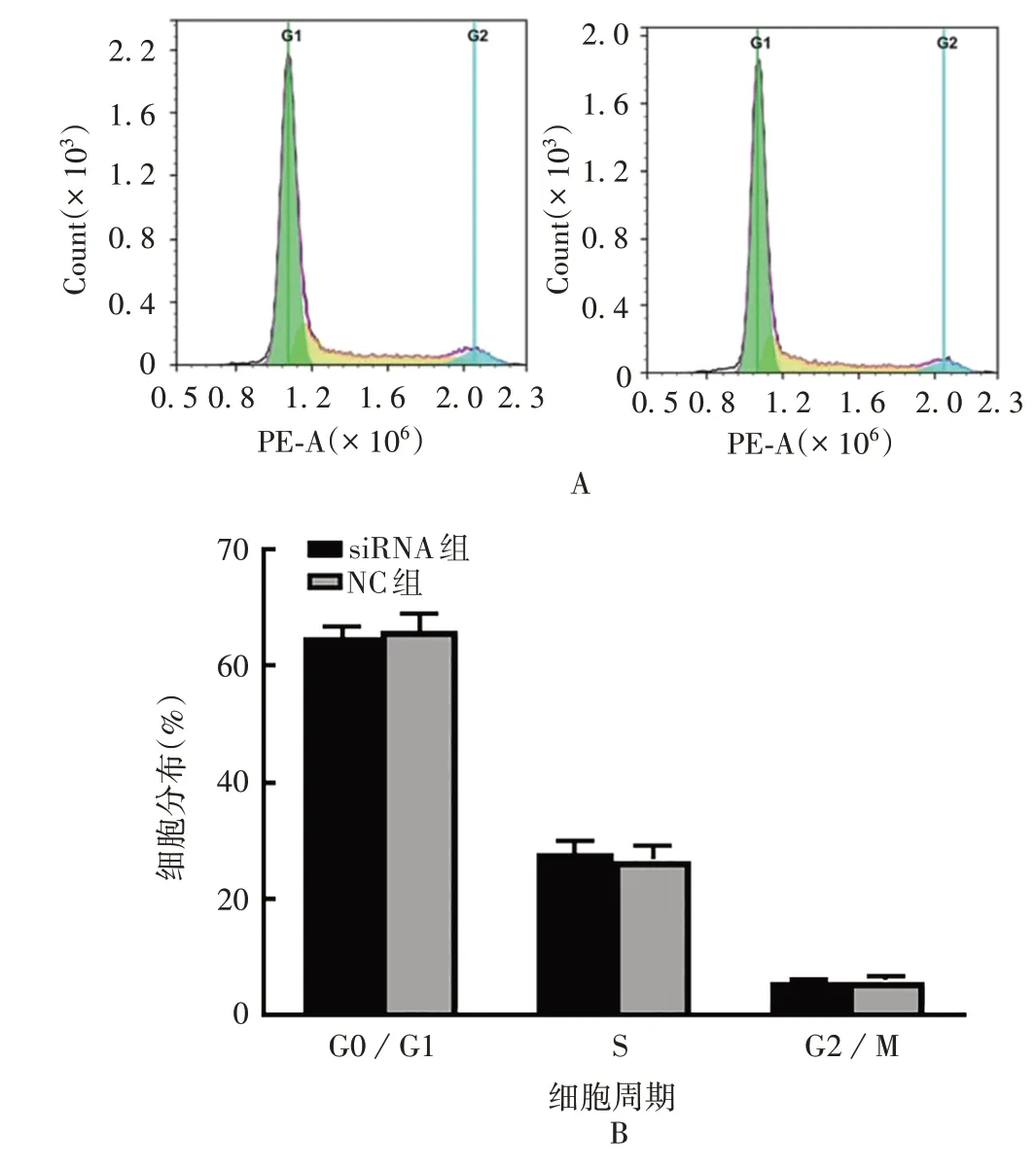
图5 CCL5对TU177细胞周期的影响Fig.5 Effect of CCL5 on TU177 cell cycle

图6 CCL5对TU177细胞凋亡影响Fig.6 Effect of CCL5 on apoptosis of TU177 cells
2.6 siRNA 干扰CCL5对多药耐药蛋白2(multidrug resistance protein 2,MRP2)、bcl-2相关x 蛋白(bcl-2-associated x protein,Bax)mRNA 转录及蛋白表达水平的影响 RT-PCR 及Western blot 分析显示,与NC组相比,siRNA 干扰CCL5不仅可促进BaxmRNA 转录水平(t= 4.376,P<0.05),也可促进其蛋白表达水平(t= 7.159,P<0.001);而siRNA 干预CCL5未能降低MRP2mRNA 转录及蛋白表达水平(t分别为0.756和0.468,P均>0.05)。见图7。表明CCL5可抑制凋亡蛋白Bax的表达。

图7 siRNA 干扰CCL5 对MRP2、Bax mRNA 转录及蛋白表达水平的影响Fig.7 Effect of siRNA interference with CCL5 on mRNA transcription and protein expression of MRP2 and Bax
3 讨论
喉癌已成为常见的头颈恶性肿瘤之一。吸烟、人乳头状瘤病毒(human papilloma virus,HPV)感染等为其主要危险因素[17-18]。流行病学调查发现,喉癌多在中老年发病,临床分型以声门型为主[19]。其中手术为其主要治疗方式[20-21],必要时辅以放化疗。近年来,虽然各种医疗条件有了极大改进和提高,但喉癌的5 年生存率一直为70%左右[22],局部晚期病例5 年生存率也仅为30%左右[23]。因此,喉癌的靶向治疗成为当今的热点问题。通过靶向治疗抑制喉癌细胞的增殖、侵袭、迁移等生物学特性,达到治疗喉癌目的,均对患者的治疗及预后具有深远意义。
CCL5又称趋化因子调节激活正常T细胞表达和分泌因子(regulated upon activation,normal T cell expressed and secreted,RANTES),是趋化因子超家族的一员。研究表明,在结肠癌、肝癌、卵巢癌等癌细胞试验中发现,CCL5 与肿瘤细胞的侵袭、迁移等生物学特性密切相关[15,24-25]。MRP2又称ATP 结合盒C亚家族成员2(ATP binding cassette subfamily C member 2,ABCC2),属于ABC 家族一员。MRP2基因编码的蛋白质是ATP 结合盒(ABC)转运体超家族成员,其成员突变后会造成多重耐药性[26],该基因可作为检测多重耐药的一个指标。Bax编码的蛋白属于Bcl-2蛋白家族。Bcl-2 家族成员形成异或同型二聚体,并作为抗或促凋亡的调节因子,参与多种细胞活动[27],是经典的凋亡蛋白,可作为检测凋亡的指标。
本研究通过GEPIA 数据库检索发现,头颈鳞状细胞癌的表达量高于正常组织,因此,CCL5 可作为研究喉癌生物学特性的因子。基于上述数据库初步结果,为进一步探索CCL5 对喉癌进展的影响,本研究用siRNA敲降CCL5,CCK8、划痕试验结果显示,低表达CCL5在各时间点的细胞增殖活性、24 h 迁移率,均低于NC 组;流式细胞术未能明确CCL5与细胞周期的相关性,但低表达CCL5晚期凋亡率高于NC组。RT-PCR 及Wes-tern blot结果显示,敲降CCL5可促进BaxmRNA 转录和蛋白表达水平,但未能明确CCL5与MRP2表达之间的关系。因此,敲降CCL5可抑制喉癌细胞TU177 增殖、迁移,促进细胞晚期凋亡及凋亡蛋白Bax的表达。
关于CCL5 在喉鳞状细胞癌中作用的分子机制尚未明确。CAO等[28]在前列腺癌中的研究表明,Bax上调可抑制肿瘤细胞增殖及迁移。Bax 为p53 通路经典蛋白,LIU 等[29]研究发现,p53 通路介导下可抑制宫颈癌细胞迁移,此时Bax 呈高表达,表明Bax 高表达抑制癌细胞迁移。同时,作为经典凋亡蛋白,Bax 上调可促进细胞凋亡。本研究结果发现,敲降CCL5后,在mRNA 及蛋白水平上Bax表达量均升高,细胞增殖率、迁移率均有所下降,细胞晚期凋亡率有所升高。因此,CCL5通过Bax介导调节细胞增殖、迁移及凋亡。
综上所述,siRNA 干扰CCL5通过上调Bax 表达抑制喉癌细胞TU177 增殖、迁移,促进凋亡,为下一步CCL5靶向治疗喉癌的相关研究奠定了基础。

