GⅡ.4 Sydney[P31]型诺如病毒GZ19株进化及其受体结合特征分析
王金冬,马亚林,段招军
1.潍坊医学院基础医学院病原生物学教研室,山东 潍坊 261053;2.中国疾病预防控制中心病毒病预防控制所,北京 102206;3.甘肃中医药大学公共卫生学院,甘肃 兰州 730000
人类诺如病毒(human norovirus,HuNoV)是一种无包膜的单正链RNA病毒,属于人类杯状病毒科(Caliciviridae)诺如病毒属。NoV 基因组大小为7 500 ~7 700 bp,包括5'和3'端非编码区以及3 个开放阅读框(open reading frames,ORFs)。ORF1 主要编码一种大的多聚蛋白,由病毒蛋白酶加工产生病毒复制所需的6 种非结构(non-structural,NS)蛋白,其中包括RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)[1];ORF2 和ORF3 分别编码主要衣壳蛋白VP1和次要结构衣壳蛋白VP2,VP1蛋白包含组织血型抗原(histo-blood group antigens,HBGAs)结合位点和关键中和表位,其可表达为独立于其他病毒组分的重组蛋白,在真核表达系统中自行组装形成病毒样颗粒(viral-like particle,VLP)[2-3]。ORF2 区包含S区和P区2个结构域,S区编码S蛋白(1 ~225 aa),构成病毒内壳;P 区构成衣壳外的突起部分,由剩余氨基酸组成,可分为P1 和P2 两个亚区,P1 亚区相对保守,P2 亚区位于衣壳最外层,是NoV 与HBGAs 受体结合的关键区域,包含主要的抗原中和位点,同时具有高度变异性和高免疫原性[4-5]。当单独表达时,24 个P 区结构域可自发组装成T = 1 的八面体对称性的P 颗粒。P 颗粒可经原核系统大量表达,与受体的结合效果强于VLP和P二聚体[6]。
VP1 蛋白是NoV 分类的主要依据。根据VP1 氨基酸序列的不同,NoV 可被分为10 个基因型(GⅠ~GⅩ)[7],其中,GⅡ.4 NoVs 是过去30 年引起NoV 急性胃肠炎暴发的最主要流行株。GⅡ.4 毒株具有高度变异性,每2 ~3 年即有新的变异株产生并取代旧的流行株,造成新一轮的暴发流行[8-9]。自1995 年以来,GⅡ.4 变异株已造成6 次大规模NoV 暴发,包括95/96 US 变异株、Farmington_Hills_2002 变异株和Hunter变异株等。GⅡ.4的变异和进化持续发生,陆续出现不同表型,目前我国的主要流行株为GⅡ.4 Sydney[P31][10-11]。
VP1 蛋白决定NoV 的抗原性和毒株特异性,是探索NoV与HBGAs受体结合模式的关键蛋白。HBGAs是一类复合糖类,具有高度多态性,广泛存在于消化道、呼吸道和泌尿生殖道等黏膜上皮细胞的表面,以及血液、唾液、乳汁等体液中[12]。研究发现,NoV具有高度特异性,不同型别的NoV可能识别不同的HBGAs受体。多数GⅡ.4 NoVs 可与A、B、O 等分泌型HBGA受体结合[13]。蛋白-受体结合模式的探索不仅有助于了解NoV 的致病机理,也可为NoV 疫苗的研究提供支持。
本研究通过对目前我国NoV 的代表流行株——GZ19 的VP1 蛋白进行进化分析和关键氨基酸位点比对,深入探讨GⅡ.4 Sydney[P31]的进化规律,同时表达并制备GZ19 株的P 颗粒蛋白,分析其与HBGAs受体的结合特征,确定该毒株的宿主感染范围,为后期NoV疫苗的研发提供理论依据。
1 材料与方法
1.1 质粒、寡糖及细胞 携带NoV GZ19株(GenBank:OK148516)ORF2 序列的质粒由苏州金唯智生物科技有限公司合成,P 区末端已引入CDCRGDCFC 修饰氨基酸基因序列以促进P 颗粒的形成;带有生物素(Biotin)标签的寡糖:A 双糖(A-di)、B 双糖(B-di)、H 双糖(H-di)、H1、H2、H3、lewis a(Lea)、lewis b(leb)、lewis x(lex)、lewis y(ley)、唾液酸化lea(sLea)、唾液酸化lex(sLex)购自美国GlycoTech公司;表达载体pGEX-6P-1 由中国疾病预防控制中心病毒性腹泻室保存;大肠埃希菌Trans5α 和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。
1.2 唾液样本 人唾液样本(项目伦理号:IVDC2017-NO.023)由中国疾病预防控制中心病毒性腹泻室保存,HBGAs表型已明确。
1.3 主要试剂及仪器 3C蛋白酶和GST标签蛋白由中国疾病预防控制中心病毒性腹泻室保存;鼠源Anti-GST单克隆抗体和HRP标记的山羊抗兔和抗小鼠IgG购自北京全式金生物技术有限公司;兔源Antinorovirus VP1 多克隆抗体购自美国GeneTeX 公司;HRP 标记的链霉亲和素购自美国Abcam 公司;亲和层析柱和谷胱甘肽琼脂糖凝胶4B 填料购自北京索莱宝科技有限公司。
1.4 进化分析和氨基酸位点比对 根据NoV GZ19株的VP1蛋白氨基酸序列,利用Mega 7.0软件,选取具有代表性的2012—2022年间流行的GⅡ.4 Sydney株构建NoV 进化树,采用Clustal W 和最大似然法进行比对和构建。同时对GⅡ.4 Sydney 株的HBGA 结合位点(HBGA binding sites,HBSs)和A-H 阻断表位的关键氨基酸进行比对,探讨GZ19 毒株与目前主要流行株以及GⅡ.4 Sydney 2012原型株之间的差异。
1.5 重组P颗粒表达质粒的构建 根据GZ19株基因序列,应用Primer Premier 5 软件设计扩增P 区的特异性引物,上游引物:5'-ATATggatccAAACCATTCTCTGT-3'(下划线为BamHⅠ酶切位点),下游引物:5'-CGCctcgagTTAGCAAAAGCAATC-3'(下划线为XhoⅠ酶切位点)。反应条件:94 ℃预变性5 min;94 ℃30 s,52 ℃30 s,72 ℃1 min,共35个循环;72 ℃延伸5 min。胶回收PCR 产物,连接至pGEX-6P-1 载体,将连接产物转化大肠埃希菌Trans5α感受态细胞。次日,随机挑取3个单克隆菌落,小量扩增后提取质粒,用BamHⅠ和XhoⅠ双酶切鉴定。将鉴定正确的重组质粒送北京擎科新业生物技术有限公司测序。
1.6 P 颗粒的表达与纯化 将测序鉴定正确的重组表达质粒转化至大肠埃希菌BL21(DE3)感受态细胞中,37 ℃培养12 ~16 h;挑取单克隆于LB 培养基(含100 μg/mL氨苄青霉素)中,37 ℃,180 r/min培养过夜;将菌液按1∶100转入新鲜LB培养液(含100 μg/mL氨苄青霉素)中继续培养,当菌液A600值达0.5 ~0.7时,加入终浓度为0.4 mmol/L的IPTG,22 ℃,150 r/min诱导过夜。收集菌体沉淀,加入PBS 重悬,冰水浴超声破碎,4 ℃,10 000×g离心后,分离上清和沉淀,进行12%SDS-PAGE分析。
将谷胱甘肽琼脂糖凝胶4B 填料介质与过滤后的上清混合,室温翻转1 ~2 h,使带有GST 标签的目的蛋白结合至介质上;将结合后的混合液倒入GST亲和层析柱中,弃滤液,加入PBS 洗涤3 ~5 次,除去未与介质结合的杂质蛋白,并重新平衡介质;将结合重组蛋白的介质吸出,加入100 μL 3C蛋白酶,4 ℃酶切过夜,去除GST 标签;次日将介质吸出,再次加入亲和层析柱中,收集重组蛋白洗脱液,加入10 kDa Millipore 超滤管中,2 800 ×g离心30 min,弃去收集管中液体,过滤完成后加入PBS缓冲液,洗涤数次,最后将蛋白样品浓缩至2 ~3 mL,取样进行12% SDSPAGE分析,NanoDrop测定蛋白浓度。
1.7 P颗粒特异性的鉴定 采用间接ELISA法鉴定P颗粒的特异性。用PBS 缓冲液将纯化的P 颗粒稀释为0.25、0.5、1、2、4、8 μg/mL,各取100 μL 加入酶标板中,4 ℃包被过夜;分别加入兔源Anti-norovirus VP1 多克隆抗体(1∶1 000、1∶2 000 和1∶4 000 稀释),37 ℃孵育1 h;设GST 标签蛋白为阴性对照,加入鼠源Anti-GST 单克隆抗体(1∶2 000稀释),4 ℃孵育过夜;0.5‰PBST 洗涤后各加入HRP 标记的山羊抗兔或抗鼠IgG(1∶10 000 稀释),37 ℃孵育1 h;加入TMB 显色液,避光显色10 min;1 mol/L 磷酸溶液终止反应,酶标仪读取波长450 nm处的吸光度值。
1.8 P颗粒的糖结合特征分析
1.8.1 唾液结合试验 将1∶1 000 稀释的唾液样本加入酶标板中,100 μL/孔,4 ℃包被过夜;加入5%脱脂奶粉,37 ℃封闭2 h;加入用PBS稀释成10 μg/mL的纯化P 颗粒,100 μL/孔,4 ℃结合过夜;依次加入NoV VP1 多克隆抗体(1∶2 000 稀释)和HRP 标记的山羊抗兔IgG(1∶10 000 稀释),37 ℃孵育1 h;加入TMB 显色液,避光显色10 min;1 mol/L 磷酸溶液中止反应,酶标仪读取波长450 nm处的吸光度值。
1.8.2 寡糖结合试验 将纯化的P 颗粒加入酶标板中,20 μg/孔,4 ℃包被过夜;加入5%脱脂奶粉,37 ℃封闭2 h;加入PBS 稀释的寡糖A-di、B-di、H-di、H1、H2、H3、Lea、Leb、Lex、Ley、sLea、sLex,0.2 μg/孔,4 ℃结合过夜;加入HRP标记的链霉亲和素(1∶2 000稀释),37 ℃孵育1 h;加入TMB显色液,避光显色10 min;1 mol/L磷酸溶液终止反应,酶标仪读取波长450 nm处的吸光度值。
2 结果
2.1 进化分析 根据NoV GZ19 株VP1 蛋白的氨基酸序列进行进化分析,结果发现,GⅡ.4 Sydney 自2012年出现至今,随着时间的推移不断发生变化,目前主要聚集于GⅡ.4 Sydney[P31]和GⅡ.4 Sydney[P16]两个谱系中。本研究选择的疫苗株GZ19来自于广州一所小学暴发性胃肠炎患者的粪便样本,经测序和序列分析,该毒株归类为GⅡ.4 Sydney[P31]谱系,其VP1 蛋白的氨基酸序列与GⅡ.4 Sydney 2012原型株(GenBank:KC175323)的同源性达98.7%,与2017—2022年其他GⅡ.4 Sydney[P31]主要流行株的VP1氨基酸序列一致性为97.5%~99.8%,与GⅡ.4 Sydney[P16]株的氨基酸序列同源性为94.6%~97.4%。见图1。
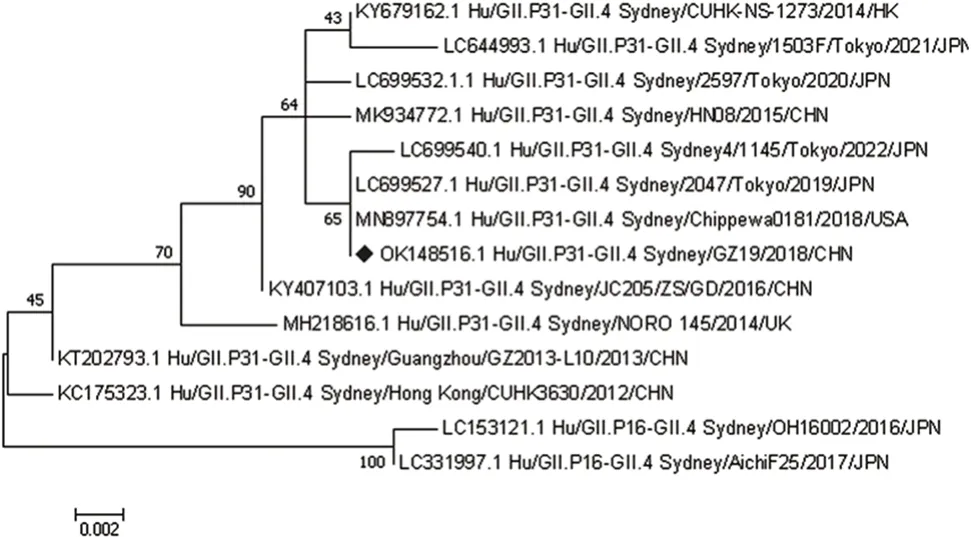
图1 基于VP1 蛋白氨基酸序列的GⅡ.4 Sydney 变异株系统进化树Fig.1 Phylogenetic tree of GⅡ.4 Sydney variant based on amino acid sequences of VP1 protein
2.2 VP1蛋白关键氨基酸位点分析 VP1蛋白上包含3个HBSs,分别为SiteⅠ(338 ~349位氨基酸)、SiteⅡ(370 ~376位氨基酸)和Site Ⅲ(440 ~446位氨基酸),均位于P结构域。对2012—2022年间GⅡ.4 Sydney株HBSs 的关键氨基酸比对发现,HBSs 具有高度保守性,与GⅡ.4 Sydney 2012 原型株相比,GZ19 株在SiteⅡ位点有两位氨基酸(372 和373)发生了突变,序列同源性为92.3%。自2015年以来,GⅡ.4 Sydney[P31]流行株的HBSs位点未发生明显改变,氨基酸序列同源性为100%。GZ19株与GⅡ.4 Sydney[P16]株(GenBank:LC153121,LC331997,MW661278)氨基酸序列一致性为92.3%,见图2A。

图2 GⅡ.4 Sydney株VP1蛋白的关键氨基酸序列分析Fig.2 Analysis of key amino acid sequences of GⅡ.4 Sydney VP1 protein
A-H 为NoV VP1 蛋白上重要的阻断表位,也是潜在的中和位点。不同型别的GⅡ.4 Sydne 毒株其阻断表位的氨基酸序列差异较大。与GⅡ.4 Sydney 2012原型株相比,GZ19株在A、B、D表位的氨基酸序列同源性分别为62.5%、50%和80%,其余表位同源性为100%。与2015年以来的其他GⅡ.4 Sydney[P31]流行株相比,GZ19 株在A、G 表位的氨基酸序列一致性分别为75%和83.3%,其余位点未检测到明显差异。与GⅡ.4 Sydney[P16]相比,GZ19株在A、D、E 和H表位分别显示出62.5%、80%、80%和50%的氨基酸同源性。见图2B。
2.3 重组表达质粒的鉴定 重组表达质粒经BamHⅠ和XhoⅠ双酶切,可见4 984 bp 的pGEX-6P-1 载体条带和990 bp 的P 区条带,大小均与预期相符,见图3。测序结果证实,插入序列与目的基因完全一致,重组质粒构建正确。

图3 重组表达质粒的双酶切(BamHⅠ/XhoⅠ)鉴定Fig.3 Restriction map of recombinant expression plasmids(BamHⅠ/XhoⅠ)
2.4 表达及纯化产物的鉴定 12% SDS-PAGE 分析显示,在诱导后的菌液和破菌上清中可见相对分子质量约62 000 的GST-P 重组蛋白,见图4。经GST 纯化、酶切与浓缩,在相对分子质量约36 000处可见明显P 颗粒蛋白条带,见图5,蛋白纯度约为90%,浓度约为2 mg/mL。

图4 表达产物的SDS-PAGE分析Fig.4 SDS-PAGE profile of expressed product

图5 纯化产物的SDS-PAGE分析Fig.5 SDS-PAGE profile of purified product
2.5 P 颗粒的特异性 间接ELISA 结果显示,随着抗原包被浓度的增加,各实验组中NoV VP1 抗体测得的A450值也不断增加,平均值在0.2 ~2.0 之间;阴性对照组中GST蛋白包被孔的A450值均低于0.1。见图6。表明纯化的P 颗粒蛋白与NoV VP1 抗体发生了特异性结合,进一步证实了P颗粒的正确表达。

图6 间接ELISA法鉴定GZ19株P颗粒的特异性Fig.6 Identification of characteristics of P particles of GZ19 strain by indirect ELISA
2.6 P颗粒的糖结合特征 唾液结合试验结果显示,GZ19 株P 颗粒可结合A、B、O、AB 等分泌型唾液样品,而与非分泌型样品不结合,见图7。寡糖结合试验表明,GZ19 株P 颗粒仅与H-di 寡糖结合,与其他寡糖未发生有效结合,见图8。

图7 GZ19株P颗粒的唾液结合特异性分析Fig.7 Saliva-binding specificity of GZ19 strain P particles

图8 GZ19株P颗粒的寡糖结合特异性分析Fig.8 Oligosaccharide-binding specificity of GZ19 strain P particles
3 讨论
NoV 具有高度多样性,根据VP1 氨基酸序列的不同,可分为10个基因型,其中,GⅡ.4 NoVs在全球范围内一直占据主导地位。发生在ORF2 区的基因突变以及ORF1和ORF2连接处的基因重组导致GⅡ.4 NoVs 不断进化并产生新的变异株,成为GⅡ.4 NoVs逃避群体免疫和大规模流行的关键[14]。GⅡ.4 Sydney株自2012 年出现以来一直在全球占据主导地位,其主要包括GⅡ.4 Sydney[P31]和GⅡ.4 Sydney[P16]两种类型。GⅡ.4 Sydney[P16]是由于聚合酶区重组而形成的新的变体,自2016 年出现以来在一些国家已取代了GⅡ.4 Sydney[P31]成为新的流行株[15-16]。但目前我国仍以GⅡ.4 Sydney[P31]株为主,GⅡ.4 Sydney[P16]总体检出率仅为0.35%[11,17]。作为目前我国NoVs 的主要流行型别,GⅡ.4 Sydney[P31]的受体结合特征分析为进一步的疫苗评价和基础研究提供了依据。
HBSs 是NoV 与HBGAs 受体结合的关键位点。通常情况下,同一型别的HBSs 相对保守,但在进化压力下,HBSs 某些氨基酸位点发生突变可能会影响NoV 与HBGA 的结合,进而导致NoV 受体结合特征的变化。通过对比发现,GZ19株与近5年的其他GⅡ.4 Sydney[P31]毒株的HBSs 氨基酸序列完全一致,而与GⅡ.4 Sydney 2012原型株以及近年流行的GⅡ.4 Sydney[P16]株在SiteⅡ位点上存在氨基酸差异,表明以GZ19 株为代表的GⅡ.4 Sydney[P31]NoVs 和GⅡ.4 Sydney原型株,以及GⅡ.4 Sydney[P16]株的受体结合模式可能存在差异。为了进一步验证此观点,本研究表达了GZ19株的P颗粒蛋白,并进行HBGAs 受体结合特征分析。在唾液结合试验中,GZ19 株显示出与其他GⅡ.4 NoVs相似的结合模式,即与A、B、O、AB型唾液样本结合,与非唾液样本不发生结合[18-19],且GZ19 株与各型别的分泌型唾液均显示出较强的结合能力;而寡糖结合试验中P颗粒仅与H-di 寡糖结合,与其他H 组寡糖不结合,这与前期报道的GⅡ.4 NoVs 可结合H 抗原(α-1,2 岩藻糖)不符[13]。考虑可能与人工寡糖的结构有关,本研究认为,相较于人工合成的低聚糖,唾液样本才能更好地反应不同唾液表型和与NoVs 的结合模式。因此,从上述结果可以看出,GZ19株显示出与其他GⅡ.4 NoVs相似的结合模式,即对占比80%的分泌型人群易感,这也是该毒株流行的主要原因之一。
位于VP1 蛋白上A-H 阻断表位是用人源和动物的单克隆抗体绘制的。除表位F 外,其余表位均位于P2 亚区的环上或颗粒表面,并与中和抗体、附着因子相互作用,因此也是潜在的中和表位[20-21]。A-H阻断表位的变化,特别是A、C和G几个关键表位的突变是导致GⅡ.4 变异株周期性出现的重要原因[22-23]。这些关键位点氨基酸的变化在一定程度上反应了病毒进化趋势。比对结果发现,GZ19 株与近5 年来的大部分GⅡ.4 Sydney[P31]流行株具有相似的阻断表位,而与GⅡ.4 Sydney 2012 原型株氨基酸差异较大,表明GⅡ.4 Sydney[P31]在不断进化。GZ19 株与GⅡ.4 Sydney[P16]株的关键氨基酸也存在较大差异,毒株之间是否存在交叉免疫,以及免疫保护效果的强弱有待进一步实验验证。
GⅡ.4 Sydney[P31]是目前我国NoVs 的主要流行型别,本研究通过分析2012年以来的GⅡ.4 Sydney[P31]毒株序列,以及比对HBSs 和A-H 阻断表位上的关键氨基酸,探索NoVs 的进化规律以及未来可能的进化趋势。GZ19 株是当前GⅡ.4 Sydney[P31]的代表毒株,通过GZ19 株P 颗粒与唾液及寡糖的结合试验,明确了当前GⅡ.4 Sydney[P31]流行株的糖结合特征,为进一步揭示GⅡ.4 Sydney[P31]的流行机制及监测该毒株的变异进化提供了思路,也为抗病毒药物和疫苗研发奠定了基础。

