猪外周血淋巴细胞干扰素诱导跨膜蛋白的拓扑学分析及其在猪繁殖与呼吸综合征病毒感染后转录水平的变化
蒙小刚,宋扬,2,3,鲁会军,霍晓伟,吕香玉,刘锴,温树波,2,3
1.内蒙古民族大学动物科技学院,内蒙古 通辽 028000;2.内蒙古自治区布鲁氏菌病防控工程技术研究中心,内蒙古 通辽 028000;3.内蒙古民族大学人畜共患病创新研究院,内蒙古 通辽 028000;4.军事科学院军事医学研究院军事兽医研究所,吉林 长春 130012
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是引起猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)的主要病原,可引起妊娠母猪流产、木乃伊胎、死胎及仔猪呼吸困难等临床症状,给养猪业带来了巨大的经济损失[1]。PRRSV 是一种具有囊膜结构的单股正链RNA病毒,基因组全长约为15 000 bp,主要分为基因1型(欧洲型)和基因2型(美洲型),含有包括ORF1a、ORF1b、ORF2a、ORF2b、ORF3 ~ORF7以及ORF5a 在内的10 个开放阅读框[2]。PRRSV 目前在我国广泛流行,由于其具有较强的突变能力,出现了多种新毒株,且易与其他病原发生混合感染,为其防控带来了很大困难[3]。
PRRSV 是一种具有严格细胞噬性的病毒,目前用来研究PRRSV 体外感染使用最多的传代细胞系是Marc145(非洲绿猴肾细胞),但因该细胞并非猪源细胞,不适用于作为研究与自然宿主相关实验的体外模型。猪外周血淋巴细胞(peripheral blood lymphocytes,PBMCs)是猪血液中的主要免疫细胞,包括T 淋巴细胞、B 淋巴细胞、单核细胞、粒细胞和自然杀伤(natural killer,NK)细胞等,在病毒入侵血液循环系统后发挥重要的抗病毒天然免疫反应[4],也是病毒入侵血液的主要靶细胞。另外,相较于猪肺泡巨噬细胞(porcine alveolar macrophages,PAM),PBMCs还具有取材方便、易制备等优势,因此,PBMCs 作为体外实验模型,在研究PRRSV 与宿主相互作用方面具有一定的潜力。
干扰素诱导跨膜蛋白(IFN-induced transmembrane,IFITM)是在哺乳动物细胞中高度保守且广泛表达的一类跨膜蛋白。其中,IFITM1、IFITM2 和IFITM3 可发挥抗病毒作用。自首次报道其抗病毒作用以来[5],已发现其可对包括流感病毒、丙型肝炎病毒和艾滋病病毒等多科病毒具有抑制作用[6-8]。目前关于IFITM分子在PBMCs应对外源病毒入侵过程中发挥的作用尚不明确,研究PRRSV 与PBMCs 来源的IFITM 分子的相互作用对阐明PRRSV 免疫逃逸和抗PRRSV 天然免疫应答机制具有重要意义。
本实验旨在分离原代猪PBMCs,并以其为感染模型,分析PRRSV 体外感染PBMCs 后宿主IFITM 分子mRNA 转录水平的变化,为研究机体抗PRRSV 天然免疫应答机制提供参考。
1 材料与方法
1.1 病毒、载体及细胞 PRRSV GXBB16-1株由军事兽医研究所病毒感染与免疫全军基因工程重点实验室分离并鉴定,在Marc145 细胞稳定传代10 代后收获的细胞毒,病毒滴度为10-4.5TCID50/mL;pMD18-T载体购自宝生物工程(大连)有限公司;大肠埃希菌DH5α 感受态细胞购自北京全式金生物技术股份有限公司。
1.2 实验动物 4 周龄仔猪为合作猪场饲养的普通长白猪。
1.3 主要试剂及仪器 Primer 9、ExTaq DNA 聚合酶、dNTP 和DNA marker DL2000 均购自宝生物工程(大连)有限公司;胎牛血清、青霉素-链霉素溶液和RPMI1640培养基均购自美国Hyclone公司;UNIQ-10柱式Trizol 总RNA 提取试剂盒为生工生物工程(上海)股份有限公司产品;MLV 反转录酶、RNA 酶抑制剂和SYBR GreenⅠ荧光染料购自美国Promega 公司;50×TAE 溶液购自北京索莱宝科技有限公司;猪外周血淋巴细胞分离试剂盒购自天津灏洋生物制品有限责任公司;温度梯度PCR 仪和Fast7500 荧光定量PCR仪为美国ABI公司产品。
1.4 引物设计及合成 根据NCBI 登录的猪β-actin(DQ452569)、IFITM1(JQ315414)、IFITM2(JQ315-415)、IFITM3(JQ315416)基因序列,使用Primer 5.0软件设计特异性qRT-PCR引物,并参考文献[9]合成猪IFITM全长扩增引物,引物序列和扩增目的条带大小见表1,引物由吉林库美生物技术有限公司合成。

表1 本研究使用的引物Tab.1 Primers used in this study
1.5 猪原代PBMCs 的分离培养 经前腔静脉采集4周龄仔猪抗凝血5 mL,经ELISA 法检测PRRSV、猪圆环病毒2(porcine circovirus 2,PCV2)和乙型脑炎病毒(Japanese encephalitis virus,JEV)血清抗体均为阴性。按照猪外周血淋巴细胞分离试剂盒说明书分离猪PBMCs,用含10%胎牛血清的RPMI1640 培养液重悬后计数,按照1 × 106个/孔接种至12 孔板中,置于37 ℃,5%CO2细胞培养箱中培养12 h 后,按照0.1 MOI 接种PRRSV,对照组接种RPMI1640 培养液。分别于病毒接种后第12、24、36、48 h 收集细胞样品。
1.6 PBMCs总RNA的提取及反转录 使用UNIQ-10柱式Trizol 总RNA 提取试剂盒提取收集到的PBMCs样品的中RNA,经1.5%琼脂糖凝胶电泳鉴定其完整性,用酶标仪检测其A260与A280比值,将比值在1.8 ~2.0 的样品进行反转录获得cDNA,置-20 ℃冰箱中保存。
1.7 猪IFITM编码区全长克隆 以PBMCs cDNA 为模板,用全长扩增引物扩增猪IFITMCDS 区全长序列。反应体系为:2×Taq Master Mix 12.5 μL,cDNA模板2 μL,上下游引物各1 μL,用去离子水将总体系补至25 μL。同时设置ddH2O 为空白对照。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃再延伸10 min。PCR 产物经1.5%琼脂糖凝胶电泳鉴定。将胶回收产物与pMD18-T 载体连接,转化大肠埃希菌DH5α感受态细胞,吸取100 μL 菌液,涂布于含50 μg/mL Amp 的LB 固体培养基,37 ℃正置培养1 h,倒置培养12 ~16 h;挑取阳性克隆菌落进行PCR 鉴定,鉴定正确后送生工生物工程(上海)股份有限公司测序。
1.8 猪IFITM 拓扑学分析及氨基酸序列比对 将测序获得的序列通过ClustalX 软件比对后,分别利用TMHMM 2.0 和SOSUI 在线跨膜蛋白拓扑学分析工具对猪IFITM 蛋白进行拓扑结构分析。从NCBI 下载不同物种来源的IFITM 氨基酸序列,通过DNA star软件进行氨基酸序列比对分析。
1.9 PRRSV体外感染PBMCs及qRT-PCR检测 将PRRSV 按照0.1 MOI 接种于12 孔细胞培养板上的PBMCs 中,分别于感染后第12、24、36 和48 h 用倒置显微镜观察细胞的形态变化。收集感染组和对照组(未感染病毒)细胞样品,提取总RNA,反转录为cDNA,以其为模板,按照SYBR GreenⅠqPCR检测试剂盒说明书,使用qRT-PCR 引物,通过qPCR 检测目的基因IFITMsmRNA转录水平。反应条件为:95 ℃10 min;95 ℃15 s,60 ℃1 min,共40个循环。采用相对定量法,根据各样品获得的Ct值[(目的基因Ct值- 内参基因Ct值)试验组-(目的基因Ct值-内参基因Ct值)对照组],计算2-ΔΔCt值,求出IFITMs基因相对转录水平的变化。将不同时间点样本获得的数据进行归一化处理,试验组以对照组的相对倍数表示,利用GraphPad 软件作图。
1.10 统计学分析 采用SPSS 20.0 软件进行统计学分析,数据的比较采用方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 猪PBMCs的分离培养 经水平离心机离心后的猪外周抗凝血样品可成功分为4 层,从上至下分别为淡黄色的血浆层、乳白色的淋巴细胞层、透明的分离液层及红色的红细胞层。吸取第2 层环状乳白色淋巴细胞层,经多次洗涤后用含10%胎牛血清的RPMI1640 培养基重悬,即获得PBMCs 悬液,计数后冻存或接种细胞培养板继续培养。
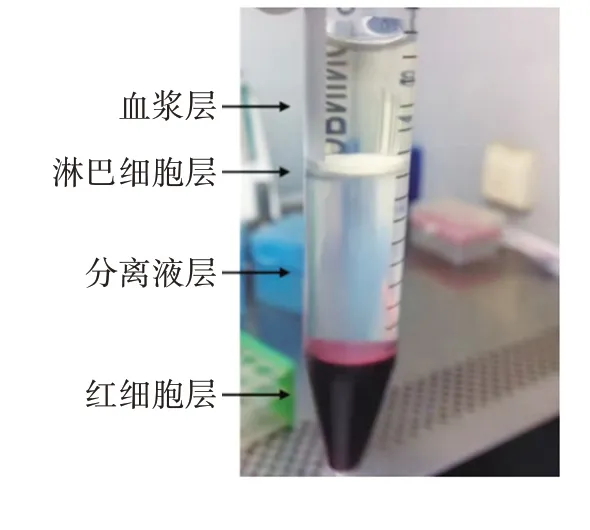
图1 猪PBMCs的分离Fig.1 Isolation of porcine PBMCs
2.2 猪PBMCsIFITM基因RT-PCR扩增产物的鉴定1.5%琼脂糖凝胶电泳分析显示,用猪IFITM全长扩增引物进行PCR 扩增,成功获得了猪IFITM1、IFITM2和IFITM3全长片段,大小均与预期相符,见图2。测序结果经比对,与NCBI 登录的猪IFITM基因序列一致。

图2 猪PBMCs IFITM基因RT-PCR扩增产物电泳图Fig.2 Electrophoretic profile of RT-PCR products of IFITM gene from porcine PBMCs
2.3 猪PBMCs IFITM蛋白拓扑学分析 经在线拓扑学预测工具TMHMM 2.0 和SOSUI 对猪PBMCs IFITM蛋白进行拓扑学分析结果见表2,发现3 种IFITM 蛋白均存在两种可能的拓扑学结构。其中TMHMM 2.0 分析结果显示,3 种猪IFITM 蛋白N-端(N')和C-端(C')均位于内质网腔内,存在2个跨膜结构区(transmembrane domain,TMD)及1 个保守的胞内环状loop 结构(conserved intracellular loop,CIL),见图3A。SOSUI 分析结果显示,3 种IFITM 蛋白可能存在另一种拓扑结构,即N-端和C-端分别位于胞质内和内质网腔中,且存在2 个胞内区(intermembrane domain,IMD)和1个TMD 以及2个CIL 结构,见图3B。另外,2个IMD和1个TMD均为α螺旋结构,见图4。

图3 猪IFITM蛋白拓扑学模型图Fig.3 Diagram of porcine IFITM protein topology model
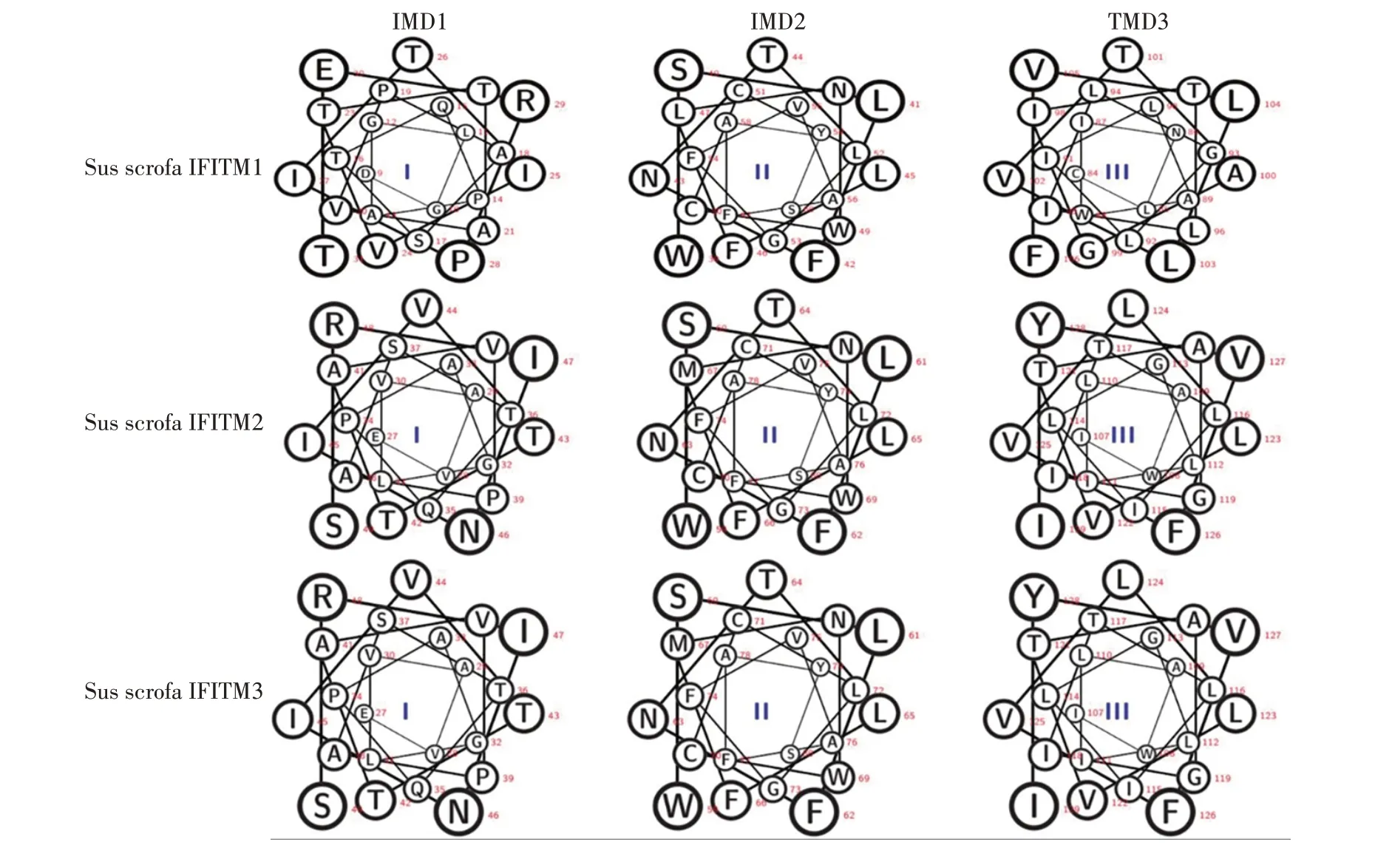
图4 SOSUI分析猪IFITM分子IMD1、IMD2和TMD3 α螺旋结构模式图Fig.4 Analysis of α helix pattern of IMD1,IMD2 and TMD3 of porcine IFITM by SOSUI

表2 TMHMM 2.0和SOSUI拓扑学分析结果Tab.2 Topology analysis of IFITM by TMHMM 2.0 and SOSUI
2.4 不同物种来源IFITM 氨基酸序列比对 不同物种来源的IFITM 氨基酸序列保守程度较高,SOSUI预测的CIL1、IMD2和CIL2区高度保守,3种IFITM分子的CD255 区均位于CIL1、IMD2 和CIL2 区。N-端和IMD1、TMD3 保守程度次之,C-端保守程度最低。见图5。

图5 不同物种来源IFITM分子氨基酸序列比对结果Fig.5 Comparison of amino acid sequences of IFITM molecules from different species
2.5 PBMCs 在体外对PRRSV 的易感性 显微镜下观察显示,未感染PRRSV 的PBMCs 大小均一,边缘光滑,形态一致,呈单个散在分布生长于12 孔细胞培养板上;感染PRRSV 24 h 后,PBMCs 出现破碎,细胞变小,边缘不整,形态不一,不规则,且与周围细胞聚集呈小团分布于12 孔细胞培养板上,表现为明显的细胞病变。见图6。提示体外PBMCs对PRRSV 具有较好的易感性。

图6 PRRSV感染PBMCs 24 h的显微镜观察(×100)Fig.6 Microscopy of PBMCs infected with PRRSV for 24 h(×100)
2.6 PRRSV 在PBMCs中的复制 1.5%琼脂糖凝胶电泳分析显示,PRRSV 感染PBMCs 后12、24、36 和48 h,用PRRSV 特异性引物均可扩增出单一的特异性条带,见图7。

图7 PCR 检测PRRSV 感染PBMCs 不同时间病毒的复制水平Fig.7 PCR detection of PRRSV replication levels in PBMCs infected with PRRSV for different time durations
2.7 PBMCs 中IFITMs基因mRNA 转录水平的变化qRT-PCR 检测结果显示,PRRSV 感染PBMCs 后12、24 和36 h,IFITM1、IFITM2和IFITM3基因mRNA 转录水平均显著上调,且3 种基因mRNA 转录水平均在病毒感染早期上调最为显著,其中IFITM1和IFITM3基因的mRNA 转录水平分别在病毒感染后第12 和24 h上调最为显著(df=4,P均=0.000 7),IFITM2基因mRNA转录水平在病毒感染后第12和24 h上调显著(df=4,P分别为0.003 2 和0.001 3);3 种IFITM基因mRNA 转录水平在病毒感染后期有逐渐下降的趋势,至病毒感染后第48 h,IFITM1和IFITM3基因mRNA转录水平上调已不显著。见图8。

图8 PRRSV 感染PBMCs 不同时间IFITM1(A)、IFITM2(B)、IFITM3(C)基因mRNA的转录水平Fig.8 Transcriptional levels of IFITM1(A),IFITM2(B)and IFITM3(C)mRNA in PBMCs infected with PRRSV for different time durations
3 讨论
病原在入侵宿主后,其核酸作为主要的病原相关分子模式(pathogen associated molecular patterns,PAMPs)被位于宿主核内体和胞质中的特异性模式识别受体(pattern-recognition receptors,PRRs)所识别[10],PAMPs与PRRs的特异性结合可诱导包括Ⅰ型IFN在内的病毒应答基因和促炎性细胞因子的表达,进而限制病毒复制或调控适应性免疫应答反应。其中,Ⅰ型IFN通过与其受体结合激活Janus激酶(Janus kinase,JAK)促进下游STAT 蛋白转录,导致转录因子复合物-干扰素刺激基因3(IFN-stimulated gene factor 3,ISGF3)转位入核,并使STAT1 和STAT2 蛋白发生磷酸化[11]。核内的ISGF3诱导上百种干扰素刺激基因(IFN-stimulated genes,ISGs)的转录。这些ISGs编码多种发挥不同生物学特性的蛋白,在病毒入侵、复制、蛋白翻译、新病毒的包装和释放等不同阶段发挥抗病毒作用[12]。有些ISGs编码的蛋白还可通过募集白细胞或作为适应性免疫应答底物发挥免疫调控作用。此外,一些ISGs也可不依赖IFN,在病毒感染后直接通过如IRF3 这样的PRRs 下游转录因子激活转录。
IFITM家族主要包括5个成员,其中包括属于CD225超家族的成员IFITM1、IFITM2 和IFITM3。IFITM 蛋白是最早已知能够抑制病毒入侵细胞的ISGs,一直是抗病毒天然免疫研究领域的热点[8]。有研究报道,猪IFITM 可抑制猪伪狂犬病病毒、甲型流感病毒、JEV、PRRSV 和非洲猪瘟病毒等的复制[13-18]。IFITM发挥抗病毒作用可能的主要机制为通过抑制病毒囊膜与内体膜融合或诱导胆固醇在晚期内体中大量富集抑制包括核酸在内的内容物释放到细胞质中,从而抑制病毒复制[19-23]。另外,IFITM 还可结合到病毒粒子表面,降低病毒感染活性,抑制病毒复制[20]。
目前,PRRSV 与宿主IFITM 蛋白之间的相互作用机制尚不明确,缺少体外猪源细胞感染模型是制约PRRSV 与宿主抗病毒天然免疫之间相互作用机制研究的重要瓶颈。PBMCs具有取材方便和容易制备等优点,作为PRRSV 与宿主相互作用的体外细胞模型具有一定的潜力。本研究通过RT-PCR法成功扩增获得了猪PBMCs源IFITMCDS区全长序列,经测序比对发现,与NCBI登录的猪IFITM基因序列一致。鉴于拓扑学结构对跨膜蛋白发挥功能具有重要意义,本研究利用线上拓扑学预测工具TMHMM 2.0 和SOSUI对猪IFITM 蛋白进行了拓扑学分析,结果发现猪IFITM 蛋白可能存在两种拓扑学结构模式。此外,比对分析发现,不同物种来源的IFITM 分子氨基酸序列在CIL1、IMD2 和CIL2 区高度保守,推测该区域对IFITM发挥抗病毒作用具有重要作用。
体外攻毒试验结合RT-PCR 检测表明,PRRSV可在体外感染PBMCs,并可引起显著的细胞病变,且PRRSV 还可在PBMCs中复制,表明PBMCs可作为研究PRRSV 与宿主相互作用的体外模型。与本实验室前期以PAM 为研究模型的发现类似[24],通过qRTPCR 检测发现,PRRSV 体外感染PBMCs 后,在感染早期,FITMs的基因转录水平均显著上调,推测IFITMs分子也参与PBMCs抗病毒免疫反应。
RT-PCR结合qRT-PCR检测结果显示,在感染后期,病毒在细胞中的复制和IFITM基因的转录水平均明显下降,表明PBMCs 作为体外模型研究PRRSV与宿主相互作用机制也存在类似于PAM 的缺陷,即作为原代细胞,PBMCs 不能在体外长期存活。有研究发现[25],PAM 永生化后丧失了感染PRRSV 的能力,而PBMCs 永生化后是否更适合作为PRRSV 体外感染模型值得进一步探讨。
综上所述,本研究结果表明,PBMCs作为PRRSV体外感染模型,在研究宿主抗PRRSV 天然免疫应答方面具有重要的应用价值。

