阿尔茨海默病中Aβ1-42磁微粒化学发光免疫检测方法的建立和应用
毛 骞,李 迎,牧晓梅,马鸿雁
(北华大学附属医院,吉林 吉林 132011)
阿尔茨海默病(Alzheimer,AD)是老年人中最常见且后果严重的神经退行性疾病,β-淀粉样蛋白(β-amyloid protein,Aβ)的神经毒性是其公认的病因之一[1].Aβ有两种形式,由40个氨基酸组成的蛋白片段为Aβ1-40,由42(43)个氨基酸组成的蛋白片段为Aβ1-42,Aβ主要见于AD患者脑内[2-3].Aβ1-42的脑内检测难度大,而血清中Aβ1-42水平也可用于预测AD病情,特别是对早期AD诊断很有意义[4-5].有研究[6-8]发现,由于Aβ1-42在脑组织内的沉积过多,导致体液中其含量明显减少,血清Aβ1-42水平检测可辅助评估AD患者认知功能障碍的风险.目前,临床血清中Aβ1-42检测主要应用ELISA法,ELISA法检测时间较长,灵敏度不够,操作复杂,且无法全自动化[5-9].因此,本研究拟建立一种定量检测人血清中Aβ1-42水平的新方法,采用Aβ1-42抗体-磁微粒偶联物识别并特异性结合Aβ1-42蛋白,然后与Aβ1-42 抗体-吖啶酯发光试剂结合,通过检测发光值来计算样本中Aβ1-42水平,其结果可为血清Aβ1-42的高灵敏、强特异性、准确检测提供一种新的技术手段.
1 材料与方法
1.1 材料与仪器
羧基磁微粒(货号:CMP1001CA,苏州为度生物技术有限公司);Aβ1-42抗体(R&D公司,美国);吖啶酯(货号:Y0266,苏州亚科科技股份有限公司);1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐、N-羟基磺基琥珀酰亚胺(Sulfo-NHS)(Sigma公司,美国);化学发光检测仪(型号:SMART500S,重庆科斯迈生物科技有限公司);发光底物(含激发液和预激发液)(货号:6E23-82和6C55-82,上海雅培制药有限公司).
1.2 Aβ1-42抗体-磁微粒偶联物的制备
采用经典的EDC/NHS方法活化羧基磁微粒后与抗Aβ1-42抗体偶联.具体步骤:应用微球缓冲液(0.05 mmol/L吗啉磺酸,pH 6.0)洗涤羧基磁微粒3次后加入等量的EDC和NHS,室温下振荡活化35 min;应用微球缓冲液洗涤3次后再加入抗Aβ1-42抗体(m(抗体)∶m(磁珠)=1∶6),室温振荡反应5 h;经封闭缓冲液(0.05 mmol/L Tris、2%牛血清白蛋白、0.05% Triton X-100、0.5% Proclin300)封闭2 h后再应用微球缓冲液洗涤3次,将沉淀物Aβ1-42抗体-磁微粒偶联物用微球稀释液(0.05 mmol/L Tris、2%BSA、4%海藻糖、0.05% Triton X-100、1%氯化钠、0.5% Proclin300)溶解,储存在4 ℃冰箱中.
1.3 Aβ1-42抗体-吖啶酯发光试剂的制备
将Aβ1-42配对抗体中的另一个抗体与吖啶酯偶联,制备Aβ1-42配对抗体-吖啶酯发光试剂.具体步骤:按照m(抗体)∶m(吖啶酯)=3∶1的比例将Aβ1-42配对抗体与吖啶酯混合均匀,室温下振荡反应30 min,加入终浓度0.5%赖氨酸以终止反应;应用0.1 mmol/L PBS透析24 h,去除未结合的吖啶酯,再通过Sephadex G50凝胶层析纯化,收集具有高发光强度的产物;将纯化后的Aβ1-42配对抗体-吖啶酯发光试剂储存在4 ℃冰箱中备用.
1.4 磁微粒化学发光法检测步骤
取50 μL Aβ1-42抗体-磁微粒溶液,加入60 μL的Aβ1-42标准品或血清样本和100 μL Aβ1-42配对抗体-吖啶酯发光剂,37 ℃下温育反应20 min,外加磁场促使磁微粒及其磁微粒偶联物聚集到试管底部,使用洗涤缓冲液(PBS+0.05% Tween 20)轻轻洗涤试管去除游离物质;分别加入100 μL激发液和100 μL预激发液后,应用化学发光仪自动检测发光值,结果显示发光值与样本中的Aβ1-42浓度呈正相关关系.上述检测步骤均在化学发光检测仪上全自动化进行,只需事先设置好各组分加入量、时间等,检测过程无需人工操作.
1.5 方法学评价
1.5.1 标准曲线绘制
采用化学发光免疫分析法对Aβ1-42检测试剂盒开展溯源程序,目前Aβ1-42暂无国家标准品,故校准品溯源到使用校准品稀释液(0.01 mmol/L PBS、0.5%组氨酸、2%海藻糖、0.40%酪蛋白、0.5% Proclin300,pH 7.0~7.6)稀释的Aβ1-42抗原,通过溯源对比试剂盒(已获证化学发光试剂)一级校准品,偏差控制在±10%以内.通过设置系列浓度(0、0.1、1、10、100、1 000、5 000 pg/mL)的Aβ1-42标准品,检测各浓度对应的发光度值,每个浓度测定3个复孔,计算平均值,绘制标准曲线.采用建立的方法检测各标准品浓度对应的发光度值,绘制标准曲线.每个浓度测定3个复孔,采用双对数数学模型(Log-Logit) 进行标准曲线的拟合.
1.5.2 稀释线性检测
采用CLSI EP6-A2方法进行稀释线性检测.将接近标准曲线线性范围上限的高值样本稀释6个梯度至接近该方法的线性下限,每个浓度重复测定3次.用最小二乘法将测定的结果和对应稀释比例进行线性拟合,并计算两者之间的相互关系,得出线性相关系数R.
1.5.3 灵敏度检测
采用CLSI EP17-A2方法进行灵敏度检测.准备5份健康人血清样本,用本研究的试剂进行检测,每个样本重复3次,连续检测4 d,得到所有样本的发光均值和标准差;准备5份浓度范围为LoB的1~4倍的血清样本,检测4次/d,间隔超过2 h,每次检测重复3次,共进行5 d;依据EP17-A2方法和公式进行数据处理和分析,计算得到空白限(LoB)、检测限(LoD)、功能灵敏度(FS).
1.5.4 准确度检测
采用EP09方法对检测试剂的加标回收率进行评估.先测定基质血清中Aβ1-42浓度,然后将已知浓度的Aβ1-42蛋白标准品加入到基质血清中,制备成高、中、低3个浓度的检测样本,使用本方法重复检测3次,计算高、中、低3个浓度标准品中Aβ1-42浓度的mean、SD、变异系数(CV)、加标回收率,以评价该方法的准确度和重复性.加标回收率=(测定浓度-基质浓度)/加标浓度×100%;CV=SD/mean×100%.
1.5.5 精密度(重复性)检测
采用CLSI EP05-A3方法进行精密度检测.检测高、中、低3个浓度水平的Aβ1-42校准品,不同浓度标本每天上午和下午各检测2次,每次检测有2个重复,时间间隔不低于 2 h,连续测定20 d,分别计算各浓度样本的分析内精密度、分析间精密度及总不精密度.
1.6 试剂盒组装
将制备好的Aβ1-42抗体-磁微粒偶联物分装在试剂管中,5 mL/管,分装时需不断吹打或搅拌微球,以保证分装过程磁微粒是均匀的.纯化后的Aβ1-42配对抗体-吖啶酯发光试剂分装在棕色的试剂管中,5 mL/管.系列浓度的Aβ1-42标准品制备成冻干粉,使用时加入PBS进行复溶,洗涤缓冲液,50 mL/管.发光底物A和B分别分装于棕色管中,10 mL/管.将分装好的试剂贴好标签,注明名称、批号、保存期限等信息,并置于试剂盒中2~8 ℃储存.
1.7 特异性实验
采用本实验建立的方法检测1 000 pg/mL Aβ1-42标准品、100 ng/mL人血白蛋白、100 ng/mL纤维蛋白原、100 ng/mL癌胚抗原(CEA)、100 ng/mL血红蛋白和100 ng/mL肿瘤坏死因子-α(TNF-α)样本,评估该方法的特异性.
1.8 干扰实验
本次评估采用了3种常见血清干扰物质,分别是甘油三酯、血红蛋白和胆红素,将一定浓度的干扰物分别加入到高浓度Aβ1-42和低浓度Aβ1-42的血清待测样本中,设为干扰物质样本;加入干扰物的体积不超过总体积的5%,对照组同时添加相同体积的PBS作为对照样本,然后对两组样本分别进行测试;每个浓度检测3次,并按照下面公式计算得到干扰率:干扰率=(干扰物质样本的测定浓度-对照组样本的测定浓度)/对照组样本的测定浓度×100%.
1.9 稳定性评估
将制备的试剂盒置于37 ℃存放7 d,然后进行热加速稳定性试验.对试剂盒的物理外观、灵敏度、准确度、重复性、特异性等进行检测,以评估该方法试剂盒的稳定性.灵敏度、准确度、重复性、特异性检测方法同上.
1.10 建立参考区间
收集100份非AD患者血清样本,用该试剂盒分别检测其Aβ1-42浓度.应用SPSS 17.0对数据进行统计分析,确定数值是否为正态分布,再根据其是否正态性选择相应的参考区间计算方法.
1.11 统计学分析
2 结 果
2.1 Aβ1-42化学发光检测方法的条件优化
采用单因素测试及多因素交叉测试筛选得到了最优的抗体对、重组抗原、磁珠与抗体最优标记比例、吖啶酯与抗体最优标记比例、基础缓冲液、校准品、反应体系以及筛选不同需求对应的血清样本.反复优化及验证得到的反应体系:样本上样量为60 μL,磁珠标记抗体上样量为50 μL,吖啶酯标记抗体上样量为100 μL;反应步骤为一步法,反应时间为20 min;相应最优缓冲液配方:磁微粒稀释液为0.05 mmol/L Tris、2.5%BSA、5%海藻糖、0.08% Triton X-100、1.5%氯化钠、0.5% Proclin300;磁微粒封闭缓冲液为0.05 mmol/L Tris、2%牛血清白蛋白、0.05% Triton X-100、0.5% Proclin300;发光物稀释液为0.01 mmol/L PBS、1.5%氯化钠、0.3%酪蛋白、5%海藻糖、0.08% Triton X-100、0.5% Proclin300;校准品或质控品稀释液为0.01 mmol/L PBS、3%海藻糖、0.3%酪蛋白、0.5%组氨酸、0.5% Proclin300.
2.2 Aβ1-42化学发光检测方法的性能评估
2.2.1 标准曲线及线性范围测试
以Aβ1-42标准品系列浓度的log10(浓度值)为横坐标,对应检测得到的化学发光值的log10(发光值)为纵坐标,建立logistic四参数拟合的曲线方程为:y=(9.796 10-3.064 51)/[1+(x/4.920 48)-0.915 88]+3.064 51,R=0.999 18.见图 1.Aβ1-42浓度在0.1~5 000 pg/mL范围内时,本检测方法的剂量-反应效应较好.
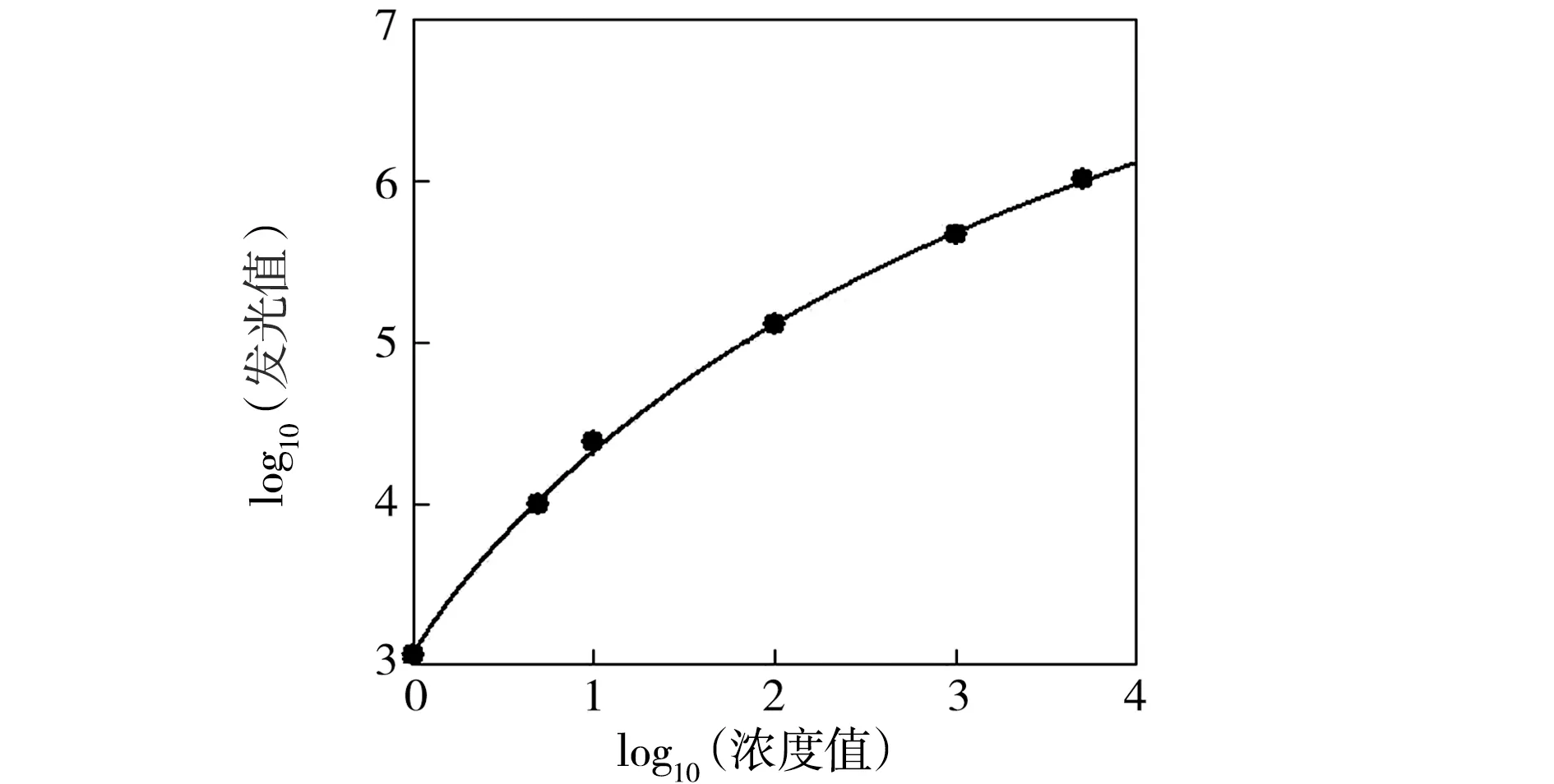
图1 Aβ1-42检测标准曲线Fig.1 Standard curve of Aβ1-42 detection
2.2.2 线性范围测试结果
将5 500 pg/mL(接近线性上限)浓度水平的血清样本逐级稀释至接近线性下限的浓度0.07 pg/mL,将所得3次结果取均值,并与理论浓度值进行最小二乘法线性拟合,得出对应的线性相关系数R.表1结果所示,在0.07~5 500 pg/mL范围内,得出相关系数(R)为0.999,不低于0.990 0,故本研究建立的方法设定的线性范围0.1~5 000是符合要求的.

表1 Aβ1-42稀释线性检测数据Tab.1 Data of Aβ1-42 dilution linear assay
2.2.3 Aβ1-42化学发光检测方法的灵敏度评估
采用CLSI EP17-A2方法进行灵敏度测试评估,结果空白限(LoB)为0.03 pg/mL,检测限(LoD)为0.05 pg/mL,功能灵敏度(FS)为0.11 pg/mL.
2.2.4 Aβ1-42化学发光检测方法的准确度评估
在线性范围内,选择高、中、低3个浓度系列的血清样本,用较低含量的阴性血清作为基质浓度,按照比例1∶9进行稀释,制备成加标回收样品,回收率在90%~110%视为符合要求,检测结果见表2.3个浓度覆盖从低到高的浓度,加标回收率均在6.10%以内,符合要求,说明该Aβ1-42磁微粒化学发光法检测血清样本中Aβ1-42浓度具有较高的准确度.

表2 Aβ1-42磁微粒化学发光检测试剂加标回收率检测结果Tab.2 Recovery rate of Aβ1-42 magnetic particle chemiluminescence assay
2.2.5 Aβ1-42化学发光检测方法的精密度评估
采用CLSI EP05-A3方法对高浓度、中浓度和低浓度水平的3个标本的各80份检测数据进行分析,结果见表3.3个浓度水平的分析内精密度为1.06%~2.70%,分析间精密度为3.61%~5.21%,总不精密度为5.93%~8.60%,分析内和分析间精密度均低于6%,总不精密度低于9%,符合要求.

表3 Aβ1-42磁微粒化学发光试剂精密度测试结果分析Tab.3 Analysis of precision test results of Aβ1-42 magnetic particle chemiluminescence assay
2.3 Aβ1-42化学发光检测试剂盒的特异性
将制备的成品试剂盒重复3次检测1 000 pg/mL的Aβ1-42标准品,得到的交叉反应率为100.85%;同时检测人血白蛋白、纤维蛋白原、CEA、血红蛋白和TNF-α,对应的交叉反应率分别为1.05%、1.34%、1.54%、1.99%和1.73%,交叉反应率均低于2%,表明该检测试剂盒对Aβ1-42检测的特异性良好.
2.4 Aβ1-42化学发光检测试剂盒的干扰实验
本研究分别将不同浓度的甘油三酯、胆红素、血红蛋白加入 2 份待测标本中作为干扰标本,同时以添加相同体积的体系缓冲液作为基础标本,根据公式计算得到干扰率.从表4的结果分析可以看出,3种干扰物质(胆红素、甘油三酯和血红蛋白)在不同浓度情况下对高浓度Aβ1-42水平和低浓度Aβ1-42水平2份样本影响效果不一致,胆红素、甘油三酯、血红蛋白浓度分别不高于40 U/L、2 mmol/L、3 g/L时,各浓度干扰率均不超过10%,即干扰物在上述3个浓度的情况下,未见明显干扰,超过该浓度,存在明显干扰现象.
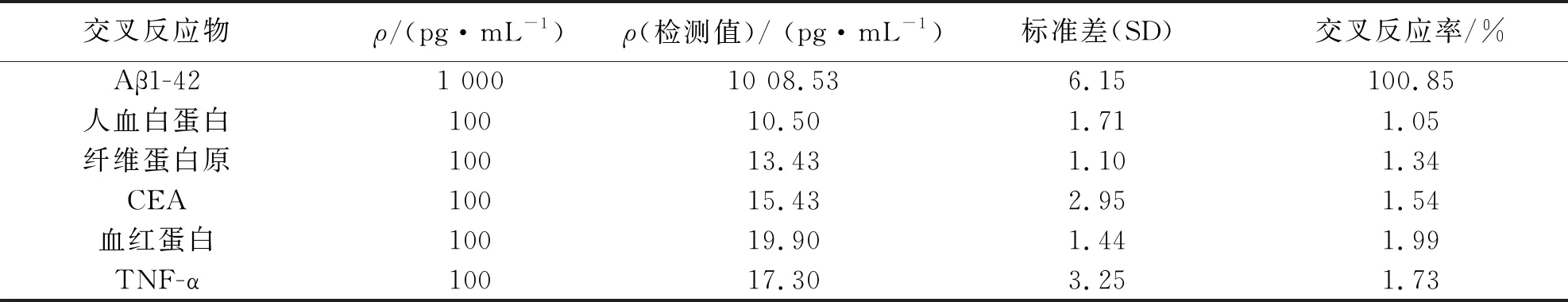
表4 特异性实验结果Tab.4 Results of specificity assay
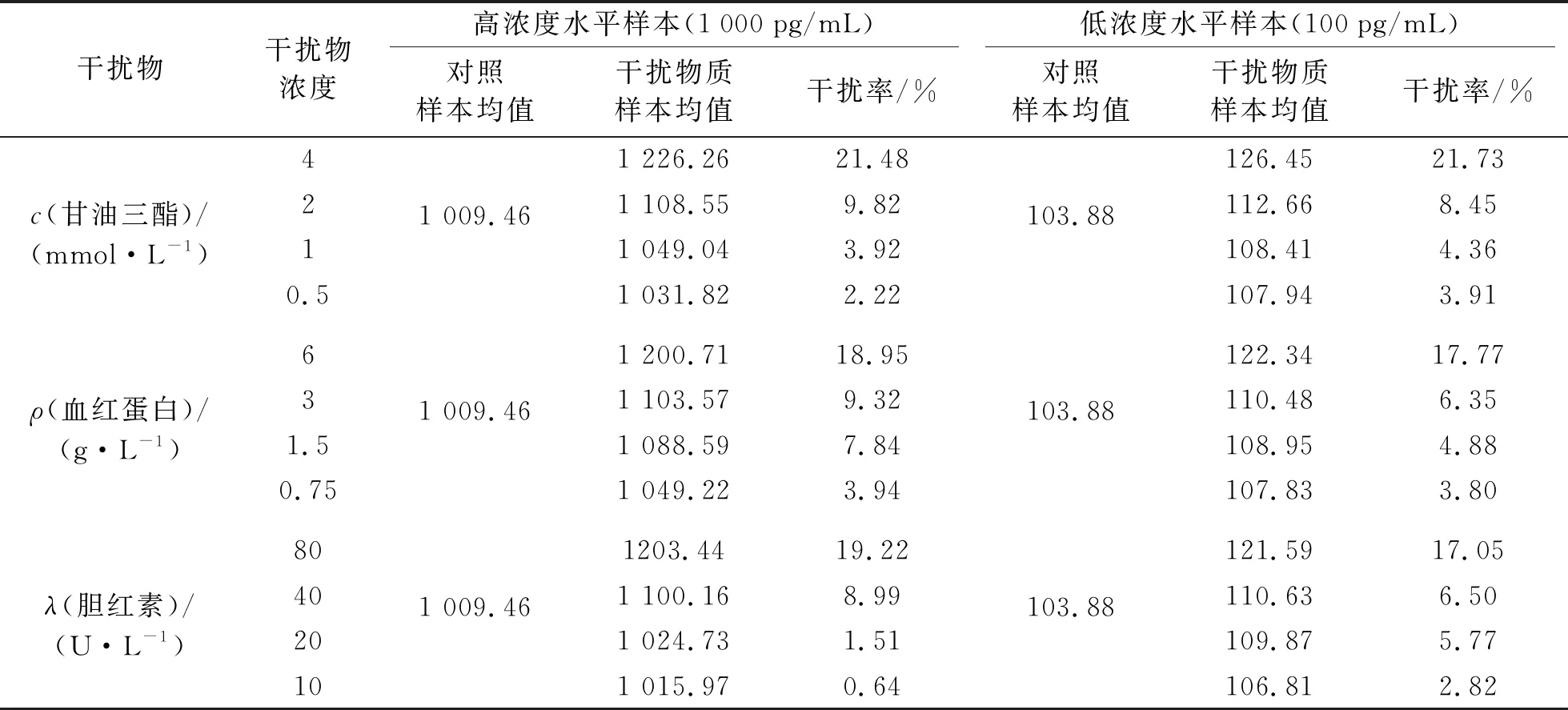
表5 干扰试剂对Aβ1-42磁微粒化学发光试剂盒的检测影响测试结果Tab.5 Detection effect of interfering reagents in Aβ1-42 magnetic particle chemiluminescence kit
2.5 Aβ1-42化学发光检测试剂盒的稳定性评价
试剂盒在37 ℃温度下保存7 d后进行热加速稳定性实验.7 d后,使用Aβ1-42标准品、基质血清等检测试剂盒的灵敏度、准确度、重复性和特异性等结果显示,试剂盒外观及其组分均未发生明显改变,检测灵敏度、准确度、重复性和交叉反应率等均未有显著性改变,表明本试剂盒稳定性较好.
2.6 参考区间
本实验通过测定100例非AD患者血清,并用非参数检验方法柯尔莫哥洛夫-斯米诺夫检验(D检验)和夏皮洛-威尔克检验(W检验)对检测结果进行检验,均显示数据不服从正态分布,故采用百分位数法,取其第95百分位,建议最合适的阈值为654.2 pg/mL,即正常参考区间为>654.2 pg/mL.
3 讨 论
近年来,随着化学发光分析技术的不断发展,其优点在临床应用过程中得到充分肯定,已成为免疫检测技术重点发展方向之一[10].化学发光免疫检测技术与放射免疫和酶联免疫相比,其具有灵敏度高、操作简便快速、批内批间变异系数小、无放射性污染、稳定性强、特异性高等优点[11].在临床检测中,往往需要对大量成分复杂且低丰度的样品进行定量测定,如何实现自动化、降低杂质干扰、高灵敏定量检测一直是临床检测方法研究的重点.Aβ1-42主要聚积在AD患者脑内,血清中Aβ1-42 水平较低,因此,寻找一种高灵敏度、降低杂质干扰的检测方法对Aβ1-42水平定量检测十分必要.磁微粒的应用使化学发光检测技术在快速分离与改善灵敏度上有了重大突破,恰好满足了Aβ1-42临床检测的需要[12-13].郭健夫等[14]采用碱性磷酸酶催化的发光底物溶液,建立了一种人体Aβ磁微粒化学发光免疫检测方法,该方法提高了免疫反应的信号强度和灵敏度,使低含量物质也能产生很强的化学发光信号,为人体Aβ的定量检测提供了一种更准确、方便快捷的方法.
本研究建立了一种管式磁微粒化学发光免疫分析法定量测定人血清中Aβ1-42水平的方法,通过制备Aβ1-42抗体-磁微粒偶联物和Aβ1-42抗体-吖啶脂发光试剂建立了高灵敏定量检测Aβ1-42水平的新方法,并组装成了试剂盒.该试剂盒对血清中Aβ1-42的检测灵敏度为空白限(LoB)、检测限(LoD)、功能灵敏度(FS)、线性范围均可以满足临床样本中对Aβ1-42的定量检测需要,无须稀释;加标回收率在100.60%~106.10%之间,符合要求,与秦海新等[15]建立的电化学发光法检测血清中Aβ水平的回收率(99.3%~101.8%)基本相当,准确度符合要求.试剂盒精密度方面,3批试剂盒检测的分析内精密度在1.06%~2.70%范围内,分析间精密度在3.61%~5.21%范围内,总不精密度在5.93%~8.60%范围内,分析内和分析间精密度均低于6%,总不精密度低于9%.与血清中常见蛋白交叉反应率均不大于2%;同时,样本中3种干扰物在胆红素、甘油三酯、血红蛋白浓度分别不高于40 U/L、2 mmol/L、3 g/L时,干扰率均低于10%,未见明显干扰,基本不影响检测结果.试剂盒在37 ℃下可稳定保存7 d以上,说明试剂盒在2~8 ℃下保质期不低于12个月.
综上,本实验通过对该试剂盒检测灵敏度、准确度、重复性、特异性、抗干扰性、稳定性等性能评价可知,该Aβ1-42化学发光检测试剂盒可满足临床对血清中Aβ1-42水平检测的性能需求.此外,本试剂盒检测了100例非AD患者血清,初步推测出非AD患者参考区间,即当血清Aβ1-42浓度≥654.2 pg/mL时,受检者罹患AD的风险较小;当Aβ1-42血清浓度<654.2 pg/mL时,受检者罹患AD的风险较大.参考区间的建立对于该试剂盒的临床应用奠定了科学基础.然而不足的是,参考区间的建立选择的非AD患者血清样本数量较少,无法进行更细致的分组比较(年龄、性别等),更为准确的参考区间需要更大量的样本验证.
磁微粒化学发光检测方法具有灵敏度和准确性高、特异性和稳定性强的优点,可为临床Aβ1-42水平定量检测提供一种新的技术手段.

