不同血糖水平的冠心病患者外周血中Th1、Th2细胞比例变化分析
高 卉,李 雷
(1.徐州医科大学研究生院,江苏 徐州 221004;2.徐州医科大学附属医院,江苏 徐州 221006)
血糖升高是动脉粥样硬化发生、发展的主要危险因素,动脉粥样硬化相关的周围血管、脑血管、心脏等血管病变发生率与非糖尿病患者相比提升约3倍,是糖尿病患者致残、致死的主要原因之一[1].糖尿病促进动脉粥样硬化发展的分子机制仍未完全明确,目前研究[2]显示,亚临床研究和慢性炎症可能是动脉粥样硬化及糖尿病发生的病理基础,细胞免疫和体液免疫参与其中并发挥重要作用.辅助性T细胞是炎症反应的主要参与者,与自然杀伤性细胞、单核巨噬细胞等共同参与动脉粥样硬化过程中的泡沫细胞形成、内皮细胞损伤等,进而加重炎症反应[3].本研究主要探讨不同血糖水平的冠心病患者外周血中1型辅助性T细胞(Th1)、2型辅助性T细胞(Th2)的细胞比例变化及意义.
1 对象与方法
1.1 研究对象
选取2020年3月—2021年7月徐州医科大学附属医院收治的冠心病患者86例.根据血糖检测结果将患者分为冠心病血糖正常组34例,冠心病合并糖耐量异常组20例,冠心病合并糖尿病组32例.冠心病血糖正常组中男19例,女15例;年龄50~75岁,平均(61.95±7.38)岁.冠心病合并糖耐量异常组男12例,女8例;年龄53~74岁,平均(62.31±6.93)岁.冠心病合并糖尿病组男12例,女8例;年龄51~74岁,平均(61.58±7.62)岁.另收集同期健康志愿者25名为健康对照组,心电图和心脏彩超检查均无异常,无糖尿病、高血压等慢性病,其中男14名,女11名;年龄47~72岁,平均(61.05±6.38)岁.性别、年龄在各组间比较差异均无统计学意义(P>0.05),具有可比性.
入选标准:符合2018年发布的《中国稳定性冠心病诊治指南》中的诊断标准,冠脉造影示1支及以上血管有硬化斑块形成,狭窄程度50%及以上;理解和沟通能力正常,自愿参与并完成随访.
排除标准:6个月内诊断为急性冠脉综合征者;先天性心脏病、严重心瓣膜病、心肌病、纽约心脏病学会(NYHA)分级≥Ⅲ级者;合并自身免疫性疾病者;恶性肿瘤患者.
1.2 主要试剂
γ干扰素、白细胞介素4、白细胞介素5、白细胞介素10酶联免疫吸附法检测试剂盒(北京梅科万德生物有限公司);Ficoll淋巴细胞分离液(北京诺博莱德科技有限公司);DMEM培养液、胎牛血清、M199细胞培养基、牛垂体提取物(浙江森瑞生物有限公司);鼠抗人γ干扰素-PE、白细胞介素4-PE单克隆抗体(南京维森特生物有限公司);磁珠(Dynal Biotech公司,挪威).
1.3 方 法
1.3.1 各组血糖、糖化血红蛋白及炎症因子水平检测
采集各组受试者的清晨空腹外周静脉血,检测空腹血糖和糖化血红蛋白水平;2 500 r/min离心10 min,收集血清,-20 ℃保存待测.酶联免疫吸附法检测血清γ干扰素、白细胞介素4、白细胞介素5、白细胞介素10水平.
1.3.2 外周血单个核细胞分离及Th1、Th2细胞比例检测
采集各组受试者清晨空腹外周静脉血,经肝素抗凝处理后使用Ficoll淋巴细胞分离液提取外周血单个核细胞.4 ℃ 2 500 r/min离心15 min,毛细滴管吸取中间层云雾状细胞层,使用5倍体积的缓冲液反复洗涤3次;4 ℃ 2 500 r/min离心10 min,弃去上清液;用DMEM培养液重悬分离得到的外周血单个核细胞,加入胎牛血清0.1 mL、丙二醇甲醚醋酸酯1 mg/L、离子霉素50 mg/L、布雷非德菌素A 500 mg/L,室温下孵箱中孵育4 h,加入鼠抗人CD3-FITC抗体,继续孵育30 min;洗涤后加入破膜液,再加入鼠抗人γ干扰素-PE、白细胞介素4-PE单克隆抗体,室温下孵育后上流式细胞仪检测,γ干扰素/CD3细胞为Th1细胞,白细胞介素4/CD3细胞为Th2细胞.
1.3.3 人脐静脉内皮细胞培养
使用缓冲液洗涤脐静脉内皮细胞3次,然后向其中注射胶原酶,注射之前经37 ℃预热,消化30 min后收集人脐静脉内皮细胞悬液;使用含10%胎牛血清的M199细胞培养基重悬,加入牛垂体提取物(终浓度300 μg/mL)和血管内皮生长因子(终浓度10 μg/mL),接种在6孔板中,培养传代至第3代用于本研究.
1.3.4 免疫磁珠清除外周血单个核细胞中CD4+T细胞
分离外周血单个核细胞,4 ℃ 2 500 r/min离心10 min,弃去上清液,加入洗涤后的免疫磁珠,在冰浴箱中摇动混匀30 min;将EP管放于磁架3 min,弃去上清液,洗涤3次后上流式细胞仪检测CD4表达.
1.3.5 细胞毒性试验
本研究共设8种效应细胞,分别为健康对照组、冠心病血糖正常组、冠心病合并糖耐量异常组、冠心病合并糖尿病组的外周血单个核细胞以及清除CD4+T细胞的外周血单个核细胞.将人脐静脉内皮细胞洗涤后加入96孔板中,向培养孔中加入效应细胞悬液,每种效应细胞设置3个复孔;加入孵育箱中37 ℃孵育6 h,弃去悬浮的细胞液,再次加入DMEM完全培养基液;向培养孔中加入MTT试剂(终浓度5 mg/mL),加入37 ℃培养箱中继续孵育4 h,弃去培养液;每孔加入二甲基亚砜150 μL,室温下振荡10 min,上酶标仪检测450 nm处各培养孔的吸光度值,计算细胞存活率.
1.3.6 随 访
患者出院后对其进行1 a的随访,采取电话随访的方式进行,记录主要不良心血管事件发生情况,包括急性心力衰竭、恶性心律失常、心肌梗死、血运重建、心源性死亡.
1.4 统计学分析

2 结 果
2.1 各组空腹血糖和糖化血红蛋白水平
本研究结果显示,冠心病合并糖尿病组患者空腹血糖、糖化血红蛋白水平明显高于健康对照组、冠心病血糖正常组、冠心病合并糖耐量异常组(P<0.05).见表1.
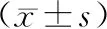
表1 各组空腹血糖和糖化血红蛋白水平 Tab.1 Fasting blood glucose and glycosylated hemoglobin levels in each group
2.2 各组Th1、Th2细胞比例分析
本研究结果显示,Th1、Th2细胞比例在各组间比较差异均具有统计学意义(P<0.05);冠心病合并糖尿病组Th1细胞比例明显高于冠心病合并糖耐量异常组、冠心病血糖正常组、健康对照组,Th2细胞比例明显低于冠心病合并糖耐量异常组、冠心病血糖正常组、健康对照组(P<0.05).见表2.
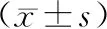
表2 各组Th1、Th2细胞比例分析Tab.2 Proportion analysis of Th1 and Th2 cells in each group
2.3 各组Th1细胞和Th2细胞炎症因子水平
本研究结果显示,γ干扰素、白细胞介素4、白细胞介素5、白细胞介素10水平在各组间比较差异均具有统计学意义(P<0.05);冠心病合并糖尿病组γ干扰素水平明显高于冠心病合并糖耐量异常组、冠心病血糖正常组、健康对照组(P<0.05),白细胞介素4、白细胞介素5、白细胞介素10水平明显低于冠心病合并糖耐量异常组、冠心病血糖正常组、健康对照组(P<0.05).白细胞介素2在各组间比较差异无统计学意义(P>0.05).见表3.
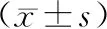
表3 各组Th1细胞和Th2细胞分泌的炎症因子水平 Tab.3 Levels of inflammatory factors secreted by Th1 cells and Th2 cells in each group
2.4 各组不同细胞亚群作用下人脐静脉内皮细胞存活率
本研究结果显示,冠心病合并糖尿病组患者外周血单个核细胞水平明显低于冠心病合并糖耐量异常组、冠心病血糖正常组、健康对照组(P<0.05);清除CD4+T细胞的外周血单个核细胞在各组间比较差异无统计学意义(P>0.05).见表4.
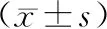
表4 各组不同细胞亚群作用下人脐静脉内皮细胞存活率 Tab.4 Survival rate of human umbilical vein endothelial cells under different cell subsets in each group
2.5 空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例对冠心病患者预后的预测价值分析
随访1 a,结果86例冠心病患者中不良心血管事件发生率22.09%(19/86),使用ROC曲线检测空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例对冠心病患者预后的预测价值.以空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例预测冠心病患者预后的灵敏度为纵坐标,以1-特异度为横坐标,构建ROC曲线,结果显示,空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例对冠心病患者预后均具有较高的预测价值(P<0.05).将空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例纳入Logistic回归模型,通过回归系数得出各指标联合的数值计算公式,得出联合数据,结果显示各指标联合检测的预测价值最高(AUC=0.942),灵敏度、阳性预测值均明显高于各指标单独检测.见图1、表5.

图1 空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例对冠心病患者预后预测价值的ROC曲线Fig.1 ROC curve of predictive value of fasting blood glucose,glycosylated hemoglobin,Th1 cell ratio and Th2 cell ratio on prognosis of patients with coronary heart disease

表5 空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例对冠心病患者预后的预测价值分析Tab.5 Analysis of predictive value of fasting blood glucose,glycosylated hemoglobin,Th1 cell ratio and Th2 cell ratio on prognosis of patients with coronary heart disease
3 讨 论
相关研究[4]显示,合成并分泌γ干扰素的Th1参与1型糖尿病患者的发病过程.辅助性T细胞是一个具有异质性的细胞群,包括具有促炎作用的Th1细胞亚群及对炎症反应具有多种调节作用的Th2细胞亚群[5].本研究中冠心病合并糖尿病组Th1细胞比例明显高于冠心病合并糖耐量异常组、冠心病血糖正常组、健康对照组(P<0.05),Th2细胞比例明显低于冠心病合并糖耐量异常组、冠心病血糖正常组、健康对照组(P<0.05);提示随着血糖水平的升高冠心病患者中Th1细胞比例明显升高、Th2细胞比例明显降低,其中合并糖尿病的冠心病患者Th1和Th2细胞比例异常改变最为明显.Th1细胞和Th2细胞参与动脉粥样硬化的发展过程,其中Th1细胞主要分泌γ干扰素、白细胞介素2,γ干扰素还能够活化单个核细胞进而维持炎症反应的持续性[6].Th2细胞能够分泌白细胞介素4、白细胞介素5、白细胞介素10,可通过活化转录激活因子6抑制GATA结合蛋白3表达,降低Th1细胞分化和γ干扰素分泌,进而减缓或抑制动脉粥样硬化的发展[7].正常生理状态下Th1细胞与Th2细胞亚群相互调节,呈动态平衡状态[8].有研究[9]显示,Th1细胞数和γ干扰素分泌量增加能够促进动脉粥样硬化的发生与发展.
本研究结果显示,随着冠心病患者血糖水平的升高,γ干扰素浓度明显增加,但白细胞介素2浓度增加不明显,提示Th1细胞炎症反应在合并糖尿病的冠心病患者动脉粥样硬化过程中处于长期慢性炎症状态,与急性冠脉综合征病情进展中硬化斑块短时间内破裂引发血栓存在区别.随着冠心病患者血糖水平的升高,Th2细胞亚群分泌的白细胞介素4、白细胞介素5、白细胞介素10浓度明显降低,提示高糖状态会减弱冠心病患者Th2细胞对炎症反应的抑制作用.高糖状态下冠心病患者外周血中存在Th1细胞、Th2细胞平衡失调和局部炎症反应,能够促进动脉粥样硬化斑块的发生与发展.
血管内皮损伤是动脉粥样硬化斑块形成的诱发因素[10],本研究经细胞毒性试验发现,冠心病合并糖尿病患者的外周血单个核细胞对人脐静脉内皮细胞的损伤程度随着血糖水平的升高逐渐加强,提示血糖水平升高会增加外周血单个核细胞对人脐静脉内皮细胞的损伤作用,且该作用随着外周血单个核细胞中CD4+T细胞的清除而逐渐消失,说明辅助性T细胞在外周血单个核细胞对人脐静脉内皮细胞的损伤过程中发挥重要作用.人体外周血单个核细胞中包含多种异质性细胞亚群,包括分泌多种细胞因子CD4+的辅助性T细胞,能够杀伤细胞的CD8+的毒性T细胞,调节免疫系统功能的调节性T细胞,相互作用形成一个复杂免疫调节网络,参与病理生理过程[11].辅助性T细胞是外周血单个核细胞中CD4+T细胞亚群的主要成分,Th1细胞亚群活化能够维持炎症反应的持续存在,还能够加强毒性T细胞对血管内皮细胞的损伤,抑制调节性T细胞对炎症反应的调节作用,进而促进冠心病患者高糖状态下动脉粥样硬化的发展[12-13].本研究进一步分析显示,空腹血糖、糖化血红蛋白、Th1细胞比例、Th2细胞比例联合检测对冠心病患者预后具有较高的预测价值(AUC=0.942),可用于冠心病患者的预后评估,还可对治疗方案的合理制定提供参考.

