氧化苦参碱对溃疡性结肠炎小鼠炎性细胞因子与肠道菌群的影响
徐德荣,徐志红,陈磊垚,许立
作者单位:1南京中医药大学附属南京市中西医结合医院药学部,江苏 南京 210014;2南京中医药大学江苏省中药药效与安全性评价重点实验室,江苏 南京210046
溃疡性结肠炎(UC)是由基因易感性人群中肠上皮功能障碍、肠道菌群和肠黏膜免疫应答平衡失调引起的炎症性肠道疾病(IBD)[1-2]。现有药物和疗法有缺陷,氨基水杨酸、单克隆抗体类无法使大部分病人获得临床缓解,而皮质类固醇或免疫抑制剂等药物不良反应过大。因此,急需寻找安全有效的中药治疗UC。
肠道微生物包括细菌、真菌、古细菌、病毒和原生生物,其中细菌负荷量约为3.9×1013,与人体自身细胞数量接近[3]。肠道菌群在肠道蠕动、肠屏障功能、免疫系统成熟和UC 发生中起着至关重要的作用[4]。调整紊乱的肠道菌群可能是UC 治疗的突破口之一。从苦参根中分离得到氧化苦参碱具有抗病毒、抗炎、促进凋亡、抗纤维化、免疫调节、抗肿瘤和心血管保护作用[5-6]。本研究在2022 年1—3 月从抗炎与调整肠道菌群结构切入,探求氧化苦参碱治疗UC的可能作用机制。
1 材料与方法
1.1 试剂与药物氧化苦参碱(Aladdin 公司,批号A111285);葡聚糖硫酸钠(DSS,36–50 kDa,MP 公司,批号S3045);肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-6、IL-1β ELISA 试剂盒(Biolegend 公司,批号分别为B262395、B282759、B293243);5-氨基水杨酸(上海源叶,批号SS0905CA24)。
1.2 仪器全自动酶标仪(美国Thermo);IX71 荧光显微镜(日本Olympus)。
1.3 动物C57BL∕6 小鼠,雌雄:雄性,洁净级别:SPF 级,周龄范围8~10 周,体质量(20±2)g,扬州大学供应。实验动物生产许可证书编号为202008024。室内温度范围20~25 ℃,相对湿度为40%~70%,光照节律12 h∕12 h,自由进食和饮水。本研究符合一般动物实验伦理学原则。
1.4 造模与给药60 只C57BL∕6 小鼠按照随机数字表法分为六组:空白组、模型组、5-氨基水杨酸组(50 mg∕kg)、氧化苦参碱低剂量组(50 mg∕kg)、氧化苦参碱中剂量组(100 mg∕kg)、氧化苦参碱高剂量组(200 mg∕kg),每组10 只。模型组、5-氨基水杨酸组及氧化苦参碱低、中、高剂量组小鼠自由饮用3%DSS溶液连续7 d,建立UC模型。自造模日起,5-氨基水杨酸组及氧化苦参碱低、中、高剂量组按剂量灌胃,每天1 次,连续10 d。每天观察并记录小鼠体质量、观察粪便性状和便血情况。最后一次给药后禁食不禁水。将小鼠脱颈椎处死,取出结肠,挤出结肠部位粪便后放在-80 ℃冰箱冷冻。结肠组织用生理盐水冲洗后,部分用10%福尔马林固定,部分保存在-80 ℃冰箱,以备后续分析。
1.5 结肠炎严重程度评估结肠组织用10%福尔马林固定、脱水、石蜡包埋、切片(4 μm 厚度),然后用苏木精和伊红(HE)染色。根据病变范围、病变深度、隐窝损害程度、炎性细胞浸润情况等评估病理损伤,计算小鼠疾病活动性指数(DAI)[7]。
1.6 ELISA 法检测结肠组织中炎症细胞因子含量取保存于-80 ℃冰箱的小鼠结肠组织,称定50 mg,剪碎后加入10倍量磷酸缓冲盐溶液混合并充分匀浆,3 000 r∕min 离心20 min 后取上清液,参考ELISA试剂盒标准操作规程测定各炎性因子含量。
1.7 肠道菌群分析微生物DNA 提取后,采用焦磷酸测序法检测各组肠道菌群。采用基因通用引物对16S rDNA 基因V3-V4高变区进行PCR 扩增,并根据制造商的说明在Illumina MiSeq 平台进行扩增子焦磷酸测序(美吉生物制药科技有限公司)。
1.8 统计学方法采用SPSS 26.0 统计软件分析,观测资料为计量资料,以表示,均符合正态分布。多组间比较采用单因素方差分析,总体有差异进一步采用LSD-t检验进行两两比较。P<0.05 为差异有统计学意义。
2 结果
2.1 氧化苦参碱缓解DSS诱导的UC空白组小鼠毛发光泽、体质量上升、精神与活动良好、饮水进食与粪便均正常。模型组小鼠毛发粗糙、精神萎靡、慵懒少动。5-氨基水杨酸组和氧化苦参碱各剂量组小鼠造模期间毛发光泽、精神与活动情况、饮水进食量改变,出现稀便、血便等症状。氧化苦参碱各给药组小鼠症状较模型组有所减轻。空白组、模型组、5-氨基水杨酸组、氧化苦参碱低、中、高剂量组的DAI 评分分别为(0.00±0.00)分、(2.63±0.25)分、(0.62±0.06)分、(1.84±0.21)分、(1.56±0.17)分 和(1.08±0.12)分。与空白组比较,模型组小鼠DAI 评分显著升高(F=67.45,P<0.001);与模型组比较,氧化苦参碱低、中、高剂量组小鼠DAI 评分显著降低(F=67.45,P<0.001)。由图1A 可知,与空白组比较,模型组小鼠结肠长度较空白组显著变短(P<0.001);氧化苦参碱中、高剂量组小鼠结肠长度较模型组明显增长(P<0.001)。结肠组织病理学结果显示(图1B),模型组结肠黏膜组织隐窝结构被破坏、杯状细胞减少、炎性细胞浸润明显,模型组病理学评分较空白组明显升高(P<0.001);经氧化苦参碱干预后,结肠组织隐窝结构清晰且炎性细胞浸润减少,氧化苦参碱中、高剂量组小鼠结肠组织病理组织学评分较模型组显著降低(P<0.001)。表明,苦参碱可以较好改善UC小鼠症状,且与剂量呈现明显的相关性。
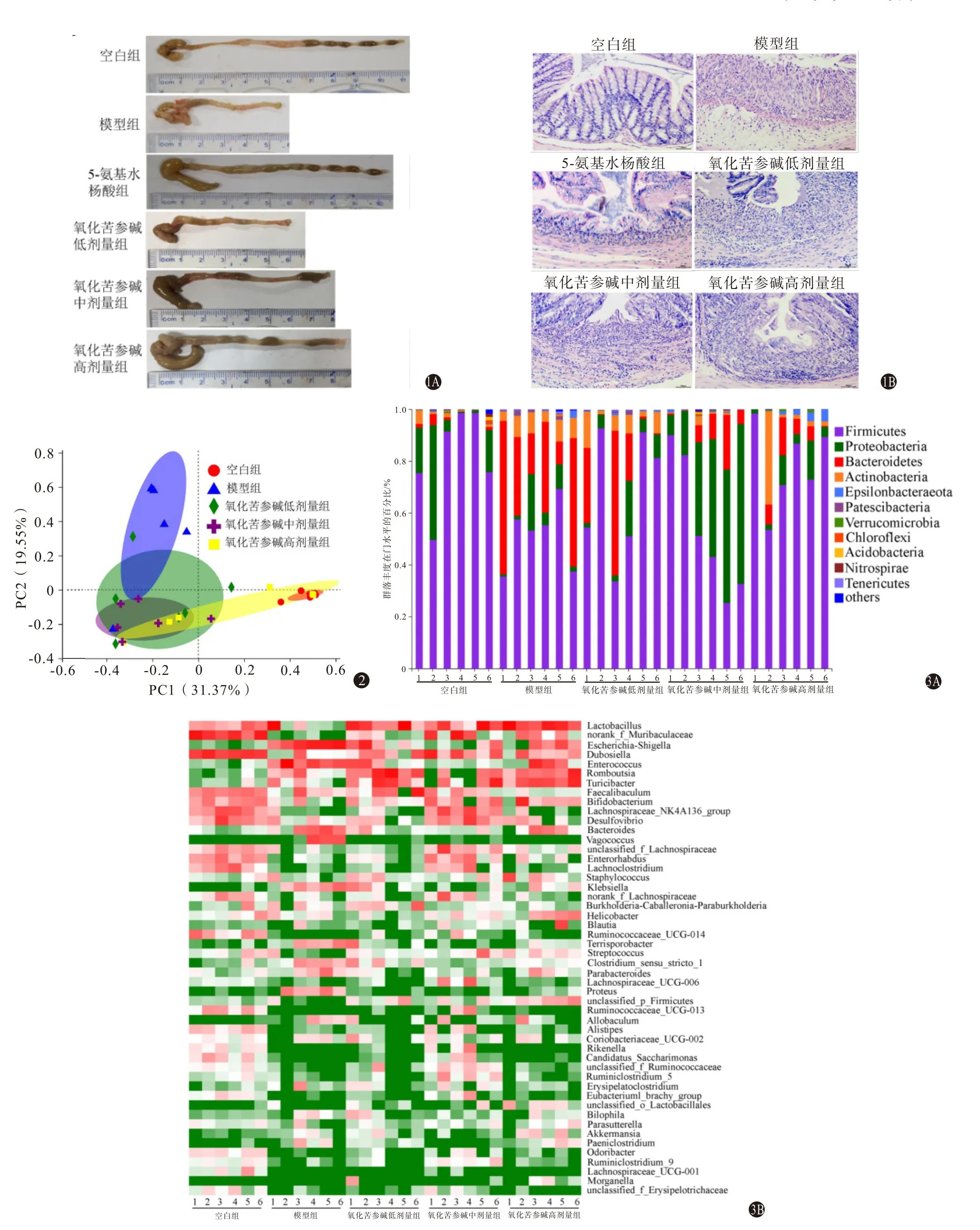
图1 氧化苦参碱对结肠损伤程度的影响:1A为结肠长度;1B为结肠组织切片(HE染色×200)图2 基于物种数丰度的主坐标分析图3 氧化苦参碱对溃疡性结肠炎小鼠肠道菌群在门水平和属水平组成的影响:3A为门水平;3B为属水平
2.2 氧化苦参碱降低UC小鼠体内炎症水平模型组结肠组织中TNF-α、IL-6、IL-1β等炎性因子表达水平均显著大于空白组(P<0.001)。与模型组比较,氧化苦参碱各剂量组显著降低TNF-α、IL-1β 含量(P<0.05,P<0.001)。而在氧化苦参碱各剂量组中,高剂量组显著降低UC 小鼠结肠组织中IL-6 含量(P<0.05,P<0.001)。见表1。
表1 各组小鼠中氧化苦参碱降低TNF-α、IL-6、IL-1β等炎性因子含量比较∕(ng∕g,)
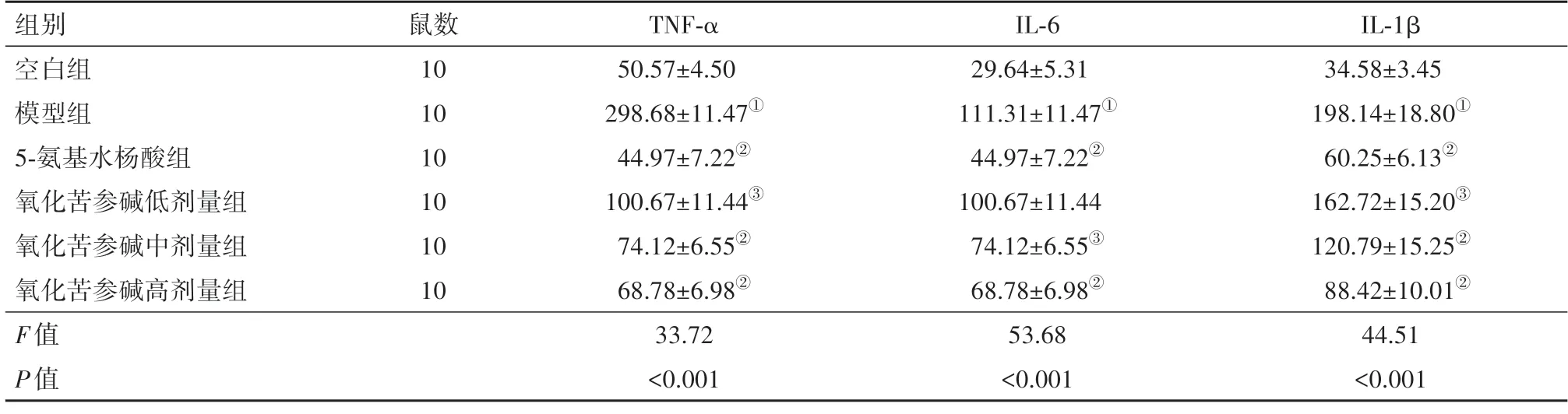
表1 各组小鼠中氧化苦参碱降低TNF-α、IL-6、IL-1β等炎性因子含量比较∕(ng∕g,)
注:TNF-α为肿瘤坏死因子α,IL-6为白细胞介素-6,IL-1β为白细胞介素-1β。①与空白组比较,P<0.001。②与模型组比较,P<0.001。③与模型组比较,P<0.05。
2.3 肠道菌群alpha多样性分析本测序对物种的覆盖度均大于99%(Coverage 指数),说明测序几乎涵盖所有序列。模型组群落多样性(Sobs 指数、Shannon 指数)及物种丰富度(Chao 指数)较空白组显著降低(P<0.001)。氧化苦参碱可以增加UC 小鼠肠道群落多样性及物种丰富度,具体见表2。
表2 各组小鼠肠道菌群alpha多样性指数∕
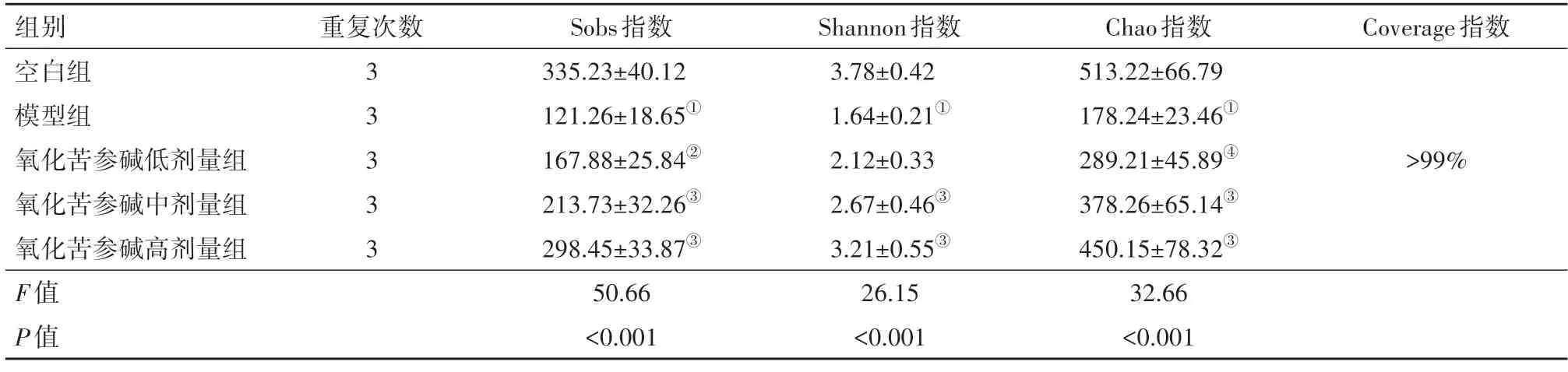
表2 各组小鼠肠道菌群alpha多样性指数∕
注:①与空白组相比,P<0.001。②与模型组相比,P<0.05。③与模型组相比,P<0.001。④与模型组相比,P<0.01。
2.4 样本比较分析由图2 可知,模型组与空白组样本之间距离较远,而且没有交集,所以模型组与空白组小鼠肠道菌群组成差异有统计学意义;氧化苦参碱各给药组随着剂量增加逐渐接近空白组,且明显近于模型组,表明氧化苦参碱可以调整UC 小鼠肠道菌群组成,使其朝着健康状态逐渐转化。
2.5 物种组成分析Firmicutes和Bacteroidetes是两个最重要的细菌门类,它们丰度之和占61.4%~85%。在模型组中,Proteobacteria丰度升高,而Actinobacteriota丰度、Firmicutes和Bacteroidetes丰 度比降低,说明UC 小鼠的肠道菌群发生紊乱。氧化苦参碱给药后,与模型组相比,Firmicutes和Bacteroidetes丰度比显著提高,Proteobacteria丰度降低,Actinobacteriota丰度升高(图3A)。共检测到50 个细菌属类。模型组较空白组Lactobacillus、Bifidobacterium和Akkermansia丰度显著降低,Escherichia-Shigella、Desulfovibrio、Blautia、Parasutterella、Turicibacter和Bacteroides丰度显著升高。氧化苦参碱给药后,与模型组相比,Lactobacillus、Bifidobacterium和Akkermansia丰度显著升高,Escherichia-Shigella、Desulfovibrio、Blautia、Parasutterella、Turicibacter和Bacteroides丰度显著降低(图3B)。
2.6 物种差异分析通过前期研究,氧化苦参碱高剂量组对UC 小鼠体质量、DAI、HE、病理组织学评分、促炎细胞因子含量的改善效果最好。因此,选择高剂量组为代表做肠道菌群部分的物种差异分析。在门水平上,Proteobacteria、Bacteroidetes、Actinobacteria、Patescibacteria在空白组、模型组、氧化苦参碱高剂量组小鼠之间差异有统计学意义(P<0.05)。在属水平上,Lactobacillus、Escherichia-Shigella、norank_f_Muribaculaceae、Enterococcus、Dubosiella、Turicibacter、Romboutsia、Bifidobacterium、Bacteroides、Faecalibaculum、Vagococcus、Lachnospiraceae_NK4A136_group、Lachnoclostrium、Enterorhabdus、Klebsiella在空白组、模型组、氧化苦参碱高剂量组小鼠之间差异有统计学意义(P<0.05)。见表3,4。
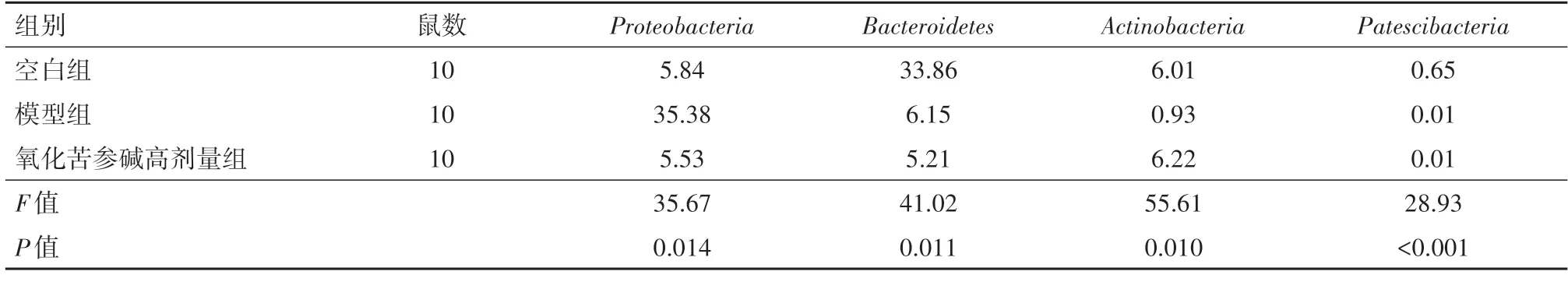
表3 采用焦磷酸测序法检测各组小鼠肠道菌群在门水平物种差异∕%
3 讨论
DSS 能够破坏肠道黏膜屏障功能,从而使细菌接触到肠固有层细胞[8-9]。DSS 还会引起严重的病理损伤,如炎性细胞浸润、结肠组织结构破坏[10]。我们使小鼠自由饮用3%DSS水溶液建立UC 小鼠模型,探讨氧化苦参碱是否可以改善疾病症状以及对炎性因子和肠道菌群结构的影响。
IBD 是一种自身免疫性疾病,过量的源于免疫细胞的炎性因子可引起黏膜损伤及持续的炎症反应。TNF-α可促进IL-1β和IL-6的产生、成纤维细胞的增殖、黏附分子的表达、促凝因子的激活和急性反应的激发[11]。TNF-α高表达可能导致黏膜屏障功能障碍,引发严重炎症反应[12]。IBD 中IL-1β表达的增加可能是由于巨噬细胞激活IL-1β 转化酶,从而释放成熟的IL-1β 到结肠黏膜[13]。IL-6 是典型的促炎因子,主要由巨噬细胞产生,在炎症反应的急性期分泌。UC 病人的血清和组织活检中发现IL-6 增加[14]。本研究结果与已有文献报道结果一致:UC模型组中TNF-α、IL-1β、IL-6 三种炎症细胞因子水平较空白组显著增加[15]。通过对TNF-α、IL-1β、IL-6等炎性因子的测定,发现氧化苦参碱对炎性因子呈现不同程度的抑制作用。
人类肠道内微生物数量庞大,被称为“人体器官”或“人类第二基因组”[16]。目前,已知的细菌门类有52 种,其中5~7 种细菌门类存在于哺乳动物的胃肠道中。虽然优势菌门相对较少,但据估计,超过1 000 种细菌的基因数量是宿主基因的150 多倍[17]。这一庞大的微生物群为宿主提供了互补的遗传资源,如必需维生素的生产、获取能量的途径、免疫系统的发育和肠道的成熟。我们发现,在门水平上,各组别的主要菌群均是Firmicutes和Bacteroidetes,其次为Actinobacteriota和Proteobacteria,与Cui 等[18]、陶金华[19]的研究结果一致。在UC 病人中发现,有益菌降低且有害菌增加[20]。有研究表明,Bifidobacterium可以降低肠道内环境pH,阻止腐败菌、病原菌生长,维持肠道屏障功能,降低肉毒素侵入血液[21]。UC 小鼠经氧化苦参碱干预后,Bifidobacterium相对丰度增加。DSS 干预后的小鼠肠道菌群中Lactobacillus相对丰度呈下降趋势,氧化苦参碱干预后具有上升趋势,且Lactobacillus可以促进乳酸的生成,有益于人体消化吸收碳水化合物,降低肠道内环境pH,抑制有害菌黏附于肠上皮,刺激产生免疫球蛋白,增强宿主免疫力[22]。Wang 等[23]证实DSS 诱导的UC 小鼠肠道中Bacteroides相对丰度增加,且Bacteroides损害肠道免疫系统。我们亦发现,模型组中Bacteroides相对丰度增加,经氧化苦参碱干预后降低。由此可见,氧化苦参碱可有效增加益生菌含量,抑制致病菌生长,调节肠道菌群结构。

表4 采用焦磷酸测序法检测各组小鼠肠道菌群在属水平物种差异∕%
肠道菌群失调与UC 密切相关,但是肠道微生态与UC 的关系尚不完全明确。我们从肠道微生物角度入手,探索氧化苦参碱对UC 小鼠肠道菌群结构组成的影响,发现氧化苦参碱对UC 小鼠肠道菌群多样性与结构的调节作用与其对UC 的治疗作用呈现相关性。但是,肠道菌群结构的改变是氧化苦参碱治疗UC 的途径还是结果,目前尚不能得出结论。我们将进一步结合多组学技术从肠道菌群角度深层次探究氧化苦参碱治疗UC的作用机制。
(本文图1~3见插图6-5)

