基于网络药理学和分子对接技术探讨十九畏药对“郁金-丁香”抗肝纤维化作用机制
汪居安,王居义,蔡叶,,李幸蓉,,吴凌,4,伊艳敏,4,檀啸,王继洲
作者单位:1中国科学技术大学附属第一医院肝胆外科,安徽 合肥 241002;2皖南医学院临床医学院,安徽 芜湖 230001;3安徽中医药大学中医学院,安徽 合肥 230038;4安徽理工大学医学院,安徽 淮南232001
肝纤维化(liver fibrosis,LF)是肝脏细胞外基质过度异常增生的病理过程,是多种慢性肝病向肝硬化进展的关键步骤,是所有慢性肝病的共同病理基础[1-2]。郁金配伍丁香属中药“十九畏”之一(丁香莫与郁金见),然而长期以来,“十九畏”同方配伍的禁忌争议不断,团队通过文献综述发现郁金配伍丁香常用于治疗消化系统疾病,多有奇效[3],中药郁金具有疏肝利胆、活血止痛的功效,其抗肝损伤、抗纤维化的确切作用已得到验证[4-6],然而二药配伍治疗肝脏疾病却罕见文献报道。为此,本实验组前期通过初步动物实验发现:郁金单用或合用丁香均能通过消除自由基和减轻炎症反应干预纤维化,且丁香能够增强郁金抗炎和抗纤维化的能力。为进一步深入挖掘郁金-丁香药对抗肝纤维化的分子机制,本研究通过网络药理学的方法对二药合用抗肝纤维化的可能机制进行预测,以期为十九畏内涵的丰富及二药临床同用提供依据。
1 材料与方法
1.1 郁金-丁香药对活性成分及靶点的获取于2022 年1 月8 日基于中药系统药理学分析平台(TCMSP,http:∕∕lsp.nwu.edu.cn∕tcmsp.php)数据库筛选郁金和丁香的活性成分,通用筛选条件为口服药物生物利用度(OB)≥30%和类药性(drug-likeness,DL)≥0.18[7],因本研究所选中药仅两味,且按前述条件进行筛选所得活性成分过少,不利于研究,故适当降低筛选条件,以OB≥15%和DL≥0.15 进行成分筛选。去除重复后,即得到主要活性成分。同时通过TCMSP 平台对筛选出的活性成分进行靶点预测,去重后得到相关靶蛋白,将相关靶蛋白通过Uniprot数据库(http:∕∕www.uniprot.or-g),以“Organism=Homo sapiens(Human)、Reviewed”为前提,并剔除无对应基因名的靶蛋白,获取对应的基因名。
1.2 郁金-丁香药对治疗肝纤维化潜在靶点与活性成分获取以“liver fibrosis”为检索词在GeneCards数据库(https:∕∕www.genecards.org∕),NCBI 基因数据(https:∕∕www.ncbi.nlm.nih.gov∕)以 及OMIM 数据库(https:∕∕www.omim.org∕)进行人类基因检索。其中,GeneCards 数据库所获得的靶点依据中位值进行得分的筛选,以获得更加相关的疾病靶点。将筛选得到的郁金、丁香活性成分候选基因靶点与LF候选基因靶点输入作图软件Venny 2.1 中,绘制郁金、丁香候选靶点与LF候选靶点的韦恩图,两者交集部分即为治疗郁金-丁香药对治疗肝纤维化的潜在作用靶点,潜在靶点所对应的活性成分即郁金-丁香药治疗肝纤维化的潜在活性成分。
1.3 药物-活性成分-靶点网络构建为了更好的理解成分、疾病以及相应靶点之间的复杂作用关系,将药物、疾病、潜在活性成分以及潜在作用靶点导入Cytoscape 3.8.2 软件,构建药物-活性成分-靶点网络,同时应用软件自带的“Network analyzer”插件对化学成分进行拓扑分析,其度值越大提示该节点在网络中越重要。
1.4 靶点蛋白-蛋白相互作用(PPI)网络构建将潜在作用靶点输入STRING 数据库(http:∕∕string-db.org∕cgi∕input.pl∕)的Multiple proteins 中,将Organism选择为Homo Sapiens,最小交互打分值设置为0.4,隐藏网络中离散的节点。最后将得到的数据以TSV格式导出并导入Cytoscape 3.8.2 软件中,设置节点大小及颜色反应度值,最终得到PPI 网络图。同时进行网络拓扑结构分析,筛选度值靠前的靶点作为核心靶点。
1.5 靶点功能通路分析及靶点-通路网络图的构建将潜在靶点输入Metascape(http:∕∕metascape.org∕)数据库,选择个性化分析,设置P<0.05,最小计数为3,富集因子>1.5,进行基因本体(Gene-Ontology,GO)富集分析,选择生物过程(BP)、分子功能(MF)和细胞组成(CC)3个部分。利用David 数据库(https:∕∕david.ncifcrf.gov∕)进行京都基因与基因组百科全书(KEGG)通路分析。
1.6 分子对接采用PubChem(https:∕∕pubchem.ncbi.nlm.nih.gov∕)数据库确定活性成分的化合物名称、分子量和2D 结构,采用RCSB PDB 数据库(http:∕∕www.rcsb.org∕)下载靶点蛋白的3D 结构。利用AutoDock软件(http:∕∕vina.scripps.edu∕),准备分子对接所需的化合物配体和蛋白质,对于目标蛋白,其晶体结构需预处理,包括去除原配体与水分子、加氢、修饰氨基酸、优化能量和调整力场参数,最后将处理后的靶点蛋白与活性成分进行分子对接,并对结合力高的组别使用PYMOL软件作图。
2 结果
2.1 活性成分及靶点筛选结果二药去除重复活性成分后,得到主要活性成分44 个,其治疗肝纤维化潜在活性成分12 个,详见表1。同时通过TCMSP平台对筛选出的44个活性成分进行靶点预测,去重后共得到209个相关靶蛋白,将相关靶蛋白通过Uniprot 数据库获取对应基因,剔除无对应基因名的靶蛋白,共获取对应基因200个。
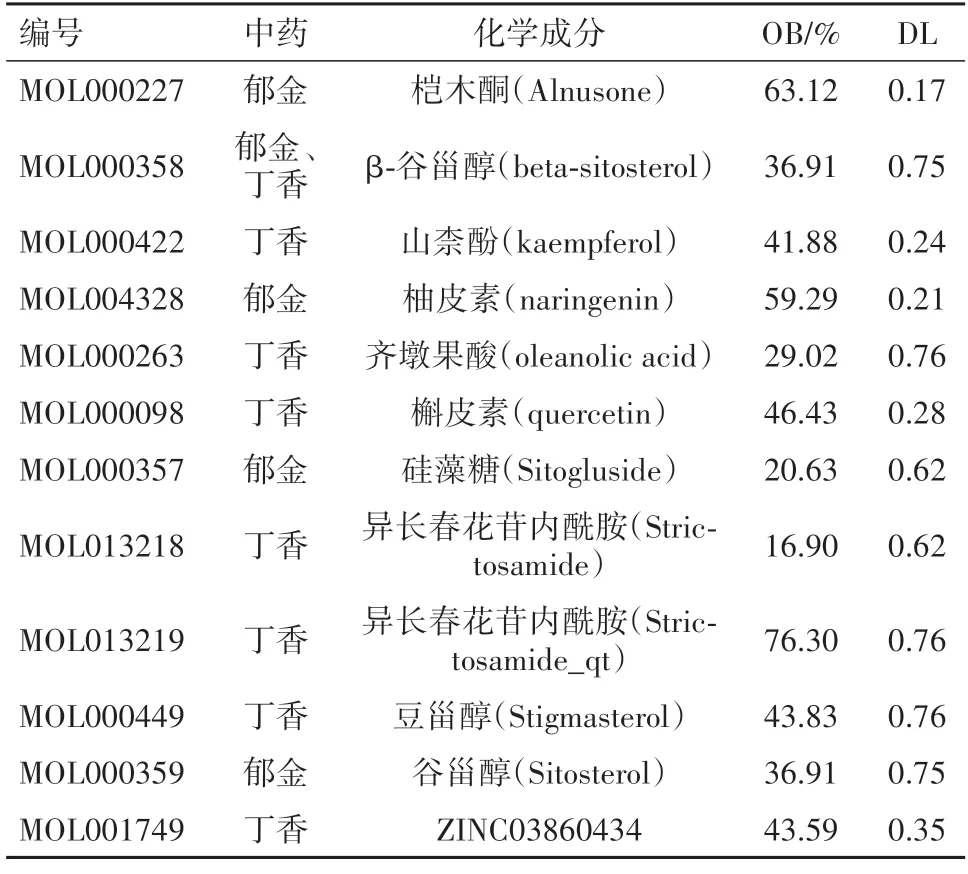
表1 郁金-丁香药对治疗肝纤维化的潜在活性成分
2.2 抗肝纤维化靶点筛选结果经检索,Gene-Cards数据库获得3 888个相关靶点;NCBI数据库获得369 个相关靶点;OMIM 数据库获得54 个靶点。将这3个数据库的基因合并删重之后,得到3 951个疾病相关基因。与郁金-丁香药对活性成分的200个基因取交集,得到共同靶点155 个,即郁金-丁香药对主要通过作用于这些共同靶点起到抗肝纤维化的作用。
2.3 药物-成分-靶点网络分析将中药、中药活性成分、关键靶点导入Cytoscape软件,构建药物-成分-靶点网络,见图1,其中黄色代表中药,蓝色代表成分,绿色代表疾病,红色代表靶点。该网络有169个节点,433 条边,其中,槲皮素、山柰酚、柚皮素、β-谷甾醇4种活性成分度值最高,分别为125,46,31,22,在郁金-丁香药治疗LF 中,推测上述成分可能发挥主要作用。
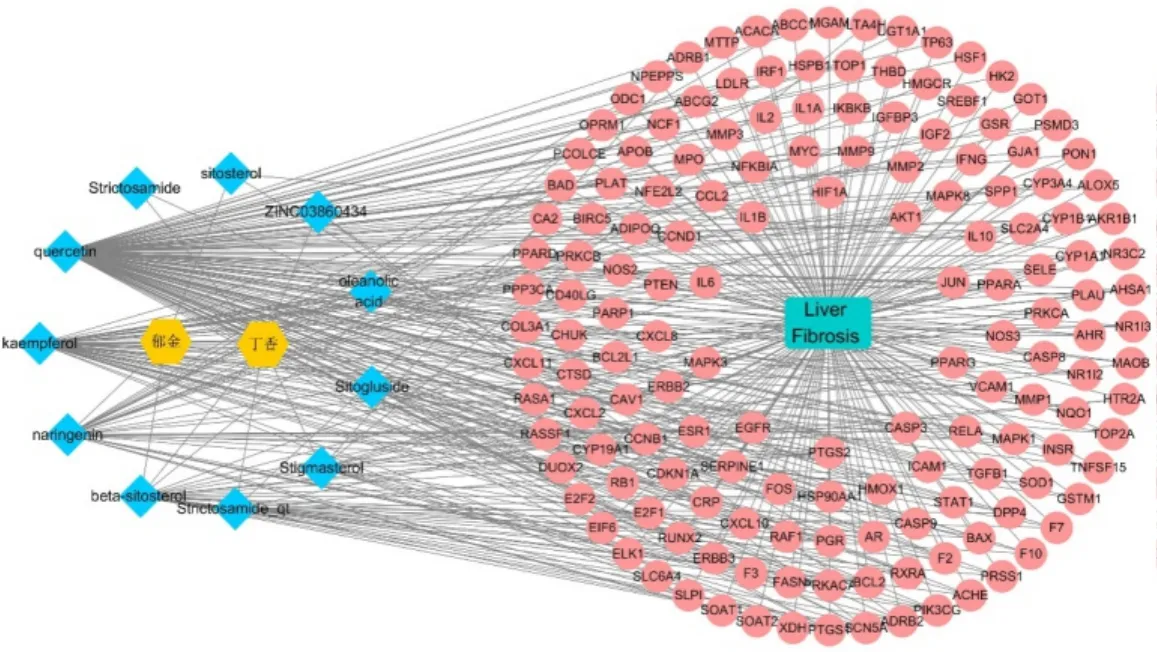
图1 郁金-丁香药对治疗肝纤维化的药物-成分-靶点网络模型
2.4 PPI 网络分析及关健靶点获取PPI 网络图见图2。节点为靶蛋白,边为两个蛋白相连,该网络中共有155 个节点,2 689 条边,平均度值为34.7。节点颜色和大小根据度值调整,度值越大,颜色越红,连线越粗。其中度值排名前十的分别为蛋白激酶B1(AKT1)、白细胞介素(IL)-6、IL-1β、牛胱天蛋白酶3(CASP3)、肉瘤病毒17 癌基因(JUN)、丝裂源活化蛋白激酶3(MAPK3)、人表皮生长因子受体(EGFR)、缺氧诱导因子1A(HIF1A)、过氧化物酶体增生激活受体(PPARG)、前列腺素过氧化物合酶2(PTGS2),推测主要通过影响这些靶点起到抗LF作用。

图2 郁金-丁香药对靶蛋白-蛋白相互作用(PPI)网络图
2.5 分子对接验证分子对接是用以评价关键活性成分与关键靶点蛋白结合能力的方法,Binding Affinity(kJ∕mol)值代表接配体与受体结合的能力,结合能小于0 提示二者可能自发结合,结合能小于-5 kJ∕mol 时提示二者可较稳定结合,且结合能数值越低,配体与受体结合越稳定,小分子化合物越易与蛋白质发生相互作用。对4个关键活性成分槲皮素、山柰酚、柚皮素、β-谷甾醇和4 个关键靶点AKT1、IL-6、IL-1β、CASP3 进行分子对接,分子对接结果见表2。对接结果表明上述成分与靶点的结合能均明显低于-5 kJ∕mol,对接紧密,证明了筛选结果可靠。使用PYMOL 软件对结合力最高的前四组作图,其结合模型见图3。
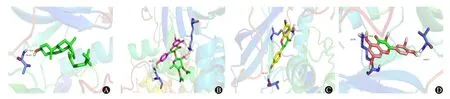
图3 郁金-丁香药对治疗肝纤维化的活性成分与靶点相互作用的分子对接示意图:A为蛋白激酶B1与β-甾谷醇;B为蛋白激酶B1与山奈酚;C为蛋白激酶B1与柚皮素;D为蛋白激酶B1与槲皮素
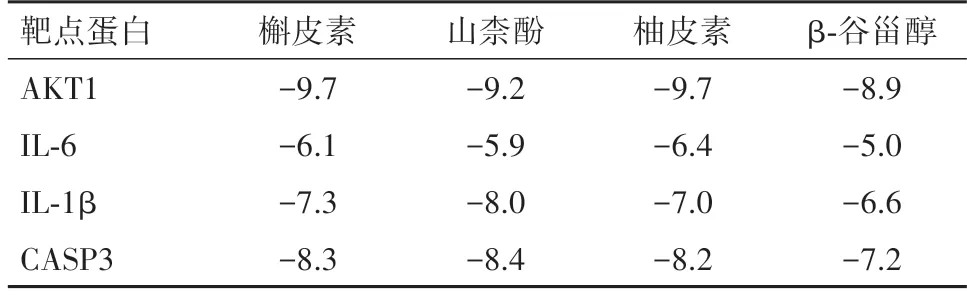
表2 郁金-丁香药对治疗肝纤维化的关键靶点及对应关键活性成分分子对接结果∕(kJ∕mol)
2.6 GO 富集与KEGG 通路富集结果155个潜在靶点经GO 富集至1 889条生物学过程、44条细胞组分表达和94 个分子功能相关的过程(P<0.05)中,GO 富集见图4(每组分选择P值排名前十)。KEGG信号通路分析富集获取信号转导通路143 条(P<0.05),包括乙肝通路、癌症通路、肿瘤坏死因子通路等,取P值排名前20的通路绘制成气泡图见图5。
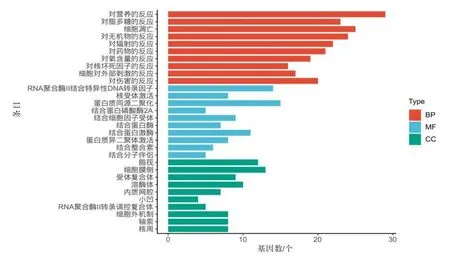
图4 郁金-丁香药对治疗肝纤维化的潜在靶点基因本体(GO)富集分析
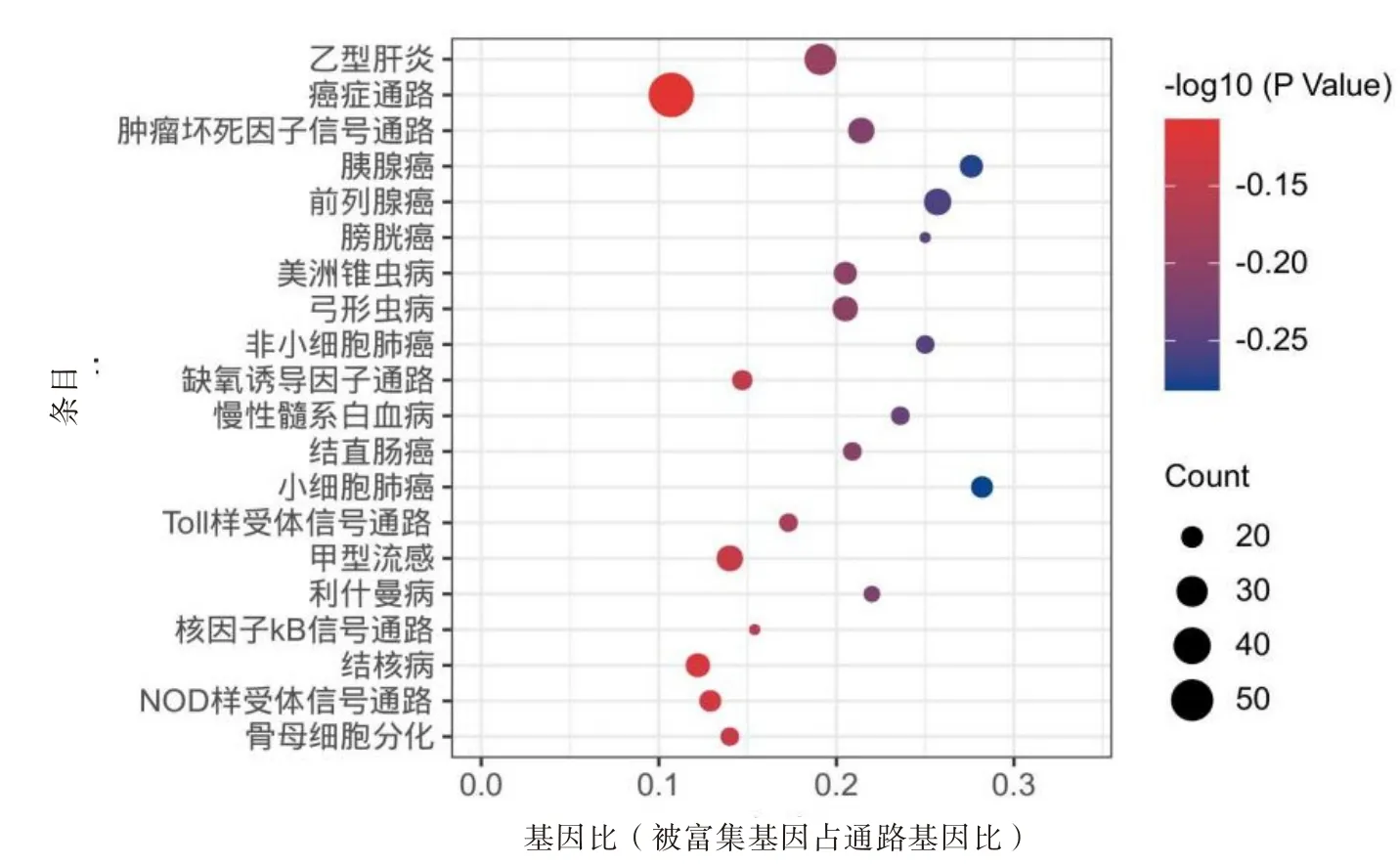
图5 郁金-丁香药对治疗肝纤维化的潜在靶点京都基因与基因组百科全书(KEGG)代谢通路
3 讨论
3.1 中医学分析丁香为桃金娘科植物丁香的干燥花蕾[8],性辛、温,归脾、胃、肺、肾经,温中降逆,补肾助阳,主治脾胃虚寒、呕吐呃逆、食少吐泻[8]。郁金性辛、苦、寒,归肝、心、肺经,行气化瘀,清心解郁,利胆退黄,主治胸腹胀痛、经闭痛经、黄疸癫狂[9]。丁香、郁金二药相畏使用首见于明代刘纯《医经小学》“十九畏”[10],因其药性乖违,一寒一热,一走一守,有夺彼功效,相互拮抗之嫌,故被选列为相畏的配伍禁忌。然而,考历代本草方书,明以前的重要著作如《神农本草经》《本草拾遗》《经史证类备急本草》《千金要方》《太平惠民合剂局方》《普济方》等均无“十九畏”和丁香、郁金二药相畏的记载。胡方媛等通过数据挖掘检索中国知网(CNKI)和《中医方剂大辞典》发现,丁香-郁金同方配伍的古代方剂有41首,现代方剂更是有231首[11]。如清代孟文瑞《春脚集》中十香返魂丹[12]主治痰厥中风方中丁香温肾化痰,郁金开窍醒神,又加之二药芳香,同苏合香、沉香、安息香等十味芳香药物共奏芳香醒神、开窍救昧之功。再如清代孟河名医费伯雄《医醇剩义》中桂朴汤[13]亦以丁香、郁金同伍,郁金下气止痛以宽中,丁香温中散寒以止呕,共治胃气虚寒之呕吐作痛。由此可见,郁金-丁香的配伍古皆有之,无论是从古代文献还是现代临床应用方面,均可以发现丁香、郁金同方配伍深具中医学“相反相成”“辨证论治”“法随证立”“反激逆从”的配伍特点。
肝纤维化属于中医学“肝积”“瘕积”“胁痛”等范畴,气滞血瘀、肝脾失调是重要的临床病机[14]。从功效上来说,丁香治冷气腹痛(《药性论》),止心腹痛(《海药本草》),温中快气,除上焦呃逆,七情五郁(《本草正》);郁金主血积(《唐本草》),治阳毒入胃(《兰室秘藏》),治冷气血积,结聚气滞,心腹作痛(《本草正》),故二药均可治疗心腹疼痛、气血郁结之证。从气味理论来说,丁香偏温偏补偏守,郁金偏寒偏泄偏走,二药通过合理的配伍,使得寒热并用,泻补相合。从“苦欲补泻”来看,《素问·藏气法时论》言“肝欲散,急食辛以散之,用辛补之”“脾苦湿,急食苦以燥之……脾欲缓,……用苦泻之”,郁金味苦以泻脾燥湿,丁香味辛以散肝补肝,二药性味以适肝、脾二脏之性,故而郁金-丁香药对的配伍,即可调和肝脾,以郁金为主药,丁香发挥佐使药“向导佐助”之功,以行气血瘀滞,并温脾胃元阳,从而达到较好的助阳化瘀,疏肝行气之效。
3.2 网络药理学分析本次网络药理学研究共纳入活性成分12种,根据药物-成分-靶点网络拓扑分析结果,郁金-丁香药对治疗肝纤维化的核心成分为槲皮素、山柰酚、柚皮素、β-谷甾醇。槲皮素能降低血清炎性因子IL-6、肿瘤坏死因子-α(TNF-α)和IL-1 水平,抑制α-肌动蛋白和Ⅰ型胶原蛋白表达起到阻止肝纤维化进展和保肝的作用[15];山柰酚可下调转化生长因子TGFβ1∕Smads 通路,并在体内外抑制肝星状细胞活化和胶原合成,有效减轻肝纤维化形成[16];柚皮素可显著逆转大鼠血液中的肝酶和促炎细胞因子,减轻肝损伤和肝纤维化[17];β-谷甾醇可减轻四氯化碳诱导肝纤维化大鼠的急慢性肝损伤[18]。
通过网络药理学和拓扑分析,本研究预测AKT1、IL-6、IL-1、JUN、MAPK3、EGFR、HIF1A 等为郁金-丁香药对抗肝纤维化的潜在核心靶点。AKT1是一种丝氨酸∕苏氨酸激酶,参与调节细胞生长、存活和增殖[19],转化生长因子-β1(TGF-β1)调节肌成纤维细胞中的AKT1 活化,抑制AKT1 可减少TGF-β 1 诱导的纤维化[20]。IL-6 是趋化因子家族中的一种细胞因子,在人群中发现其与肝硬化的严重程度呈正相关[21]。IL-1已被认为是慢性肝病炎症和组织损伤的重要介质[22],与脂肪变性转化为脂肪性肝炎和肝纤维化密切相关[23]。激活蛋白1(AP-1)是一种二聚体转录因子,由JUN和FOS组成[24],与肝纤维化密切相关,TGF-β1 的基因转录是AP-1 依赖性的,抑制AP-1可有效抑制肝纤维化[25-26]。实验已证明靶向抑制MAPK3 可减弱四氯化碳诱导的肝纤维化[27]。表皮生长因子受体EGFR 是一种跨膜受体酪氨酸激酶,其高表达与肝损伤、肝纤维化和肝细胞肝癌密切相关[28]。通过GO 富集分析可推测,这些关键靶点主要在脂筏、受体复合物、内质网腔等部位发挥作用,并通过对营养和脂质的应答、细胞凋亡、氧水平应答等生物过程,发挥RNA 聚合酶Ⅱ结合特异性DNA 转录因子、蛋白磷酸酶2A 结合、细胞因子受体结合等分子功能。
KEGG 通路富集分析表明,郁金-丁香药对可能通过影响TNF 信号通路、HIF-1 信号通路、Toll 样受体信号通路、核因子κB信号通路等干预肝纤维化的发生。TNF-α 是LF 重要的介质之一,可作为直接刺激源使HSC 活化并激活肿瘤坏死因子1∕2 型受体(TNFR1∕2),启 动TNF 通路的下游转导并激活MAPK、核因子κB 等其他促LF 途径启动或加速LF的进程[29],本研究显示,郁金-丁香药对可能通过靶向作用于AP-1、核因子κB、JNK、AKT 等蛋白调控TNF 通路干预肝纤维化的过程。在肝脏受损时,核因子κB的抑制蛋白IKB磷酸化后被降解,通过经典与非经典途径启动信号转导,在LF 的免疫、炎症以及氧化应激等病理生理过程中起明显作用[30],本研究显示,郁金-丁香药对可能通过靶向作用于IL-1、IKB、KB抑制因子激酶(IKK)等靶蛋白,抑制转导的发生。Toll 样受体(TLRs)属于模式识别受体家族,TLR2 信号转导与肝脏炎症、LF 和肝硬化的发生与进展密切相关[31],本研究显示,郁金-丁香药对可能通过靶向作用于AKT、ERK、JUK 等靶蛋白达到干预肝纤维化的作用。HIF-1α 在缺氧与代谢紊乱时可过表达,通过调节TGF-β1、VEGF、核因子κB 等HSC活化介质,参与肝纤维化的形成[32],本研究显示,郁金-丁香药对可能通过靶向作用于HIF-1α 等靶蛋白,影响活化介质的信号调控过程,达到抗肝纤维化的作用。
综上所述,本研究从中医理论和网络药理学方面对郁金-丁香药对治疗LF 的可能机制进行了阐述,郁金-丁香药对是通过多种活性成分作用于多靶点、多途径、多通路起到干预LF的功效,为进一步的实验研究提供了理论依据,也为郁金丁香同方配伍内涵的进一步探索及其临床应用提供了参考和思路。未来团队将从上述关键靶点与关键活性成分的结合以及关键疗效通路出发,对二者治疗肝纤维化的作用进行更多的实验研究。
(本文图1,2见插图6-1;图3~5见插图6-2)

