基于计算机模拟的丹参中黄酮类化合物抗肿瘤活性筛选
蒯振彧,朱正飞,曾宣,陈泓蓉
作者单位:马鞍山职业技术学院药学教研室,安徽 马鞍山243031
丹参是唇形科鼠尾草属植物,又名赤参,紫丹参,红根等,为常见中药,有“一味丹参,功同四物”之说,历代本草皆有收载,味苦,性微寒,归心、肝经。具有活血调经,祛瘀止痛,凉血消痈,清心除烦,养血安神等功效[1]。现代药学研究表明丹参中主要含有丹参酮类[2]、丹酚酸类[3]、挥发油[4]等化学成分,具有保护心血管、抗心律失常、抗炎、抗氧化、抗肿瘤等药理作用[5]。近年来体外药理实验发现丹参中黄酮类化合物如丹参酮Ⅰ、ⅡA、Ⅵ、隐丹参酮、异隐丹参酮等抗肿瘤活性[6-7],其中丹参酮ⅡA 的作用机制研究的较为深入,具有诱导肿瘤细胞凋亡[8],抑制肿瘤细胞迁移[9],抑制肿瘤细胞增殖[10]等作用。研究表明,丹参类制剂临床上联合放化疗治疗,在增加抗肿瘤疗效的同时能够减轻放化疗产生的毒副反应,改善病人生活质量,延长生存期[10-13]。
目前对于丹参黄酮类的化合物主要集中在提取分离和单体分子的体外活性实验,抗肿瘤作用机制的研究不够系统。分子对接通过模拟候选药物与靶点蛋白的结合,分析作用机制,预测结合模式,促进了药物设计和新药研发的效率[14-16]。本研究于2021 年12 月至2022 年3 月利用对接模拟预测活性分子与靶点蛋白结合能力,Lipinski五法则及一系列ADMET(吸收,分布,代谢,排泄,毒性)特性对化合物进行类药性分析,为天然药物丹参中活性成分的筛选以及抗肿瘤药物的研发提供参考及线索。
1 资料与方法
1.1 资料来源中药系统药理学数据库与分析平台(TCMSP,Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,网址:http:∕∕tcmspw.com∕tcmsp.php)和TCM@TAIWAN(网址:http:∕∕tcm.cmu.edu.tw∕)数据库;有机小分子生物活性数据库(PubChem,网址:https:∕∕pubchem.ncbi.nlm.nih.gov);蛋白质数据库(PDB,Protein Date Bank,网 址:https:∕∕www1.rcsb.org);Sybyl-X 2.1 软件;Molegro Virtual Docker(MVD)软件;Discovery Studio 2019 Client软件。
1.2 方法
1.2.1小分子配体准备 在TCMSP 和TCM@TAIWAN数据库中搜索关键词“丹参”,选择丹参黄酮类分子,从PubChem 数据库下载相应sdf 格式的化合物,并采用Chem 3D 软件中Calculations 程序对所有分子进行Minimize Energy 力场优化后完成mol2 格式转换,建立此次分子对接的小分子化合物库,配体信息见表1。

表1 丹参黄酮类对接的配体分子信息
1.2.2受体蛋白优化处理 根据文献[15,22-24],选择了20个肿瘤相关的靶点蛋白作为受体,从PDB数据库中下载相应蛋白结构,以pdb结构保存,蛋白信息见表2,利用Sybyl-X 2.1软件Application模块中Docking suite 对靶蛋白进行去水,加氢等蛋白结构优化处理,根据靶点蛋白自身配体生成对接空腔位点口袋。
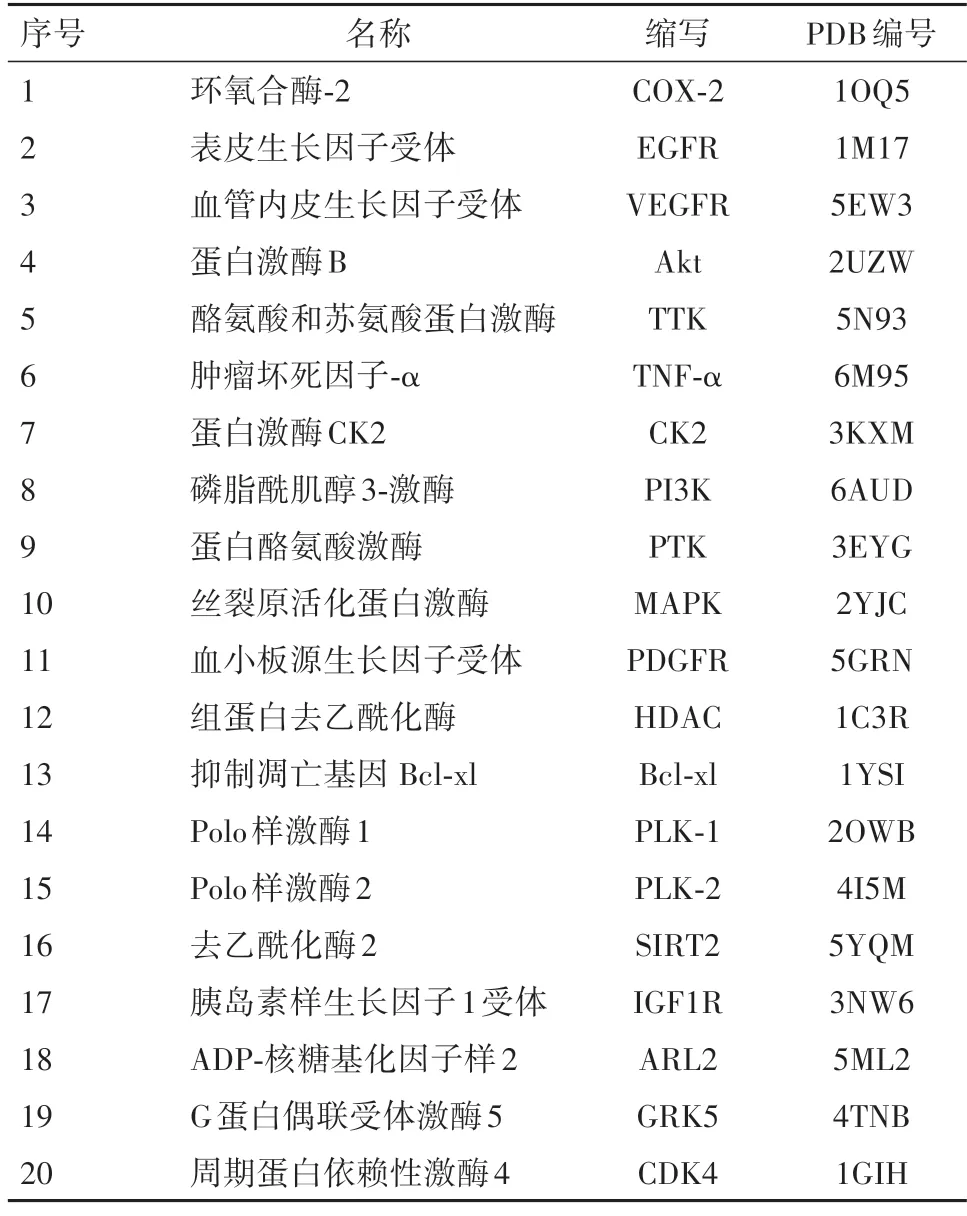
表2 与丹参黄酮类分子对接受体蛋白信息
1.2.3分子对接 利用Sybyl-X2.1 软件Surflex-dock模块,以23 个丹参黄酮类化合物分子为配体,20 个抗肿瘤靶点蛋白为受体进行分子对接,以打分函数Total Score 为评价标准小分子配体与靶点蛋白的相互结合作用,Total Score 分数高低反应了配体与受体的结合能力大小,该函数计算综合考虑了极性作用、疏水作用、焓和熔剂化等因素,该数值越大,表明小分子配体与大分子靶点蛋白的匹配结合活性较好,亲和力较大。
1.2.4类药性筛选 根据Lipinski五法则,使用Discovery Studio 2019 Client 的Filter by Lipinski 模块进行类药性预筛选评估,预测氢键受体和供体的数量、油水分配系数(LogP)、分子量(MV)和极性表面积等属性。
1.2.5基于计算机模拟的药动学和毒性研究 将筛选出的与靶点蛋白结合力强的化合物进行ADMET预测,采用Discovery Studio 2019 Client 软件中small molecules 模块中ADMET descriptors 进行参数设置,对化合物的吸收、分布、代谢、排泄和毒性进行预测。
1.2.6对接分析与图像处理 采用Discovery Studio 2019 Client 软件中Receptor-Ligand Interactions模块对Total Score>7[17]的分子对接的结果进行分析,并制作对接图。
2 结果
2.1 分子对接结果将19 个丹参中黄酮类小分子配体与20 个肿瘤靶蛋白进行结合评估,打分函数Total Score 显示数值提示,红根草邻醌与肿瘤坏死因子-α(TNF-α),硫草酮与Polo样激酶1(PLK-1),鼠尾酮与胰岛素样生长因1 受体(IGF1R),二氢丹参酮Ⅰ与ADP-核糖基化因子样2(ARL2),异丹参酮Ⅱ与酪氨酸和苏氨酸蛋白激酶(TTK)结合最好,新隐丹参酮与表皮生长因子受体(EGFR)、周期蛋白依赖性激酶4(CDK4),丹参酮ⅡA 与丝裂原活化蛋白激酶(MAPK),丹参酮Ⅵ与血小板源生长因子受体(PDGFR)的Total Score>7,说明结合作用较强。丹参中黄酮类小分子配体与靶蛋白对接结果,具体函数得分情况见表3。
本研究评价了8个具有高结合能力黄酮类化合物的类药性,见表4,鼠尾酮、二氢丹参酮Ⅰ、异丹参酮Ⅱ、新隐丹参酮、丹参酮ⅡA、丹参酮Ⅵ表现出合理的理化性质:LogP≤5,MV<500 g∕mol,氢键受体数≤10,氢键供体数≤5和PSA≤140Å。

表4 对筛选的化合物进行Lipinski五规则预测
2.2 ADMET 分子动力学预测结果筛选出的8个丹参黄酮类化合物进行ADMET 预测结果见表5。根据水溶性预测标准,非常低:-8.00<log(SW)<-6.00;低:-6.00<log(SW)<-4.00;好:-4.00<log(SW)<-2.00;二氢丹参酮Ⅱ、新隐丹参酮和丹参酮Ⅵ水溶性评价处在-4.00<log(SW)<-2.00的区间里,水溶性较好;分子透过血脑屏障难易程度等级标准,极高:0;高:1;中等:2;低:3;不确定:4。二氢丹参酮Ⅱ、异丹参酮Ⅱ和丹参酮Ⅵ血脑屏障透过能力强,优于其他化合物;根据细胞色素P450 的主要亚型CYP2D6对化合物代谢行为进行评估,筛选出的化合物对细胞色素P450 2D6都无抑制作用;筛选出的化合物都与血浆蛋白有较高的结合率;根据总清除率(log mL·min-1·kg-1)来判断药物排泄的能力。总清除率最高的是二氢丹参酮I,其次是丹参酮Ⅵ和新隐丹参酮;筛选出的化合物二氢丹参酮Ⅰ、异丹参酮Ⅱ、新隐丹参酮和丹参酮Ⅵ不具有肝毒性。综上所述,化合物二氢丹参酮Ⅰ具有最佳药物样特性。
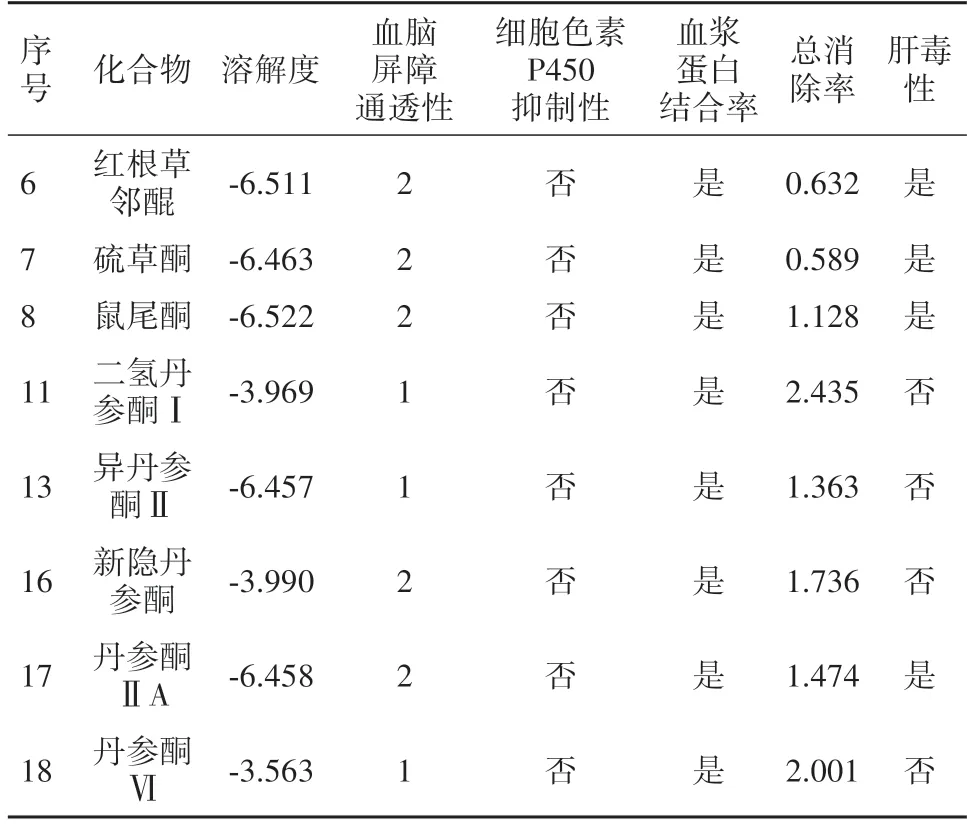
表5 8个黄酮类化合物的ADMET预测
2.3 筛选化合物的亲和力分析为了验证筛选出的化合物二氢丹参酮Ⅰ与ADP-核糖基化因子样2受体的结合情况,使用基于SPR技术的Biacore T200生物分子互作分析系统,将二氢丹参酮Ⅰ稀释到32 μmol∕L,通过响应值观察小分子与蛋白的结合强度,发现二氢丹参酮Ⅰ与ADP-核糖基化因子样2 受体的响应值高,结合具有较高的特异性,见图1。
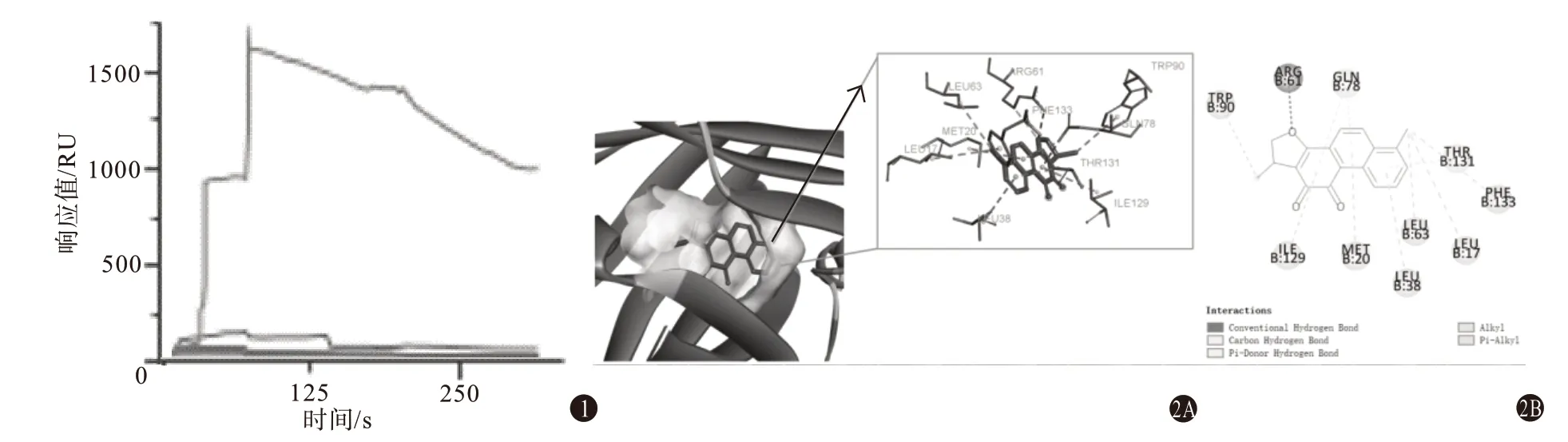
图1 在Biacore系统中二氢丹参酮Ⅰ与ADP-核糖基化因子样2受体蛋白结合响应情况 图2 二氢丹参酮Ⅰ与ADP-核糖基化因子样2受体分子对接效果图:2A为二氢丹参酮Ⅰ与ADP-核糖基化因子样2作用的三维模式图;2B为氢丹参酮Ⅰ与ADP-核糖基化因子样2作用的二维图
2.4 对接结果分析二氢丹参酮Ⅰ相较于其余丹参黄酮类化合物,与ADP-核糖基化因子样2 受体结合函数打分最高,Total Score 为8.140 2,分子对接得分为-85.040 8,为了明确二氢丹参酮Ⅰ与ADP-核糖基化因子样2 受体的相互作用情况,采用分子对接技术分析其结合位点,结果显示,二氢丹参酮Ⅰ落入蛋白活性口袋中,且二氢丹参酮Ⅰ与氨基酸残基精氨酸61(ARG61)形成氢键,与谷氨酰胺78(GLN78)形成C-H 键,与异亮氨酸29(ILE29)、蛋氨酸(MET20)等形成疏水键,见图2。
3 讨论
本研究将丹参中的19 个黄酮类小分子化合物与20个已知肿瘤靶点蛋白通过对接评估,将筛选出的化合物进行类药性、生物利用度和ADMET 预测,确定最佳药物相似成分。其中二氢丹参酮Ⅰ具有最佳药物样特性。目前多数的丹参中黄酮类化合物的药理研究多集中在隐丹参酮和丹参酮ⅡA,隐丹参酮能够选择性的抑制血管内皮生长因子的活性,从而发挥抗肿瘤作用[24],丹参酮ⅡA 可通过下调COX-2的表达抑制大肠癌和直肠癌的血管生成[25],本研究结果提示丹参酮ⅡA 与COX-2 的Total Score 优于其余黄酮类化合物,初步验证了计算机筛选的准确性。
此外,通过体外Biacore 系统检测,二氢丹参酮Ⅰ与ADP-核糖基化因子样2 受体具有较高的结合力。模拟对接分析结合受力方式,发现结构中的醚键和酮基基团可与靶点蛋白中的多个氨基酸以氢键及疏水键等作用力相结合。
综上所述,虚拟筛选和分子对接有助于提高药物筛选效率,本研究为丹参中黄酮类化合物二氢丹参酮Ⅰ抗肿瘤作用提供了理论基础,为后续靶向ADP-核糖基化因子样2 受体的小分子抑制剂的研发提供了良好的先导化合物。

