CAFs联合LVD对早期宫颈鳞癌淋巴结转移的预测价值*
黄晓岚,魏文斐,陈晓静,王梓慈,郭楚鸿,陈佩玉,王 薇
(1.广州医科大学附属第一医院妇产科,广州 510120;2.珠海市人民医院,珠海 519000)
淋巴结转移(lymph node metastasis,LNM)是宫颈鳞状细胞癌(cervical squamous cell carcinoma,CSCC)的主要转移途径,是影响临床治疗与预后的独立危险因素。2018年宫颈癌FIGO指南将淋巴结转移的影像学和病理学检查纳入临床分期标准并指导临床治疗[1]。术前影像学检查可评估淋巴结受累情况,但具有难以发现微转移灶及鉴别良恶性淋巴结、敏感度与特异性差异较大等局限性[2]。目前尚无可靠的工具及综合性判断指标可精确预测CSCC淋巴结转移。
肿瘤微环境(tumor microenvironment,TME)在癌症进展和肿瘤细胞转移中具有重要作用,其中淋巴管内皮细胞(lymphatic endothelial cells,LECs)与肿瘤相关成纤维细胞 (cancer-associated fibroblasts,CAFs)是TME中的重要组成成分。淋巴管密度(lymphatic vessel density,LVD)及CAFs浸润的增加与肿瘤恶性侵袭和转移密切相关,并在某些研究中被当作一些实体肿瘤预后的预测指标[3-4]。然而,关于CSCC中CAFs和LVD之间的关系及其在预测LNM的作用研究较少,两者对LNM的预测价值还需进一步研讨。本研究通过回顾分析早期CSCC中CAFs密度和LVD单独及联合检测在预测LNM中的应用价值,并探讨术前检测活检标本病理标志物对LNM预测的可行性,以期在术前辅助影像学检查,更好地评估及预测早期CSCC淋巴结状态,为个体化治疗方案的建立提供参考依据。
1 资料与方法
1.1 研究对象 选取2014年至2017年广州医科大学附属第一医院妇产科收治的132例行根治性子宫切除术和盆腔淋巴结切除术的Ⅰb1~Ⅱa2期(2009年FIGO分期)CSCC患者,石蜡包埋组织标本包括92例手术切除标本(32例伴淋巴结转移,60例不伴淋巴结转移)及40例活检组织标本(10例伴淋巴结转移,30例不伴淋巴结转移),同时收集与整理相关临床病理资料。本研究经医院伦理委员会审核批准,并符合《赫尔辛基原则宣言》所规定的原则,标本采集均经患者知情同意并签署知情同意书。
1.2 主要试剂 抗α-SMA抗体(Abcam公司,ab5694),抗D2-40抗体(ZM-0465)、Tris/EDTA修复液(pH=9.0)、抗小鼠/兔HRP聚合物检测试剂盒(PV-6000)、DAB显色试剂(北京中杉金桥),PBS、枸橼酸钠抗原修复液粉剂(广州鼎国);四色多重荧光免疫组化染色试剂盒(Opal 4-color IHC Kit)(Perkin Elmer公司)。
1.3 实验方法
1.3.1 免疫组化检测 石蜡切片常规烤片、脱蜡水化、高压抗原修复(α-SMA采用枸橼酸钠缓冲液pH 6.0,D2-40采用EDTA pH 9.0),3% H2O2室温孵育15min,山羊血清室温封闭30min。弃羊血清,一抗(anti α-SMA,1∶800;D2-40工作液)4℃孵育过夜。PBS缓冲液清洗,相应二抗37℃孵育30min。DAB镜下显色、苏木素染核、常规脱水、透明,干燥后中性树脂胶封片。光学显微镜采集照片。所有染色切片均由两位不了解患者临床状况的病理学家独立评估。
1.3.2 多重免疫荧光染色 石蜡切片脱蜡、水化、高压抗原修复、山羊血清封闭条件同免疫组化步骤,一抗(D2-40工作液)37℃孵育1h,相应二抗37℃孵育10min,避光室温孵育Opal荧光素(Opal520)10min,避光重复抗原修复,一抗(anti α-SMA,1:800)避光37℃孵育1h,二抗避光37℃孵育10min,避光室温孵育Opal荧光素(Opal570)10min,DAPI避光染核5min,抗荧光淬灭剂封片。正置激光共聚焦显微镜(LSM 880)采集照片。
1.4 免疫组化结果的判定
1.4.1 CAFs判定 光学显微镜于低倍镜(×40)下观察免疫组化染色切片,α-SMA(CAFs标志物)阳性表达位于间质细胞胞质,呈棕黄色颗粒,选取阳性表达细胞的密集区域,即“热区”,在高倍镜(high power lens,HP)(×400)下随机选取5个不重叠视野,使用Image J软件(版本1.4.3.67)对阳性染色面积百分比进行测量,每个视野取3次测量平均值,最终得到每例患者的CAFs密度值(α-SMA%)(不包括血管)[5]。根据中位数对所有样本进行分组:大于或等于中位数(18.65%/400×)者为CAFs高密度组(CAFs高),小于中位数者为CAFs低密度组(CAFs低)。
1.4.2 LVD判定 低倍镜(×40,×100)下观察免疫组化染色切片,D2-40阳性表达位于淋巴管内皮细胞胞质和胞膜,呈棕黄色颗粒。阳性细胞围成的腔隙为淋巴管,低倍镜下选取“热区”,再于高倍镜(×200)下随机选取5个不重叠的视野,计数各视野中淋巴管数,取其平均数,最终得到每例患者的LVD值(个/HP)。对所有样本进行分组:大于或等于中位数者(7.35个/200×)为高密度组(LVD高),小于中位数者为低密度组(LVD低)[4]。
1.5 统计学分析 使用SPSS 25.0统计软件(IBM公司)分析数据,Graphpad Prism 8.3.0绘图。Kolmogorov-Smirnov单样本检验法验证正态分布;呈偏态分布的计量资料用中位数和四分位数间距[M(P25,P75)表示;采用Mann-WhitneyU检验比较两组间结果的差异;Spearman相关系数分析相关性;应用χ2检验或Fisher确切概率法分析组间差异;logistic回归分析建立logistic回归模型,ROC曲线的曲线下面积(area under curve,AUC)评价各指标的诊断效能。α=0.05为显著性检验水准,P<0.05(双尾)为差异有统计学意义。
2 结 果
2.1 CSCC中α-SMA和D2-40表达分布及CAFs密度与LVD的相关性 多重免疫荧光染色结果显示,α-SMA+CAFs密度高的组织中D2-40+淋巴管数量增多(图1)。根据中位数分组代表性图见图1。免疫组化结果显示,LVD高组的CAFs密度显著高于LVD低组(χ2=19.183,P=0.000) (表1),CAFs密度与LVD呈正相关(Spearman's rho=0.597,P<0.001)(图2E)。
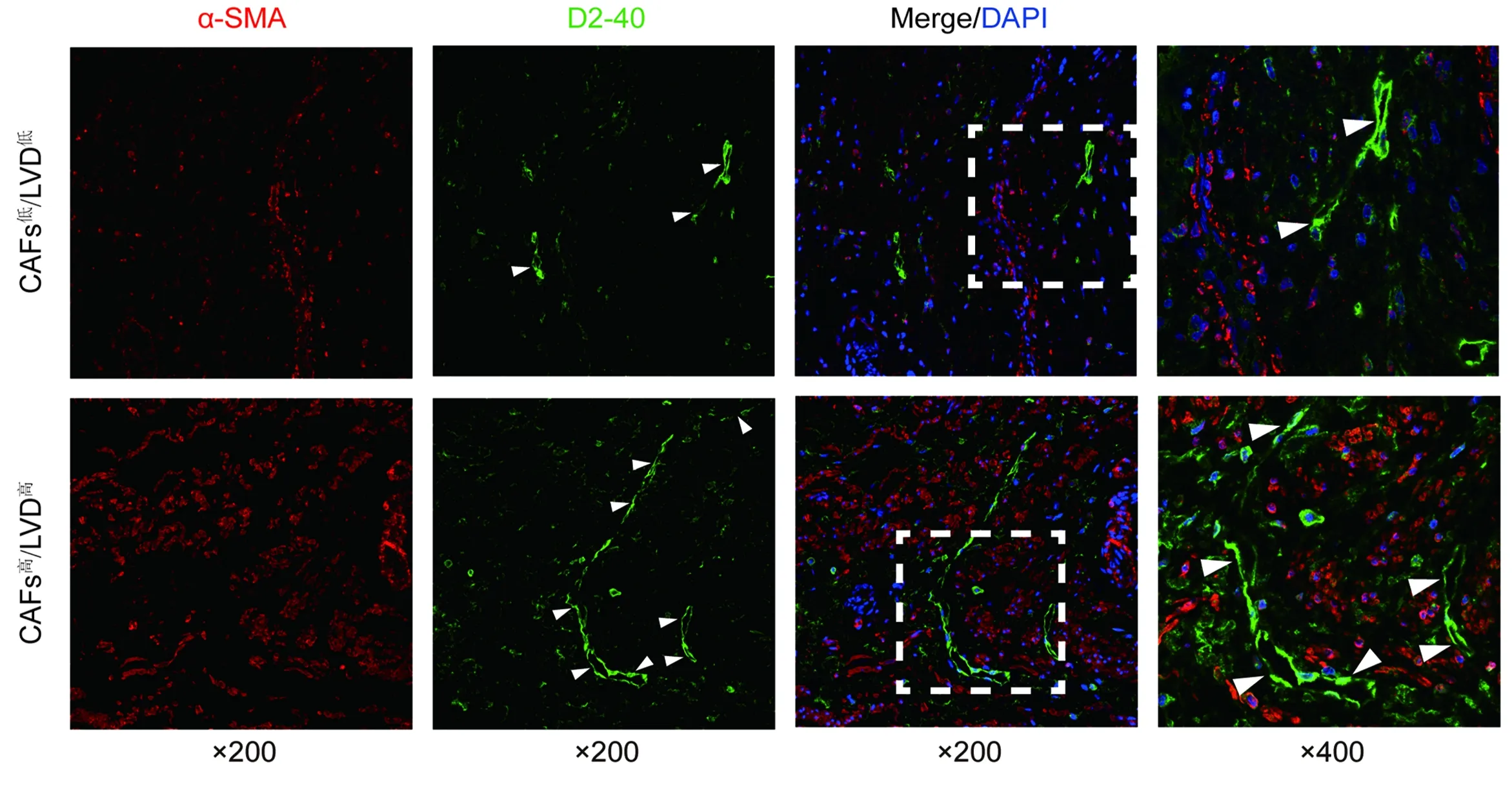
图1 CAFs和淋巴管的多重免疫荧光染色和分组代表性图(×200,×400)早期CSCC手术标本组织中α-SMA+CAFs(红色)、D2-40+LVs(绿色)、细胞核(蓝色)的多重免疫荧光染色,白色箭头代表围成腔隙的淋巴管。CAFs高/LVD高:α-SMA+CAFs≥18.65%/400×,D2-40+LVs≥7.35个/200×;CAFs低/LVD低:α-SMA+CAFs<18.65%/400×,D2-40+LVs<7.35个/200×

表1 CAFs密度和LVD的相关性 (Pearson's χ2 test)
2.2 CAFs密度或LVD在早期CSCC不同淋巴结转移组中的表达分析 免疫组化染色切片(图2A)和Mann-WhitneyU检验(图2C、D)结果显示,LNM组中CAFs密度与LVD高于non-LNM组(P<0.001)。
2.3 CAFs密度与LVD作为单一因素和联合因素在早期CSCC组织中临床病理参数分析 Fisher检验结果显示,早期CSCC组织中,CAFs密度和LVD均与LNM、淋巴脉管浸润(lymphovascular invasion,LVI)(P<0.05)密切相关,而与年龄、FIGO分期、肿瘤直径、分化程度无显著相关(P>0.05)(表2)。CAFs与LVD联合表达水平与LNM(P=0.000)及LVI(P=0.004)显著相关,而与年龄、FIGO分期、肿瘤直径及分化程度无关(P>0.05)(表3)。高表达和低表达CAFs的LNM率分别为 63.04%(29/46)、6.52%(3/46);高表达和低表达LVD的LNM率分别为59.57%(28/47)、8.89%(4/45),两者同时高表达的LNM率为76.47%(26/34),同时低表达为3.03%(1/33)。单独检测CAFs密度、LVD以及联合检测的阳性预测值(PPV)分别为63.04%、59.57%、76.47%,阴性预测值(NPV)分别为93.48%、91.11%、96.97%。
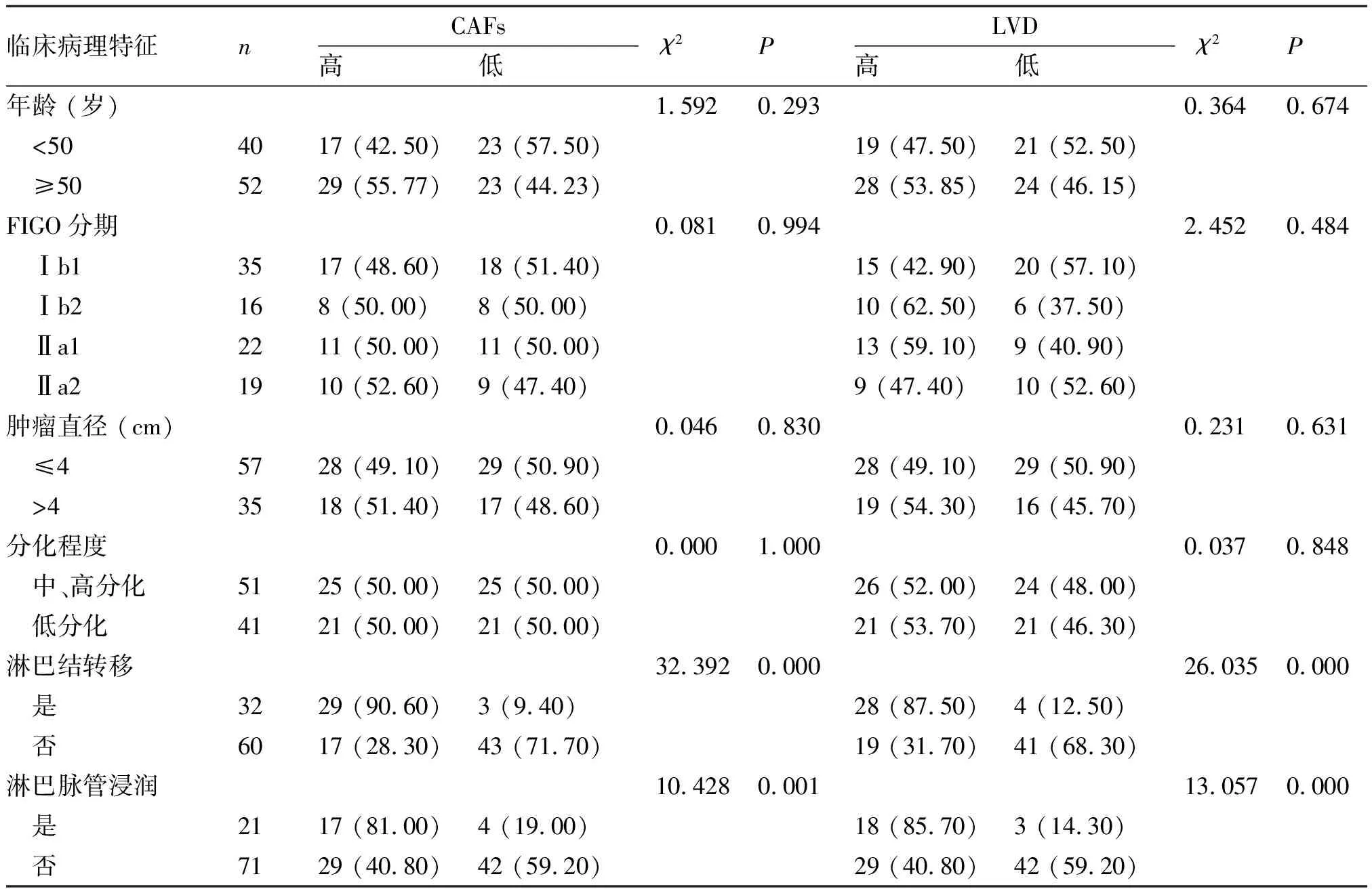
表2 92例早期CSCC患者CAFs密度和LVD与临床病理特征的关系 [n(%)]
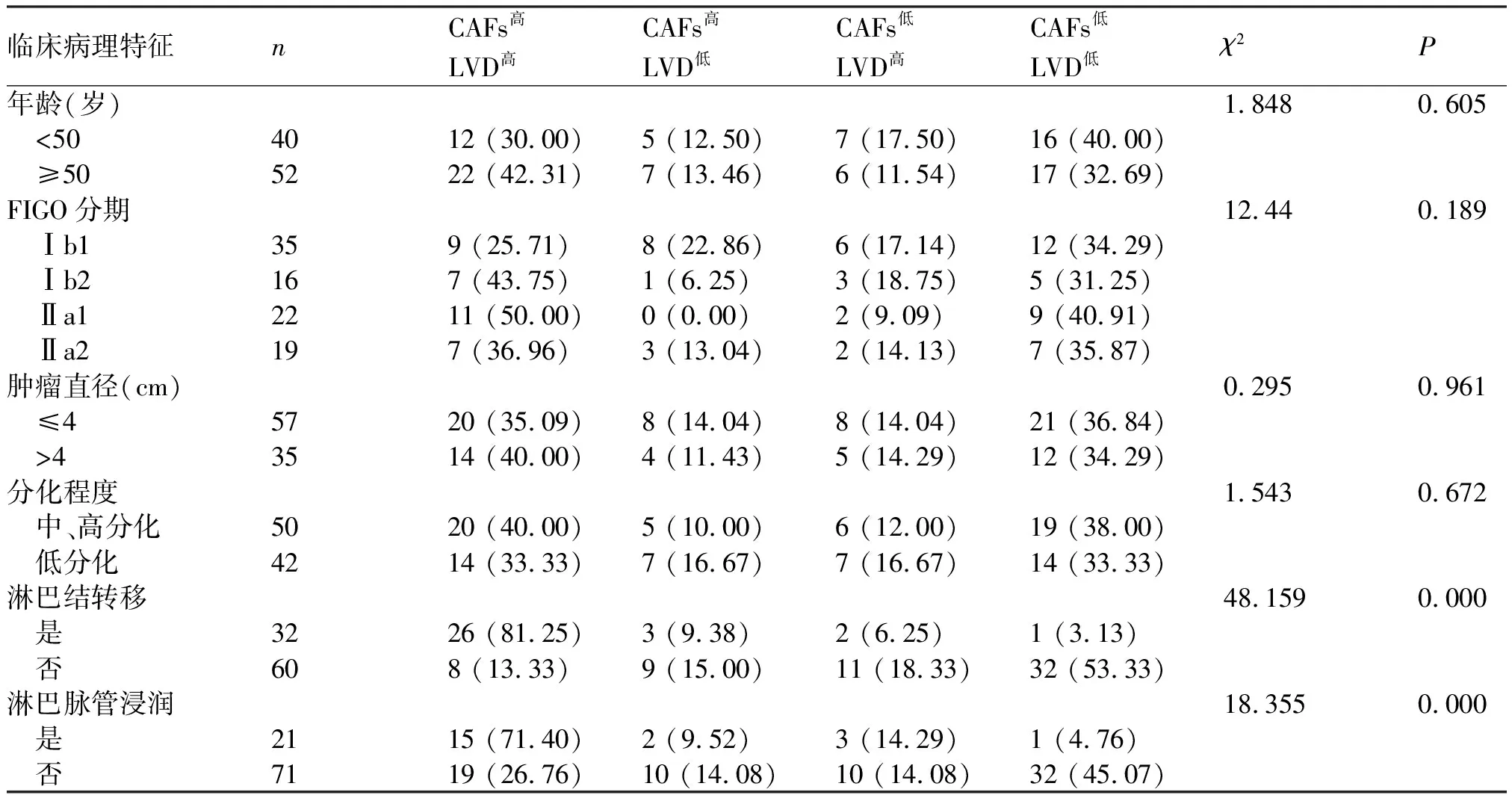
表3 CAFs联合LVD与临床病理特征的关系 n(%)
2.4 单独或联合检测早期CSCC组织中CAFs密度和LVD对淋巴结转移的预测价值 以LNM为因变量,CAFs密度、LVD为自变量,建立logistic回归方程(表4)。ROC曲线(图3)结果显示,CAFs密度和LVD的cut-off值分别为19.81%/400×和9.12/200×时,“CAFs+LVD”联合检测方案的AUC(0.958)均大于单独检测CAFs密度(0.926)和LVD(0.904)的AUC,且具有最佳准确性(90.22%)(表4)。40例早期CSCC患者的活检标本检测结果显示,CAFs密度与LVD呈正相关(Spearman's rho= 0.487,P<0.001)(图2H),LNM组中CAFs密度与LVD均高于non-LNM组(P<0.001)(图2F、G)。以根治术后的病理诊断为金标准,CAFs密度≥19.81%/400×、LVD≥9.12/200×(cut-off值)为阳性,小于cut-off值为阴性,CAFs密度与LVD联合检测中任一项为阳性即视为检测阳性,二者均为阴性视为检测阴性。以cut-off值诊断40例患者中淋巴结转移为9例,无淋巴结转移为1例,检出率为90.0%(9/10),宫颈活检标本的预测与术后病理诊断LNM的总符合率为97.5%(39/40),两法一致性检验Kappa值为0.931(表5)。
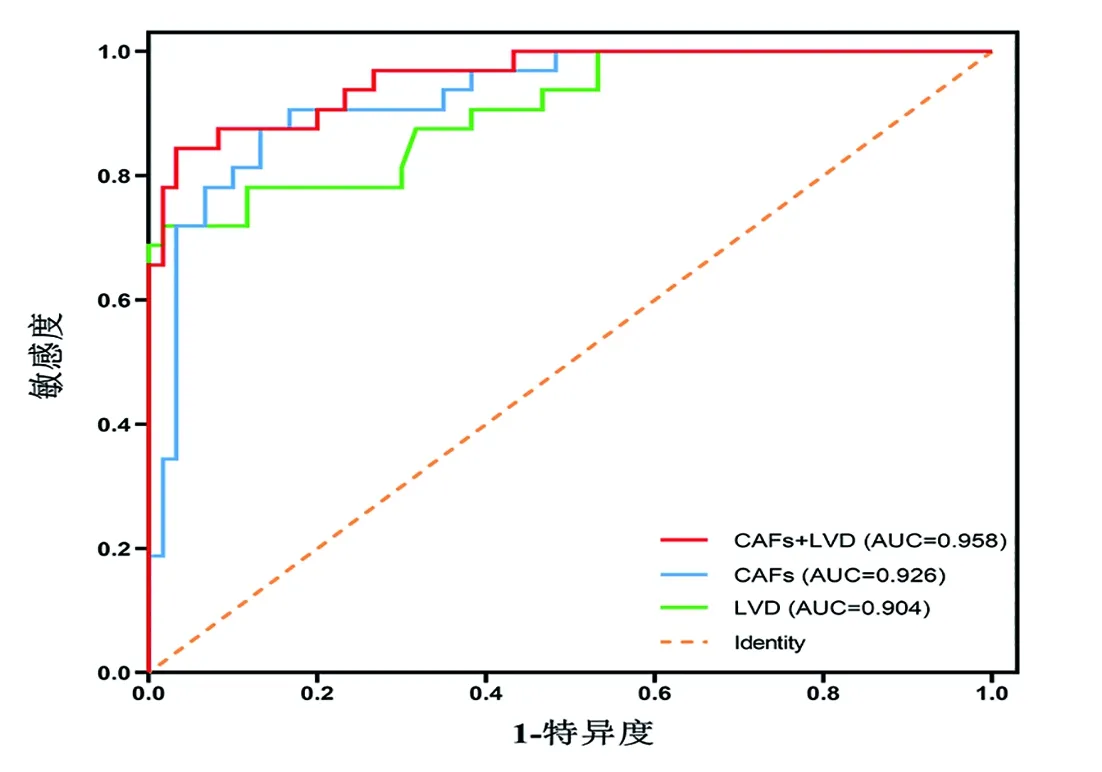
图3 单独或联合检测患者CAFs、LVD的ROC曲线
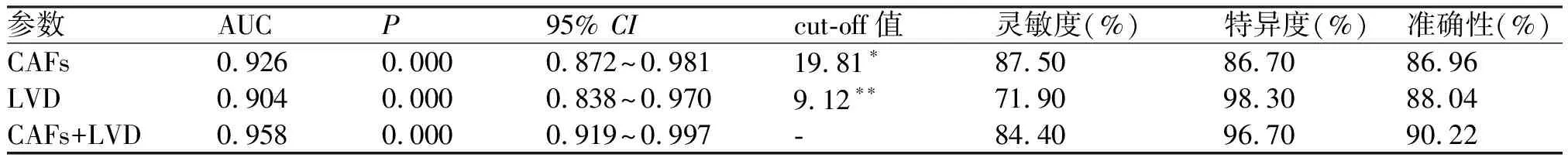
表4 联合各参数对早期CSCC淋巴结转移的预测效能比较

表5 活检标本预测与术后病理诊断淋巴结转移的总符合率
3 讨 论
淋巴结转移是宫颈鳞癌复发和预后不良的关键因素之一。早期宫颈癌的淋巴结转移率约为13.9%~38.1%,近2/3的患者可能因过度切除淋巴结而引发严重并发症[6-7]。此外,目前研究中并没有足够的证据支持,接受了根治术后的患者完成辅助同步放化疗后进行额外的化疗能明显改善生存预后[8]。FIGO 2018宫颈癌分期指南中,淋巴结转移的影像学及病理学检查结果对临床分期和主要治疗方案的决策具有重要参考意义[1]。然而,在选择接受手术的临床分期Ⅰb1和Ⅰb2的患者中,FDG-PET检测鳞癌盆腔淋巴结转移的敏感性比腺癌几乎高出一半,但总体敏感性仍低于50%[9]。即使影像学检查对淋巴结转移的检测具有较高的特异性,但较高的假阴性率使影像学阴性的高危患者不能完全排除隐匿性淋巴结转移,导致部分患者无法接受充分治疗[10-11]。因此,若能在术前精确评估淋巴结状态,或能改善患者生存质量。
淋巴管基膜不连续、通透性大等结构特征与淋巴管的重塑易使组织液中的肿瘤细胞进入毛细淋巴管[12]。LVD作为评估淋巴管生成情况的重要指标,有助于评估口腔鳞状细胞癌、肝内胆管癌、头颈鳞状细胞癌淋巴结转移风险及肿瘤预后[4,13-14]。盛圆等[15]研究报道,LVD预测早期胃癌LNM的AUC值为0.835(95%CI为0.758~0.912),其cut-off值为14个/200×,敏感度与特异度分别为63.40%、90.0%。本研究发现,LVD与早期CSCC淋巴结转移、LVI显著相关,且伴有淋巴结转移的组织中LVD更高。ROC曲线显示,LVD单独检测的AUC为0.904,cut-off值为9.12个/200×,敏感度、特异度和准确性分别为71.90%、98.30%和88.04%,提示LVD对早期CSCC淋巴结转移具有良好的预测价值。
尽管已有研究评估了LVD在宫颈癌中的重要性,但对于预测宫颈癌淋巴结转移的意义尚存争议。Gombos等研究提出,LVD的增加与早期宫颈鳞癌的侵袭行为及淋巴结转移相关(P=0.0095),淋巴结转移瘤周LVD中位数达10个[16]。而Tantari等评估了早期宫颈癌(包括腺癌与鳞癌)中淋巴管生成和增殖的标记物(Ki67、D2-40、CD31和VEGF-C),结果显示这些标志物均不能预测盆腔淋巴结转移(P=0.43)或肿瘤复发(P=1.00),因此强调,早期宫颈癌的淋巴管扩散与肿瘤周围预先存在的淋巴管相关而不需新增的淋巴管内皮细胞[17]。关于肿瘤周围淋巴管在肿瘤进展中作用的矛盾结果可能是由于患者的选择、方法学中标记物的选择和(或)分析中包括的肿瘤类型的差异[14]。这可能反映了肿瘤淋巴管生成和淋巴转移是复杂的机制,在不同类型或解剖位置的肿瘤中可能有显著差异。考虑到腺癌与鳞癌有着不同的生物学行为特征,本研究关注于宫颈鳞癌的TME对肿瘤淋巴结转移的影响,以寻找可靠的联合预测因子。淋巴管的生成与重塑受到TME中多种细胞因子、趋化因子、机械刺激等因素的调节[18-19]。CAFs作为TME中的主要基质成分,能分泌大量细胞因子和趋化因子重塑细胞外基质,在促进肿瘤进展的同时还参与淋巴管的调节,在胆管癌、头颈癌的研究中发现,CAFs能诱导肿瘤相关淋巴管生成增加和淋巴管内皮屏障受损,并且CAFs浸润丰度增多与淋巴结转移密切相关[20-21]。CAFs能通过破坏淋巴内皮的完整性以促进CSCC淋巴结转移[22]。本研究中,CAFs密度与淋巴结转移和LVI显著相关,进一步提示宫颈鳞癌中CAFs可能通过联合肿瘤新生淋巴管共同调控淋巴结转移进程。
目前关于CAFs与LVD预测CSCC淋巴结转移的研究尚少,也因缺乏统一评判标准,两者与CSCC淋巴结转移之间的关系尚未明确。据Chen等报道,肺腺癌中CAFs密度与LVD增加密切相关(χ2=16.355,P=0.000),CAFs密度和LVD与淋巴结转移相关,均可作为预测预后的指标[23]。本研究同样证实了CAFs密度与LVD呈正相关(Spearman's rho=0.597,P<0.001),二者联合表达水平与淋巴结转移密切相关(P=0.000)。此外,ROC曲线联合分析结果表明,相较于单一检测,CAFs密度、LVD的联合检测在淋巴结转移的诊断中有更好的预测效果。
目前预测肿瘤淋巴结转移的研究多基于影像组学特征、血清或术后标本肿瘤标志物(如SCC-Ag、p16等)与临床病理特征的结合,对宫颈鳞癌淋巴结转移的诊断有一定的价值,但尚存在较高的假阳性率和假阴性率,其准确性仍需大样本数据证实。本研究除了结合手术标本的生物标志物和临床病理特征进行分析,还探讨了术前活检标本对于预测隐匿性淋巴结转移的可行性。既往由于缺乏统一标准、组织取样不足等因素,研究者们利用活检组织进行临床诊断具有一定的局限性。然而,越来越多的研究在探索活检标本对疾病诊断及预后价值等方面得到意想不到的结果。Rivera-Colon等及于静等研究认为,宫颈活检组织的肿瘤病理学特征有助于预测肿瘤淋巴浸润和复发风险[24-25]。一项多中心研究中,Wang等对794例宫颈腺癌标本进行肿瘤细胞核分级(TNG)与坏死肿瘤碎片(NTD)的观察,TNG与NTD的预测敏感性可达82%及89%,特异性分别为89.5%、71.5% ,这或许能在活检阶段识别淋巴结转移风险患者,有利于实施个性化、侵略性更小的治疗[26]。本研究回顾分析早期CSCC患者宫颈活检标本中CAFs密度与LVD的情况,利用ROC曲线cut-off值判断LNM与术后病理诊断LNM的总符合率达97.5%,诊出率为90%,漏诊率为10%,表明术前活检标本中CAFs密度和LVD联合检测对早期CSCC患者LNM具有一定的评估价值。
综上所述,α-SMA+CAFs和D2-40+LVs表达水平与早期CSCC淋巴结转移显著相关,联合检测CAFs密度及LVD可能有助于提高术前淋巴结转移的检出率,为患者个体化治疗方案的建立提供参考依据,从而改善患者临床预后。

