有机种植与常规种植蔬菜地土壤细菌群落多样性分析
曾广娟, 冯 阳, 吴 舒, 彭红丽, 耿世刚
(1.河北环境工程学院,河北秦皇岛 066102; 2.企美实业集团有限公司,河北邯郸 057150)
长期以来高强度地掠夺性种植和化肥农药引发的耕地质量下降问题已成为制约中国农业可持续发展的瓶颈。因此,有机农业应时而生,有机农业更强调对生态环境的保护及注重土壤的健康。丰富而稳定的土壤微生物多样性是维持土壤肥力和土壤健康的核心与关键,土壤细菌的丰富度和多样性对于维持土壤生态系统健康发挥着关键作用[1],在绿色发展大背景下土壤微生物在未来农业生产中将扮演越来越重要的角色。因此,探索有机与常规种植土壤细菌群落多样性对建立高效、安全、资源节约、环境友好的有机农业发展具有重要作用。国内外学者对有机种植与常规种植2种农业生产方式的农作物产量与品质[2-3]、土壤环境质量[4-6]、土壤肥力效应[7-9]、根际代谢产物[10]、不同种植方式对生态环境的影响[11-12]等角度开展了相关研究,认为与常规种植方式相比,有机种植方式在各方面显示出显著的优越性。随着土壤生物技术的发展和不断完善,土壤微生物研究迅速成为国际科学研究热点之一。汪润池等认为,有机种植地块的土壤微生物群落特征的综合评分高于常规种植地块[13]。冯海玮等研究证明,有机种植麦田中细菌种群更为丰富,有机种植可以增加土壤细菌多样性,且不同土层细菌多样性存在差异[14]。黄化刚等对喀斯特地区由常规种植转为有机种植的烟田微生物的分析表明,土壤有益微生物类群数量增加,细菌以变形菌门、放线菌门、酸杆菌门占优势[15]。微生物多样性越高的土壤,表现出更复杂的生态功能、更高的抗环境胁迫和作物生产能力[16-17]。土壤微生物数量巨大、种类丰富,但能够被鉴定的微生物种类不足5%[18],随着高通量测序平台的发展,更多低丰富群落物种被鉴定,提高了微生物群落研究的完整性,成为了研究微生物群落多样性的重要手段。然而,采用高通量测序技术探究有机种植与常规种植蔬菜地土壤细菌群落结构多样性的差异研究尚鲜见报道。采用Illumina测序技术对2种不同种植方式土壤细菌群落的组成和多样性进行分析,以期为保护土壤微生物多样性、保持土壤肥力、维护土壤健康、建立合理的种植方式提供理论依据。
1 研究区概况与研究方法
1.1 材料
研究区位于河北省邯郸市永年区企美实业集团有限公司南王庄有机蔬菜种植基地和隔离带外的常规种植基地(36°37′N,114°41′E),面积均为1.33 hm2,为鲜食大豆和西兰花轮种,土壤为褐土。南王庄有机蔬菜种植基地2018年开始进行有机蔬菜种植,开始有机种植前2种植基地土壤的经营管理状况一致。有机种植基地施用肥料为公司自制羊粪 30 000 kg/(hm2·年),常规种植区域施用肥料为 1 500 kg化肥/(hm2·年);有机肥在3月初施入,化肥根据蔬菜生长状况于生长季节施入。
1.2 土壤样品采集
鲜食大豆于2021年7月底采收,西兰花于8月初栽植,2021年8月25日在2基地内各设置2个 10 m×10 m的样方,每个样方按梅花形采样法,分别挖取0~15 cm和15~30 cm土壤样品并相同土层多点混合而成,所有样品分成2份,1份置于 -80 ℃ 保存用于土壤高通量测序,1份风干后用于土壤化学性质测定。有机种植样地的土壤样品记为YJ1(0~15 cm)、YJ2(15~30 cm);常规种植样地的土壤样品为CK1(0~15 cm)和CK2(15~30 cm)。
1.3 土壤细菌群落分析
采用CTAB法从样品中提取总基因组DNA,在1%琼脂糖凝胶上监测浓度及纯度;依据16S rRNA基因的变异区域,利用保守区设计通用引物进行PCR扩增;对PCR产物进行纯化;使用TruSeqDNA PCR-Free样品制备试剂盒生成测序文库(Illumina);对高变区进行测序分析和菌种鉴定。
1.4 土壤理化性质测定
土壤有机质的测定采用重铬酸钾氧化-容量法,全氮测定采用凯氏定氮法,全磷测定采用硫酸-高氯酸消煮法,全钾的测定采用NaOH熔融-火焰光度法,土壤pH值测定采用电位法。
1.5 数据处理
基于Illumina NovaSeq 测序平台,利用双端测序的方法,进行PE250双末端测序,测序得到的下机数据进行拼接和质控,得到Clean Tags,再进行嵌合体过滤,得到可用于后续分析的有效数据。以97%的一致性将序列聚类成为OTU(operational taxonomic units),共得到8 792个OTU,然后对OTU序列与Silva138数据库进行物种注释。根据物种注释情况,进行组间细菌相对丰度比较及进一步计算α多样性,进行组间差异的比较,揭示不同种植方式下土壤细菌群落结构的差异特征。
2 结果与分析
2.1 有机种植与常规种植土壤化学性质分析
由测定结果(表1)可知,有机种植与常规种植土壤均为弱碱性,表层土壤pH值低于深层土壤,有机种植土壤pH值低于同土层常规种植pH值。相同土层土壤有机质以有机种植方式高,表层土壤高于深层土壤,变化趋势为YJ1>CK1>YJ2>CK2,表层与深层表现出了显著性差别;土壤全氮、全磷、全钾表现出了相同变化趋势,为CK1>CK2>YJ1>YJ2;方差分析(ANOVA)和LSD多重比较显示不同种植方式土壤化学性质存在显著差别(P<0.05)。
2.2 有机种植与常规种植土壤细菌OTU分布
由测序结果(图1)可知,随着测序量的增加,4组土壤样品的稀释曲线逐渐趋于平缓,提示测序数据量渐进合理,更多的数据量仅会产生少量新的物种(OTU)[19]。所有样品的测序覆盖度均在97%以上,证明本次试验取样量基本合理,可开展后续的多样性分析,能真实反映有机种植和常规种植土壤细菌的群落组成。

对Illumina NovaSeq测序所得土壤样品数据经质检后,所有样品获得的细菌有效序列总数为 206 946 条,4组12个土壤样品的8 792个OTU分属于88门152纲319目446科841属371种。
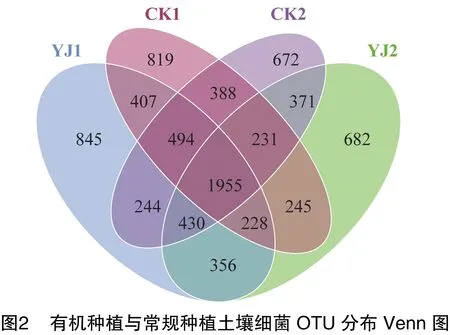
由图2、图3可知,Venn图中有机种植与常规种植土壤细菌共有的OTU数是1 955个,占总数的23.4%。YJ1特有的OTU数最高,为845个,占总数的10.1%;CK1特有的OTU为819个,占比9.8%;YJ2为686个,占总数的比例为8.2%;CK2特有的OTU数量最低,为672个,占总数的8.0%。表明不同种植方式不同土层细菌群落结构有一定相似性,同时表现出特异性,以YJ1土壤细菌特有的OTU最高,可能与种植方式有密切关系。
2.3 有机种植与常规种植方式土壤细菌α多样性指数分析
由表2可知,α多样性指数分析中,分别对4个样品的observed_species指数、Shannon指数、Simpson指数、Chao1指数、ACE指数进行统计,使用方差分析(ANOVA)和LSD多重比较探究不同样品的差异显著性,YJ1的5个指数均为最大,除observed_species指数外,YJ1在上述4个指数分别与YJ2、CK1、CK2存在显著差别(P<0.05),表明YJ1细菌群落的丰富度、物种的均匀度均为最高。

表2 有机种植与常规种植土壤细菌Alpha多样性指数比较
2.4 有机种植与常规种植土壤细菌相对丰度分析
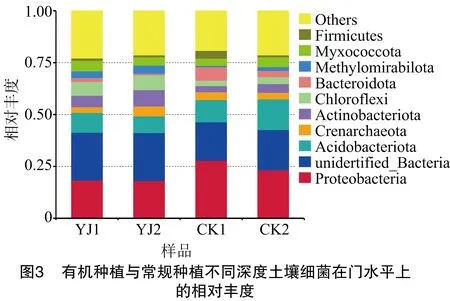
由图3可知,物种注释结果,YJ1、YJ2、CK1、CK2样品土壤细菌在门分类水平上属于88个门,相对丰度排名前10的细菌门依次为变形菌门(Proteobacteria)、unidentified_Bacteria、酸杆菌门(Acidobacteriota)、泉古菌门(Crenarchaeota)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)、甲基肌酐菌门(Methylomirabilota)、黏菌门(Myxococcota)、厚壁菌门(Firmicutes),10个菌门的相对丰度在样本YJ1、YJ2、CK1、CK2中占所有菌门的比例分别为77.17%、78.66%、80.83%、78.67%。以变形菌门(相对丰度18.10%~27.86%)和酸杆菌门(相对丰度8.10%~14.74%)2大菌门占绝对优势。进一步LSD多重比较显示,放线菌门、绿弯菌门和甲基肌酐菌门3个菌门的相对丰度以有机种植的不同土层丰度高,与常规种植表现出显著差异(P<0.05);而常规种植中变形菌门、酸杆菌门、拟杆菌门和厚壁菌门4个菌门的相对丰度显著高于有机种植(P<0.05)。由表3可知,相同种植方式的不同土层间,YJ1和YJ2在门水平未表现出显著性差异;而常规种植中,酸杆菌门、拟杆菌门和厚壁菌门在CK1和CK2间的相对丰度差异显著(P<0.05)。而泉古菌门和黏菌门在有机种植与常规种植不同土层中的相对丰度接近,未表现出显著差别。
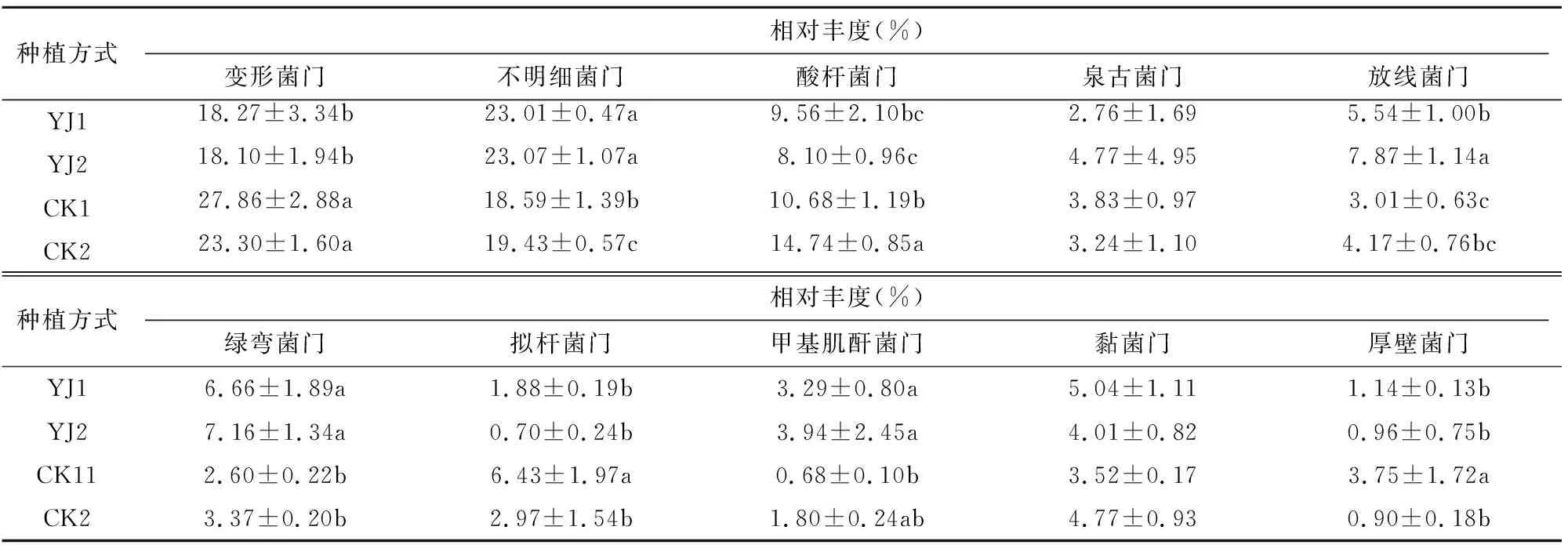
表3 有机种植与常规种植不同深度土壤细菌在门水平的相对丰度差异分析
高通量测序显示,4个样品共分属于841属,其中优势菌属(相对丰度>1%)为MND1、Sphingomonas、Haliangium、Dongia。由图4可知,属水平聚类丰度热图,YJ1样品细菌丰度较大的属包括MND1、Haliangium和Dongia,Dongia在YJ2样品中丰度也较高,但Haliangium和Dongia在CK1和CK2中丰度明显降低甚至消失;在YJ2样品中丰度较高而在CK1和CK2中丰度较低或几乎接近零的属包括oc32、MIZ17、Pelagibius、Castellaniella、Gaiella、Candidatus_Nitrososphaera、Lysobacter。在CK1丰度较大但在其他样品丰度极低的属是Faecalibacterium和Ellin6055,CK1和CK2丰度同时较高的属是Massilia、Flavisolibacter、Steroidobacter、Pontibacter、Sphingomonas、YC-ZSS-LKJ147、SWB02、Bacillus、Bryobacter、RB41和Pseudoxanthomonas;CK1和YJ1丰度均较高的属有Lactobacillus、Candidatus_Entotheonella和Skermanella。CK2和YJ2丰度都较高的属是Ralstonia和Pseudomonas。

2.4 有机种植与常规种植土壤细菌群落组成分析
为探究有机种植与常规种植土壤细菌群落结构差异,基于weighted Unifrac距离进行主坐标分析(PCoA)。由图5可知,pcoa1轴和pcoa2轴分别表示2种不同种植方式不同土层间差异贡献率分别是50.7%和15.66%,累计贡献率为66.36%。其中,YJ1和YJ2位于第Ⅱ和第Ⅲ象限,CK1和CK2位于第Ⅰ象限,土壤细菌群落按照不同样品聚集成簇;另发现,CK1和CK2这2个圈的距离大于YJ1和YJ2这2个圈的距离,说明YJ1和YJ2细菌群落结构差异不明显,CK1和CK2间差异较明显,有机种植的细菌群落和常规种植的细菌群落可很好地区分。PCoA分析表明,2种不同模式的土壤细菌群落有明显差别。

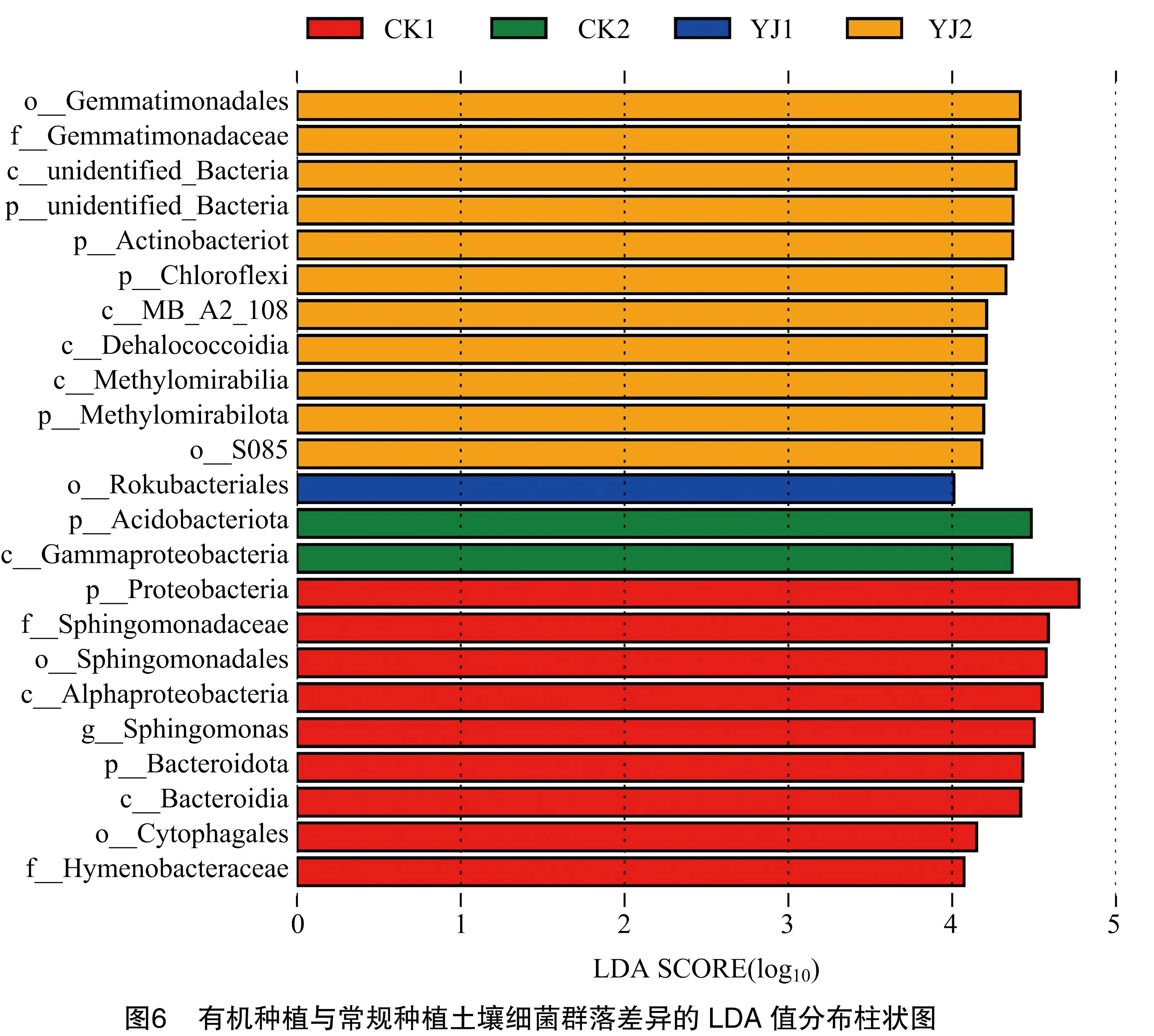
由图6可知,LDA score>4的土壤样品丰度差异的显著物种。本次共检测到23个有显著差异的细菌群落。对于YJ1组,对其有显著影响效应的菌群是罗库菌目(Rokubacteriales);对于YJ2土壤细菌群落,对其有显著影响的菌群为11个,其中,影响较大的3个菌群分别为芽单胞菌目(Gemmatimonadales)、芽单胞菌科(Gemmatimonadaceae)、放线菌门;对于CK1组,对其有显著影响的菌群为9个,其中影响较大的3大菌群依次为变形菌门、鞘脂单胞菌科(Sphingomonadaceae)、鞘脂单胞菌目(Sphingomonadales);对CK2组影响较大的菌群是酸杆菌门和γ变形菌纲(Gammaproteobacteria)。因此,不同种植方式、不同土层细菌群落均有差别。
2.5 土壤细菌群落与环境因子的冗余分析
为进一步揭示影响不同种植方式土壤微生物群落的环境因子,以土壤细菌属水平群落丰度为响应变量,土壤环境因子为解释变量进行基于距离的冗余分析(dbRDA),由图7可知,细菌的第一轴和第二轴累计解释变异量为81.51%。有机种植中 0~15 cm土层的采样点YJ1(Y.J.1、Y.J.2和Y.J.3)与15~30 cm土层的采样点YJ2(Y.J.4、Y.J.5和Y.J.6)距离更近,而常规种植中0~15 cm采样点CK1(C.G.1、C.G.2和C.G.3)与15~30 cm采样点的CK2(C.G.4、C.G.5和C.G.6)距离更近,表明相同种植方式不同土层微生物群落的组成类似,不同种植方式土壤微生物群落差异明显。细菌群落中,Haliangium与SOM呈正相关,而与pH值呈负相关;MND1、unidentified_Bacteria和Candidatus_Nitrosotenuis与pH值呈正相关,而与SOM呈负相关;Sphingomonas、RB41与Pontibacter与TN、TP、TK呈正相关,且对Sphingomonas影响最大;Dongia和Candidatus_Nitrososphaera与TN、TP、TK呈正相关。环境因子对土壤细菌群落的影响大小依次为TN>SOM>TP>pH>TK,Mantel test检验表明,TN(R2=0.853 5,P=0.001)、SOM(R2=0.757 2,P=0.002)、TP(R2=0.701 1,P=0.005)、pH值(R2=0.520 6,P=0.04)是影响不同种植方式土壤细菌群落的主要环境因子,而TK(R2=0.285 4,P=0.217)对土壤细菌群落的影响不显著。

3 讨论
本研究是基于16S rRNA高通量测序技术分析对比了有机种植与常规种植蔬菜地2种不同模式、不同深度土层的细菌群落结构特征,发现不同种植方式、不同土层的OTU数目、细菌群落组成和多样性存在差异。
3.1 不同种植方式不同土层土壤化学性质比较
分析结果发现, 有机种植降低了土壤pH值,有机种植蔬菜地有机质含量分别比常规种植相同土层提高了18.29%和20.53%, 这与王宏燕、姜瑢等对华北和华中典型农场有机种植土壤的研究结果[6,20]一致。但TN、TP、TK均低于常规种植相同土层,这可能是由于:第一,有机肥的氮素矿化率显著低于无机肥,土壤氮素有效性下降[21]。第二,有机种植时间短,有机种植体系实施前期养分释放缓慢从而导致土壤养分的供应不足[22]。第三,常规种植过量施用化肥。第四,2种种植方式地上部产量基本接近。
3.2 有机种植与常规种植不同种植方式不同土层细菌多样性
α-多样性指数是有效评价土壤微生物群落多样性和物种丰富度的指标[23]。本研究发现,YJ1的Shannon指数、Simpson指数、Chao1指数、ACE指数在4个样品中均为最大,表明有机种植方式下0~15 cm土壤细菌群落的多样性、丰富度与物种的均匀度均为最高,说明有机种植增加了表层土壤细菌的多样性和丰富度,研究结果与前人研究结果[14]一致,这可能与有机种植过程中仅施用园区内闭合循环过程中自制的有机肥料有关。陈芝兰等研究证明,有机肥可为土壤微生物提供所需的氮源、碳源与能量,有利于微生物的生长与繁殖,增加微生物的数量和活性[24]。但本研究中,有机种植15~30 cm 深的土层α多样性指数最低,这可能与细菌在土壤中的分布特性有关,也可能是由于有机种植时间较短所致。
3.3 不同种植方式不同土层细菌群落特征分析
有机种植与常规种植土壤细菌群落空间分布显示,不同种植方式不同土层差异对土壤细菌群落组成有一定的影响,2种种植方式下既有共同的优势细菌群落,同时也存在差异。门水平上,不同种植方式不同土层中,土壤细菌以变形菌门、酸杆菌门、泉古菌门、放线菌门等占绝对优势,这与已有的研究结果[15]一致。本研究中,放线菌门、绿弯菌门为有机种植方式的优势菌群,放线菌门属于土壤中的有益菌群,有助于土壤的生物缓冲作用并在作物生产的有机物分解中扮演着一定作用,放线菌门细菌还具有共生固氮和解磷作用[6,25];绿弯菌门参与包括CO2固定、CH4氧化及纤维素等大分子降解的碳循环过程,同时也是氮硫元素循环的重要参与者[5],还能促进土壤有毒物质的降解[26]。常规种植方式中变形菌门、酸杆菌门表现出更高的丰度,变形菌门在土壤的碳氮及硫循环中起着关键作用,但同时也含有一些致病菌[27]。常规种植土壤中变形菌门相对丰度显著上升,可能会增加一些不利于植物生长发育的致病菌;酸杆菌门是寡营养细菌[28],一般被认为是较贫瘠土壤环境的指示细菌[29];还可以作为土壤质量健康的一个指标[30],土壤质量越好酸杆菌门相对丰度越低,表明常规种植土壤的营养状况和环境状况出现恶化现象。由此可知,有机种植更有利于增加土壤中的有益菌群,有利于保持土壤质量,维护土壤生态系统的健康,上述研究结果与前人研究结果[14,31]一致。然而,也有学者指出变形菌门的丰度与有机质的含量呈正相关[32],本研究中虽未能证明这一点,但研究结果显示变形菌门是所有土壤样品中的最优势菌群,在有机质分解转化中起着重要作用,且研究区域土壤为弱碱性土壤,因此推测变形菌门可能是碱性土壤中的优势细菌群落,这与王鹏、赵祥等的研究结果[33-34]一致。
属水平上,有机种植土壤中Haliangium、Dongia、Pelagibius和Castellaniella为优势属,其中Haliangium被证实能分离出抗植物病原真菌物质,从而证明了Haliangium具有潜在的生防作用[35],属于有益生防细菌。Pelagibius属于嗜盐细菌,在盐碱土壤有机质循环及其土壤修复中发挥着重要作用,Castellaniella具有降解石油烃的功能,说明有机种植更能为微生物生长提供良好的环境条件。常规种植土壤中显著增加的菌属为Candidatus_Entotheonella、Terrimonas、Adhaeribacter、鞘氨醇单胞菌属、Pseudoxanthomonas、Candidatus_Nitrosotenuis、芽孢杆菌属、Flavisolibacter、Ralstonia,可能与大量施用化肥从而使氮磷在土壤中累积导致促进硝化过程与磷素循环的细菌增多;以及由于使用化学农药进行病虫害防治促使降解有机污染物的微生物增多;Ralstonia是一类重要的土传病害细菌,可导致青枯病的发生,常规种植土壤中有害细菌的增加可能是由于化肥、化学农药的过度使用,造成了土壤理化性质恶化,微生物区系结构失衡,或者是由于轮作时间短所致。
不同土层之间,YJ1土壤Stenotrophobacter的相对丰度极显著高于YJ2样品,有学者研究表明,Stenotrophobacter具有结瘤效果[36],可能是花椰菜上茬种植的鲜食大豆在有机种植方式下土壤表层根部更有利于根瘤的形成。常规种植CK1样品中Candidatus_Entotheonella相对丰度极显著高于CK2样品,说明化肥施入后,氮肥在表层积累更多。研究还发现,YJ1样品中具有解磷作用的Inquilinus相对丰度极显著高于CK1和CK2样品,表明有机种植土壤表层细菌可能更有利于难溶性磷转化为可溶性磷,从而保证土壤中磷的有效供应。Opitutus在YJ2样品与CK1样品间表现出极显著差异,Opitutus为厌氧发酵细菌,能培肥土壤和促进土壤生态良性循环,表明有机种植深层土壤也能为微生物创造良好的生态环境,有利于土壤的健康。Solimonas能降解黄曲霉毒素B1,在CK1样品中相对丰度极显著高于YJ2样品,可能是常规种植的管理措施导致了土壤生态系统的恶化。李思萌等研究认为,有机种植总体上能明显降低土壤中的重金属含量[26],本研究发现耐铬菌属Terribacillus在CK1样品中相对丰度明显高于YJ2样品,表明有机种植对土壤中重金属的富集能起到抑制作用。
3.4 微生物群落结构与土壤环境因子的dbRDA分析
有机种植与常规种植由于农业生产标准的差别,在施肥种类与方式、种植强度、农药选择等方面存在较大差异,因而导致土壤理化性质和土壤微生物群落结构等发生显著变化,Dean等的研究表明,土壤微生物多样性和群落结构变化与土壤特性相关[37-38]。本研究有机种植中施用的有机肥为园区内闭环循环生产的羊粪,肥料方面不存在外来引入的干扰因素,研究发现有机种植土壤的pH值低于常规种植相同土层的pH值,与王玲等的研究结果[10]一致。从不同种植方式土壤微生物(属水平)与环境因子的dbRDA分析可以看出,总氮、有机质、pH值和总磷是影响微生物群落结构的关键土壤环境因子。Sphingomonas与全氮、全磷、全钾和有机质同时正相关,Sphingomonas能降解土壤中的有毒物质[39],对植物生长起到保护作用。增施有机肥能够提升有益菌群Haliangium和Sphingomonas的生长,从而创造有利于植物生长的细菌群落结构。
4 结论
不同种植方式不同土层中,细菌多样性和群落结构不同,有机种植0~15 cm土壤具有更丰富的细菌多样性和稳定性,确认放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)为有机种植方式的特征优势菌群,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)为常规种植方式的特征优势菌群。α-多样性指数分析表明,有机种植0~15 cm土层细菌群落多样性、丰富度和物种的均匀度均为最高。dbRDA分析结果显示,土壤细菌群落主要受总氮、土壤有机质、总磷、pH值等环境因子的显著影响,而总钾对微生物群落的影响不显著。

