多组学手段揭示嫁接茶树接穗对砧木的影响
周泳臣, 刘 颖, 郑文忠, 高 峻, 孔 胜, 吕才有
(1.云南农业大学茶学院,云南昆明 650100; 2.云南省现代农业茶叶产业体系建设栽培研究室,云南昆明 650201;3.普洱茶树良种场,云南普洱 665000)
早在公元6世纪,贾思勰著的《齐民要术》中就记录有“桃接李则甘,李接桃则酸”的事例,嫁接作为一种无性繁殖的方法,在果树、桑树等经济作物中已经被广泛应用[1]。嫁接是人工营养繁殖植物的方法之一,即把一种植物的枝或芽嫁接到另一种植物的茎或根上,使接在一起的2个部分生长成为一个完整的植株[2]。我国对茶树嫁接的研究始于20世纪70年代[3],嫁接技术在茶树中主要应用于改造老茶园[4]、茶苗扩繁[5]、良种保存[6]等。代谢组学是对生物体内所有代谢物进行定性定量分析,并寻找代谢物与生物体生理生化变化的关系[7]。目前,代谢组学技术已广泛应用于茶叶产业中的各个环节,以揭示机体在代谢水平上的反应[8]。通过代谢组学技术,我们可以更加深入地了解茶叶中内含物质从育种栽培到加工再到品尝过程中的变化规律,解释茶叶的风味是如何形成的,并提高茶叶的食品安全性[9]。转录组学在RNA层面上对基因的表达进行研究,探索细胞中基因转录情况及转录调控规律[10]。一直以来,茶树种质资源和品种特性的研究都是通过形态学和农艺性状的观察来实现的。然而,茶树是一种长期异花授粉、自交不亲和性的植物,表现出高度杂合的生殖特点,其后代的遗传变异较小,因此很难通过表型来对品种进行鉴定[11]。转录组学为茶树基因的研究开辟了新途径,在茶树功能基因探索[12]、茶树的发育动态研究[13]、茶树叶色的基因调控探究[14]等方面有着广泛的应用。转录组学和代谢组学的联合分析已经成为了植物研究领域的趋势[15],多组学的联合分析可以减少单一组学分析带来的假阳性[16-17],更有利于研究生物学过程的调控机制[18]。
嫁接技术在茶树中的应用以及组学技术在茶叶学中的应用已有很多研究,但是有关嫁接茶树与多组学技术的结合研究却很少有文献提及。嫁接植物的砧穗间存在一定的互作[19],接穗不仅对砧木的生长发育有影响,还对其生理生化的代谢有所影响。目前,嫁接亲和力[20]和砧木对接穗的影响[21]等方面是植物嫁接中的主要研究方向,但是研究接穗对砧木的影响相对较少。基于此,本研究以茶树品种福云6号为接穗、短节白毫为砧木进行嫁接,将嫁接成活后的砧木短节白毫和未经过嫁接的短节白毫为研究对象,利用代谢组学与转录组学,从代谢水平和基因水平联合分析茶树经过嫁接后砧木的内含物质所发生的变化,寻找关键代谢物及基因的调控机制,以期为嫁接在茶树中的应用提供理论依据,为促进茶树育种、茶叶的品质及制茶工艺的发展奠定理论基础。
1 材料与方法
1.1 试验材料
2018年1月15日已在中国云南省普洱市普洱良种场的茶园中进行了大量的嫁接试验,获得嫁接成活的茶树,其中接穗为普洱良种场命名的福云6号茶树品种,砧木为短节白毫茶树品种。2020年9月27日,采集嫁接后的砧木短节白毫及未经过嫁接的短节白毫为试验对象。
1.2 试验流程
试验流程见图1。
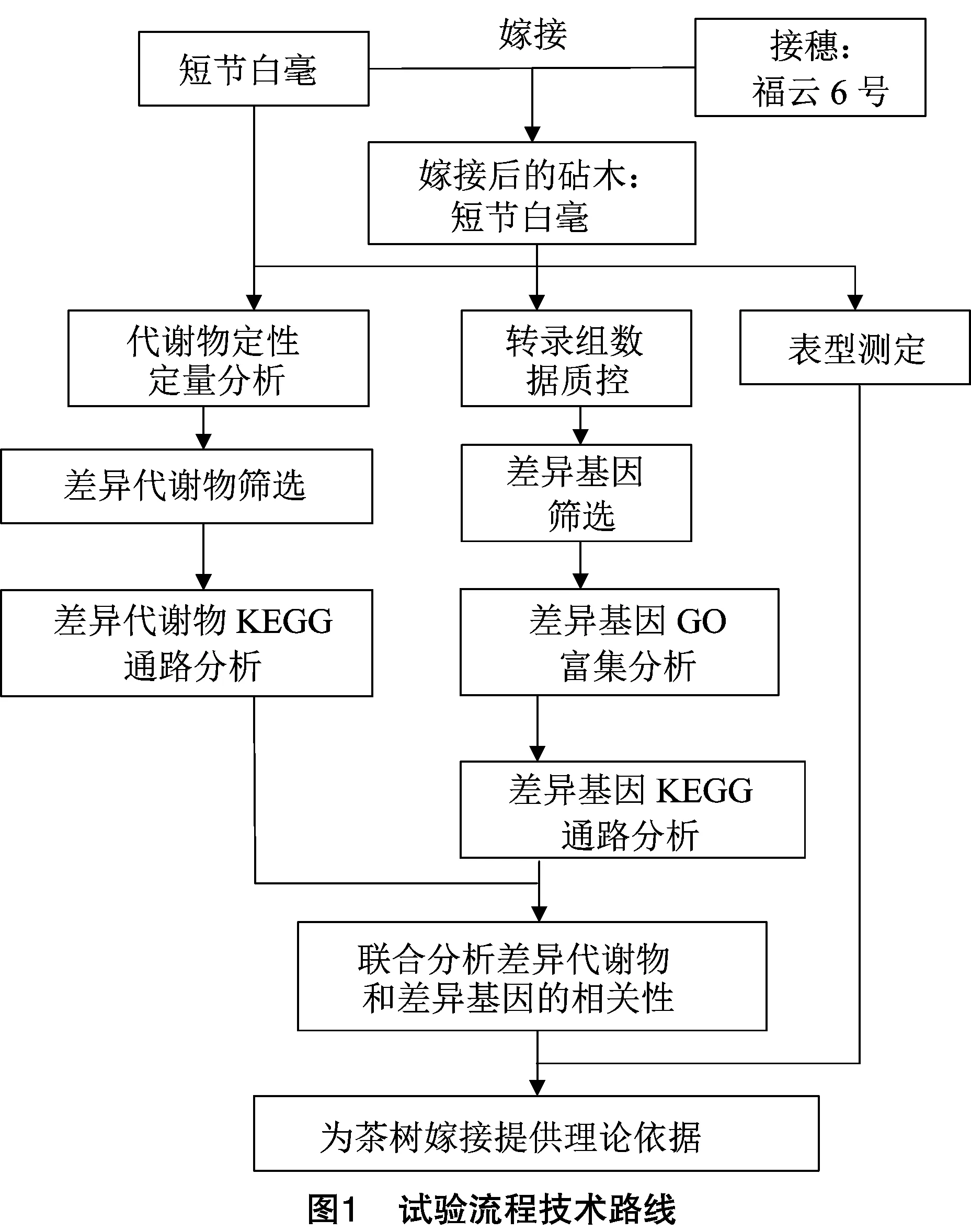
1.3 表型数据测定
随机选取茶树品种短节白毫嫁接前后各30个样本(共60个样本)进行茶叶农艺学性状的测定,求取其平均值,测定内容为叶长、叶宽、叶片厚度、节间长度。测量工具用20 cm直尺和游标卡尺,取样部位为同等高度生长的分蘖枝,节间测量部位均为第1节灰梗,叶长、叶宽、叶片厚度测量均为成熟、健康的叶片,叶面积=0.7×叶长×叶宽。
1.4 代谢组学分析
供试材料选取短节白毫嫁接前后2个样本的一芽二叶嫩芽,对应编号为ACK、BCK;ACK代表嫁接后的砧木短节白毫,BCK代表未经过嫁接的短节白毫;每个样本有3个重复。各样本分组以及对应信息在表1中列出。基于UPLC-MS/MS检测平台进行广泛靶向代谢组测序及生物信息学分析。
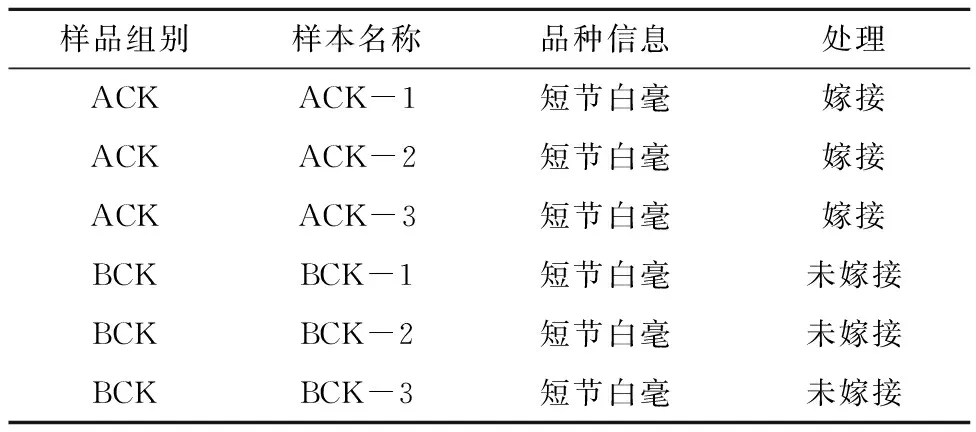
表1 样本信息及编号
使用冻干机(Scientz-100F)将样本进行真空冷冻干燥,然后用研磨仪(MM 400,Retsch)研磨(30 Hz,1.5 min)至粉末,称取100 mg样本粉末,用 1.2 mL 70%甲醇提取液将其溶解,进行6次涡旋,每次30 s,每次间隔30 min,之后将样本用4 ℃冰箱保存过夜,最后离心(转速12 000 r/min)10 min,用微孔滤膜(0.22 μm)过滤样本的上清液,放入进样瓶中进行UPLC-MS/MS分析。利用数据库MWDB(metware database)对质谱检测的一级谱、二级谱数据进行定性分析,将检测到的数据利用Analyst 1.6.3软件进行定性定量分析,使用MultiaQuant软件对质谱结果进行色谱峰的积分和校正,最终获得代谢物的相关数据。按照fold change≥2或fold change≤0.5且VIP(Variable Importance in Projection)≥1的标准筛选差异代谢物,并将差异代谢物注释到KEGG数据库中,绘制成柱形图。
1.5 转录组学分析
供试材料的各样本分组以及对应信息与代谢组一致,通过Illumina测序平台对样本进行转录组测序,对测序获得的原始数据进行筛选、测序错误率检测、GC含量分布检测,最后获得可用于分析的Clean Reads。将质控后的Clean Reads与参考基因组[22]的序列进行比对,以获取在参考基因组或基因上的位置信息和测序样本唯一的序列特征信息。之后对2个样本的FPKM值进行统计,用DEseq软件分析差异基因表达,将|log2Fold Change|≥1和FDR<0.05作为筛选差异基因的标准。筛选出差异基因后,将其注释到KEGG数据库,统计KEGG通路中差异基因的数量,并绘制柱形图。
1.6 联合分析
本研究中,对筛选出的差异代谢物和差异基因进行通路富集,并绘制柱状图。再将差异基因和差异代谢物采用相关性系数做出二者的关联图,相关性网络分析中的差异基因和差异代谢物之间需要存在一定的关联或概率才可以进行分析,选取每个通路中皮尔逊相关系数大于0.80且P<0.05的差异基因和差异代谢物作为相关性结果作图,揭示代谢物和基因的关系。最后,将筛选的差异基因和差异代谢物同时映射至KEGG通路,进行KEGG通路整合,形成基因和代谢物的调控网络图。
2 结果与分析
2.1 表型分析
随机选取茶树品种短节白毫嫁接前后的30个样本(共60个样本)的茶叶农艺学性状,测定结果列于表2中。可以看出,嫁接茶树中接穗对砧木的表型性状存在着一定的影响,叶面积和叶片厚度明显增加,节间变长。
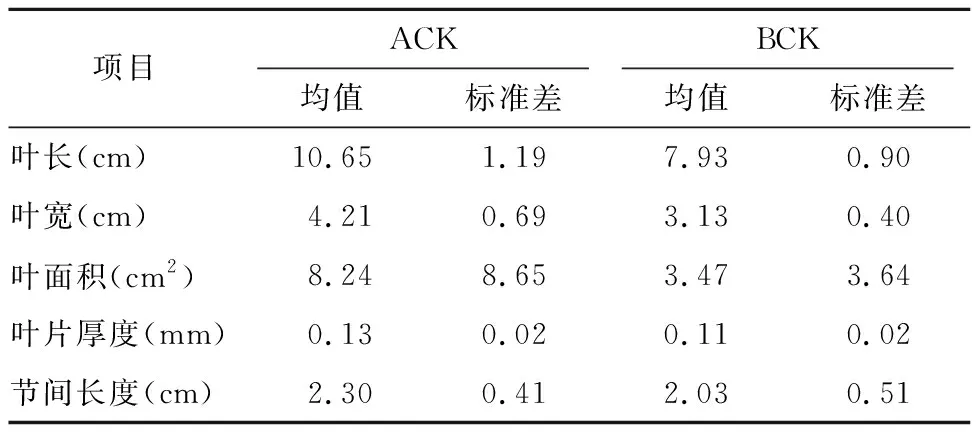
表2 茶叶样本的农艺性状
2.2 代谢组分析
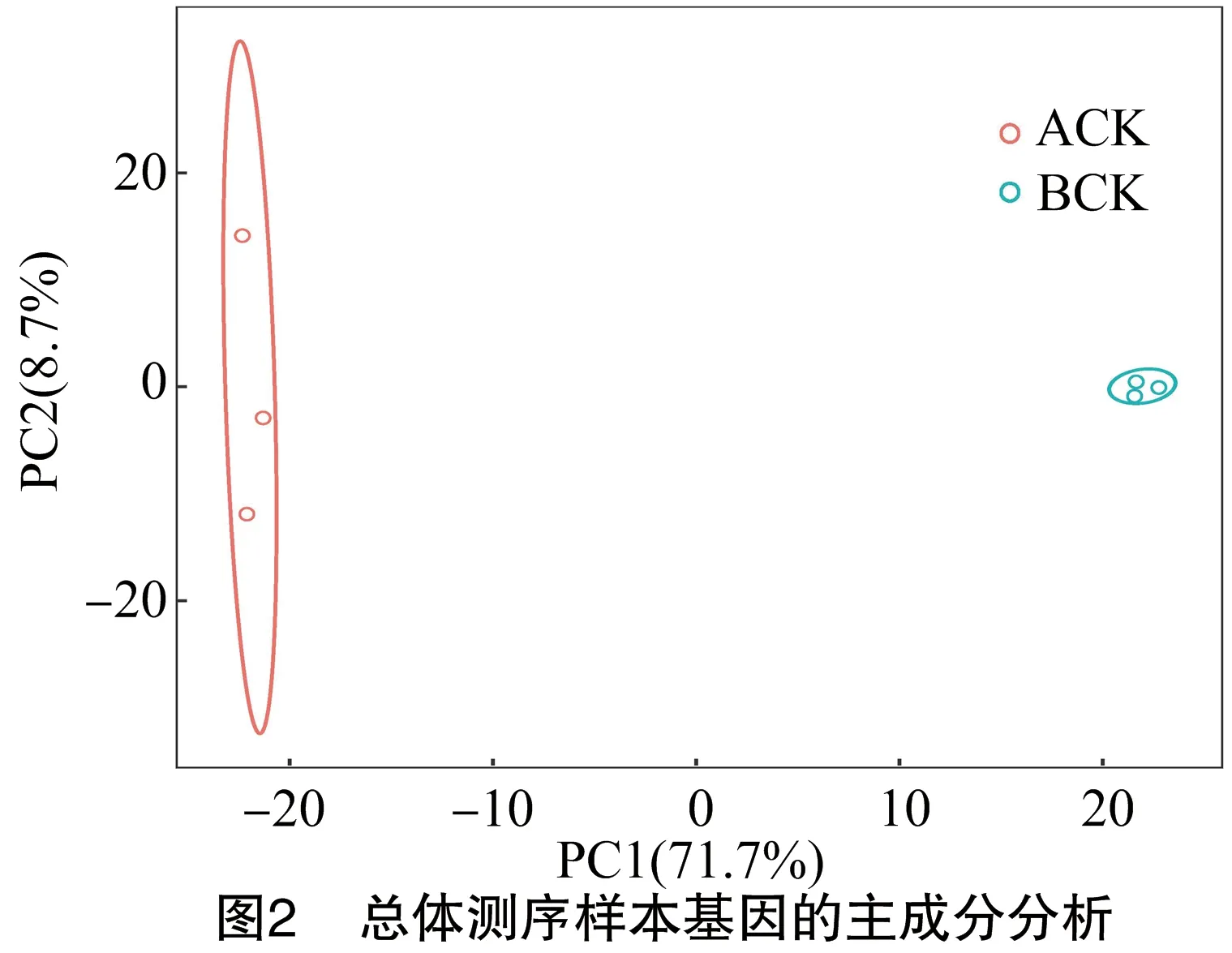
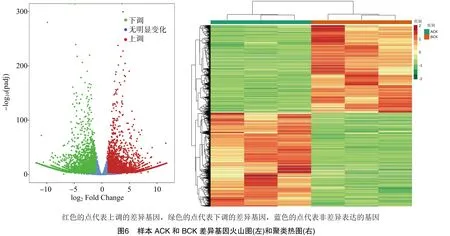
2.2.1 主成分分析 通过对测序样本进行PCA分析,可以从复杂数据中找到样本的聚集规律。分析结果中,样本的组成成分越相近,那么反映在PCA散点图中的距离越近。图2为总体测序样本代谢物的主成分分析图,可以看出样本ACK和BCK有明显的距离,说明嫁接前后的短节白毫的组分发生了明显的改变。
2.2.2 差异代谢物的筛选 通过对代谢物的定性定量分析,共检测到807个代谢物。其中ACK和BCK相比,有238个明显变化的差异代谢物,127个差异代谢物的丰度明显增加,而另111个明显降低(图3)。说明经过嫁接后,茶树接穗福云6号对砧木短节白毫产生了影响,有29.5%的代谢物发生了明显的差异变化。由表3可见,这些差异代谢物按照数量从多到少依次为黄酮类、酚酸类、鞣质、有机酸、氨基酸及其衍生物、核苷酸及其衍生物、脂质、其他类、木质素与香豆素、生物碱。
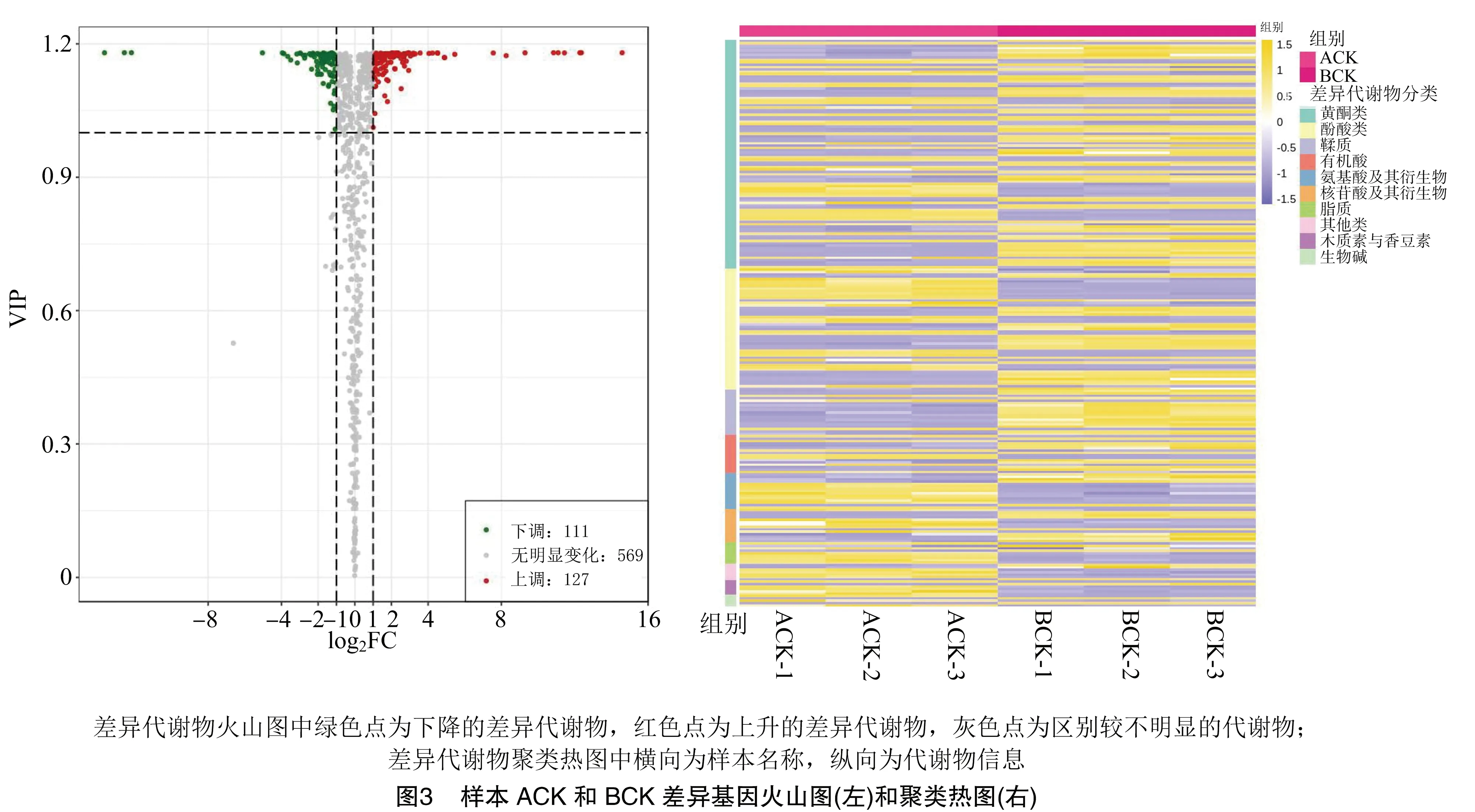
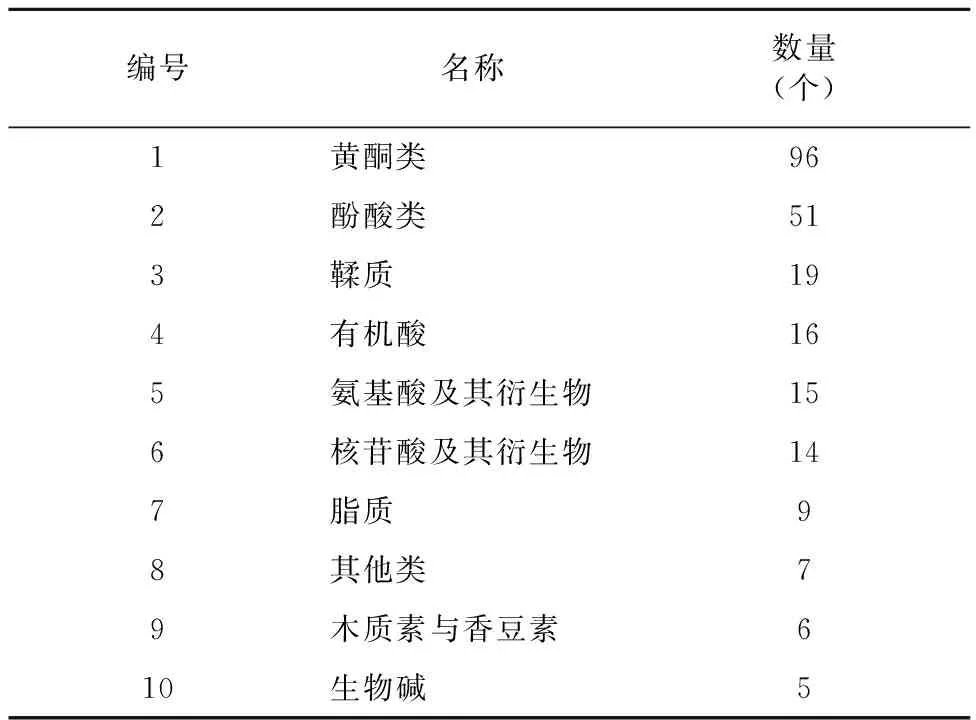
表3 样本ACK和BCK差异代谢物
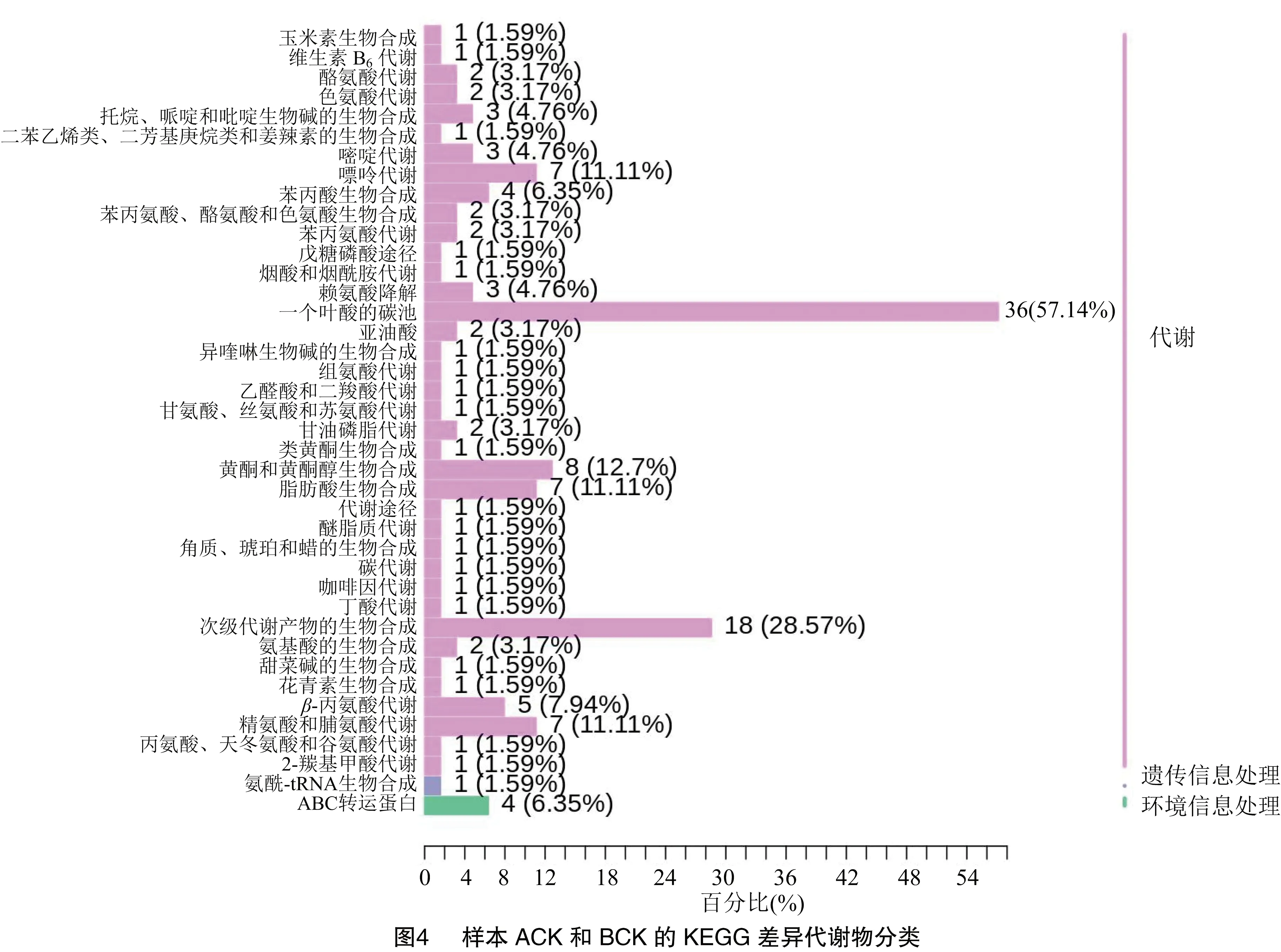
2.2.3 差异代谢物通路分析 差异代谢物在生物体内相互作用,形成了不同的通路。图4为样本ACK和BCK的差异代谢物KEGG通路图,路径分析表明,差异代谢物在40条KEGG通路中富集,大多数已经鉴定的差异代谢物存在于嘌呤的代谢、类黄酮的生物合成、黄酮及黄酮醇的生物合成、花青素生物合成等途径中。
2.3 转录组分析
2.3.1 测序数据的质控及比对 本研究共完成2个样本的转录组测序分析,各测序样本经过滤后的高质量序列数(Clean Reads)占原始下机序列数(Raw Reads)91%以上,其中ACK、BCK 2个样本平均获得43 931 135、43 325 123 Clean reads。Q20碱基百分比在97%及以上,Q30碱基百分比在92%及以上,整体测序错误率都在0.03%,且GC含量在43%~45%之间,说明测序质量可靠(表4)。
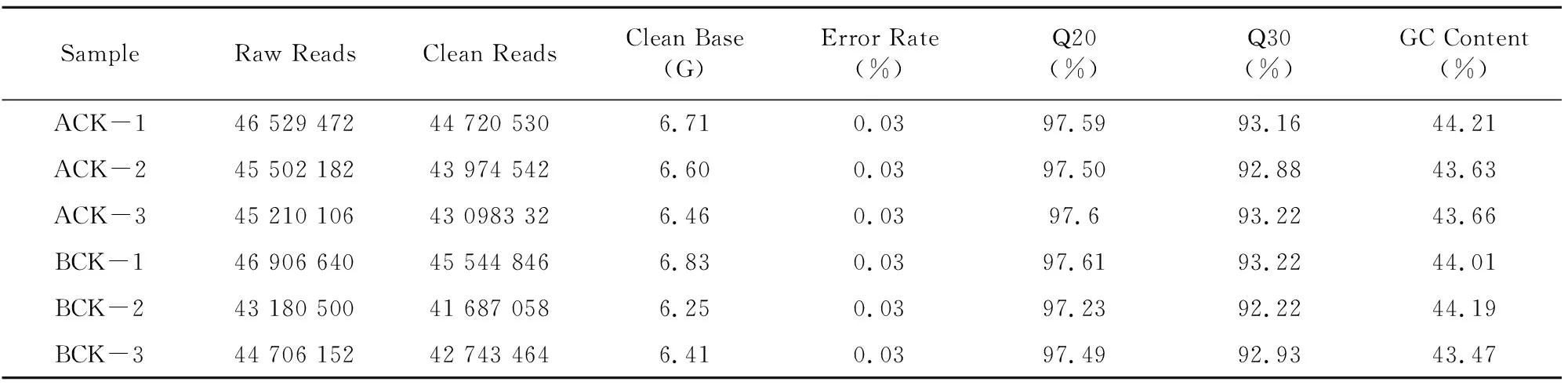
表4 2个样本数据过滤统计分析
2.3.2 样品基因表达量总体分布 从箱线图中不仅可以看出单个样本基因表达水平分散程度,还可以直观地比较出不同样本的整体基因表达水平。本研究各样本的FPKM箱线分布如图5所示,可以看出嫁接前后样本的基因表达量发生了一定的改变。
2.3.3 差异基因的筛选 通过与参考基因组比对,并对差异基因的FPKM进行聚类分析,共筛选出 9 984 个差异基因,ACK与BCK相比,有5 154个差异基因下调,4 830个差异基因上调。火山图可直观地显示2组样品中差异基因的总体分布,在聚类分析中,差异基因在同一样本的不同重复间表达量相似,样本重复性较好,而在嫁接前后对比中的表达量存在较大差异,说明嫁接后样本的差异基因发生了较大的改变(图6)。
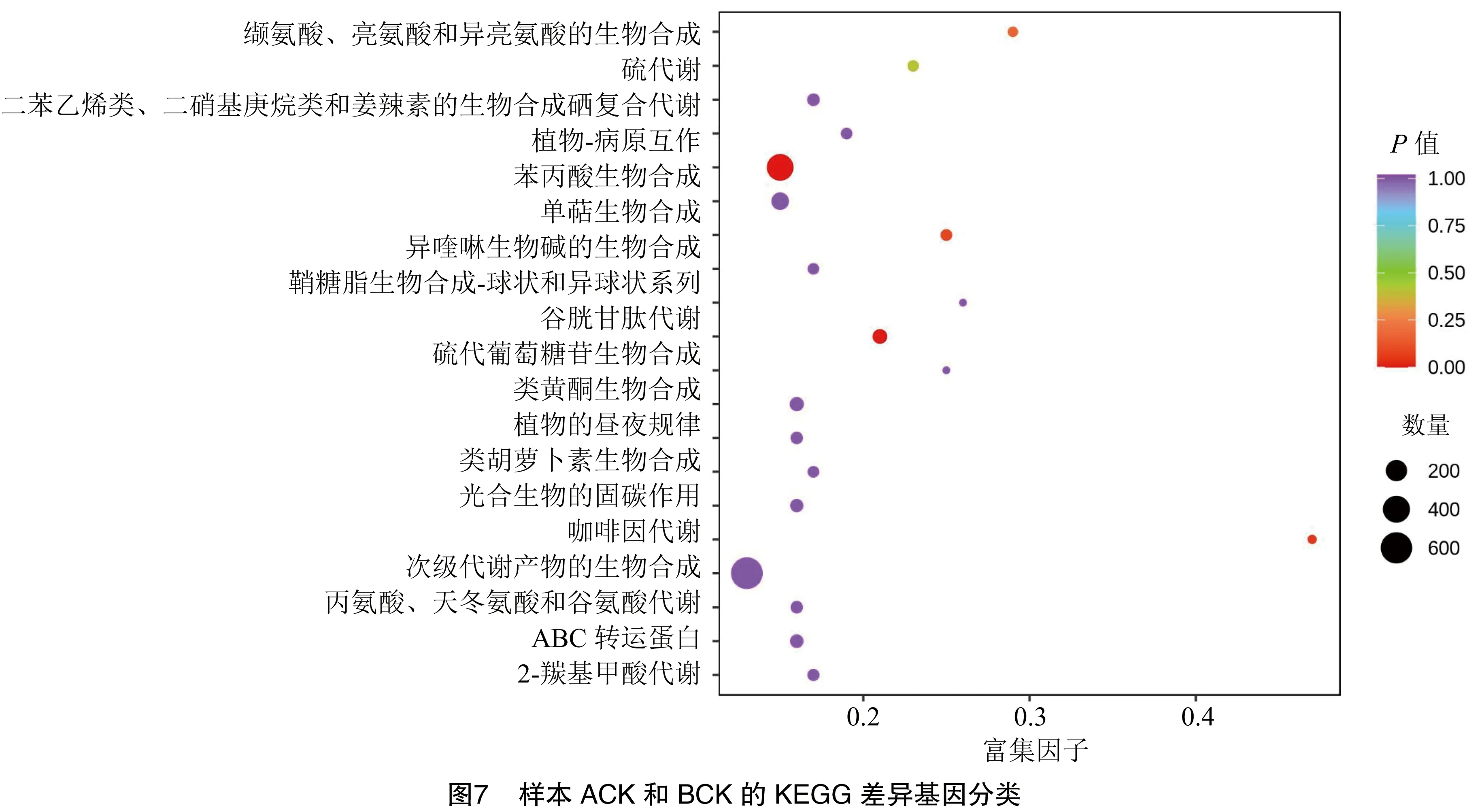
2.3.4 差异基因通路分析 生物体内的各种基因产物通过相互作用从而拥有生物学功能,对差异基因的通路注释分析可以更深入地理解基因的功能。ACK和BCK中,共有2 577个差异基因被注释到了140条通路中,这些通路主要包括植物-病原相互作用、植物激素信号转导、植物的MAPK信号、内质网中的蛋白质加工、苯丙烷生物合成等途径(图7)。
2.4 联合分析
通过KEGG通路富集分析(图8),可以看出ACK、BCK组合中共有63个差异代谢物和2 577个差异基因被注释到了41条通路中。这些通路主要包括次级代谢产物的生物合成、苯丙烷生物合成、氨基酸的生物合成、类黄酮生物合成、嘌呤代谢等途径。
黄酮类、氨基酸及酚酸类物质对茶叶品质的形成有着非常重要的影响,故本研究对短节白毫嫁接前后的黄酮类、氨基酸及酚酸类物质的合成通路进行重点分析。
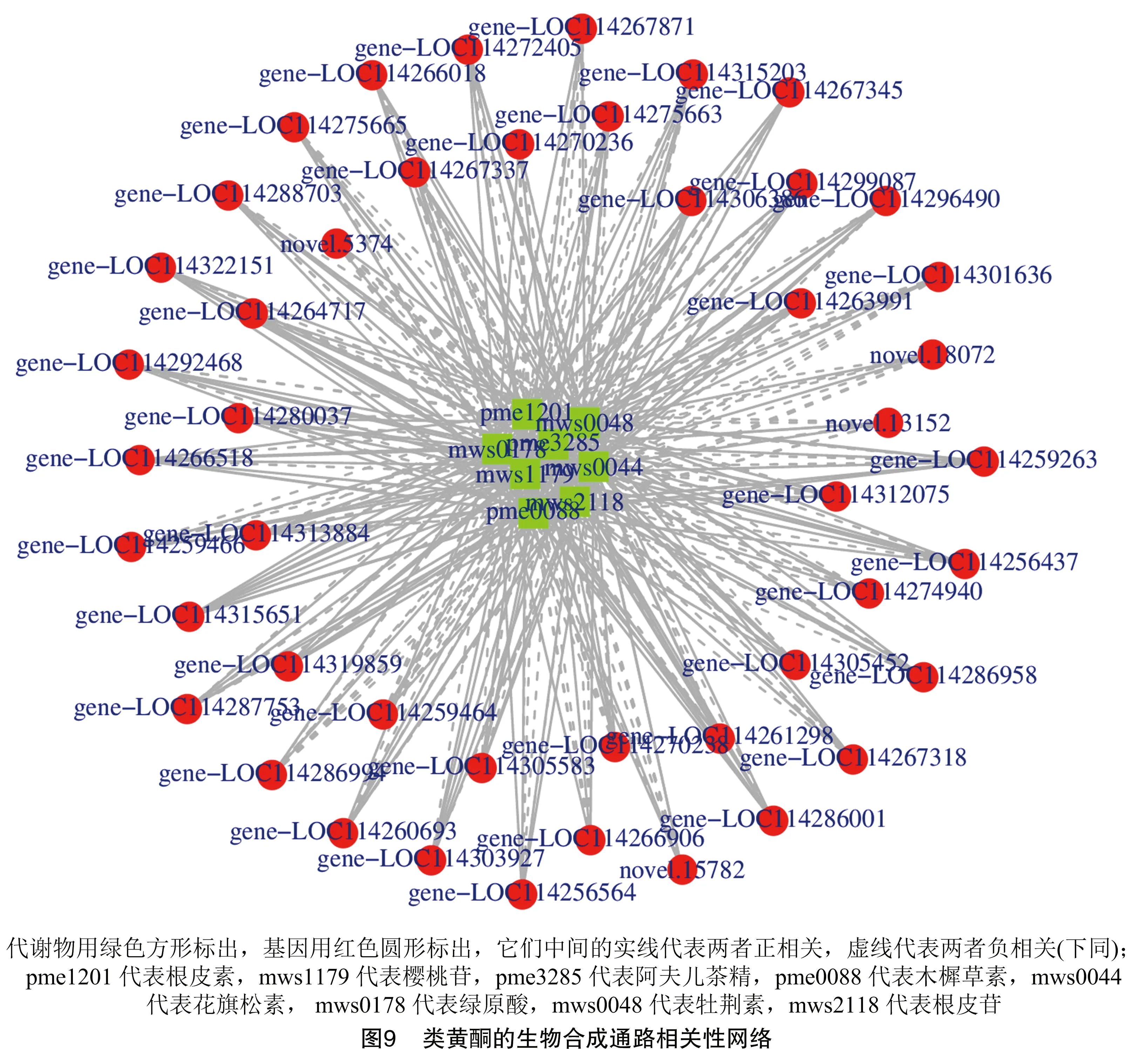
2.4.1 类黄酮的生物合成通路分析 类黄酮的生物合成通路(ko00941)中,有8个差异代谢物[阿夫儿茶精(C09320)、根皮素(C00774)、木樨草素(C01514)、花旗松素(C01617)、绿原酸(C00852)、牡荆素(C01460)、樱桃苷(C09099)、根皮苷(C01604)]与47个差异基因(LOC114256437、LOC114256564、LOC114259263、LOC114259464、LOC114259466、LOC114260693、LOC114261298、LOC114263991、LOC114264717、LOC114266018、LOC114266518、LOC114266906、LOC114267318、LOC114267337、LOC114267345、LOC114267871、LOC114270236、LOC114270238、LOC114272405、LOC114274940、LOC114275663、LOC114275665、LOC114280037、LOC114286001、LOC114286958、LOC114286994、LOC114287753、LOC114288703、LOC114292468、LOC114296490、LOC114299087、LOC114301636、LOC114303927、LOC114305452、LOC114305583、LOC114306386、LOC114312075、LOC114313884、LOC114315203、LOC114315651、LOC114319859、LOC114322151、LOC114256437、novel.13152、novel.15782、novel.18072、novel.5374)存在着一定的调控关系(图9)。
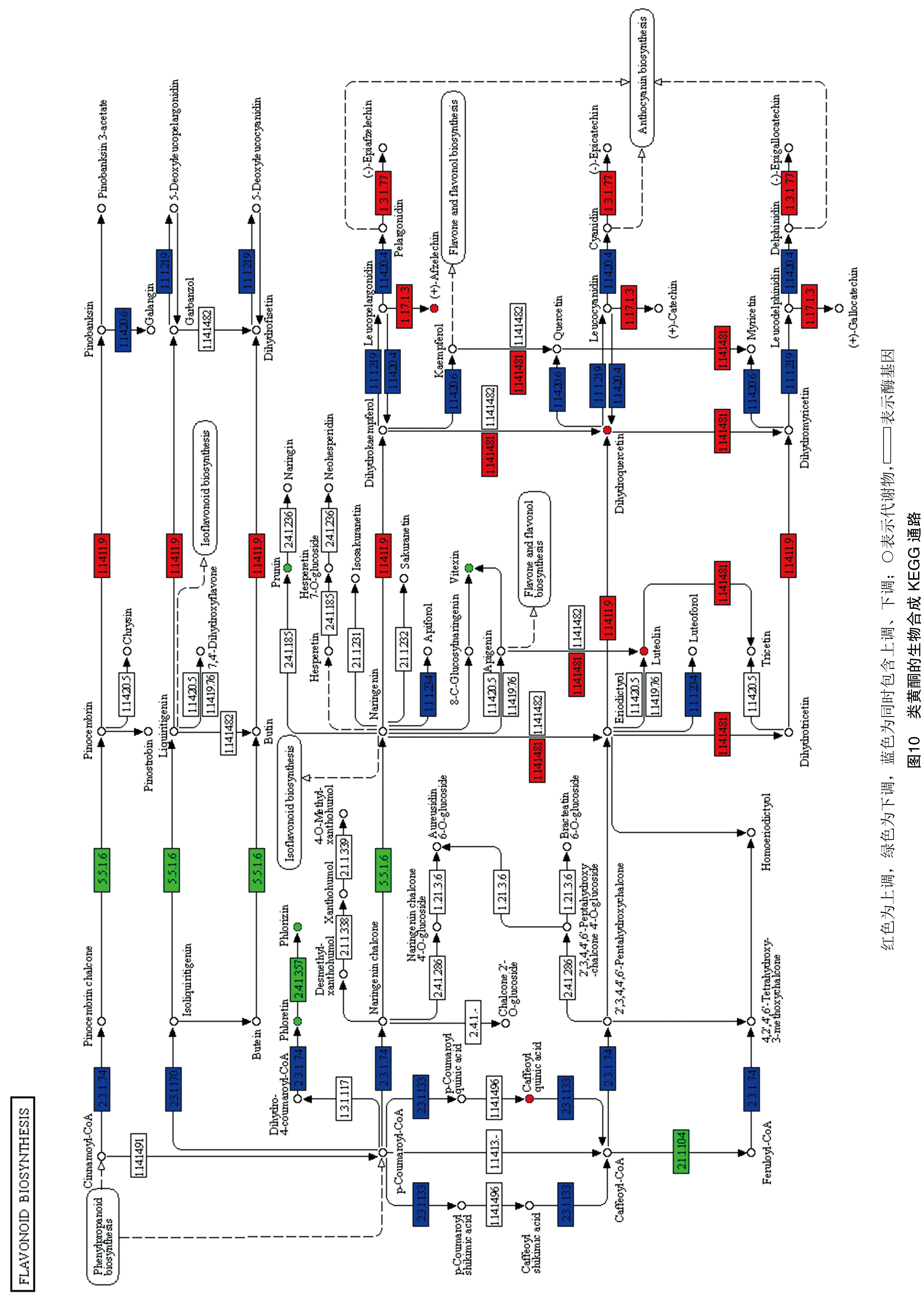
在KEGG通路可视化中(图10),ACK(嫁接后)和BCK(未嫁接)相比,结合前文的黄酮类差异代谢物统计结果(共96个,上调56个,下调40个),发现黄酮类物质从种类和数量上整体呈现上升趋势,说明嫁接后的ACK黄酮含量整体上是减少的。此通路中的黄酮类差异代谢物樱桃苷、牡荆素、根皮苷、根皮素呈低表达,而阿夫儿茶精、木樨草素、花旗松素呈高表达。其中根皮素在上调基因LOC114322151、LOC114270236和下调基因LOC114270238的调控下其含量降低,根皮苷在下调基因LOC114312075的调控下其含量降低,樱桃苷和牡荆素在下调基因LOC114259263的调控下其含量降低,阿夫儿茶精在上调基因LOC114266906的调控下其含量升高,花旗松素在上调基因LOC114261298的调控下其含量升高,木樨草素在上调基因LOC114261298的调控下其含量升高。
2.4.2 精氨酸和脯氨酸代谢通路分析 精氨酸和脯氨酸代谢通路(ko00330)中,有5个差异代谢物[4-胍基丁酸(C01035)、胍丁胺(C00179)、5-氨基戊酸(C00431)、乙酸胍(C00581)、γ-氨基丁酸(C00334)]与26个差异基因(LOC114260176、LOC114265516、LOC114269508、LOC114273252、LOC114276775、LOC114277967、LOC114285207、LOC114288439、LOC114290062、LOC114294609、LOC114303664、LOC114304913、LOC114313679、LOC114315487、LOC114260176、LOC114317839、LOC114318073、LOC114320768、novel.11085、novel.15379、novel.16185、novel.16616、novel.18748、novel.299、novel.443、novel.8839)存在着一定的调控关系(图11)。
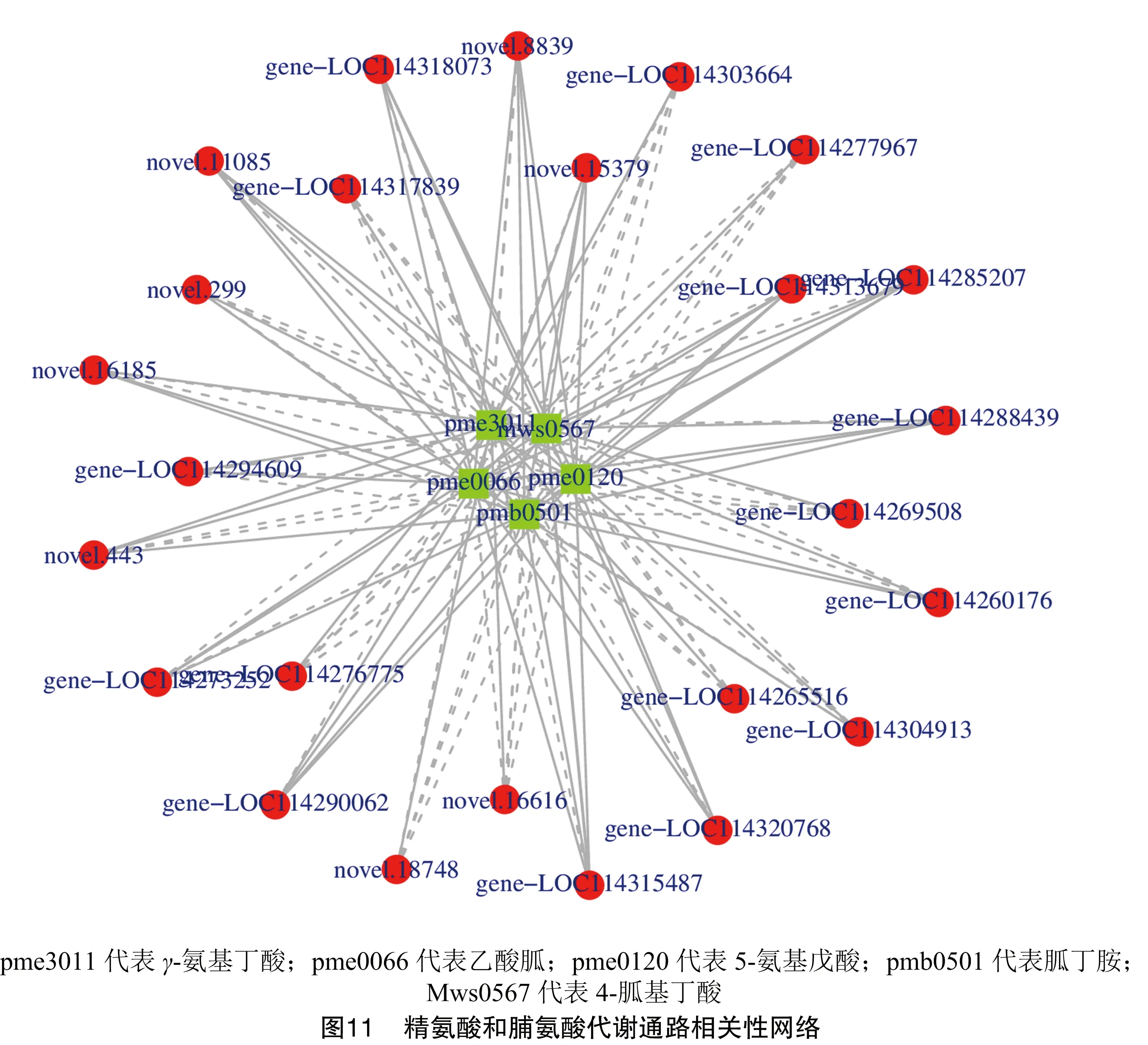
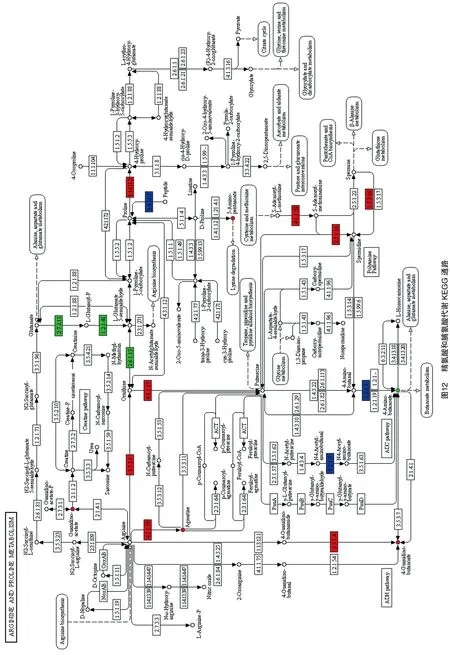
在KEGG通路可视化中(图12),ACK和BCK相比,结合前文的氨基酸及其衍生物的差异代谢物统计结果(共15个,其中上调5个,下调10个),发现氨基酸及其衍生物从种类和数量上整体呈现下降趋势,说明嫁接后的A3氨基酸及其衍生物含量整体上是增加的。在此通路中的氨基酸及其衍生物类差异代谢物5-氨基戊酸和乙酸胍的含量是增加的。5-氨基戊酸在上调基因LOC114320768、novel.15379的调控下其含量增加,乙酸胍在上调基因LOC114269508、LOC114303664、LOC114269508、LOC114303664的调控下其含量增加。
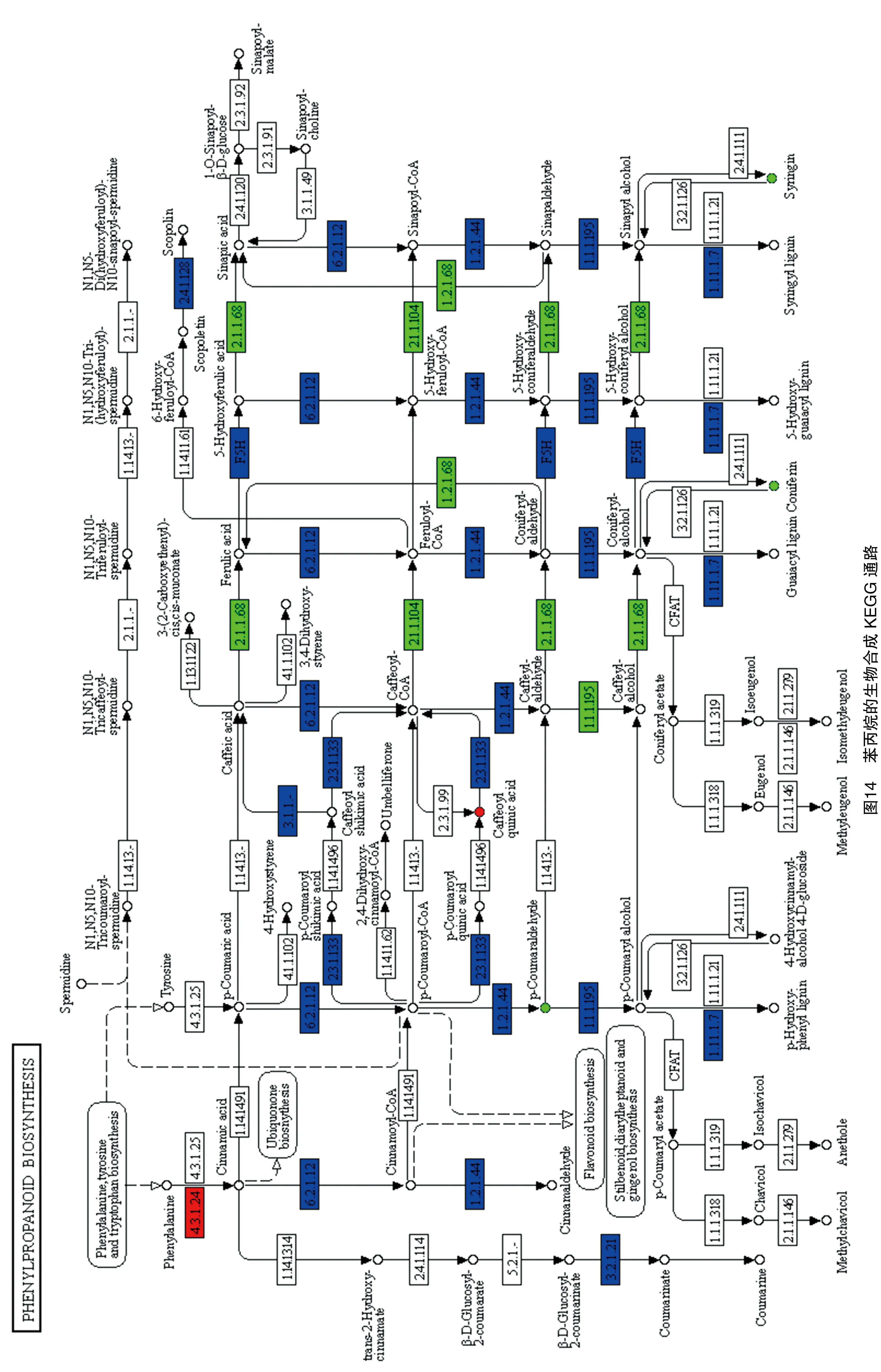
2.4.3 苯丙烷的生物合成通路 苯丙烷的生物合成通路(ko00940)中,有4个差异代谢物[对香豆醛(C05608)、松柏苷(C00761)、绿原酸(C00852)、紫丁香苷(C01533)]与106个差异基因(LOC114256437、LOC114256564、LOC114257237、LOC114257689、LOC114257730、LOC114258465、LOC114258906、LOC114258943、LOC114259464、LOC114259466、LOC114260459、LOC114262583、LOC114262994、LOC114263991、LOC114264503、LOC114264717、LOC114265680、LOC114265749、LOC114266018、LOC114266518、LOC114267042、LOC114267318、LOC114267337、LOC114267339、LOC114267345、LOC114267871、LOC114268545、LOC114269233、LOC114270247、LOC114270690、LOC114271793、LOC114272405、LOC114272408、LOC114274262、LOC114275663、LOC114275665、LOC114278685、LOC114278832、LOC114281235、LOC114281633、LOC114282324、LOC114282326、LOC114283463、LOC114283464、LOC114284668、LOC114286001、LOC114286958、LOC114287892、LOC114288093、LOC114288703、LOC114292363、LOC114292468、LOC114292633、LOC114293833、LOC114296006、LOC114296174、LOC114296490、LOC114297845、LOC114298482、LOC114299631、LOC114302292、LOC114303070、LOC114303752、LOC114303927、LOC114304830、LOC114305112、LOC114305583、LOC114305594、LOC114305605、LOC114308066、LOC114308469、LOC114308775、LOC114308776、LOC114309119、LOC114309223、LOC114309410、LOC114309568、LOC114310843、LOC114311453、LOC114311917、LOC114313884、LOC114314146、LOC114314337、LOC114315203、LOC114315274、LOC114315460、LOC114315462、LOC114316100、LOC114317021、LOC114318050、LOC114318719、LOC114318737、LOC114319656、LOC114256437、LOC114319859、LOC114323055、novel.10226、novel.13152、novel.13415、novel.15157、novel.15499、novel.15782、novel.18072、novel.4981、novel.7088、novel.8826)存在着一定的调控关系(图13)。
在KEGG通路可视化中(图14),ACK和BCK相比,结合前面酚酸类差异代谢物统计结果(共51个,其中上调25个,下调26个),发现酚酸类物质从种类和数量上整体呈现下降趋势,说明嫁接后的A3酚酸类物质含量整体上是增加的。在此通路中的差异代谢物对香豆醛、松柏苷、紫丁香苷呈低表达,绿原酸呈高表达,对香豆醛在上调基因LOC114292363、LOC114296174、LOC114302292、LOC114310843和下调基因LOC114257237、LOC114268545、LOC114284668、LOC114314337、novel.10469的调控下其含量降低,松柏苷在下调基因LOC114258943、LOC114291012、LOC114298482、LOC114311917的调控下其含量降低,紫丁香苷在下调基因LOC114258943、LOC114291012、LOC114298482、LOC114311917的调控下其含量降低,绿原酸在上调基因LOC114319859、LOC114256437、LOC114256564、LOC114263991、LOC114264717、LOC114266018、LOC114266518、LOC114267318、LOC114267337、LOC114267345、LOC114272405、LOC114286958、LOC114292468、LOC114296490、LOC114313883、LOC114313884、LOC114313885、novel.13152、novel.15782和下调基因LOC114259464、LOC114259466、LOC114267871、LOC114286001、LOC114288703、LOC114315203、novel.18072的调控下其含量增加。
3 讨论
范盛尧通过嫁接试验,得出接穗郁李对杏砧的茎、叶、花性状都有所改变的结论[23]。本研究通过形态观察发现,嫁接后的砧木短节白毫叶长和叶宽都有显著的增加,叶质变得较柔软,节间变长。
周开兵等研究表明,接穗对砧木的生理生化活性有一定的影响[24]。在本研究中,未嫁接的砧木短节白毫和嫁接后的砧木短节白毫之间共检测和定量了807种代谢物,且有238种显著变化的差异代谢物,说明经过嫁接后,接穗福云6号对砧木短节白毫产生了影响,有29.5%的代谢物发生了显著的差异变化。
黄酮对茶叶非常重要,有着很多的保健功效,如降胆固醇、抗病毒、增强免疫力等[25-26]。通过分析代谢组与转录组数据发现,短节白毫在嫁接前后共检测到了黄酮类差异代谢物96个,嫁接后有40个黄酮类物质含量增加,56个黄酮类物质含量减少。在类黄酮的生物合成通路(ko00941)中,有8个差异代谢物和47个差异基因参与类黄酮生物合成的代谢通路,黄酮类差异代谢物樱桃苷、牡荆素、根皮苷、根皮素在嫁接后其含量增加,阿夫儿茶精、木樨草素、花旗松素在嫁接后其含量降低,该通路中的相关调控基因LOC114322151、LOC114270238等在嫁接后含量既有增加也有减少,包括其他通路中黄酮类差异代谢物和差异基因在内的变化使得嫁接后的短节白毫的黄酮种类整体上是减少的。从黄酮对茶叶的影响来看,以福云6号为接穗、短节白毫为砧木进行嫁接,不利于短节白毫的品质形成。
氨基酸的组成、含量和降解产物对茶叶的品质有非常重要的影响[27],是构成茶叶滋味的重要组成部分,其含量越高,茶的味道越好、香气越浓[28-29]。通过分析代谢组与转录组数据发现,短节白毫在嫁接前后共检测到了氨基酸及其衍生物15个,嫁接后有10个氨基酸及其衍生物含量增加,5个氨基酸及其衍生物含量减少。在氨基酸的生物合成通路(ko01230)中,有5个差异代谢物和26个差异基因参与了该代谢通路,发现在此通路中的氨基酸及其衍生物类差异代谢物5-氨基戊酸和乙酸胍的含量在嫁接后含量降低,调控这2个代谢物的相关基因LOC114320768、LOC114269508等在嫁接后含量均降低,但是其他通路中氨基酸及其衍生物类的差异代谢物和差异基因的变化使得嫁接后的短节白毫氨基酸及其衍生物含量整体上是增加的。从氨基酸及其衍生物的含量方面分析,以福云6号为接穗、短节白毫为砧木进行嫁接,可以促进短节白毫的品质形成。
茶叶中的酚酸类物质具有利胆、降压、治疗冠心病等作用[30]。通过代谢组与转录组数据表明,短节白毫在嫁接前后共检测到了酚酸类差异代谢物51个,嫁接后有26个酚酸类物质含量增加,25个酚酸类物质含量减少。在苯丙烷的生物合成通路(ko00940)中,有4个差异代谢物和106个差异基因参与了该代谢通路,发现在此通路中的酚酸类差异代谢物中,对香豆醛、松柏苷、紫丁香苷呈现嫁接后含量增加,绿原酸在嫁接后含量降低,相关调控基因LOC114310843、LOC114257237等在嫁接后含量既有增加也有减少,包括其他通路中酚酸类差异代谢物和差异基因的变化使得嫁接后的短节白毫酚酸类物质含量在整体上是增加的。因此,从酚酸类物质含量方面来分析,以福云6号为接穗、短节白毫为砧木进行嫁接,可以促进短节白毫的品质形成。
4 结论
茶树品种短节白毫作为砧木在嫁接后表型性状发生了改变,叶长、叶宽显著增加,节间变长。
茶树品种短节白毫作为砧木在嫁接前后共检测到807个代谢物,其中有238个显著变化的差异代谢物,127个差异代谢物的在嫁接后含量降低,而另111个含量增加。这些差异代谢物按照数量从多到少依次为黄酮类、酚酸类、鞣质、有机酸、氨基酸及其衍生物、核苷酸及其衍生物、脂质、其他类、木质素与香豆素、生物碱。且差异代谢物在40条KEGG 通路中富集,大多数已经鉴定的差异代谢物存在于嘌呤的代谢、类黄酮的生物合成、黄酮及黄酮醇的生物合成、花青素生物合成等途径中。筛选出9 984个差异基因,4 830个差异基因在嫁接后含量降低,有5 154个差异基因在嫁接后含量增加,差异基因在140条KEGG通路中富集,大多数已经鉴定的差异基因存在于植物-病原相互作用、植物激素信号转导、植物的MAPK信号、内质网中的蛋白质加工、苯丙烷生物合成等途径中。
短节白毫作为砧木在嫁接后,其黄酮类物质含量[根皮苷(C01604)等]在基因LOC1142564376等的调控下整体上是减少的;氨基酸及其衍生物类物质含量[5-氨基戊酸(C00431)等]在基因LOC114260176等的调控下整体上是增加的;酚酸类物质含量[对香豆醛(C05608)等]在基因LOC114292363等的调控下整体上是增加的。

