不同凋落物水浸提液对杉木种子萌发和幼苗早期生长的化感作用
李梦琪, 赵 冲, 罗 航, 陈 杭, 刘 博, 王正宁
(1.福建农林大学林学院,福建福州 350007; 2.曲阜师范大学生命科学学院,山东曲阜 273100; 3.莆田南门学校,福建莆田 351100)
凋落物是森林生态系统中的一部分,参与了生态系统的物质循环,在很大程度上影响了森林的生长及天然更新[1]。凋落物层是植物种子脱落后的最初始阶段接触的物理环境,而在森林天然更新的过程中,种子萌发及早期生长阶段最为敏感和脆弱,也明显受到凋落物的影响[2-4]。目前,凋落物的水源涵养和水土保持功能、养分循环状况及分解速率等一直是凋落物生态学方面研究的重点,而目前尚少见将凋落物作为单独的因子研究其对森林植被更新的影响[5-6]。
物理、化学和生物作用机制是凋落物影响种子萌发和早期生长的三大作用机制,其中化学作用,即化感作用具有重要影响[7]。研究发现,森林凋落物可以通过雨水淋溶、腐烂分解或者微生物作用等途径将化感物质释放入土壤环境中,影响种子休眠、萌发、幼苗生长等过程,进而调节群落的物种组成,并进一步影响种群的自然更新和群落演替等过程[8-9]。罗侠等的研究结果显示,不同干质量浓度(0.025、0.050、0.100、0.200、0.300 g/mL)的天山云杉(Piceaschrekiana)凋落物水浸提液对自身种子萌发和幼苗生长均起着不同程度的抑制作用,并且浓度越高,抑制作用越强[10]。晋梦然等为了研究格氏栲(Castanopsiskawakamii)天然林凋落物浸提液对杉木(Cunninghamialanceolata)种子萌发与胚根生长的影响,分别对不同分解层、不同浓度凋落物浸提液与种子萌发和生长相关指标的相关性进行分析,结果显示,5种料液比(1 g ∶5 mL、1 g ∶10 mL、1 g ∶30 mL、1 g ∶50 mL、1 g ∶100 mL)的格氏栲天然林凋落物浸提液对杉木种子萌发总体表现出“低促高抑”的作用[11]。庄正等通过设置不同浓度(10、20、40 g/L)的杉木凋落物水浸提液,研究其对杉木种子萌发及超氧化物歧化酶(SOD)、过氧化物酶(POD)等相关酶活性的化感作用,结果表明,化感作用强度与浸提液浓度呈正相关,对杉木种苗的抑制作用随杉木凋落物浸提液浓度的增加而增强[12]。雷日平等的研究结果表明,不同浓度华山松(Pinusarmandi)与锐齿栎(Quercusacutissima)凋落物浸提液对油松(Pinustabulaeformis)种子发芽无显著影响,但对油松幼苗的生长均有明显的促进作用[13]。众多研究结果表明,化感物质对植物生长会产生各种促进或抑制作用,但是由于森林的树种组成不同,各种林分差异明显,不同类型的凋落物(如针叶和阔叶)在分解时产生的化感物质也不相同,在不同浓度处理下植物的反应也有所差异,因此会对种子萌发与幼苗生长产生不同影响[11,14-15]。
杉木是我国南方地区种植面积最大的经济树种,在满足我国木材需求和维持生态安全中发挥着重要作用。但在长期的经营过程中,杉木人工林因林分结构简单、林龄单一,引起了一系列种植障碍,如土壤板结、养分含量降低、有毒物质积累及林木产量难以长期维持等,这些都会影响杉木林的可持续健康发展[16]。木荷(Schimasuperba)是我国常见的常绿阔叶树,以其为优势种的常绿阔叶林群落在我国南方地区分布广泛。何宗明等通过6年的观测试验发现,杉木的8种伴生植物中木荷对杉木株高的促进效果最明显[17]。曹光球也通过试验证实,在种间生化物质关系的研究中,木荷化感物质对杉木化感物质的毒性具有一定程度的降解作用[18]。因此,目前木荷也被当作杉木的理想混交树种广泛用于营造针阔混交林分[19]。部分研究发现,影响杉木种子萌发及幼苗生长的原因之一是林下不断累积的凋落物产生的化感物质抑制了杉木种子萌发及幼苗生长,但是目前尚不清楚杉木和木荷混交后会对杉木种子萌发和幼苗生长机制产生怎样的影响[3]。并且,尽管目前已有关于凋落物浸提液对种子萌发和幼苗生长的研究,但是大部分研究都采用培养皿的试验方法[20],具有一定的局限性。本试验采用盆栽方法,种子萌发与幼苗生长试验均在花盆中进行,更有利于模拟自然环境。本试验设计参考前人的方法,设置3种凋落物类型(杉木、木荷、混合凋落物)和5种浸提液浓度(0与10、20、50、100 g/L 浸提液)[11-12,21],探究凋落物的化感作用对杉木种子萌发、幼苗存活、生物量累计和分配及幼苗叶片生理特性的影响,从而探明不同类型凋落物的不同浓度浸提液如何影响杉木种子的萌发及生长,为杉木人工林的可持续发展研究提供依据。
1 材料与方法
1.1 试验材料的收集与处理
本试验所需的杉木种子于2017年11月下旬从福建省漳平五一国有林场(25°02′N,117°29′E)收集,本试验于福建农林大学林学院实验室开展。试验开始前,先用0.3%高锰酸钾(K2MnO4)对种子进行消毒,30 min后用去离子水把种子清洗干净,将种子静置3 h后,去除浮在水面的种子,再把剩下的种子放置在45 ℃温水中自然冷却,浸泡时间为1 h,最后挑选自然下沉、形状大小一致的种子备用[10]。
收集杉木、木荷的凋落物带回实验室,等凋落物自然风干后,将其放进烘箱中烘至恒质量,随后用粉碎机粉碎,再用2 mm筛过筛。试验共设置3种凋落物类型(杉木、木荷及混合凋落物),每种类型的凋落物各称取100 g装入棕色瓶子中,注入 1 000 mL 蒸馏水,在室温下避光浸提48 h,然后将溶液过滤,把提取的浸提液放入棕色瓶中,于2 ℃低温保存。试验时将母液稀释至10、20、50、100 g/L,经高压灭菌后储存备用,以灭菌后的蒸馏水(0 g/L)作为对照。
本试验为盆栽试验,以河沙为生长基质,每盆称取3.2 kg清洗后经高温灭菌的河沙,每个处理设置5个重复,每个重复均匀撒播50粒经过处理的杉木种子。用3种不同类型的水浸提液进行喷洒,每种类型的凋落物水浸提液设置5种浓度(0、10、20、50、100 g/L),第1次均喷洒100 mL水浸提液,对照喷施100 mL蒸馏水。之后每隔2 d喷洒50 mL水浸提液和蒸馏水。种子萌发结束后继续进行幼苗生长试验,此时将浇灌时间延长至3 d 1次。
1.2 指标测定内容与方法
1.2.1 种子萌发指标的测定 将种子播种后,每天记录其萌发状况,连续2周后没有新种子萌发便结束观测试验,萌发时间大约为1个月。种子萌发的标准为出现第1张真叶;幼苗存活的标准为具有鲜活的根、茎、叶[22]。相关计算公式:
种子萌发率=(种子发芽数/种子数)×100%;
幼苗存活率=(试验结束时存活的幼苗数/种子发芽数)×100%[23]。
化感作用(RI)计算公式:
RI=1-C/T。
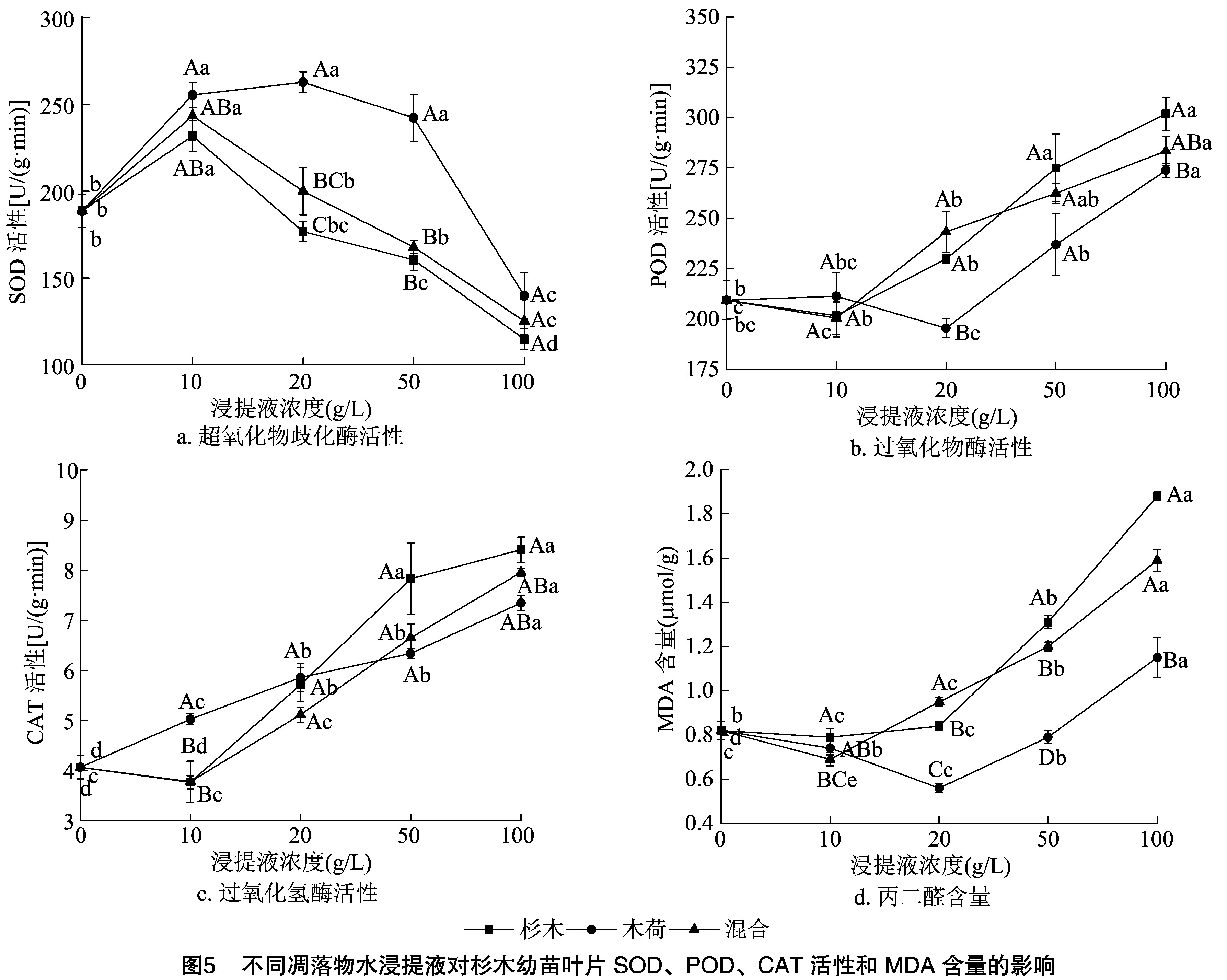
式中:T为处理值,C为对照值[11]。当T≥C、RI>0时为促进作用;当T 1.2.2 幼苗形态指标的测定 种子萌发试验结束后,不改变任何环境条件继续培养幼苗2个月,全部试验结束后,收回所有培养的幼苗,清洗干净后每盆随机选择5株幼苗,分离其根、茎、叶,然后用毫米刻度尺测量杉木幼苗的根长、茎长和株高,记录数据。 1.2.3 幼苗生物量积累及其分配测定 用信封将幼苗的根、茎、叶进行分装,装好后置于80 ℃烘箱中,干燥48 h至恒质量,用0.000 1 g电子分析天平称质量,分别计算根、茎、叶的生物量和总生物量与根生物量占比(根生物量/总生物量)、茎生物量占比(茎生物量/总生物量)、叶生物量占比(叶生物量/总生物量)、根冠比(根生物量/地上生物量)[3]。 1.2.4 幼苗叶片生理指标的测定 试验时先将杉木幼苗叶片用纯水冲洗干净、擦干,从中称取0.2 g放入提前预冷却的研钵中,随后加入1 mL pH值为7.8的磷酸缓冲液将其研磨成匀浆,再用4 mL磷酸缓冲液,多次少量地将匀浆冲洗到5 mL离心管中,用离心机冷冻离心(4 ℃、10 000 r/min)20 min后,用胶头滴管吸取上清液到新离心管中,放入4 ℃冰箱中保存,作为待测酶液,可以用来测定SOD、POD、过氧化氢酶(CAT)活性及丙二醛(MDA)含量,每个指标都需测定3次[12]。 本试验采用氮蓝四唑法对SOD活性进行测定[24],POD活性的测定选用愈创木酚法[25],CAT活性的测定采用紫外吸收法[26],采用硫代巴比妥酸法[27]测定MDA含量。 本试验用Excel 2010对数据进行整理,用SPSS 20.0软件对整理后的数据进行统计分析,用Excel 2010、Origin 2018进行图表的绘制,采用双因素方差分析法(Two-way ANOVA)分析不同类型、不同浓度凋落物水浸提液以及两者交互作用是否对杉木种子萌发率、幼苗存活率、根长、茎长、苗高、根生物量、茎生物量、叶生物量、总生物量、根生物量占比、茎生物量占比、叶生物量占比、根冠比及SOD、POD、CAT活性、MDA含量产生显著影响,用最小显著性差异法(LSD)进行显著性检验。 由表1可以看出,凋落物水浸提液的浓度对杉木种子萌发及幼苗存活存在极显著影响,凋落物水浸提液类型及凋落物水浸提液的浓度与凋落物水浸提液类型的交互作用则对其无显著影响。 图1显示,本试验所挑选的3种类型的凋落物中,随着凋落物浸提液浓度不断增高,杉木种子的萌发率和幼苗的存活率呈现出先升高后下降的趋势。在3种凋落物水浸提液作用下,当浓度为10、20 g/L时,种子萌发及幼苗的存活都受到促进,当水浸提液浓度提升至100 g/L时,则会抑制种子萌发及幼苗的存活,且浓度越大,抑制作用越强。当浸提液浓度为10 g/L时,杉木、混合浸提液处理下种子的萌发率、幼苗的存活率均高于木荷凋落物浸提液处理,而当浸提液浓度提升至20、50、100 g/L时,木荷凋落物浸提液处理下种子的萌发率、幼苗的存活率反而高于杉木、混合浸提液处理。由此可以看出,在同样的处理下,木荷浸提液对杉木种子萌发、幼苗存活的反应与杉木和混合浸提液处理下的反应有差异,但是杉木与混合凋落物浸提液处理下杉木种子的萌发率和幼苗的存活率差异很小。 由表1可知,凋落物水浸提液类型只对杉木幼苗根长起显著影响,而对茎长、苗高无显著作用,凋落物水浸提液浓度不仅影响杉木幼苗的根长,而且对其茎长、苗高都具有显著影响,但凋落物水浸提液类型与凋落物水浸提液浓度的交互作用对三者均无显著影响。 表1 不同凋落物水浸提液对杉木种子萌发率、幼苗存活率和生长及生理特征的双因素方差分析 由图2可知,随着掉落物浸提液浓度的升高,杉木根长呈先上升后下降的趋势,且在10、20 g/L浸提液浓度下,根长均显著高于对照,此时的浓度明显是利于根系生长的;当浸提液浓度为100 g/L时,根长显著低于对照,在杉木、木荷、混合浸提液处理下分别下降了约24.0%、19.2%、21.8%。在3种凋落物浸提液处理下,杉木幼苗的茎长、苗高整体上随着浓度的提升而降低,除了在20 g/L浓度的混合浸提液下茎长高于对照,10 g/L浓度的杉木浸提液下苗高高于对照,其他浓度处理下的相应指标均低于对照。在3种浸提液处理下,幼苗茎长分别下降了14.0%、12.9%、12.9%,幼苗的苗高分别下降了13.1%、11.4%、20.3%。通过对比3种类型凋落物处理后的数据发现,在杉木浸提液处理下,幼苗较高但根、茎长较短;在木荷浸提液处理下,幼苗根较长但茎长、苗高均受到抑制,而受混合浸提液的影响,杉木幼苗的苗高较低,根、茎较长。综合比较分析得出,影响杉木幼苗根长、茎长和苗高的主要因素是浸提液浓度。 由表1可知,凋落物水浸提液浓度对幼苗根、茎、叶及总生物量均有极显著影响,而凋落物水浸提液的类型以及凋落物水浸提液浓度与凋落物水浸提液的类型的交互作用则对杉木幼苗的叶生物量和总生物有显著影响。 由图3可知,在3种凋落物浸提液处理下,杉木幼苗的根、茎、叶和总生物量等指标都呈现出先增后降的趋势。在杉木浸提液和混合浸提液处理下,幼苗的根、茎、叶及总生物量都在10 g/L浓度时达到最高值,且高于对照,随后便呈下降趋势,在50、100 g/L浓度时均低于对照。在木荷浸提液处理下,幼苗的根、茎、叶及总生物量都在10、20 g/L浓度时高于对照,并且在20 g/L浓度时达到最高值,随后在高浓度浸提液处理下,生物量显著下降。在3种凋落物浸提液处理下,杉木幼苗的茎生物量在低浓度处理下显著提高,而在高浓度处理下茎生物量与对照相比差异较小。幼苗的叶生物量与总生物量在不同浸提液处理下有几乎相同的变化趋势,在杉木浸提液处理下的幼苗根生物量低于木荷和混合浸提液处理下的根生物量。 由表1可以看出,不同凋落物水浸提液的类型对杉木幼苗的根生物量占比、叶生物量占比和根冠比影响显著,而杉木幼苗的茎生物量占比受到凋落物水浸提液类型的影响并不显著。不同凋落物水浸提液浓度对杉木幼苗茎生物量占比、叶生物量占比影响显著,幼苗的根生物量占比、根冠比受浸提液浓度的影响甚微。凋落物水浸提液浓度与凋落物水浸提液类型的交互作用对幼苗生物量的分配无显著影响。 由图4可以看出,杉木幼苗的根生物量与根冠比的变化趋势大致相同,随着杉木凋落物浸提液浓度的提高,杉木幼苗的根生物量与根冠比下降,且均低于对照。在木荷浸提液处理下,幼苗的根生物量占比与根冠比在浸提液处理浓度为10、50 g/L时高于对照,而在100 g/L处理下低于对照。在混合凋落物浸取液浓度为10 g/L时,杉木幼苗的根生物量占比与根冠比达到最大值,随后随着浸提液浓度的上升而降低,直至浸提液浓度为50、100 g/L时低于对照。杉木幼苗的茎生物量占比随着凋落物浸提液浓度的提升呈现先降后升的趋势。当3种凋落物浸提液浓度为10 g/L时,杉木幼苗茎生物量占比低于对照,而在50、100 g/L凋落物浸提液浓度下,幼苗茎生物量占比高于对照。随着杉木浸提液浓度的提升,杉木幼苗的叶生物量占比呈现先上升后下降的变化趋势,当浸提液浓度为10、20 g/L时,叶生物量占比高于对照,在浸提液浓度为50、100 g/L时,幼苗叶生物量占比稍低于对照。在木荷浸提液处理下,只有当浸提液浓度为20 g/L时幼苗的叶生物量占比高于对照,其余浓度处理下均低于对照。在不同浓度的混合凋落物浸提液处理下,杉木幼苗的叶生物量占比均小于对照。 由表1可以看出,凋落物水浸提液的类型会显著影响幼苗叶片中的SOD、POD活性和MDA含量,而杉木幼苗叶片中的SOD、CAT、POD活性和MDA含量受浸取液浓度的影响较大,且效果极显著,两者的交互作用则会对幼苗叶片SOD、CAT活性及MDA含量产生显著影响。 由图5可以看出,随着凋落物浸提浓度的提升,杉木幼苗的SOD活性表现出先升后降的变化,最终低于对照,而POD、CAT活性和MDA含量在3种凋落物浸提液处理下随着浸提液浓度的上升有不同的变化,但最终都是显著高于对照。当杉木浸提液浓度为10 g/L时,杉木幼苗叶片中的SOD活性比对照高,在其余浸提液浓度下,杉木幼苗叶片的SOD活性均低于对照。POD、CAT活性及MDA含量的变化趋势则与SOD活性刚好相反,在浸提液浓度为 10 g/L 时低于对照,其余浓度下高于对照。在木荷浸提液处理下,幼苗叶片的SOD活性在浸提液浓度为20 g/L时达到最高值,在浸提液浓度为100 g/L时达到最低值且低于对照,其余均高于对照。杉木幼苗叶片的POD活性与MDA含量在木荷浸提液浓度为20 g/L时最低,在浸提液浓度为100 g/L时高于对照;CAT活性随着浸提液浓度的上升而提升,且在每个梯度处理下都高于对照。在混合凋落物浸提液处理下,杉木幼苗叶片的SOD活性在浸提液浓度为10、20 g/L的处理下高于对照,在浸提液浓度为50、100 g/L的处理下低于对照;POD、CAT活性及MDA含量的变化趋势与在杉木浸提液处理下的变化趋势相同,表现为先降后升,差异在于各浓度之间的变化比例不同。在整个生理变化过程中,杉木与混合凋落物浸提液处理下杉木幼苗的酶活性反应大致相同,与木荷凋落物水浸提液处理下的反应有明显差异。在高浓度浸提液处理下,杉木幼苗的生理结构受到破坏,酶活性变化与对照相比具有显著差异。 森林凋落物是化感物质的重要来源之一,由凋落物分解产生的化感物质进入土壤中后,会影响土壤的理化性质和微生物群落组成与结构,导致其周围的微生态环境发生变化,从而影响林下植物的生长和林木自然更新,最终可能导致群落退化[28]。本试验结果显示,在3种凋落物浸提液处理下,低浓度处理对杉木种子萌发、幼苗存活起到积极的促进作用,而在高浓度处理下,杉木种子萌发与幼苗存活则受到抑制,这与已有研究结果[18,29]一致。由于凋落物在分解过程中会将养分归还给森林生态系统,因此在初期会促进杉木种子的萌发和生长,而后期随着化感物质的不断积累,细胞器受到破坏,植物难以有效地吸收和利用养分与水分,便会逐渐抑制种子的萌发、幼苗的生长[12]。对不同类型的凋落物而言,化感作用的强度也有所差异,在20、50、100 g/L木荷浸提液处理下,杉木种子的萌发率、存活率基本上高于杉木浸提液处理下的萌发率、存活率;在50、100 g/L混合浸提液处理下,杉木种子的萌发率略高于杉木浸提液处理下种子的萌发率,说明木荷化感物质对杉木有毒化感物质起到了一定的降解作用,杉荷混交能够在一定程度上缓解杉木连栽所造成的生态问题,这也是众多研究者提出的解决杉木人工林更新困难的举措之一。 化感作用对植物生长产生的影响最直观的体现便是植株生长形态的变化,由植株地上、地下部分的形态变化状况可以判断植株受环境变化影响的程度[30]。刘忠玲等的研究结果显示,同一植物在不同凋落物浸提液处理下的变化不同,而且相同植物的不同器官对浸提液处理的响应也有差异[31]。在本研究中,杉木幼苗根部在3种不同浓度浸提液处理下最敏感,其根长、根生物量在不同浓度处理下的变化比茎长、苗高及叶生物量和茎生物量明显,原因可能是化感物质对植物生长的影响主要是以土壤为媒介,通过植物根系分泌、植物残体和凋落物的分解及雨水淋溶等途径进入土壤中,通过土壤作用对其他植物的生长产生影响,因此,根系对化感物质的感应程度更加敏感,这点与叶玉娟等的研究结果[32]相似。当凋落物浸提液浓度为50、100 g/L 时,发现木荷、混合浸提液处理下杉木幼苗的根生物量、茎生物量及总生物量高于杉木浸提液处理,说明在相同高浓度浸提液处理下,木荷凋落物及杉荷混合凋落物累积所产生的化感物质与杉木自身凋落物产生的有毒物质比对杉木幼苗生长的影响更小。化感物质会导致植物幼苗生物量分配发生改变,本试验结果显示,随着浸提液浓度的提高,杉木幼苗的根生物量占比、叶生物量占比降低,而茎生物量占比升高,这种变化与前人的研究结果基本一致。在化感作用的影响下,植物会调整地上、地下部分的分配情况以更好地适应环境[2,33]。从杉木幼苗生长的相关数据可以看出,幼苗的根长、茎长、苗高及总生物量在高浓度浸提液处理下均低于对照,可见林下不断累积的凋落物会影响幼苗的生长。 植物体内活性氧的产生和清除维持在一个相对平衡的状态,一旦外界环境发生变化,植物的生存受到威胁时,植物体内的自我保护机制就会发挥作用,通过抗氧化酶来清除多余的活性氧,SOD、CAT和POD便是控制植物体内活性氧积累最主要的酶[34]。本研究结果显示,杉木幼苗叶片中SOD活性呈现先升后降的趋势,原因可能是浸提液浓度较低时,幼苗的自我保护机制发挥作用,而使SOD活性升高,然而随着浸提液浓度的升高,杉木幼苗的细胞膜脂过氧化程度加深,导致细胞受到更多伤害,进一步影响到杉木幼苗细胞内蛋白质等物质的合成,最终导致细胞抗氧化酶活性降低[35-37]。在本研究中,幼苗叶片的POD活性、CAT活性的变化趋势与SOD活性相反,浸提液浓度越高时,杉木幼苗叶片的POD活性、CAT活性反而越高,原因可能是在凋落物浸提液浓度较低时,凋落物浸提液会促进种子萌芽和前期生长活动,因而导致POD、CAT活性在低浓度时的变化并不明显;但是当凋落物浸提液浓度进一步提升后,植物体内的活性氧过度积累,为了清除植物体内的这些有害物质,导致POD活性、CAT活性显著提升。MDA含量也能反映植物受伤害的程度,植物在正常生长的情况下,MDA含量处于较低水平,而在逆境胁迫下,MDA含量则会随着时间的推移和逆境的积累而显著增加,植物器官受到损伤后则会发生膜脂过氧化作用[38]。本研究结果显示,在10、20 g/L低浓度浸提液处理下,杉木幼苗叶片中的MDA含量变化不大,而随着浸提液浓度的提升,杉木幼苗叶片中的MDA含量大幅增加,高于对照且在100 g/L浓度处理下作用最显著,说明高浓度的浸提液处理破坏了细胞生物膜的结构和功能,使得幼苗叶片正常代谢和生长受到阻碍,这与国内外其他相关研究结果一致,随着凋落物的累积产生的化感物质破坏了杉木幼苗叶片的生理结构,不利于幼苗的生长[39]。 在森林生态系统中,凋落物参与了物质循环环节,因此其分解产生的化感物质会直接对植物的生长造成影响[40]。本研究结果表明,在3种类型不同浓度凋落物浸提液处理下,杉木种子萌发率、幼苗的存活率、生物量的累积均随着浓度的提升呈现“低促高抑”的现象,说明随着凋落物的累积,分解所产生的化感物质对幼苗生长的抑制作用逐渐增强,对幼苗的生理结构产生严重破坏。因此,在杉木人工林的种植与日常养护过程中,要充分考虑凋落物分解所产生的化学物质对林木种子与幼苗的影响,及时合理地对林内凋落物进行清理是比较好的解决方法。另外,结合杉木种子萌发率和幼苗存活率及后期生长阶段的数据发现,在3种类型的凋落物处理下,木荷凋落物对杉木幼苗生长的抑制作用最小,其次是杉木与木荷的混合凋落物。可见单一的杉木林分是不利于其自身的更新与生长的,可以通过构建杉木与木荷的针阔混交林,在一定程度上缓解杉木纯林因凋落物累积所产生的化学作用而造成的生态问题。1.3 数据处理与统计分析
2 结果与分析
2.1 凋落物化感作用对种子萌发、幼苗存活的影响
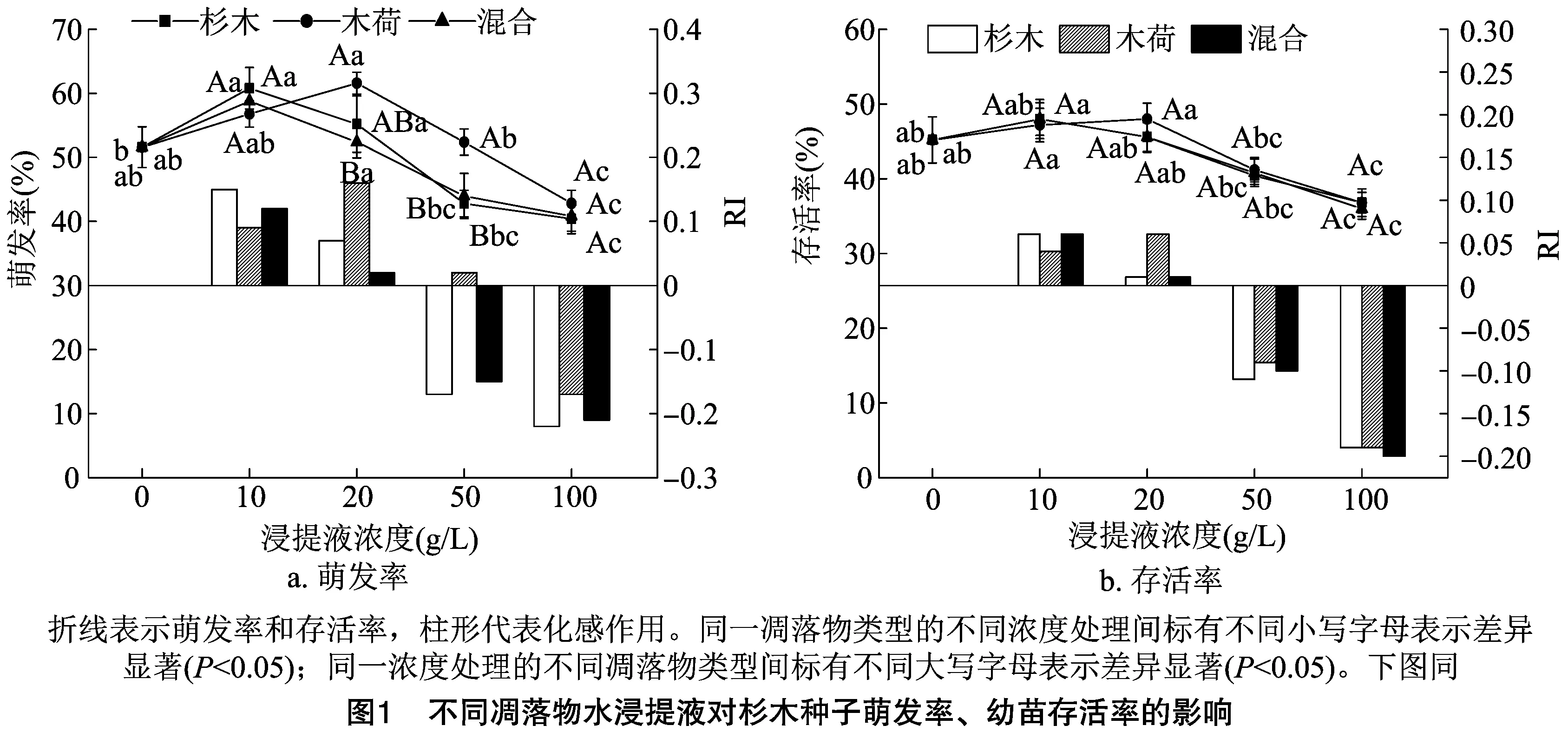
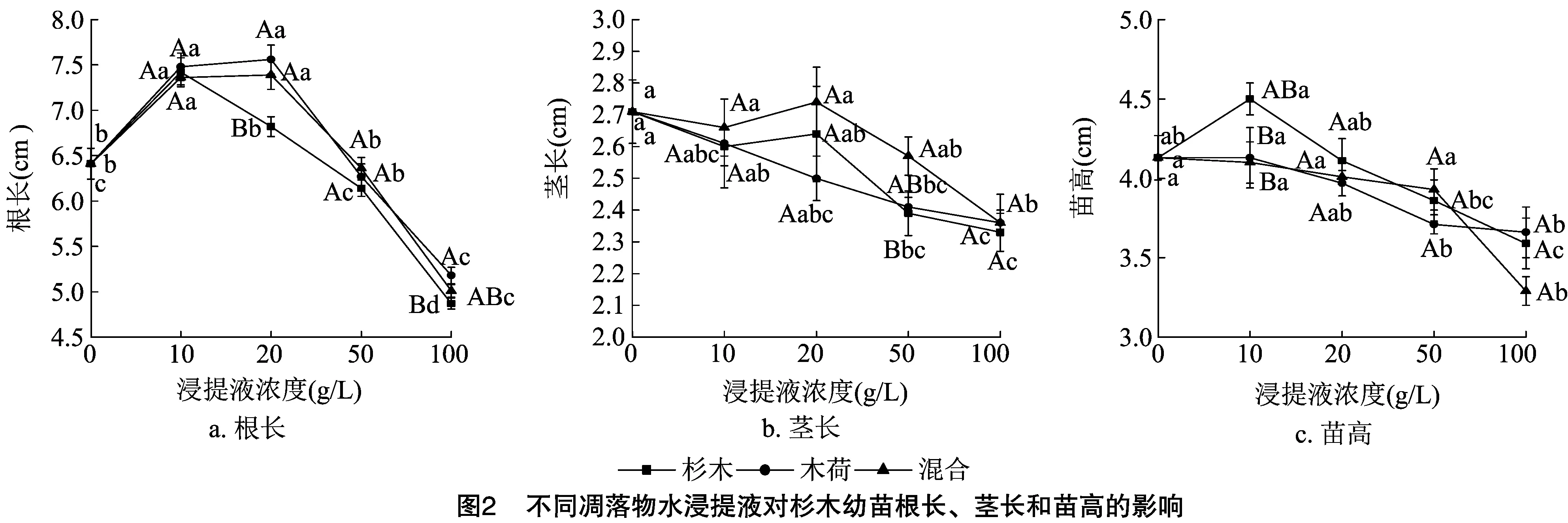
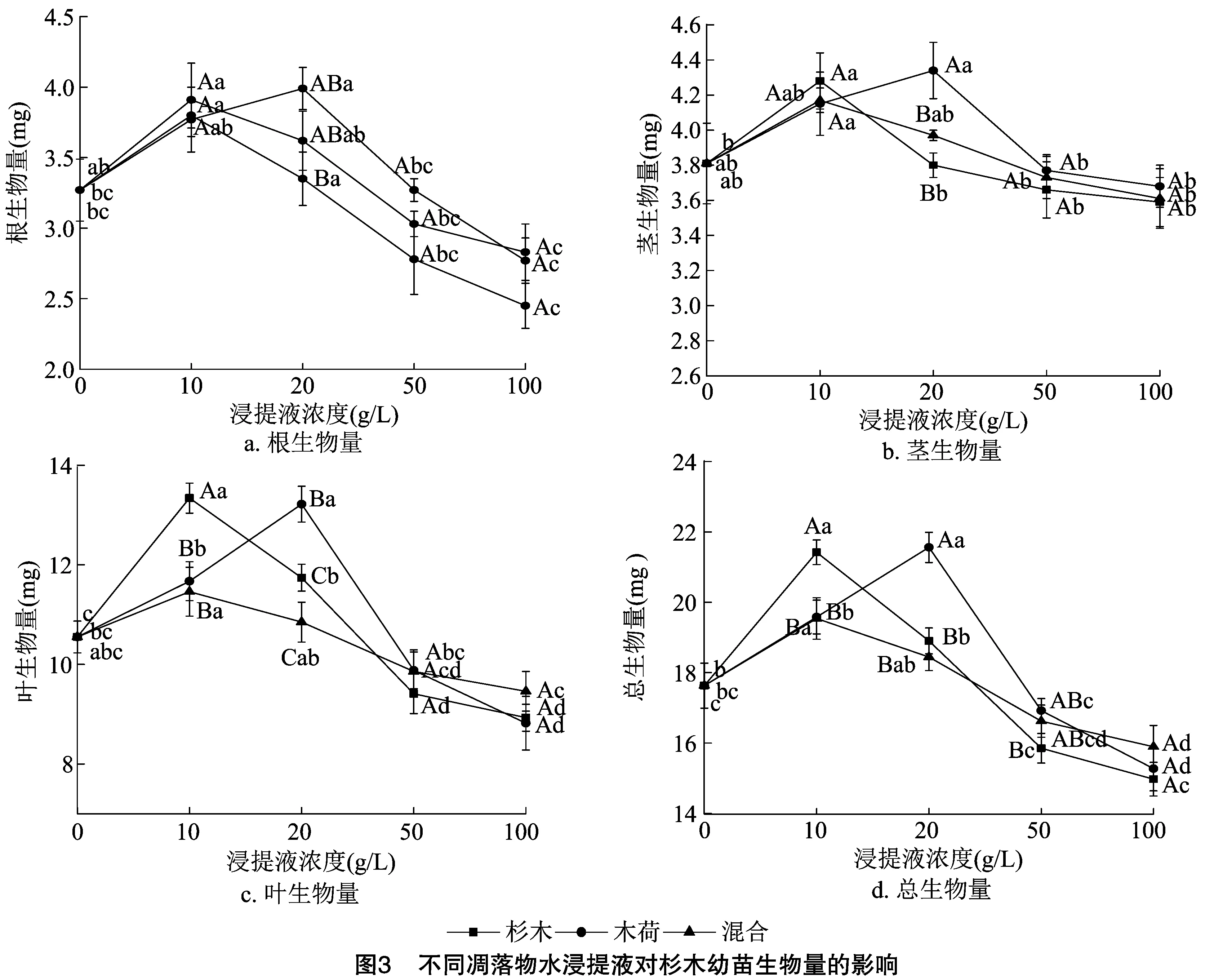
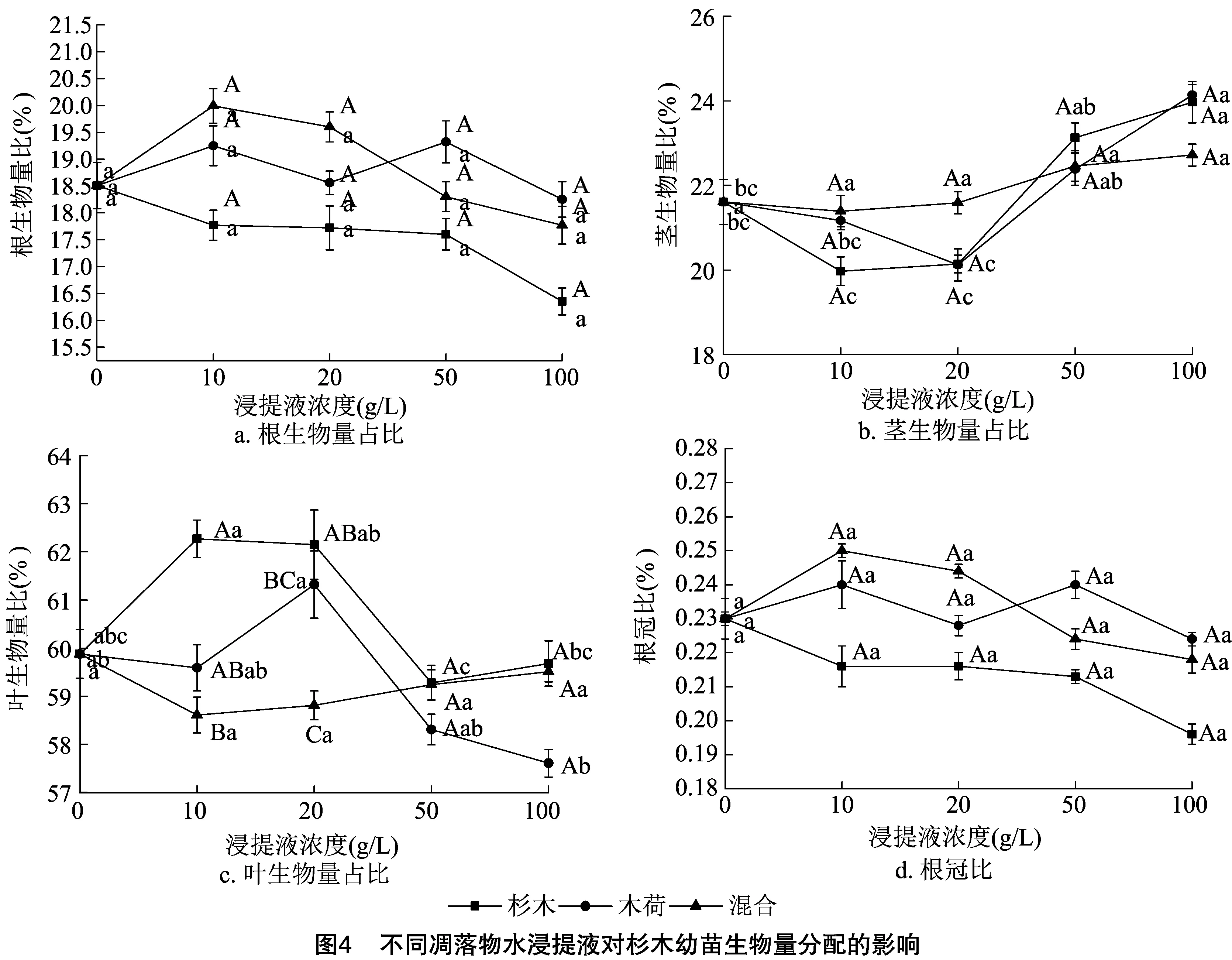
2.2 凋落物化感作用对幼苗生长、生物量积累及分配的影响

2.3 凋落物化感作用对幼苗叶片生理特性的影响
3 讨论与结论
——以渤海S油田为例

