基于PI3K/Akt/mTOR信号通路的苦参碱诱导人乳腺癌MCF-7细胞自噬及其机制的研究
贾绍华,丁海鑫,孙萌遥,金诗鹏
(哈尔滨商业大学 药学院(药物工程技术研究中心),黑龙江 哈尔滨 150076)
细胞自噬是程序性细胞死亡(PCD)类型之一,与细胞凋亡不同,它是哺乳动物真核细胞在自噬相关基因(ATG)的调控下,通过细胞骨架的运输和溶酶体内的水解酶,降解细胞内衰老蛋白和受损细胞器的过程,又被称为II型程序性细胞死亡[1]。在营养不足、缺氧、氧化应激、内质网应激、代谢条件应激等多种状态下都可通过细胞自噬来提高细胞对生物大分子的回收能力,从而使细胞能在压力状态下也存活[2]。P13K/Akt/mTOR信号在肿瘤细胞中广泛存在,在控制细胞的生长、增殖、代谢等过程中起着重要作用[3]。
苦参碱(matrine)是由豆科植物苦参的干燥根、植株等部位经乙醇等有机溶剂提取制成的一种生物碱,具有抗菌、抗病毒、抗炎、调节免疫、调节心脑血管疾病、抗肿瘤等多种药理活性[4-5]。研究发现苦参碱能有效治疗肝癌[6]、胃癌[7]、前列腺癌[8]、乳腺癌[9-10]等多种癌症,其可通过抑制肿瘤细胞增殖和转移,诱导肿瘤细胞凋亡等多种途径来发挥抗肿瘤作用[11]。本文通过苦参碱对MCF-7细胞自噬及其P13K/Akt/mTOR信号通路的研究,从自噬的角度进一步揭示其抗肿瘤作用机制。
1 仪器与材料
1.1 仪器
ECO-170P-230培养箱(美国NBS公司);CKX-41-32型倒置显微镜(日本OLYMPUS公司);Adventurer万分之一电子天平(美国Ohous公司);DK-8D型电热恒温水浴锅(上海一恒科学有限公司);DL-CJ-1N医用型超净工作台(北京东联哈尔仪器制造有限公司);680型全自动酶标仪(美国BIO-RAD公司);DL-CJ-1N医用超净工作台(北京东联哈尔仪器制造有限公司);Image Quant LAS 500凝胶成像系统(GE公司);DYCZ-24N型垂直电泳仪(北京六一仪器厂);DYCZ-40D型电泳转印槽(北京六一仪器厂);硝酸纤维素(NC)膜(美国PALL公司); DMI3000B荧光显微镜(德国Leica公司);日立H8650透射电镜(日本日立高新技术公司);细胞培养板(美国康宁公司)。
1.2 药品与试剂
苦参碱(含量≥98 %,批号:A0094,规格:20 mg,成都曼思特;RPMI1640溶液(大连美仑);胎牛血清(批号:2017412,杭州四季青);盐酸表阿霉素(批号:17110102,哈尔滨三联药业);溴化四氮唑蓝(MTT,批号:20170512,天津阿尔法);Bradford蛋白浓度测定试剂盒(批号:P0006,碧云天);特超敏ECL化学发光试剂盒(批号:MA0186,大连美仑);兔抗β-actin多克隆抗体(批号:bs-0061R,博奥森生物技术有限公司);辣根过氧化物酶标记山羊抗兔IgG(H+L)(批号:A0208,碧云天);兔抗LC3多克隆抗体(批号:bs-8878R,博奥森);兔抗AKT多克隆抗体(批号:AA326,碧云天);兔抗Phospho-AKT(Ser473)多克隆抗体(批号:AA329,碧云天);兔抗PI3Kinase p110α/PIK3CA 多克隆抗体(批号:AF7749,碧云天);兔抗Phospho-PI3K多克隆抗体(批号:AF5905,碧云天);兔抗mTOR多克隆抗体(批号:AF1648,碧云天);兔抗PhosphomTOR多克隆抗体(批号:AF5869,碧云天);4 %多聚甲醛固定液(批号:BL539A,天津阿尔法);自噬双标腺病毒(mRFP-GFP-LC3,批号:AD21042301,上海汉恒);2.5 %戊二醛溶液(批号:A00151,天津阿尔法)。
1.3 细胞株
人乳腺癌MCF-7细胞株,由哈尔滨商业大学药学院(药物工程技术研究中心)提供。
2 方法
2.1 细胞培养
人乳腺癌MCF-7细胞复苏后,用含10 %胎牛血清的RPMI-1640培养基于37 ℃、5% CO2培养箱中培养。当细胞密度达到80 %~90 %且细胞状态良好时,用0.25 %胰蛋白酶消化并吹打成细胞悬液进行传代培养。
2.2 自噬双标腺病毒(mRFP-GFP-LC3)法检测苦参碱对MCF-7细胞自噬的影响
取处生长状态良好的MCF-7细胞,弃掉培养基,再加入PBS清洗,加入胰酶进行消化,消化完全后加入3 ml培基,用移液枪将细胞吹打成单细胞悬液,分别在6孔板中每孔加入1.5 ml细胞悬液,放入培养箱中继续培养,待细胞完全贴壁,空白对照组加入1.5 ml 1640溶液,阳性对照组加入0.4 μg/ml盐酸表阿霉素溶液作为阳性对照,给药组分别加入0.4,0.8,1.2 mg/ml苦参碱溶液,给药后继续放入培养箱培养24 h。取出6孔板,每孔加入10 μl自噬双标腺病毒(mRFP-GFP-LC3),放入培养箱继续培养24 h,24 h后将6孔板取出,PBS清洗3次,每次5 min,每孔加入多聚甲醛固定20 min后,PBS清洗3次,每次5 min,再用PBS清洗,荧光显微镜观察,整个实验过程中注意避光。
2.3 透射电镜(TEM)法观察苦参碱给药后MCF-7细胞的形态变化
取生长状态良好的细胞,传代后放入培养箱培养24 h,待细胞贴壁后进行给药,空白对照组加入无血清的1640培养基,阳性对照组加入浓度为0.4 μg/ml的盐酸表阿霉素溶液,给药组加入0.8 mg/ml苦参碱溶液,48 h后,用细胞刮将贴壁细胞刮下,1500 r/min离心5 min,待细胞成为细胞团后,加入1.5 ml戊二醛固定液,固定,低温切片机切片,TEM下观察细胞形态。
2.4 Western blot法检测细胞中相关蛋白的表达
将细胞培养瓶从培养箱中取出,待观察到细胞完全贴壁且生长密度超过80 %,传代,将新培养瓶置于37 ℃、5% CO2培养箱中进行培养24 h,分别加入最终浓度为0.4,0.8,1.2 mg/ml的苦参碱,阳性对照组加入终浓度为0.4 μg/ml的盐酸表阿霉素(EPI),阴性对照组加入含10 %胎牛血清的1640培养基,继续培养48 h。用细胞刮将贴壁细胞从细胞培养瓶中刮下,直至贴壁细胞面变得透明。再将悬液收集至EP管中,1500 r/min离心5 min,弃上清,每管加入PBS1 ml,吹匀,将悬液转移至1.5 ml EP管中,1500 r/min离心5 min,再次弃去上清,每管中加入蛋白质裂解液100 μl。吹打混匀,-80 ℃保存备用。按Bradford蛋白浓度测定试剂盒说明书操作,加入5×蛋白稀释液将蛋白浓度调平,每管中加入1/4体积的5×蛋白上样缓冲液配制成电泳上样所需样品,沸水水浴10 min,-20 ℃保存使用。选择12 %的分离胶、10 %的浓缩胶,恒压80 V/120 V,直至条带跑至近下侧边缘,停止电泳。打开胶板,根据目标蛋白质分子量切去多余的凝胶,将NC膜做好标记,按黑色夹板、多孔垫片、三层滤纸、凝胶、NC膜、三层滤纸、多孔垫片、白色夹板的顺序放置于电转液中,将电转仪置于4 ℃冰箱中,恒流200 mA,电泳1.5 h左右。将转膜完成后的NC膜置于5 % 脱脂奶粉溶液中,室温,封闭2 h。将封闭后的NC膜置于密封袋中,加入稀释好的一抗,用压膜机封口,平放在4 ℃冰箱里孵育过夜,第二天将NC膜取出,TBST清洗3次,每次15 min,然后加入二抗,室温孵育2 h,TBST清洗3次,每次15 min。加ELC,避光,将膜平放在Image Quant LAS 500凝胶成像系统中,用Image pro plus 6.0测定条带灰度值,以各组待测蛋白条带灰度值和内参蛋白灰度值比值计算蛋白的相对表达。
2.5 统计学处理
采用SPSS 21.0软件对实验数据进行统计学处理,各组实验数据均值采用均数±标准差表示,组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
3 结果
3.1 苦参碱对MCF-7细胞自噬的影响
结果见图1、图2。由图1可见,阳性对照组、中剂量组和高剂量组与空白对照组自噬水平差异具有高度统计学意义(P<0.01),EPI组的细胞自噬现象明显,出现了明显的溶酶体与自噬小体融合成为自噬溶酶体的生物学过程,苦参碱各剂量组随着给药浓度的升高,细胞的自噬率呈明显上升并伴随着自噬溶酶体的出现,提示苦参碱能诱导MCF-7细胞自噬。

图1 苦参碱对MCF-7细胞自噬率的影响
TEM观察结果见图2。由图2可见,阴性对照组MCF-7细胞形态正常;1.0,0.4 μg/ml EPI处理MCF-7细胞48 h后,细胞质内出现丰富的自噬空泡,表明苦参碱可升高细胞自噬的水平。

图2 苦参碱对MCF-7细胞形态的影响
3.2 苦参碱对PI3K/Akt/mTOR信号通路相关蛋白表达的影响
不同浓度的苦参碱作用于人乳腺癌MCF-7细胞后,Western Blot法检测相关蛋白的表达情况,结果见图3。与阴性对照组相比,微管相关蛋白轻链II/I(LC3-Ⅱ/LC3-I)的比值随着苦参碱给药浓度的增加而变大;Bcl-2同源结构域蛋白(Beclin-1)的表达量呈上升趋势;磷脂酰肌醇三羟基激酶(PI3K)、蛋白激酶B(Akt)、哺乳动物雷帕霉素靶蛋白(mTOR)相对表达量在各组间差异不具有统计学意义(P>0.05),磷酸化磷脂酰肌醇三羟基激酶(p-PI3K)、磷酸化蛋白激酶B(p-Akt)、磷酸化雷帕霉素靶蛋白(p-mTOR)的表达量明显降低,与阴性对照组相比,差异具有统计学意义(P<0.05)。以上结果表明苦参碱能上调人乳腺癌MCF-7细胞自噬水平,其机制可能与PI3K/Akt/mTOR信号通路相关。
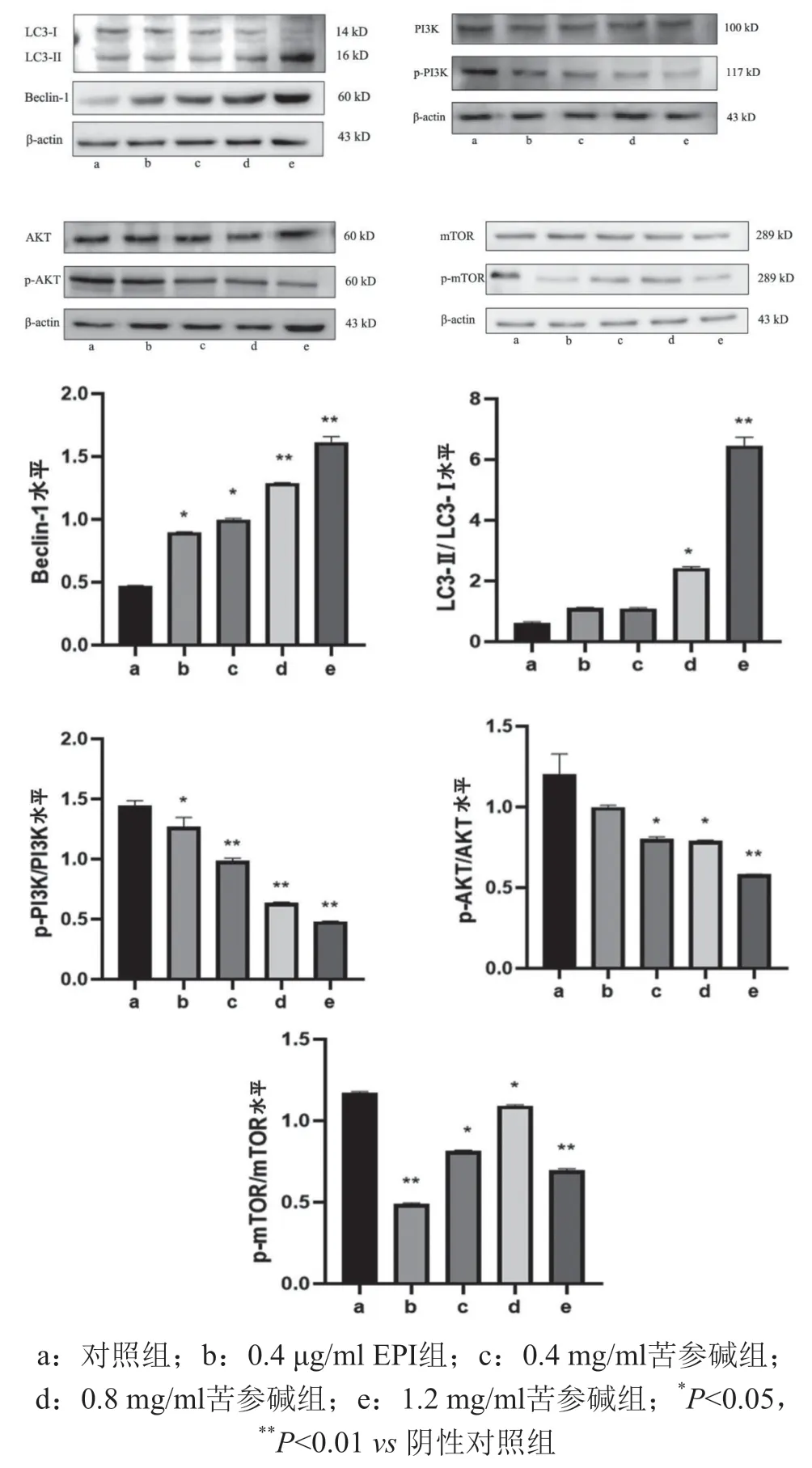
图3 苦参碱对MCF-7细胞中PI3K、p-PI3K、Akt、p-Akt、mTOR、p-mTOR、LC3-I、LC3-II、Beclin-1蛋白表达的影响
4 讨论
细胞自噬是广泛存在于真核细胞中的基本生命进程,近年国内外大量研究发现,肿瘤细胞自噬活性高出正常水平数倍,并从多个方面影响恶性肿瘤的发生和预后过程[12-13]。其可分为组成型和适应型,组成型多作用于去除受损或衰老细胞器并维持基础能量代谢,而适应型则作用于营养缺乏时,动员细胞内的营养物质以满足能量需求[14],其生理功能包括降解自身受损、变性、衰老的蛋白质类大分子物质及受损的细胞器,调节免疫功能或延长细胞寿命等。
与自噬相关的基因在进化上都非常保守,被命名为ATG基因。到目前为止,已有40余种ATG基因,其中15个核心基因与哺乳动物的ATG具有保守的一致性[15]。其中Beclin-1是哺乳动物ATG6的同源基因,其与ATG14蛋白结合,参与自噬泡的形成与延伸,在调节自噬细胞双层膜的形成中起着重要作用;在自噬启动过程中,ATG5-12-16复合体与ATG8(LC3)-I结合到自噬体内膜与自噬体外膜上,转变为LC3-II,以脂质的形态存在。自噬小体形成后,除了部分LC3-II仍与内皮细胞结合外,其他主要ATG蛋白都重新进入细胞浆, LC3-II则全部留在成熟的自噬小体上,在自噬小体与溶酶体彻底融合为自噬溶酶体后降解,这种特征一般可用于监测自噬过程[16],故Beclin-1和LC3都被广泛认同为自噬的相关标志性蛋白。本研究中,通过Western blot检测发现自噬标志性蛋白LC3-II/LC3-I、Beclin-1的表达量均呈上升趋势,表明给药后MCF-7细胞内有自噬现象的发生;与此同时mRFP-GFP-LC3法和TEM法观察发现了明显的溶酶体与自噬小体融合为自噬溶酶体及丰富的自噬空泡的生物学过程,这些结果都强有力地证明了苦参碱可诱导人乳腺癌MCF-7细胞中自噬现象的发生。另外Western-blot法检测到MCF-7细胞内p-PI3K、p-AKT、p-mTOR的表达量均呈下降趋势,进一步揭示了苦参碱可能通过降低PI3K/AKT/mTOR通路相关蛋白的磷酸化使MCF-7细胞自噬水平上升。
总之,细胞自噬在健康细胞中发挥着维持稳态功能的重要作用[17],且其在体内也有预防癌症发展的作用。有研究发现自噬的存在也降低了DNA的损伤和肿瘤形成的可能性[18]。与此相一致的是,自噬基因敲除的小鼠体内胰腺癌病变的发生率上升[19-20]。尽管如此,自噬也可能在某些疾病中适应良好[21],如肿瘤细胞在饥饿状态下可通过自噬激活来维持生存,使其在营养枯竭的微环境中得以生存和增殖[22],因此细胞自噬对于肿瘤细胞究竟是利还是弊,以及其与细胞凋亡究竟存在何种联系,仍需进一步研究。

