尾穗苋体外细胞毒活性成分的研究
刘贤贤,覃丽清,张 业,刘玮欣,何瑞杰
(1. 桂林师范高等专科学校,广西 桂林 541199;2. 桂林医学院,广西 桂林 541100;3. 神州细胞工程有限公司,北京 100041;4. 广西壮族自治区中国科学院广西植物研究所 广西植物功能物质与资源持续利用重点实验室,广西 桂林 541006)
尾穗苋(Amaranthus caudatusL.)为苋科(Amaranthaceae)苋属(AmaranthusL.)一年生草本植物,具有药食两用的特性,在我国大部分地区均有种植。尾穗苋营养丰富[1-2],同时因其富含黄酮[3]、有机酸[4]、多糖[5]等化学成分而具有抗氧化[3,6-7]、抗肿瘤[8]、增强免疫力[9]等作用。为充分发掘该植物的药食两用价值,本研究以尾穗苋为研究对象,分别用不同溶剂对尾穗苋进行提取,分离出单体化合物,单体化合物的结构经多种核磁共振谱、熔点及高分辨质谱数据鉴定,随后采用MTT法研究单体化合物的细胞毒活性,以冀为尾穗苋的进一步研究开发提供支持。
1 仪器与材料
1.1 仪器
M1000酶标仪(Tecan公司);KQ5200DE 型数控超声波清洗器,FB224自动内校电子分析天平(上海舜宇恒平科学仪器);RE2000B旋转蒸发仪(上海亚荣生化仪器);ZF-8型暗箱四用紫外分析仪(上海嘉鹏科技);500 MHz Bruker Avance Ш HD核磁共振波谱仪(瑞士布鲁克公司);依利特P270半制备高效液相(大连依利特);MAT 95XP高分辨质谱(美国Thermo);SP-MAX3500FL多功能荧光酶标仪(上海闪谱)。
1.2 材料
尾穗苋全草由贵州省特色生物科技有限公司提供,经广西植物研究所韦发南研究员鉴定为苋科苋属植物尾穗苋(Amaranthus caudatusL.),标本(编号:20120926)被保存于桂林师范高等专科学校化学系实验室。RPMI Medium 1640,胎牛血清,DMEM(Gibco);噻唑蓝(Sigma-Aldrich);甲醇,乙醇,石油醚,乙酸乙酯,正丁醇,二甲基亚砜(分析纯,西陇化工);5-氟尿嘧啶(上海阿拉丁)。
1.3 细胞
肝癌SMMC-7721细胞,HepG2细胞(中科院细胞研究所)。
2 方法
2.1 提取与分离
称取干燥尾穗苋200 g,粉碎,分别以甲醇、70 %乙醇、石油醚、乙酸乙酯、正丁醇和水为提取溶剂,在温度为50~55 ℃,频率为80~100 Hz条件下超声提取,第一次超声提取2 h,料液比为1:3,第二,三次物料比超声提取1 h,物料体积比为1:2,合并三次提取液并减压浓缩,得各溶剂粗提物,提取率分别为:16 %,26 %,12.5 %,14 %,15 %,12 %。
取干燥的尾穗苋粉末1 kg,分别用70 %乙醇超声提取3次,提取的条件为:温度50~55 ℃,频率80~100 Hz,第一次用3 L 70 %乙醇超声提取2 h,第二、第三次用2 L 70 %乙醇超声提取1 h,一共提取3次,合并3次的提取液,浓缩,得浸膏145 g。随后取140 g浸膏上大孔树脂D101(10.0 cm×50.0 cm),以乙醇-水(0:100,10:90,40:60,70:30,100:0,v/v)为流动相进行洗脱,得到5个组分Fr-1~Fr-5。组分Fr-3(52 g)用少量甲醇溶解,55 g硅胶(100目)拌样,过硅胶柱层析(500 g,200~300目,6.0 cm×50.0 cm),依次用氯仿-甲醇(l00:0~100:50,v/v)常压下进行梯度洗脱,合并相同流份,得到10个亚组分Fr-3-1~Fr-3-10。Fr-3-3部分(4.9 g)过聚苯乙烯基反相树脂(MCI)层析柱(3.0 cm×20.0 cm),用甲醇-水(0:100~100:0)梯度洗脱,得到Fr-3-3-1~Fr-3-3-10亚组分。Fr-3-3-1(1.1 g)通过半制备液相(Amethyst,10 mm×250 mm,5 μm),以甲醇-水(20:80~30:70,v/v;流速2 ml/min)洗脱,得化合物4(tR= 20.5 min,16.0 mg)和10(tR=30.5 min,1.2 mg)。再将Fr-3-3-2(1.3 g)通过半制备液相,以甲醇-水(20:80~16:84,流速2 ml/min)洗脱,得化合物3(tR=23.1 min,10.0 mg)和化合物5(tR=25.8 min,24.1 mg)。Fr-3-4(5.1 g)过MCI柱(3.0 cm×20.0 cm),用甲醇-水(0:100~100:0)梯度洗脱,得Fr-3-4-1~Fr-3-4-10亚组分。Fr-3-4-4(1.8 g)通过半制备液相,以甲醇-水(45:55,v/v,流速2 ml/min)洗脱,再上凝胶色谱柱,以氯仿-甲醇(7:3)洗脱,得化合物1(9.0 mg)、化合物2(6.1 mg)。Fr-3-4-6(2.1 g)上半制备液相,以甲醇-水(60:40~70:30,v/v;流速2 ml/min)洗脱,得化合物6(tR=10.5 min, 1.6 mg)、7(tR32.5 min, 1.4 mg)、8(tR=24.5 min, 1.8 mg)、9(tR=26.2 min, 1.1 mg)。
2.2 体外细胞毒活性实验
用胰蛋白酶消化80 %~90 %汇合度的单层细胞,将细胞收集到含血清的培养基中。离心细胞悬液,使细胞沉积下来,用培养基重悬细胞。将细胞稀释至2.5×104~50×104个/ml,向96孔板中加入180 μl/孔细胞悬液。将培养板放至培养箱,于5 % CO2、37 ℃ 湿润环境中温育24 h,细胞进入指数生长期时加入药物。
将对数生长期细胞按5×107个/L的密度,接种于96孔板,每孔180 μl。细胞贴壁后,分为阴性对照(等量RPMI-1640)组、阳性药组(5-氟尿嘧啶,10-4mol/L)、5个10倍梯度(0.01,0.1,1.0,10,100 μg/ml)的药物样品组和溶媒对照(含0.5 %乙醇的RPMI-1640)组。每组设5个平行孔。各孔加入相应药物20 μl。于结束培养48 h前4 h加入5 g/L MTT溶液,20 μl/孔。结束培养后,吸上清弃去,加入DMSO,200 μl/孔,待细胞内生成的蓝紫色甲臢完全溶解后,用酶标仪于570 nm处检测各孔的光密度(optical density,OD)值。重复实验3次。
先用100% DMSO助溶药物,然后用无血清高糖DMEM将药物稀释,制备4个药物浓度(使助溶剂DMSO最终浓度为1 %),阴性对照为无血清高糖DMEM(含1%DMSO),阳性对照为5-氟尿嘧啶,所设药物浓度同药物组(均含1 % DMSO),每个浓度重复3孔。细胞贴壁,长至50 %~60 %汇合度时加入20 μl药物,各浓度重复3孔。药物作用48 h后,去除各孔中的培养基(目的是避免药物本身颜色干扰),每孔加入200 μl新鲜的培养基,同加入浓度为5 mg/ml的 MTT 20 μl/孔,于37℃湿润环境中温育4 h,然后弃去孔中的培养基,加入150 μl DMSO,以溶解甲臜结晶,振荡摇匀,10 min内在490 nm处记录吸光值。
按下列公式计算细胞抑制率,用Graphpad Prism 5.0计算IC50值。
抑制率(%)=[(阴性对照孔OD值-实验孔OD值)/阴性对照孔OD值]×100
所得数据以IC50±SD表示,采用单因素方差分析进行组间比较。设定P<0.05时,具有统计学意义。
2 结果与分析
从尾穗苋70%乙醇提取物中分离鉴定了10个化合物,其结构见图1,其中化合物1~5为首次从该植物中分离到。化合物2对人肝癌细胞系HepG2和SMMC-7721具有较强的体外抗肿瘤细胞毒活性。
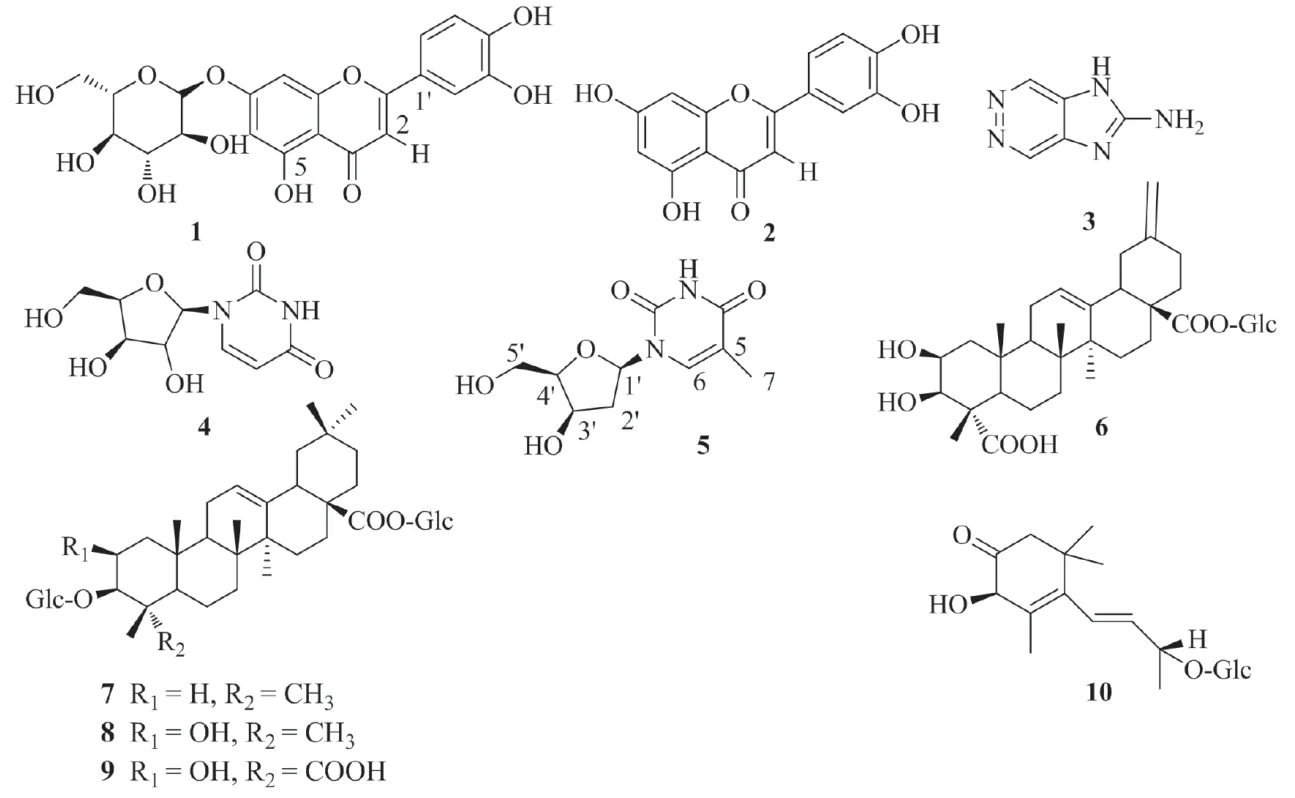
图1 化合物1~10的化学结构
2.1 化合物结构鉴定
化合物1:黄色晶体(甲醇-水),mp 255~256 ℃,微溶于甲醇,难溶于水。紫外灯(254~365 nm)照射下显黄色,喷AlCl3荧光变成黄绿色,故推断其为黄酮类化合物。HR-ESI-MSm/z:447.0930 [MH]-,结合碳谱数据推断其分子式为C21H20O11。1H NMR(500 MHz,DMSO-d6)δ:6.43(1H,s,H-2),6.73(1H,d,J=2 Hz,H-6),6.79(1H,d,J=2 Hz,H-8),7.40(1H,d,J=2.4 Hz,H-2’),6.88(1H,d,J=8.4 Hz,H-5’),7.44(1H,dd,J=8.4,2.4 Hz,H-6’),12.95(s,5-OH),5.06(1H,d,J=8.8 Hz,H-Glc-1),3.25~3.70 [6H,m,H-Glc-(2-6)]。13C NMR(500 MHz,DMSO-d6)δ:182.0(C-4),164.5(C-7),163.0(C-2),161.1(C-5),156.9(C-9),149.9(C-4’),145.8(C-3’),121.4(C-1’),119.2(C-6’),116.1(C-5’),113.6(C-2’),105.3(C-3),103.2(C-10),99.9(C-Glc-1),99.5(C-6),94.7(C-8),77.2(C-Glc-4),76.4(C-Glc-3),73.1(C-Glc-2),69.5(C-Glc-5),60.6(C-Glc-6)。以上数据与文献[10]中的数据基本一致,故鉴定该化合物1为木犀草素-7-O-β-D-葡萄糖苷。
化合物 2:黄色晶体(甲醇-水),m p 198~199 ℃,溶于甲醇-氯仿,难溶于水,在紫外灯(254 nm)照射下显黄色,喷AlCl3荧光变成黄绿色,故判断其为黄酮类化合物。HR-ESIMSm/z:285.0401[M-H]-,结合碳谱数据推断其分子式为C15H10O6。1H NMR(500 MHz,DMSO-d6)δ:7.42(1H,dd,J=8.4,2.3 Hz,H-6’),7.39(1H,d,J=2.3 Hz,H-2’),6.89(1H,d,J=8.4 Hz,H-5’),6.44 (1H,d,J=1.6 Hz,H-8),6.17(1H,d,J=1.6 Hz,H-6),6.69(1H,s,H-3)。13C NMR(125 MHz,DMSO-d6)δ:181.7(C-4),164.1(C-2),163.9 (C-7),161.5(C-9),157.3(C-5),149.7(C-4’),145.7(C-3’),121.5(C-1’),119.0(C-6’),116.0(C-5’),113.4(C-2’),103.7(C-10),103.7 (C-3),98.8(C-6),93.8(C-8)。以上数据与文献[11]中数据基本一致,故鉴定该化合物2为木犀草素。
化合物3:无色晶体(氯仿-甲醇),m p 270~271 ℃,溶于DMSO,甲醇,难溶于乙醇。HR-ESI-MSm/z:136.0620 [M+H]+,结合碳谱数据推断其分子式为C5H5N5。1H NMR(500 MHz,DMSO-d6)δ:7.08(2H,br s,NH2),8.09(2H,br s,H-3,6),12.80(1H,br s,NH)。13C NMR(125 MHz,DMSO-d6)δ: 139.3(C-4,5),152.4(C-3,6),155.3(C-8)。以上数据与文献[12]报道一致,故鉴定化合物3为1H-咪唑并[4,5-D]哒嗪-2-胺。
化合物4:白色晶体(甲醇-水),mp 167~168 ℃,溶于DMSO,甲醇,难溶于水。HR-ESI-MSm/z:245.0770 [M+H]+,结合碳谱数据推断其分子式为C9H12N2O6。1H NMR (500 MHz,DMSO-d6)δ:3.49-4.00 [5H,m,H-Rib-(2’-5’)],7.83(1H,d,J=8.1 Hz,H-6),5.81(1H,d,J=4.5 Hz,H-1’),5.64(1H,d,J=8.1 Hz,H-5)。13C NMR(125 MHz,DMSO-d6)δ:163.3(C-4),150.9 (C-2),140.8(C-6),101.8(C-5),87.8(C-Rib-1’),84.9(C-Rib-4’),73.7 (C-Rib-3’),70.0(C-Rib-2’),61.0(C-Rib-5’)。以上数据与文献[13]报道一致,故鉴定化合物4为尿嘧啶核苷。
化合物5:白色晶体(氯仿-甲醇),m p 188~189 ℃,易溶于热水、甲醇,难溶乙醇等有机溶剂。HR-ESI-MSm/z:243.0979 [M+H]+,结合碳谱数据推断其分子式为C10H14N2O5。1H NMR(500 MHz,D2O)δ:7.64(1H,s,H-3),6.28(1H,t,J=6.8 Hz,H-6),1.88(3H,s,H-7),4.47(1H,m,H-1’),4.00 (1H,m,H-2’),3.82(1H,m,H-3’),3.76(1H,m,H-4’),2.28(2H,m,H-5’)。13C NMR(125 MHz,D2O)δ:166.6(C=O),151.8(C=O),137.5(C-6),111.5(C-5),86.5(C-1’),85.1(C-3’),70.5(C-2’),61.2(C-4’),38.5(C-5’),11.6(C-7)。以上数据与文献[14]报道的一致,故鉴定化合物5为2-脱氧胸腺嘧啶核苷。
化合物6:白色粉末,易溶于甲醇。HR-ESIMSm/z:649.3581 [M+H]+,结合碳谱数据推断其分子式为C35H52O11。1H NMR(500 MHz,CD3OD)δ:0.84 (3H,s,Me-26),1.22(3H,s,Me-27),1.31(3H,s,Me-25),1.42 (3H,s,Me-24),3.62(1H,d,J=3 Hz,H-3α),4.12(1H,m,H-2α),5.40(1H,m,H-12),4.65(2H,br s,=CH2),5.39(1H,d,J=7.5 Hz,H-Glc-1’)。13C-NMR(125 MHz,CD3OD)δ:44.8(C-1),70.7(C-2),77.5(C-3),54.1(C-4),52.0(C-5),21.8(C-6),33.5(C-7),41.1(C-8),48.0(C-9),37.5(C-10),24.1(C-11),124.2(C-12),144.5(C-13),41.1(C-14),28.8(C-15),24.5(C-16),48.0(C-17),47.8(C-18),43.0(C-19),149.5 (C-20),30.9(C-21),38.5(C-22),177.0(C-23),13.7(C-24),17.1(C-25),17.7(C-26),26.5(C-27),177.3(C-28),107.5(C-29),95.8 (C-Glc-1’),73.9(C-Glc-2’),78.7 (C-Glc-3’),71.0 (C-Glc-4’),78.3(C-Glc-5’),62.4(C-Glc-6’)。以上数据与文献[15]报道一致,故鉴定化合物6为2β, 3β-二羟基-30-降冰油烷-12, 20(29)-二烯-23, 28-二甲酸28-O-β-D-吡喃葡萄糖酯。
化合物7: 白色粉末,易溶于甲醇。HR-ESIMSm/z:781.4735 [M+H]+,结合碳谱数据推断其分子式为C42H68O13。1H NMR(500 MHz,CD3OD)δ:0.84 (3H,s,Me-26),0.88(3H,s,Me-24),0.95(3H,s,Me-30),0.97(3H,s,Me-29),0.99(3H,s,Me-23),1.11(3H,s,Me-25),1.19(3H,s,Me-27),2.89(1H,dd,J=13.7,5 Hz,H-18),5.29(1H,m,H-12),C-3位上糖片段端头碳质子的化学位移δ:4.46(1H,d,J=7.5 Hz,H-Glc-1’),C-28位上糖片段端头碳质子的化学位移δ:5.42(1H,d,J=7.5 Hz,H-Glc-1’’)。13C NMR(125 MHz,CD3OD)δ:39.6(C-1),26.7(C-2),90.7(C-3),40.6(C-4),56.7(C-5),19.3(C-6),33.1(C-7),40.1(C-8),48.0(C-9),37.7(C-10),24.4(C-11),123.6(C-12),144.8(C-13),42.6(C-14),28.2(C-15),26.2(C-16),47.8(C-17),42.3(C-18),47.2(C-19),31.5(C-20),34.7 (C-21),33.2(C-22),28.2(C-23),16.4(C-24),16.7(C-25),17.7(C-26),26.1(C-27),178.3(C-28),33.5(C-29),23.8(C-30),C-3位上糖基片段碳的化学位移δ:105.8(C-1’),73.8(C-2’),78.5(C-3’),71.6(C-4’),78.1(C-5’),62.4(C-6’),C-28位上糖片段碳的化学位移δ:95.6(C-1’’),74.9(C-2’’),78.8(C-3’’),71.4(C-4’’),78.3(C-5’’),62.6(C-6’’)。以上数据与文献[15]报道一致,故鉴定化合物7为齐墩果酸3-O-β-D-葡萄糖苷-28-O-β-D-吡喃葡萄糖酯苷。
化合物8: 白色粉末,易溶于甲醇。HR-ESIMSm/z:797.4681[M+H]+,结合碳谱数据推断其分子式为C42H68O14。1H NMR(500 MHz,CD3OD)δ:0.94(3H,s,Me-30),1.01(3H,s,Me-26),1.04(3H,s,Me-29),1.18(3H,s,Me-24),1.20(3H,s,Me-23),1.28(3H,s,Me-27),1.34(3H,s,Me-25),2.89(1H,dd,J=13.7,5 Hz,H-18),3.61(1H,d,J=3 Hz,H-3α),4.14 (1H,m,H-2α),5.29(1H,m,H-12),C-3位上糖片段端头碳质子的化学位移δ:4.44(1H,d,J=7.5 Hz,H-Glc-1’),C-28位上糖片段端头碳质子的化学位移δ:5.42(1H,d,J=7.5 Hz,H-Glc-1’’)。13C NMR(125 MHz,CD3OD) δ:44.6(C-1),70.1(C-2),91.2(C-3),39.3(C-4),56.7(C-5),19.3(C-6),33.1(C-7),39.5(C-8),47.5(C-9),37.7(C-10),24.4(C-11),123.4(C-12),144.7(C-13),42.7(C-14),28.4(C-15),25.2(C-16),47.6(C-17),42.3(C-18),46.2(C-19),31.5(C-20),34.7(C-21),33.6(C-22),28.9(C-23),16.4(C-24),17.4(C-25),17.6(C-26),26.1(C-27),178.3(C-28),33.2(C-29),23.7(C-30),C-3位上糖片段碳的化学位移δ: 105.8(C-1’),73.7(C-2’),78.4(C-3’),71.6(C-4’),78.0(C-5’),62.4 (C-6’),C-28位上糖片段碳的化学位移δ:95.6(C-1’’),74.9(C-2’’),78.8 (C-3’’),71.4(C-4’’),78.3(C-5’’),62.6(C-6’’)。以上数据与文献[15]报道一致,故化合物8被鉴定为2β-羟基齐墩果酸3-O-β-D-葡萄糖苷-28-O-β-D-吡喃葡萄糖酯苷。
化合物9:白色粉末,易溶于甲醇。HR-ESIMSm/z:827.4423 [M+H]+,结合碳谱数据推断其分子式为C42H68O14。1H NMR (500 MHz,CD3OD)δ:0.84 (3H,s,Me-26),1.22(3H,s,Me-27),1.31(3H,s,Me-25),1.42(3H,s,Me-24),0.95(3H,s,Me-30),0.97(3H,s,Me-29),2.89(1H,dd,J=13.7,5 Hz,H-18),5.29(1H,m,H-12),C-3位上糖片段端头碳质子的化学位移δ:4.44(1H,d,J=7.5 Hz,H-Glc-1’),C-28位上糖片段端头碳质子的化学位移δ:5.42(1H,d,J=7.5 Hz,H-Glc-1’’)。13C NMR(125 MHz,CD3OD) δ:44.7(C-1),70.6(C-2),77.4(C-3),54.1(C-4),52.0(C-5),21.8(C-6),33.5(C-7),41.1(C-8),48.0(C-9),37.5(C-10),24.4(C-11),123.6(C-12),144.8(C-13),42.6(C-14),28.2(C-15),26.2(C-16),47.8(C-17),42.3(C-18),47.2(C-19),31.5(C-20),34.7(C-21),33.2 (C-22),177.0(C-23),13.7(C-24),17.1(C-25),17.7(C-26),26.1 (C-27),178.3(C-28),33.5(C-29),23.8(C-30),C-3位上糖片段碳的化学位移δ: 105.8(C-1’),73.9(C-2’),78.7(C-3’),71.8(C-4’),78.2(C-5’),62.6(C-6’),C-28位上糖片段碳的化学位移δ:95.6(C-1’’),74.9(C-2’’),79.0(C-3’’),71.5(C-4’’),78.6(C-5’’),62.6(C-6’’)。以上数据与文献[15]报道一致,故鉴定化合物9为3-O-β-D-吡喃葡萄糖基-2β, 3β-二羟油酸-12-烯-23, 28-二甲酸28-O-β-D-吡喃葡萄糖基酯苷。
化合物10:白色粉末,易溶于甲醇。HRESI-MSm/z:387.2016 [M+H]+,结合碳谱数据推断其分子式为C19H30NO8。1H NMR(500 MHz,CD3OD)δ: 2.42 (1H,d,J=15.0 Hz,H-2a),2.22(1H,d,J=15.0 Hz,H-2b),4.52(1H,s,H-4),6.06(1H,d,J=15.5 Hz,H-7),5.62(1H,dd,J=15.5,6.5 Hz,H-8),4.15(1H,q,J=6.0 Hz,H-9),1.35(3H,d,J=6.0 Hz,H-10),1.11(3H,s,H-11),1.05(3H,s,H-12),1.95(3H,s,H-13),4.36(1H,d,J=7.5 Hz,H-Glc-1’),3.26(1H,dd,J=9.5,7.5 Hz,H-Glc-2’),3.42(1H,t,J=9.5 Hz,H-Glc-3’),3.34(1H,t,J=9.5 Hz,H-Glc-4’),3.29(1H,m,H-Glc-5’),4.01(1H,dd,J=12.0,3.2 Hz,H-Glc-6’a),3.62(1H,dd,J=12.0,5.1 Hz,H-Glc-6’b)。13C NMR(125 MHz,CD3OD)δ:36.5(C-1),50.1(C-2),209.1(C-3),73.0(C-4),128.05(C-5),135.00(C-6),125.83(C-7),138.89 (C-8),76.92(C-9),21.22(C-10),30.02(C-11),28.21(C-12),23.50 (C-13),糖片段碳的化学位移δ:103.97(C-Glc-1’),74.72(C-Glc-2’),78.0 (C-Glc-3’),71.51(C-Glc-4’),77.96(C-Glc-5’),62.42(C-Glc-6’)。以上数据与文献[16]报道一致,故鉴定化合物10为3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷。
2.2 尾穗苋粗提取物对SMMC-7721细胞的体外细胞毒活性
检测尾穗苋甲醇提取物、70 %乙醇提取物、石油醚提取物、乙酸乙酯提取物、正丁醇提取物、水提取物对SMMC-7721细胞的体外细胞毒活性,结果见表1。

表1 尾穗苋各溶剂提取物对肝癌7721细胞系的细胞毒活性
由表1的结果可见,尾穗苋70 %乙醇提取物对SMMC-7721细胞体外细胞毒活性高于其他溶剂提取物,因此,对尾穗苋70 %乙醇提取物的化学成分进行进一步研究。分离得到的化合物1~5对人肝癌细胞系HepG2和SMMC-7721细胞体外细胞毒活性见表2。

表2 化合物1~5对肝癌细胞系HepG2和SMMC-7721细胞的细胞毒活性
由表2可见,木犀草素(2)对肝癌细胞系HepG2和SMMC-7721细胞生长有较显著的抑制作用,其IC50值分别为13.36±1.01 μg/ml和16.70±1.15 μg/ml;对照组5-氟尿嘧啶的IC50值分别为22.3±1.35 μg/ml和12.66±0.98 μg/ml。由此可知,木犀草素具有较好的体外肿瘤细胞毒活性,其可能是尾穗苋主要抗肿瘤活性成分之一。
3 讨论与结论
尾穗苋为药食两用植物,有较高的药用价值和经济价值。本文对尾穗苋70 %乙醇提取物的化学成分进行分离鉴定,从中分离到10个化合物,包括黄酮(1和2),生物碱(3~5)、以及萜类(6~10),其中化合物1~5为首次从该植物中分离到。随后对化合物1~5进行体外肿瘤细胞毒活性研究,结果显示木犀草素(2)对人肝癌细胞系HepG2和SMMC-7721有显著的细胞毒活性,其他化合物对以上两种细胞没有细胞毒活性。本研究可为该植物的深入开发利用提供科学依据。

