梅毒患者外周血滤泡辅助性T细胞水平及临床意义
潘凯茜, 陈聪, 张君, 李青, 吕萍
1.南方医科大学第一临床医学院,广东 广州 510515;2.南方医科大学皮肤病医院,广东 广州 510091
梅毒是一种由梅毒螺旋体引起的慢性性传播疾病,在我国总发病率逐年增长[1-2]。梅毒螺旋体侵犯机体部位广泛,可对不适用青霉素以及疏于治疗的人群造成神经、心血管、眼、骨骼、皮肤粘膜等多个器官的严重危害。固有免疫、体液免疫和细胞免疫均参与机体对梅毒的应答过程[3-5],但确切的免疫学机制尚未完全阐明。近年来,一种命名为滤泡辅助性T细胞(follicular helper T cell,Tfh)的新型CD4+T细胞亚群被陆续报道。Tfh细胞存在于淋巴组织的生发中心及外周血中,具有促进生发中心形成、B细胞成熟与分化、高亲和力抗体产生等功能,参与多种自身免疫性疾病、传染性疾病的免疫应答过程[6-10]。目前,Tfh细胞与梅毒发病机制的关系尚未完全阐明,因此,本研究分析梅毒患者外周血Tfh细胞比例及其与病程、血清TRUST滴度的关系,探讨Tfh细胞在梅毒发生发展过程中的作用。
1 对象与方法
1.1 研究对象
选取2015年5月—2016年3月在南方医科大学皮肤病医院就诊的84例梅毒患者,依据临床诊断和病程将研究对象分为4组:治疗前组、治疗中组、治愈组、血清固定组。治疗前组纳入标准:①符合WS273—2007《梅毒诊断标准》[11];②未经任何梅毒治疗。治疗中组纳入标准:①符合WS273—2007《梅毒诊断标准》;②经过规范抗梅毒治疗1~6个月;③未达到临床治愈。治愈组纳入标准:①规范抗梅毒治疗2年及以上;②梅毒临床症状消失;③非梅毒螺旋体血清学试验阴性。血清固定组纳入标准参考2015年《梅毒血清固定临床处理专家共识》[12]:①经过规范抗梅毒治疗;②经过随访(一期梅毒随访1年,2期梅毒随访2年,晚期梅毒随访3年);③非梅毒螺旋体血清学试验维持在一定滴度超过3个月;④排除再感染、神经梅毒、心血管梅毒和生物学假阳性。纳入同期医院体检健康者37例作为对照组,纳入标准:①无不洁性交史;②无梅毒症状和体征;③非梅毒螺旋体血清学试验阴性。所有组别排除标准:①合并严重精神疾病;②合并恶性肿瘤;③合并红斑狼疮、类风湿关节炎等自身免疫性疾病。本研究经南方医科大学皮肤病医院伦理委员会批准(GDDHLS-20150613)。研究对象均签署知情同意书。
1.2 研究方法
1.2.1 资料收集 收集研究对象的年龄、性别以及患者临床诊断等资料。
1.2.2 流式细胞术检测外周血不同表型Tfh细胞 使用EDTA抗凝管采集研究对象外周血5 mL,采用 Ficoll 密度梯度分离法分离外周血单个核细胞(PBMC)。取约1×105个PBMC,分别加入PerCP-eFluorTM标记的CXCR5单克隆抗体、FITC标记的CD4单克隆抗体和PE标记的ICOS单抗(均购于eBioscience公司), 4 ℃避光标记30 min, PBS洗2遍, 200 μL PBS 重悬,转入流式管,用BD FACSCantoTMⅡ流式细胞仪检测。每次上机检测前,均采用流式校准微球(BD CS&T research beads)对流式细胞仪进行质控。
1.2.3 TRUST滴度检测方法 采集研究对象外周血4 mL,分离血清,送南方医科大学皮肤病医院检验科,由检验人员严格按照TRUST试剂盒(上海荣盛生物)说明书操作及判读结果。
1.3 统计学方法
采用SPSS 25.0软件进行统计分析。组间性别比较采用卡方检验,年龄比较采用单因素方差分析。临床分组组间不同表型Tfh细胞水平的总体比较采用Kruskal-WallisH检验,两两比较采用Mann-WhitneyU检验,两两比较Bonferroni校正后显著性水准α=0.012 5,Tfh细胞与TRUST滴度相关性采用Spearman相关进行分析。显著性水准α=0.05(双侧),P<0.05被认为差异有统计学意义。
2 结果
2.1 一般资料
共纳入121例研究对象。男77例(63.64%),女44例(36.36%),年龄2~76岁,平均(33.00±14.62)岁。各组性别、年龄情况见表1。5组之间性别(2=2.41,P=0.660)、年龄(F=0.67,P=0.617)分布无统计学差异。
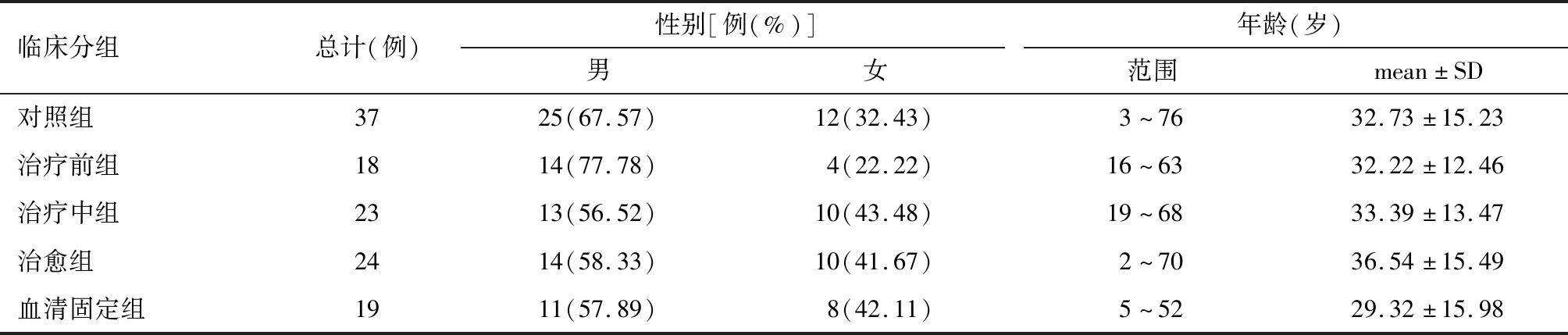
表1 各组研究对象性别、年龄情况Table 1 Demographic characteristics of subjects
2.2 外周血不同表型Tfh细胞在临床分组中的差异
各临床分组研究对象外周血不同表型Tfh细胞比例见表2、图1。CD4+CXCR5+ICOS+Tfh细胞占CD4+T细胞比例在5组之间差异有统计学意义(P=0.001),而CD4+CXCR5+和CD4+ICOS+Tfh细胞占CD4+T细胞比例在5组之间无统计学差异(P值分别为0.559、0.424)。
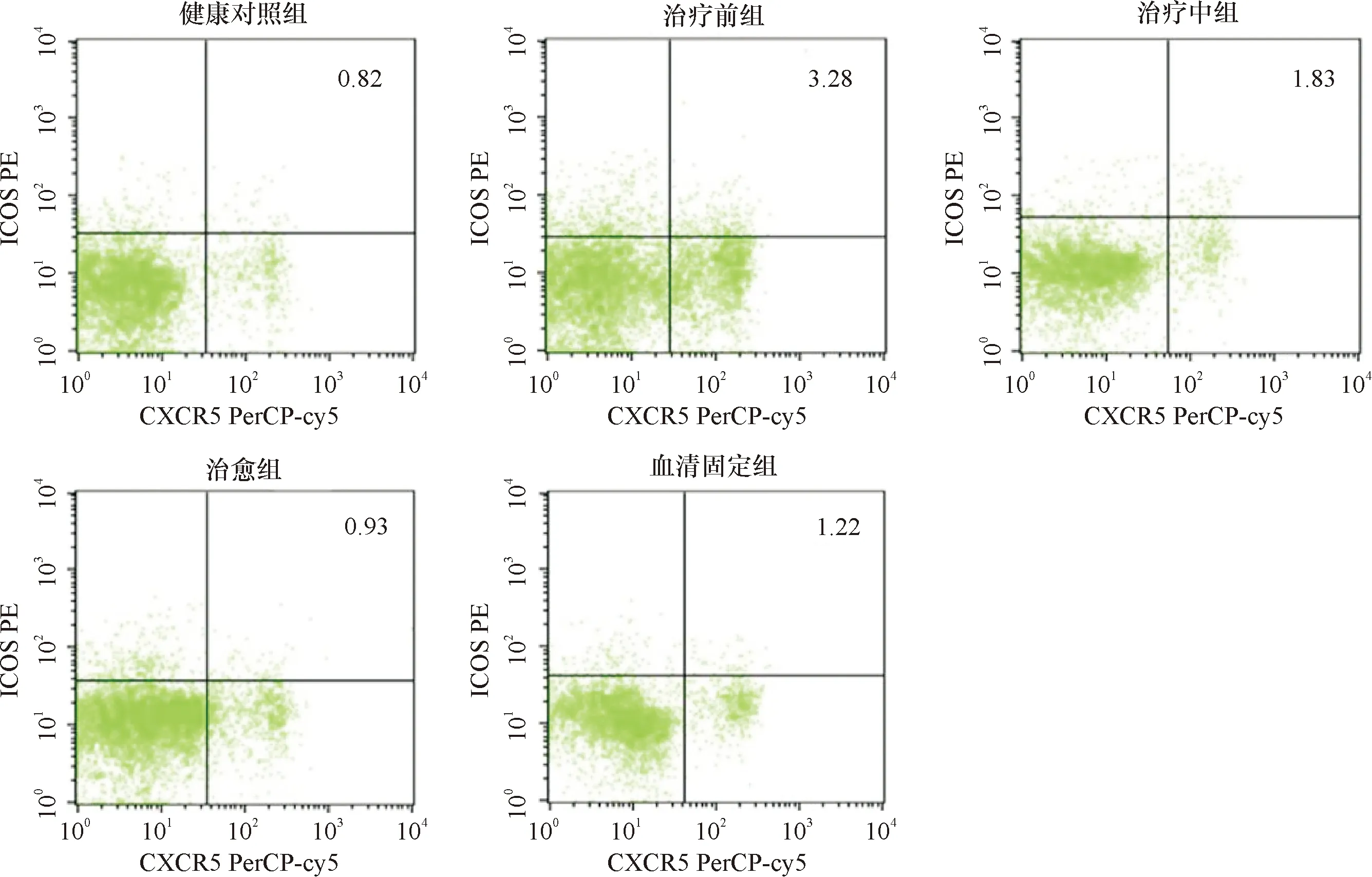
图1 各组外周血CD4+CXCR5+ICOS+Tfh细胞流式细胞分析的代表性散点图Figure 1 Representative scatter plots of flow cytometric analysis of CD4+CXCR5+ICOS+Tfh cells in peripheral blood.

表2 各组研究对象外周血不同表型Tfh细胞占CD4+T细胞比例 (%,mean±SD)Table 2 The percentages of CD4+CXCR5+ICOS+ Tfh cells in CD4+ T cells in the five groups (%,mean±SD)
与对照组相比,梅毒治疗前患者CD4+CXCR5+ICOS+Tfh细胞占CD4+T细胞比例显著上升(U=121.00,P<0.001)。与治疗前组相比,CD4+CXCR5+ICOS+Tfh细胞占CD4+T细胞比例在治疗中组无明显变化(U=128.50,P=0.039),而在治愈组(U=71.50,P<0.001)和血清固定组(U=84.50,P=0.009)均显著下降。其余组间无显著差异(P>0.012 5)。
2.3 外周血不同表型Tfh细胞的比例与TRUST滴度的相关性分析
相关性分析显示, CD4+CXCR5+ICOS+T细胞所占CD4+T细胞比例与TRUST滴度呈正相关(r=0.30,P<0.01,图2),CD4+CXCR5+T细胞所占CD4+T细胞比例与TRUST滴度无明显相关(r=-0.06,P=0.519),CD4+ICOS+T细胞所占CD4+T细胞比例与TRUST滴度亦无明显相关(r=0.14,P=0.118)。

图2 TRUST滴度与CD4+CXCR5+ICOS+Tfh细胞占CD4+T细胞比例呈正相关Figure 2 Correlation between TRUST titers and the percentage of CD4+CXCR5+ICOS+Tfh cells in CD4+T cells.
3 讨论
目前人体对梅毒螺旋体感染的免疫学应答机制尚未被完全阐明,研究表明梅毒患者存在体液免疫功能亢进,细胞免疫功能缺陷的现象[13],其外周血CD4+T细胞水平下降[14]。有研究发现,在人扁桃体中,与CD4+CD45RO+CXCR5-T细胞相比,CD4+CD45RO+CXCR5+T细胞可以有效地促进IgA和IgG免疫球蛋白的产生,这种细胞被命名为Tfh细胞[15-16]。CXCR5是Tfh细胞最重要的表面标记物,在其配体CXCL13的趋化下使Tfh细胞定位至生发中心,促进B细胞分化为浆细胞和记忆型B细胞。ICOS是Tfh细胞必不可少的共刺激分子,与B细胞表面的ICOSL结合,促进Tfh细胞分泌IL-21进一步诱导B细胞分化为浆细胞产生特异性抗体[17-18]。Tfh细胞是介导体液免疫、促进B细胞产生特异性抗体的CD4+T细胞。在慢性乙型肝炎的研究中,Tfh细胞通过IL-21途径促进HBe血清学转换[19],Tfh细胞参与了HBV的清除,敲除慢性乙型肝炎小鼠模型中的Bcl-6基因,可以使小鼠缺失Tfh细胞且延缓HBV的清除,移植Tfh细胞能够促进HBV的清除[20]。
本研究利用流式细胞分析,比较各组外周血CD4+CXCR5+ICOS+Tfh细胞占外周血CD4+T细胞比例,结果显示,治疗前梅毒患者较对照组明显上升;治疗中患者与治疗前患者比较无明显差异,推测原因可能是疗程不足引起;治愈组、血清固定组较治疗前显著下降,提示Tfh细胞参与梅毒自然病程发生阶段的免疫应答。分析TRUST滴度与CD4+CXCR5+ICOS+Tfh细胞比例的关系,结果显示两者呈正相关。提示Tfh细胞可能参与调控梅毒非特异性抗体的产生,可能与梅毒病程发展相关。
CD4+CXCR5+T细胞被认为是记忆型Tfh细胞[21]。与健康对照相比,病毒性肝炎、艾滋病患者外周血中CD4+CXCR5+T细胞数量上升[22-23],且HIV病毒载量与CD4+CXCR5+T细胞计数呈负相关,说明这种记忆型Tfh细胞可能参与人体对部分传染性疾病的免疫应答。本研究发现外周血表型为CD4+CXCR5+、CD4+ICOS+的Tfh细胞比例在不同临床分组、不同TRUST试验滴度之间差异未见统计学意义。分析原因一方面可能是本研究纳入对象的年龄段较广,即CD4+CXCR5+Tfh细胞的比例与年龄有关[24],不同年龄研究对象基础免疫力的差异可能掩盖了CD4+CXCR5+Tfh细胞比例在梅毒患者中的差异;另一方面是CXCR5可在活化的CD4+T细胞上短暂表达,但只有Tfh细胞可稳定表达CXCR5,外周血中部分短暂活化的CD4+T细胞可能影响了结果。
综上所述,本研究显示未经治疗的梅毒患者CD4+T细胞亚群中的CD4+CXCR5+ICOS+Tfh细胞占外周血CD4+细胞比例显著上升,结果佐证了梅毒患者存在体液免疫功能亢进的现象。但Tfh细胞是否直接参与梅毒抗体生成及病原体清除尚不明确,需进一步深入探索。

