LncRNA SNHG1通过miR-101-3p/MYLIP轴调节宫颈癌细胞增殖、凋亡和迁移的研究
白小英,曹蕾,张卫霞,陈琳,胡海燕,杨婷
宫颈癌(cervical cancer,CC)是一种常见的女性恶性肿瘤。人乳头瘤病毒(human papilomavirus,HPV)感染为CC的主要危险因素,基因表达的变化也为其诱发因素[1]。目前,CC的发病机制是妇科肿瘤领域的研究热点。非编码RNA,如长链非编码RNA(lncRNA)和microRNA(miRNA),在CC的发生发展中发挥着重要作用[2]。小核仁RNA宿主基因1(small nucleolar RNA host gene 1,SNHG1)是一种lncRNA,已证明SNHG1的异常表达在乳腺癌[3]、前列腺癌[4]、卵巢癌[5]等多种癌症中发挥致癌作用,其失调可能与癌症患者的生存和预后有关。最近,SNHG1被发现在CC中上调并促进肿瘤发展[6],然而,lncRNA SNHG1在CC中的作用机制仍不清楚。
lncRNA SNHG1可通过与miRNA结合来调节癌症或疾病的进展,具有潜在的诊断和预后价值[7]。miRNA是一种短的非编码RNA,可调节下游目标mRNA的转录后水平,从而影响基因翻译。生物信息学数据库预测MicroRNA-101-3p(miR-101-3p)是lncRNA SNHG1的靶基因之一。miR-101-3p是miR-101家族的成员,研究表明miR-101-3p在多种癌症中具有抑癌作用[8],并可能成为癌症的潜在治疗靶点,包括CC[9-10]。肌球蛋白调节轻链相互作用蛋白(MYLIP),又称泛素-蛋白连接酶,在癌症的发展中起着重要作用[11]。据报道,MYLIP在CC中过度表达,下调其表达可抑制CC细胞的肿瘤生长和转移[12]。此外,生物信息学预测显示MYLIP与miR-101-3p也具有靶向关系。因此,推测lncRNA SNHG1、miR-101-3p和MYLIP可能与CC的进展有关。然而,这三个基因是如何影响CC的发生发展的,目前研究较少,本文探讨了其可能的机制。
1 材料与方法
1.1 主要材料和试剂细胞
1.2 细胞培养
H8细胞和人CC细胞(Hela、Caski、C-33A、SiHa)在含有10%胎牛血清(FBS)和1%青霉素/链霉素的RPMI-1640培养基中培养,温度为37℃,含5% CO2。
1.3 方法
1.3.1 qRT-PCR检测CC细胞中SNHG1、miR-101-3p和MYLIP表达 使用TRIzol试剂提取细胞中的总RNA。使用逆转录酶将RNA逆转录为互补DNA(cDNA),然后,通过SYBR Green Master Mix Kit在ABI Prism® 7500型荧光定量PCR仪上进行qPCR。反应系统(20 μL):10 μL SYBR® Premix Ex TaqTM(2×)、0.8 μL PCR正向引物(10 μM)、0.8 μL PCR反向引物(10 μM)、2 μL cDNA(200 ng/μL)和6.4 μL无菌水。PCR反应条件如下:95℃,30 s(预变性),95℃,5 s(变性),55℃,10 s(退火),72℃,15 s(延伸),共计40个循环。根据2-ΔΔCt方法进行定量,U6和GAPDH分别用作靶基因的内部参考。将靶基因的表达水平标准化为相应的对照。

表1 qRT-PCR引物
1.3.2 Western blot检测CC细胞中MYLIP蛋白表达 收集CC细胞并在RIPA缓冲液中裂解。使用BCA蛋白质测定试剂盒测定蛋白质浓度。蛋白质(30 μg)通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离并转移到聚偏二氟乙烯膜上。用5%脱脂牛奶封闭后,将膜与抗MYLIP(1∶500)和GAPDH(1∶2 000)的一抗一起在4℃下孵育过夜。GAPDH为内部参考。然后将膜与适当的HRP偶联二抗在室温下孵育1 h。通过电化学发光试剂显色条带。Image J软件分析蛋白条带的灰度值。
1.3.3 细胞转染 将Hela细胞(在对数生长期)用0.25%胰蛋白酶进行消化,并转移到6孔板中(5×106个细胞/孔)。细胞生长稳定后,使用Lipofectamine 3000将si-SNHG1、anti-miR-101-3p及其阴性对照si-NC、inhibitor-NC转染到Hela细胞中。实验分为对照组(Control组,不进行任何转染)、si-NC组(转染si-SNHG1阴性对照)、si-SNHG1组(转染si-SNHG1)、si-SNHG1+anti-NC组(转染si-SNHG1和anti-miR-101-3p阴性对照inhibitor-NC)、si-SNHG1+anti-miR-101-3p组(转染si-SNHG1和anti-miR-101-3p)。转染后将细胞在37°C、5% CO2培养箱中继续培养。转染48 h后,提取细胞总RNA进行qRT-PCR检测SNHG1、miR-101-3p和MYLIP表达水平,验证转染效果。转染成功后用于后续实验。
1.3.4 CCK-8法检测细胞活力 将转染后的Hela细胞制成单细胞悬液,以每孔10 000个细胞的密度将它们接种在96孔板中(每组6个重复)并培养24、48和72 h。培养相应的时间后,每孔加入10 μL CCK-8溶液,然后将细胞在37℃下孵育2 h。使用Multiskan FC酶标仪在450 nm波长下检测每个孔的吸光度(A)值。
1.3.5 流式细胞术检测细胞凋亡 转染后用胰蛋白酶消化Hela细胞,用PBS冲洗,并重悬于500 μL结合缓冲液中。随后,将Hela细胞(5×105个细胞)在Annexin V-FITC和PI(100 μg/mL)溶液中避光孵育15 min。随后,使用流式细胞仪检查凋亡细胞。
1.3.6 Transwell小室实验检测细胞迁移、侵袭能力 转染后48 h,将Hela细胞重新悬浮在无血清培养基中,并接种到Transwell上室(每孔2.5×104个细胞)。下室加入含10% FBS的培养基。对于侵袭实验,Transwell上室在37℃下用Matrigel预包被1 h,然后加入细胞悬液(200 μL/孔)。而迁移实验,腔室中不添加Matrigel。细胞迁移侵袭48 h后,用棉签去除上室中不能通过膜的细胞,然后将粘附在下室膜上的细胞用4%多聚甲醛固定15 min,0.1%结晶紫溶液染色20 min,在光学显微镜下计数侵袭和迁移的细胞数量。
1.3.7 亚细胞分布分析 使用PARIS试剂盒提取细胞质和核RNA,然后进行qRT-PCR,检查细胞质和细胞核中的SNHG1水平。U6和GAPDH分别是细胞核和细胞质的内参。
1.3.8 靶基因预测和双荧光素酶报告(dual luciferase reporter assay,DLRA)基因检测 StarBase v2.0数据库用于预测miR-101-3p与SNHG1或MYLIP之间的结合位点。将含有miR-101-3p结合位点的SNHG1或MYLIP 3′UTR的序列插入pmirGLO荧光素酶报告载体以生成野生型荧光素酶报告载体(SNHG1-WT和MYLIP-WT)。同时,通过突变结合位点产生相应的突变体(SNHG1-MUT和MYLIP-MUT)。使用Lipofectamine 3000将构建的荧光素酶报告载体与miR-101-3p mimic或miR-NC共转染到Hela细胞中。在转染前将Hela细胞种植到24孔板中,每孔密度为5×104个细胞。转染48 h后使用DLRA分析系统评估荧光素酶活性。
1.3.9 RNA结合蛋白免疫沉淀(RNA binding protein immunoprecipitation,RIP) 用Magna RNA结合蛋白免疫沉淀试剂盒裂解转染了miR-101-3p mimic或miR-NC的Hela细胞用于RIP测定。在完全RIP裂解缓冲液中裂解Hela细胞后,将细胞裂解物与含有抗Ago2或抗IgG抗体的磁珠在4℃下进行孵育过夜,抗IgG为阴性对照。孵育过夜后,用蛋白酶K处理磁珠以提取免疫沉淀的RNA。然后通过qRT-PCR测定Ago2或IgG RIP复合物中SNHG1和miR-101-3p的富集水平。
1.4 统计学方法
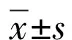
2 结果
2.1 CC细胞中SNHG1、miR-101-3p和MYLIP表达
与H8细胞相比,CC细胞(Hela、Caski、C-33A、SiHa)中SNHG1、MYLIP mRNA和蛋白水平显著升高(P<0.05),miR-101-3p表达水平显著降低(P<0.05);其中Hela细胞中SNHG1、MYLIP mRNA和蛋白水平明显高于其他细胞,miR-101-3p表达水平明显低于其他细胞。因此选择Hela细胞进行后续实验。见下页图1、表2。
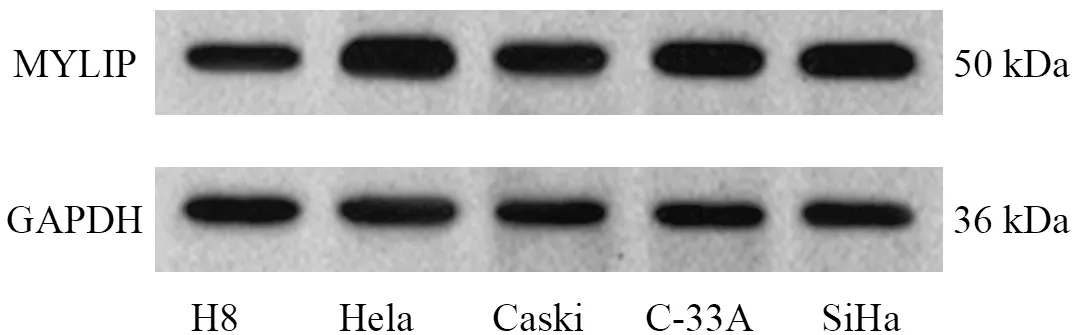
图1 CC细胞中MYLIP蛋白表达
表2 CC细胞中SNHG1、miR-101-3p和MYLIP表达水平比较
2.2 转染各组Hela细胞中SNHG1、miR-101-3p和MYLIP表达水平
与Control组相比,si-NC组SNHG1、miR-101-3p和MYLIP表达差异无统计学意义(P>0.05),si-SNHG1组SNHG1、MYLIP mRNA和蛋白水平显著降低,miR-101-3p表达水平显著升高(P<0.05);与si-SNHG1组相比,si-SNHG1+anti-miR-101-3p组MYLIP mRNA和蛋白水平显著升高,miR-101-3p表达水平显著降低(P<0.05)。见图2、表3。
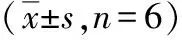
表3 转染各组Hela细胞中SNHG1、miR-101-3p和MYLIP表达水平比较
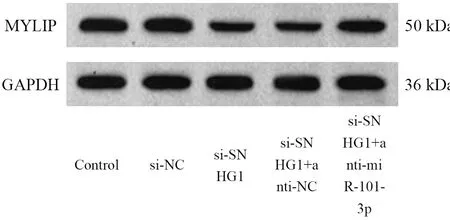
图2 转染各组Hela细胞中MYLIP蛋白表达
2.3 SNHG1沉默对Hela细胞活力的影响
在48 h和72 h时,与Control组相比,si-NC组Hela细胞活力差异无统计学意义(P>0.05),si-SNHG1组Hela细胞活力显著降低(P<0.05);与si-SNHG1组相比,si-SNHG1+anti-miR-101-3p组Hela细胞活力显著升高(P<0.05)。详见表4。
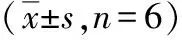
表4 各组Hela细胞活力比较
2.4 SNHG1沉默对Hela细胞凋亡的影响
与Control组相比,si-NC组Hela细胞凋亡率差异无统计学意义(P>0.05),si-SNHG1组Hela细胞凋亡率显著升高(P<0.05);与si-SNHG1组相比,si-SNHG1+anti-miR-101-3p组Hela细胞凋亡率显著降低(P<0.05)。见下页图3、表5。
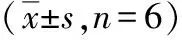
表5 各组Hela细胞凋亡率比较

图3 各组Hela细胞凋亡情况(流式细胞术)
2.5 SNHG1沉默对Hela细胞迁移、侵袭能力的影响
与Control组相比,si-NC组Hela细胞迁移和侵袭的数量差异无统计学意义(P>0.05),si-SNHG1组Hela细胞迁移和侵袭的数量显著减少(P<0.05);与si-SNHG1组相比,si-SNHG1+anti-miR-101-3p组Hela细胞迁移和侵袭的数量显著增加(P<0.05);见图4(彩插1)、表6。
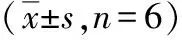
表6 各组Hela细胞迁移和侵袭的数量比较
2.6 SNHG1竞争性结合miR-101-3p并抑制其在CC细胞中的表达
亚细胞定位分析结果显示,在Hela细胞的细胞质中,SNHG1的比例较高,而在细胞核中SNHG1的比例较低,见下页图5A。使用StarBase v2.0数据库预测到SNHG1包含miR-101-3p的结合位点,见图5B。DLRA结果显示,与miR-NC相比,转染miR-101-3p mimic后,含SNHG1-WT质粒细胞的荧光素酶活性显著降低(P<0.05),含SNHG1-MUT质粒细胞的荧光素酶活性未受显著影响(P>0.05),见图5C。RIP结果显示,与抗IgG相比,SNHG1和miR-101-3p在抗Ago2复合物中高度富集(P<0.05),见图5D。
注:A为qRT-PCR显示SNHG1在Hela细胞的细胞质和细胞核中的分布;B为StarBase数据库中预测的SNHG1和miR-101-3p的靶向结合序列;C为DLRA检测证实SNHG1和miR-101-3p在Hela细胞中的直接结合;D为RIP实验验证SNHG1与miR-101-3p在Hela细胞中的相互作用;*P<0.05。
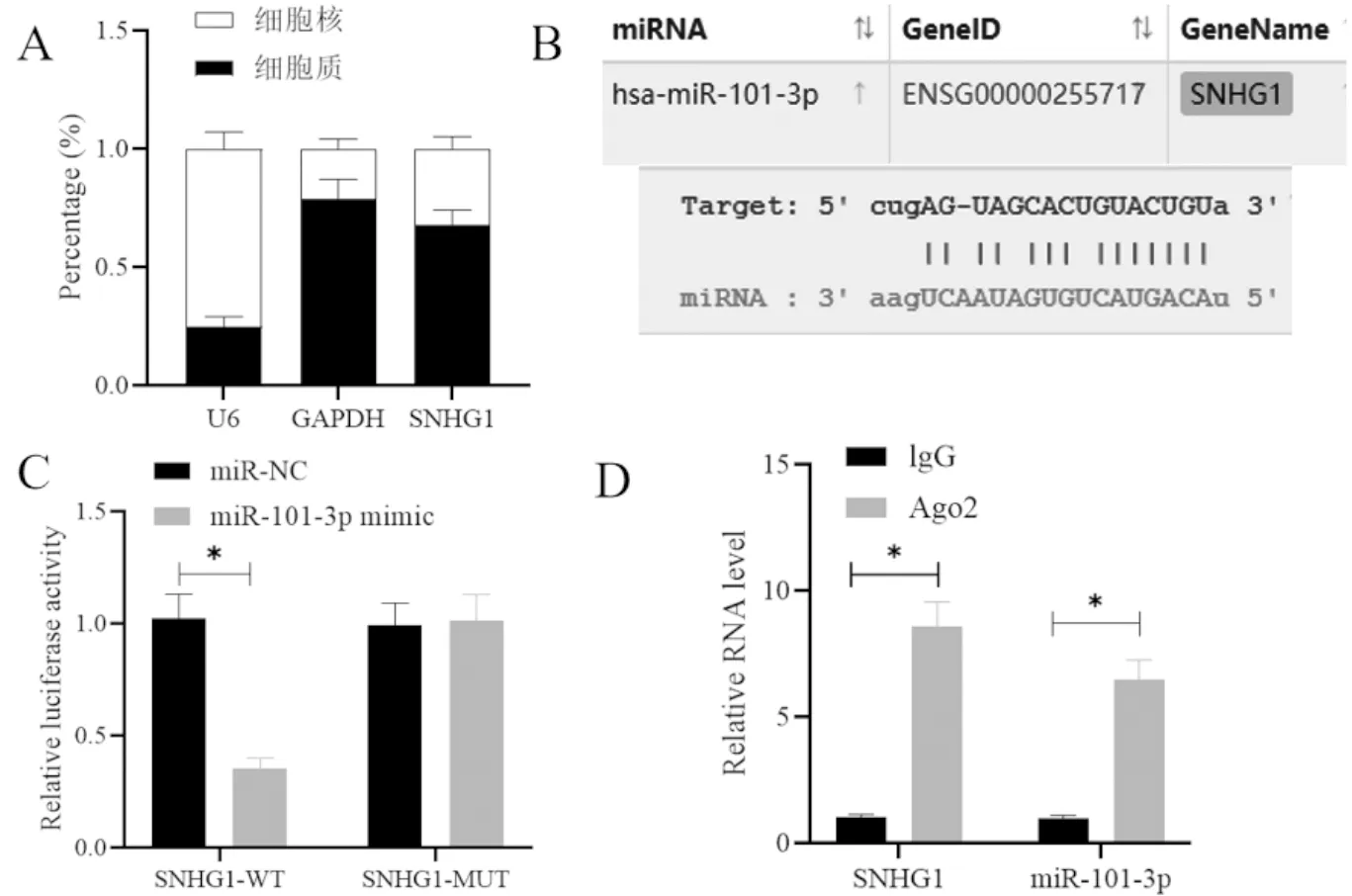
2.7 MYLIP为miR-101-3p的靶标
使用StarBase v2.0数据库预测miR-101-3p的靶基因,发现MYLIP的3′UTR具有与miR-101-3p互补的序列,见下页图6A。DLRA结果显示,与miR-NC相比,转染miR-101-3p mimic后,含MYLIP-WT质粒细胞的荧光素酶活性显著降低(P<0.05),含MYLIP-MUT质粒细胞的荧光素酶活性未受显著影响(P>0.05),见下页图6B。

注:A为StarBase数据库预测的miR-101-3p和MYLIP的靶向结合序列;B为DLRA测定确认miR-101-3p和MYLIP在Hela细胞中的直接结合;*P<0.05。
3 讨论
尽管CC的治疗选择(如手术、放疗和化疗)取得了很大进展,但相当一部分患者会出现复发或转移[13]。目前,仍无有效的分子特征来预测CC患者的复发率和生存率。因此,迫切需要寻找新的CC诊断和预后生物标志物。
近年来,越来越多的CC相关lncRNA被发现,为CC的诊断和治疗提供了新的思路。据报道,在CC中SNHG1上调,miR-101-3p下调,它们的异常表达与CC的发生发展有关[6,9]。lncRNA调节miRNA是细胞中常见的分子调控机制,因此当两种RNA出现异常表达时,它们所参与的细胞调控将不可避免地失控[14]。本研究结果显示,SNHG1和miR-101-3p在CC细胞中呈“一高一低”的表达趋势,这与既往的发现一致。生物信息学分析表明SNHG1主要位于细胞质中。亚细胞定位分析结果进一步验证了SNHG1的细胞质定位。越来越多的证据表明,大多数细胞质lncRNA作为特定miRNA的竞争性内源性RNA(ceRNA)或分子海绵,从而影响其生物活性[15-16]。因此,推测lncRNA SNHG1可能通过特定位点与miR-101-3p结合,从而降低其水平。
接下来,利用StarBase v2.0数据库预测和寻找两个基因之间的结合位点,结果表明在SNHG1的序列中有一个可以与miR-101-3p配对并结合的序列片段,并将miR-101-3p确定为目标miRNA。进行了双荧光素酶报告基因检测以验证该位点的存在,结果表明当miR-101-3p mimic和SNHG1-WT共转染到细胞中时,荧光素酶活性降低。在进行RIP检测后,观察到SNHG1和miR-101-3p被Ago2抗体显著富集。这表明SNHG1可以与miR-101-3p结合,从而抑制其水平。此前已报道miR-101-3p在CC细胞中呈低表达,其高表达可显著抑制癌细胞生长和转移[9-10]。然而,目前尚缺少关于SNHG1对miR-101-3p的作用或其在CC中的作用研究。在本研究中,通过构建相应的表达载体,探讨SNHG1、miR-101-3p对CC的特异性作用。结果显示,miR-101-3p的水平因SNHG1的敲低而升高,且下调miR-101-3p表达后,由SNHG1敲低引起的细胞增殖抑制作用被减弱,同时SNHG1敲低的促凋亡和抗迁移、侵袭作用也被anti-miR-101-3p恢复。这些结果表明SNHG1可能是CC细胞中miR-101-3p的海绵。提示,SNHG1可靶向miR-101-3p并在CC中负调控miR-101-3p表达。
miRNA通过识别特定靶mRNA的互补靶位点,在转录后调节基因表达[17-18]。因此,下游靶mRNA是ceRNA调控网络的重要组成部分。MYLIP是一种重要的E3泛素连接酶,据报道它在各种癌症中发挥重要作用[11]。在CC中,MYLIP呈高表达,下调其表达可抑制CC细胞的生长和转移[12]。在本研究中,MYLIP在CC细胞中表达升高,与miR-101-3p表达趋势相反。StarBase数据库预测到MYLIP的3'UTR序列中存在miR-101-3p的结合位点,表明MYLIP可能是miR-101-3p的靶标。双荧光素酶报告实验进一步证实了MYLIP是miR-101-3p的靶基因。重要的是,SNHG1的下调可以下调MYLIP,而miR-101-3p的下调可升高MYLIP表达,减弱SNHG1敲低对癌症进展的影响,表明SNHG1可能通过与miR-101-3p结合来调节MYLIP,从而参与CC的进展。
综上所述,SNHG1敲低可能是通过上调miR-101-3p来抑制MYLIP表达,进而抑制CC细胞增殖、迁移和侵袭,并促进CC细胞凋亡。本研究表明SNHG1是治疗CC的潜在靶点,并为SNHG1提供了新的调控机制。然而,需要更多的实验,如体内和临床实验,以进一步证实SNHG1/miR-101-3p/MYLIP轴在CC进展中的生物功能。

