LSD1抑制剂联合顺铂对宫颈癌CaSki细胞功能影响的研究
李蒙蒙,张丽荣,彭军,陈莹莹,李广太*
近年来,随着表观遗传学的发展,肿瘤内部的调控机制渐趋清晰,表观遗传学中的组蛋白甲基化以及乙酰化修饰对多种肿瘤基因的表达造成影响,从而控制肿瘤的进程[1]。在肿瘤发生中常伴随基因甲基化或组蛋白甲基化的缺失[2-3]。赖氨酸特异性组蛋白去甲基化酶1(lysine specific demethylase 1,LSD1)是一种表观遗传酶,它能催化组蛋白H3K4 位点去甲基化、参与多种肿瘤基因的激活,与肿瘤的发生发展存在密切联系,目前已成为研究的热点。LSD1与多种癌症预后相关,并且已被建议作为肿瘤的治疗靶点[4-7]。研究表明,LSD1抑制剂对晚期宫颈癌增殖及转移的治疗起到重要作用[8],可通过对宫颈癌抑癌基因的甲基化,实现宫颈癌基因的转录沉默,增强宫颈癌的治疗效果[9]。
本研究通过LSD1抑制剂OGL002和顺铂联合作用于宫颈癌CaSki细胞系,检测LSD1以及其下游组蛋白的表达水平,最终通过比较单用药和联合用药对宫颈癌细胞增殖、侵袭和凋亡水平的影响,从表观遗传学阐明联合用药的作用效果,以期为晚期复发宫颈癌患者的精准靶向治疗提供实验依据。
1 材料和方法
1.1 材料
人类宫颈癌细胞系CaSki购自美国ATCC细胞库。LSD1特异性抑制剂OGL002购自美国Selleck Chemicals公司,注射用冻干型顺铂购自齐鲁制药有限公司,鼠源GAPDH单克隆抗体、兔源LSD1单克隆抗体、兔源H3单克隆抗体、兔源H3K4me1单克隆抗体、兔源H3K4me2单克隆抗体、羊抗兔二抗、羊抗鼠二抗均购自英国Abcam公司。
1.2 方法
1.2.1 细胞培养与分组 将CaSki细胞培养于恒温培养箱中,细胞培养基选择含10%胎牛血清的1640培养基。每3 d更换细胞培养基,维持细胞浓度约为1×106个/mL。实验设计分组:对照组,OGL002组,顺铂组,OGL002+顺铂组。实验中OGL002组浓度为10 μmol/L,顺铂浓度为2 μmol/L。
1.2.2 MTT法检测细胞增殖 将培养的CaSki细胞以103个细胞/孔接种在96孔板,放置于细胞培养箱中4 h。之后更换培养基,对照组加入正常培养基,OGL002组加入含有抑制剂的培养基,顺铂组加入含顺铂的培养基,OGL002+顺铂组加入含抑制剂和顺铂的培养基,继续培养48 h,到达时间后每孔加入10 μL MTT继续培养3 h,最后每孔加入150 μL DMSO,酶标仪490 nm测定吸光度,在测定中进行了6次重复。
1.2.3 集落形成实验检测细胞增殖 将CaSki细胞接种于六孔板中,细胞贴壁后,按照组别用药物处理48 h,之后更换含有10% FBS的1640培养基。14 d后,用甲醇固定细胞并用结晶紫(0.1%)染色,拍摄菌落图。
1.2.4 Transwell检测细胞侵袭 待细胞长满后,离心收集,调整细胞浓度,每组分别按照组别用对应的含药培养基重悬细胞。将200 μL细胞悬液用移液枪均匀地转移到Transwell小室,将小室放于24孔板中,下室加入含10%FBS的1640培养基培养。之后用甲醛固定下室细胞,用结晶紫染色。采用显微镜对穿孔细胞进行计数,作为细胞侵袭能力的指标。
1.2.5 Annexin V-FITC/PI双染法检测细胞凋亡 将CaSki细胞接种于六孔板中,细胞贴壁后,分别更换为含药培养基作用,48 h后离心收集,重悬细胞后取5×105个细胞,加入5 μL AnnexinV-FITC和10 μL PI,作用10 min后离心,重悬细胞后上机检测。
1.2.6 实时荧光定量PCR法检测LSD1的表达 将CaSki细胞接种于六孔板中,细胞贴壁后用药物处理48 h,收集细胞, Trizol法提取RNA,NanoDrop-2000测量RNA浓度。之后进行逆转录合成cDNA,Q-PCR法扩增cDNA片段,序列:LSD1上游5’ CGACTTCCCCATGACCGAAT 3’,下游5’GAGTGGCTTCAAACGTCAGC3’,GAPDH上游5’ ATGGCCTTCCGTGTTCCTACC3’,下游5’ CCTGCTTCA CCACCTTCTTGATG 3’。
1.2.7 Western blot检测LSD1以及H3K4me1和H3K4me2蛋白的表达 如前所述离心收集药物作用后的细胞,按照RIPA裂解液法提取细胞总蛋白,通过BCA 蛋白质测定试剂盒对提取的蛋白进行定量,之后向蛋白中加入Lodding buffer,煮沸后使蛋白质变性。提前配制电泳凝胶,根据蛋白定量的值,每孔加入40 μg样本上样,注意用Lodding buffer补齐体积,上样电泳,转膜,之后封闭2 h,兔单抗LSD1(1∶1 000),鼠单抗GAPDH(1∶1 000),H3K4me1(1∶2 000),H3K4me2(1∶2 000),H3(1∶3 000),室温孵育2 h,之后用TBST洗3次,每次5 min,二抗(1∶3 000)室温孵育2 h,TBST洗3次,显色曝光,Tanon 4200R 全自动化学发光图像分析系统扫描,Image J 软件进行分析。
1.3 统计学方法
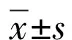
2 结果
2.1 MTT法检测细胞增殖
MTT结果显示OGL002组、顺铂组与对照组相比,细胞增殖的水平明显下降,并且OGL002+顺铂组细胞增殖水平最低,说明OGL002抑制剂以及顺铂作用于宫颈癌细胞都可以降低宫颈癌细胞的增殖,并且二者联合用药对宫颈癌细胞增殖的抑制作用最大(n=6,***P<0.001)。见下页图1。

图1 各药物处理组CaSki细胞增殖比例柱形图
2.2 集落形成实验检测细胞增殖
为了充分验证OGL002和顺铂联合用药对宫颈癌细胞增殖的影响,我们接着进行了集落形成实验,OGL002组、顺铂组与对照组相比,细胞增殖水平显著降低,并且OGL002+顺铂组为最低,进一步确定二者联合用药对宫颈癌细胞增殖的抑制作用最大(n=6,**P<0.01,***P<0.001),见下页图2。
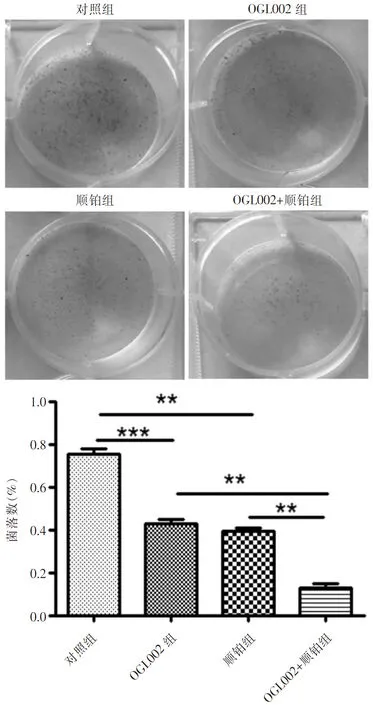
图2 各药物处理组CaSki细胞集落形成图
2.3 Transwell检测细胞的侵袭
Transwell检测结果显示,OGL002组和顺铂组与对照组相比,CaSki细胞的侵袭水平降低,OGL002+顺铂组为最低(n=6,*P<0.05,**P<0.01,***P<0.001),说明抑制剂联合顺铂作用降低了宫颈癌细胞的侵袭能力,如图3。

图3 各药物处理组CaSki细胞侵袭图
2.4 流式细胞仪检测细胞的凋亡
为了验证联合用药对宫颈癌细胞凋亡的影响,我们采用流式细胞检测仪细胞凋亡, OGL002组和顺铂组与对照组相比,CaSki细胞的凋亡水平增加,OGL002+顺铂组凋亡水平高于其它组(n=6,*P<0.05;**P<0.01),说明抑制剂以及顺铂增加了CaSki细胞的凋亡,见下页图4。
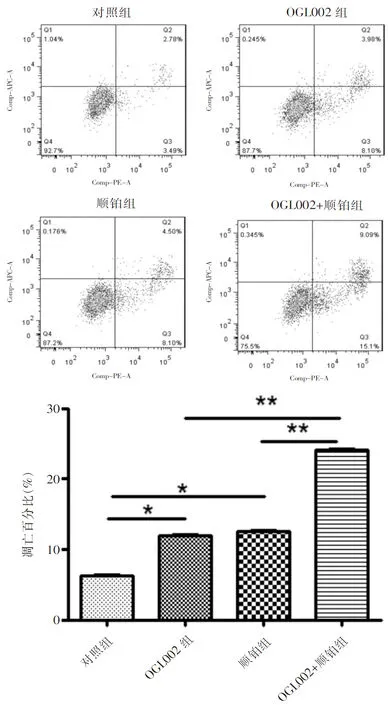
图4 各药物处理组CaSki细胞凋亡图
2.5 Q-PCR法检测LSD1基因的表达量
为了深入探究OGL002抑制剂和顺铂对宫颈癌细胞影响的分子机制,我们对各组LSD1基因的表达进行检测,OGL002组和顺铂组与对照组相比,LSD1基因表达水平会明显降低,OGL002+顺铂组为最低,差异有统计学意义(n=6,P<0.01),说明抑制剂联合顺铂降低了LSD1基因的表达,见下页图5。

图5 各组LSD1基因表达比例柱形图
2.6 Western法检测LSD1以及下游H3K4me1、H3K4me2蛋白的表达
OGL002组和顺铂组与对照组相比,细胞中LSD1表达水平降低,而其下游H3K4me1、H3K4me2的表达升高,其中OGL002+顺铂组差别最大(n=6,*P<0.05;**P<0.01;***P<0.001),说明抑制剂以及顺铂都实现了LSD1蛋白水平的降低以及下游组蛋白甲基化水平升高。见图6。
3 讨论
表观遗传学中的组蛋白甲基化及乙酰化修饰影响了多种肿瘤基因的表达从而影响了肿瘤的发生发展过程[1]。近年来发现多种表观遗传标记的酶可作为癌症治疗的潜在靶点[11]。目前认为染色质修饰在肿瘤中占有重要地位[12],通过对组蛋白进行去甲基化修饰以在染色质调控中行使功能。乙酰化通常与转录激活相关[13],而组蛋白甲基化作为激活或抑制转录的标记,其对转录的影响主要是由残基甲基化的位置和程度决定的[14]。越来越多的证据表明表观遗传酶LSD1在肿瘤基因的表达和调控中起着重要的作用[15-16],LSD1可以使组蛋白赖氨酸H3K4 位点去甲基化从而在肿瘤分子信号通路中调节肿瘤的增殖、侵袭以及转移。目前已发现LSD1通过组蛋白去甲基化影响宫颈癌细胞的生理过程,与肿瘤预后和分化相关[17]。一些研究表明表观基因组的变化对于宫颈癌的治疗起着重要的作用,LSD1抑制剂可通过对宫颈癌抑癌基因的甲基化,实现宫颈癌基因的转录沉默,增强宫颈癌的治疗效果,有望成为新的宫颈癌治疗靶点[4,9,18]。
顺铂属于铂金属络合物的一种治疗癌症的非特异性药物。以铂类药物为基础的联合化疗是妇科恶性肿瘤的基本化疗方案,其联合紫杉醇或贝伐珠单抗以治疗转移或复发的晚期宫颈癌[10],但对于晚期复发转移的宫颈癌治疗效果并不理想,且常可能会诱导耐药和不良作用的产生[19],因此探索联合用药的癌症治疗方案对于控制癌症的进展以及良好的预后都具有重要意义。
本研究采用LSD1的特异性抑制剂OGL002和抗癌药物顺铂作用于宫颈癌细胞。结果发现与对照组相比,OGL002和顺铂分别单独应用均可抑制宫颈癌CaSki细胞的增殖和侵袭,但二者的联合作用效果比单独作用效果更加明显,对宫颈癌细胞的增殖和侵袭抑制的水平更高,同时也使凋亡水平显著上调。
我们进一步验证了LSD1以及下游组蛋白甲基化水平对宫颈癌CaSki细胞的影响,发现OGL002组和顺铂组与对照组相比,LSD1基因表达水平会明显降低,OGL002+顺铂组为最低,差异有统计学意义,说明OGL002抑制剂联合顺铂降低了LSD1基因的表达。同时,我们发现其下游H3K4me1、H3K4me2的表达升高,其中以OGL002+顺铂组差别最大,说明抑制剂以及顺铂都实现了LSD1蛋白水平的降低以及下游组蛋白甲基化水平升高,但二者的联合应用更增强了这种效应。
肿瘤细胞的增殖侵袭能力越强,凋亡水平越低,肿瘤发生转移的概率越大,所以目前针对肿瘤细胞的侵袭增殖和凋亡的检测是研究的热点,我们对LSD1以及下游组蛋白表达改变的细胞增殖、侵袭、凋亡水平进行检测,显示随着LSD1表达水平的降低,细胞的增殖侵袭能力同时降低,而细胞的凋亡水平升高,提示通过改变宫颈癌细胞中的组蛋白修饰对宫颈癌细胞的表观遗传功能产生了影响,从表观遗传学角度阐明了LSD1抑制剂OGL002在宫颈癌中的作用,为后续宫颈癌的靶向治疗提供了实验依据,我们正拟行动物体内实验以寻找新的宫颈癌治疗靶点和更进一步的循证支持。

