慢性铝暴露对小鼠精子质量及睾丸细胞焦亡的影响
农威华,杨凤莲,李红阁, 窦晟,董明右,王俊利
(1. 右江民族医学院附属医院妇产科,广西 百色 533000;2. 右江民族医学院生物医药与大健康现代产业学院,广西 百色 533000;3. 右江民族医学院附属医院,广西医疗卫生重点学科生殖医学,广西 百色 533000)
铝是一种在自然环境中丰富存在且使用广泛的金属元素,可以通过皮肤、呼吸道、消化道、肌肉注射等途径进入人体。人类接触铝的来源主要包括食物、空气传播的微粒和烟雾、药物、化妆品等[1]。铝在体内积累将对男性精子质量产生负面的影响,包括降低精子数量、活力及存活率,增加精子畸形率等[2]。目前已发现多种途径参与铝诱导的男性生殖毒性,如氧化应激、炎症、DNA损伤和线粒体功能障碍,其中炎症是早期的标志性损伤[3-5]。
焦亡是由某些炎症小体引发的细胞程序性死亡的一种炎症形式[6],可导致细胞肿胀、质膜溶解、染色质碎裂、细胞内促炎内容物如IL-18和IL-1β的释放[7],Gasdermin D(GSDMD)是Caspase-1(CASP1)的一种蛋白底物,是细胞焦亡过程中的执行分子,其裂解可导致N-结构域寡聚化和质膜孔形成,是细胞死亡的破裂形式[8]。在探讨铝对神经系统影响的研究中发现,铝可以刺激核苷酸寡聚结构域样受体家族pyrin结构域,炎症小体NLRP3组装并激活CASP1,诱导GSDMD介导的细胞焦亡信号,释放细胞因子IL-1b和IL- 18,放大神经炎症反应[9]。对来自病原体感染、组织损伤和毒物反应,机体促炎细胞因子激活,如肿瘤坏死因子-α (TNF-α)、白介素-1β (IL-1β) 和白介素-6 (IL-6),从而对 HPG 轴、睾丸组织、精子质量产生负面影响[10-11]。多项研究发现,铝可以诱发睾丸炎症和精子质量下降,基于炎症与焦亡的发生密切相关,认为焦亡是铝对男性生殖毒性的潜在机制。
本研究通过分析铝暴露对小鼠精子质量的影响,结合铝暴露组与对照组睾丸细胞焦亡关键基因(Nlrp3、Caspase-1、Gsdmd和IL1b)mRNA和蛋白的表达差异,探讨铝通过睾丸细胞焦亡影响精子质量的潜在机制。
1 实验材料和方法
1.1铝暴露小鼠模型的构建 12只成熟雄性c57bl/6j小鼠,8周龄,购买于斯莱克景达动物公司,许可证号:SCXK(湘)2019-0004。在实验开始前进行1周的适应性饲养。饲养条件为室温(25±2) ℃、相对湿度 50%~70%、12 h∶12 h明暗交替光照,实验期间小鼠可自由摄食及饮水。随后,将小鼠随机分为两组:对照组(n=6)、铝模型组(n=6)。铝模型组采用10 mg/(kg·d) AlCl3(AlCl3·6H2O,上海阿拉丁生化科技公司,批号:A112509)灌胃,每天1次[12]。对照组用铝暴露组AlCl3等体积的蒸馏水灌胃,每天1次。模型构建持续8周,取小鼠睾丸组织、附睾组织及附睾精子进行分析。精子质量及睾丸组织形态是评估铝暴露小鼠模型建造成功的重要指标,精子质量下降及睾丸组织形态受损说明实验组小鼠生殖系统成功因铝暴露而受损[13]。
1.2精子质量检测 取一侧附睾组织,置于1.5 mL 37 ℃的生理盐水中,剪碎、混匀,37 ℃水浴箱中温育15 min,取得附睾精子滤液。取10 μL精子滤液滴入预热的Makler精子计数板,利用计算机辅助精液分析仪(CASA) ,参照WHO 精子运动分类标准[14],将精子活动力分为 PR(前向运动精子)、NP(非前向运动精子)和 IM(不动精子)三级,对精子进行分类计数,显微镜下计数 200 个精子,分析前向运动精子百分比,精子活力检测工作于3 min内完成。采用Diff-Quik快速染色法试剂盒(北京索莱宝科技公司,批号:G2572)进行精子形态学检查,统计异常精子数,计算异常精子率。
1.3睾丸组织病理学、生精小管面积和直径测量 取左侧睾丸固定于4%聚甲醛24 h,进行脱水、石蜡包埋,切割成5 μm的石蜡切片。石蜡切片进行苏木精-伊红染色,于蔡司显微镜下分析睾丸、附睾组织病理学。于显微镜下每组随机筛选50个圆形生精小管进行直径和面积测量。
1.4定量实时聚合酶链反应(qRT-PCR) 采用Trizol(美国英杰生命科技有限公司)法提取睾丸总RNA,测定总 RNA浓度及纯度,按逆转录试剂盒the PrimeScript 1st strand cDNA Synthesis Kit [宝生物工程(大连)有限公司]说明书步骤将mRNA逆转录成cDNA,使用ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技有限公司)在A28132 PCR系统下进行实时荧光定量 PCR扩增。以Gapdh为内参基因,数据采用2-ΔΔCt法进行分析。使用引物序列如表1所示。
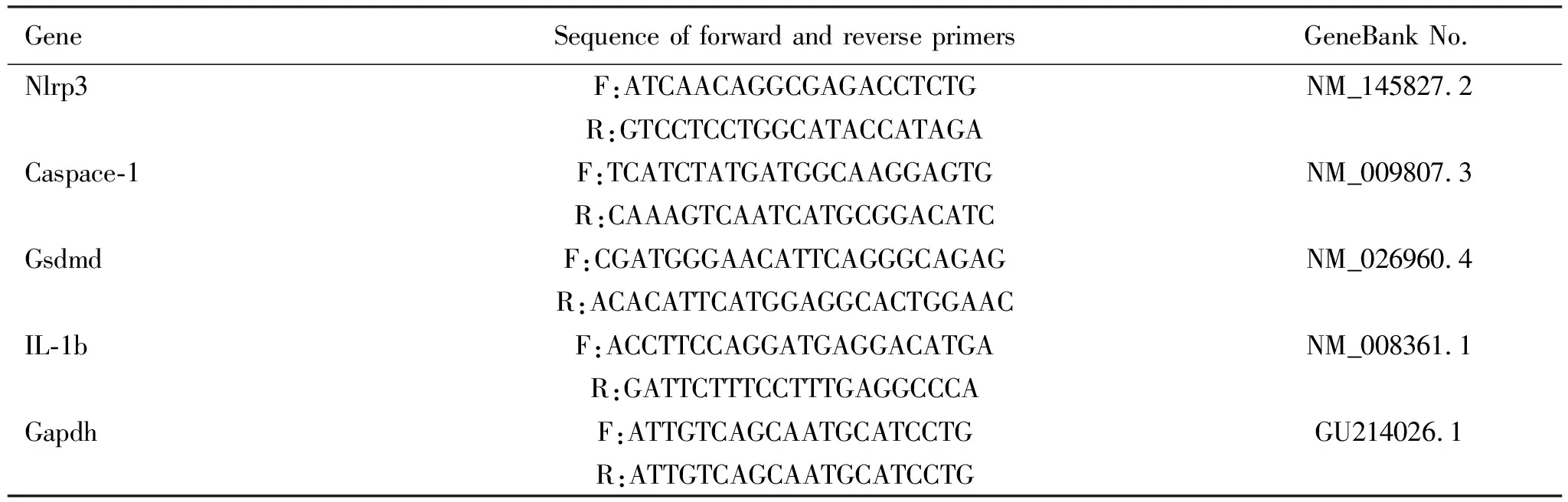
表1 qPCR实验相关基因的引物序列
1.5免疫组织化学检测 石蜡切片用酒精梯度进行水化,用pH 6.0柠檬酸盐缓冲液高压孵育3 min修复抗原,滴加内源性过氧化物酶阻断剂,PBS清洗,滴加非特异染色阻断剂,滴加对应的一抗液,盖上湿盒盖,放入4 ℃冰箱内过夜,PBS冲掉切片内的一抗液,加入二抗,孵育20 min,用PBS冲掉切片内的二抗液,使用DAB显色液显色,水洗尽DAB液后,放入苏木素中染色、水洗、返蓝、脱水、封片,显微镜下分析染色结果。使用抗体如表2所示。
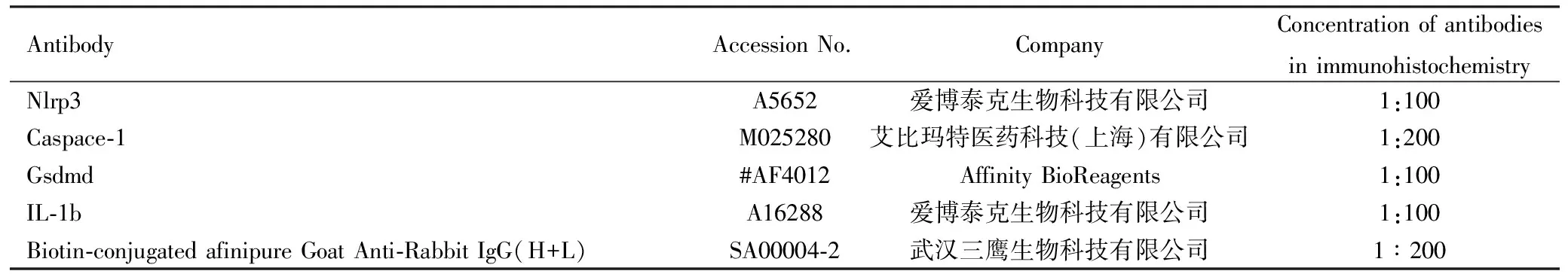
表2 免疫组化中相关抗体信息
2 实验结果
2.1铝暴露对小鼠体重、睾丸重量、附睾重量及精子质量的影响 与对照组相比,铝暴露小鼠体重、睾丸重量及附睾重量均明显下降(P<0.01)。与对照组相比,铝暴露小鼠附睾精子数量、精子活力均显著下降(P<0.01),精子畸形率显著增加(P<0.01)。结果见图1。
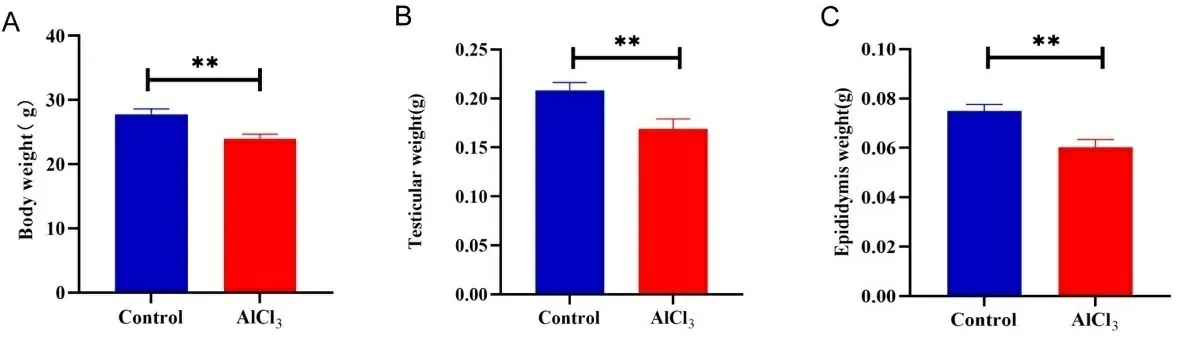
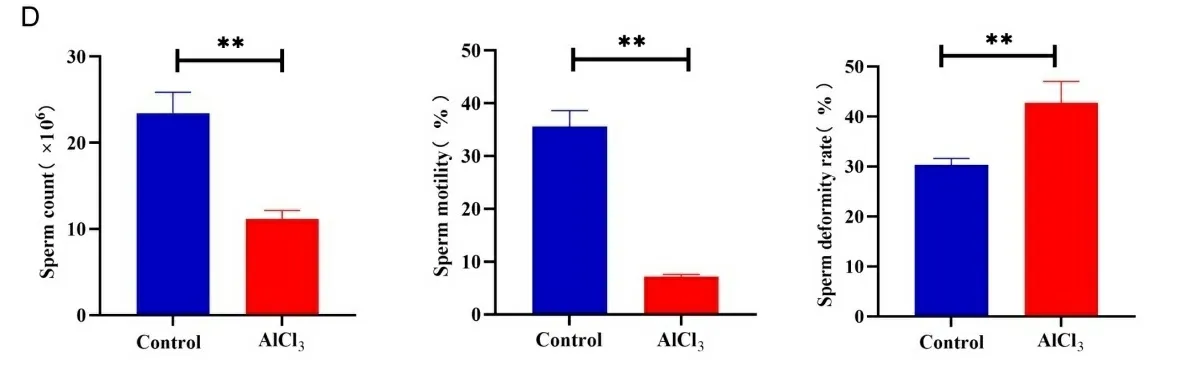
注:A.对照组与铝暴露小鼠体重; B.对照组与铝暴露小鼠睾丸重量;C.对照组与铝暴露
2.2铝暴露对小鼠睾丸、附睾病理形态的影响 对照组小鼠睾丸组织学正常形态,有组织良好的生精小管,管内包含不同成熟阶段的生精细胞,细胞排列整齐,管内精子数量多(见图2A),同样的在附睾中精子数量多(见图2B)。然而在铝暴露小鼠中,部分睾丸生精小管萎缩,直径及面积减小,生精细胞层数及数量减少,细胞排列紊乱,管内精子数量明显减少(见图2A),在附睾中精子数量明显减少(见图2B)。
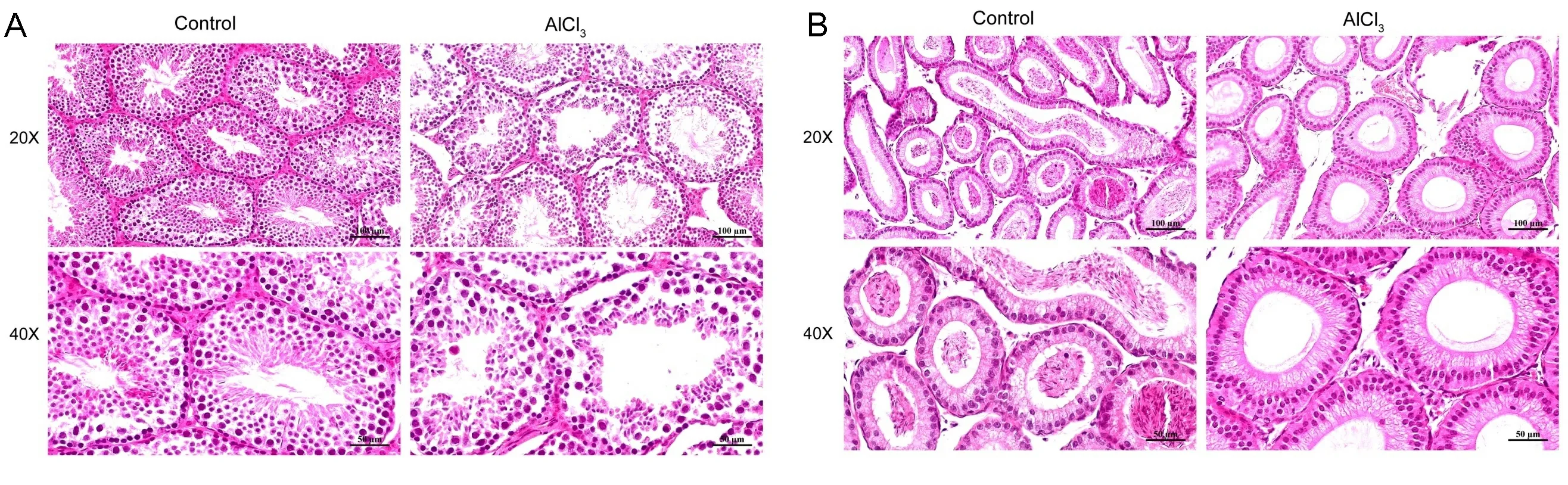
注:A.对照组与铝暴露小鼠睾丸HE染色; B.对照组与铝暴露附睾HE染色。
2.3铝暴露对小鼠生精小管直径及面积的影响 与对照组大鼠生精小管的平均面积(55968.42±7420.05) μm2相比,铝暴露小鼠生精小管平均面积(39255.70±2647.92) μm2缩小(见图3A)。与对照组生精小管直径(266.69±11.76) μm相比,铝暴露小鼠生精小管直径(223.95±10.45) μm也是减小(见图3B)。
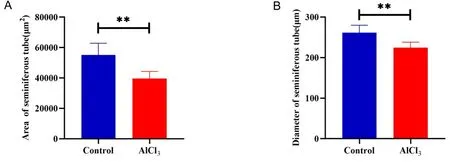
注:A.对照组与铝暴露小鼠生精小管面积; B.对照组与铝暴露生精小管直径;n=6,**P<0.01。
2.4铝暴露对小鼠睾丸组织中焦亡关键基因表达的影响 qRT-PCR 检测显示,与对照组相比,铝暴露小鼠睾丸组织中焦亡关键基因Nlrp3、Caspase-1、Gsdmd和IL-1b mRNA表达均上调(见图4A)。免疫组化结果显示,与对照组相比,铝暴露小鼠睾丸组织中焦亡关键基因Nlrp3、Caspase-1、Gsdmd和IL-1b 的蛋白表达均上调(见图4B)。
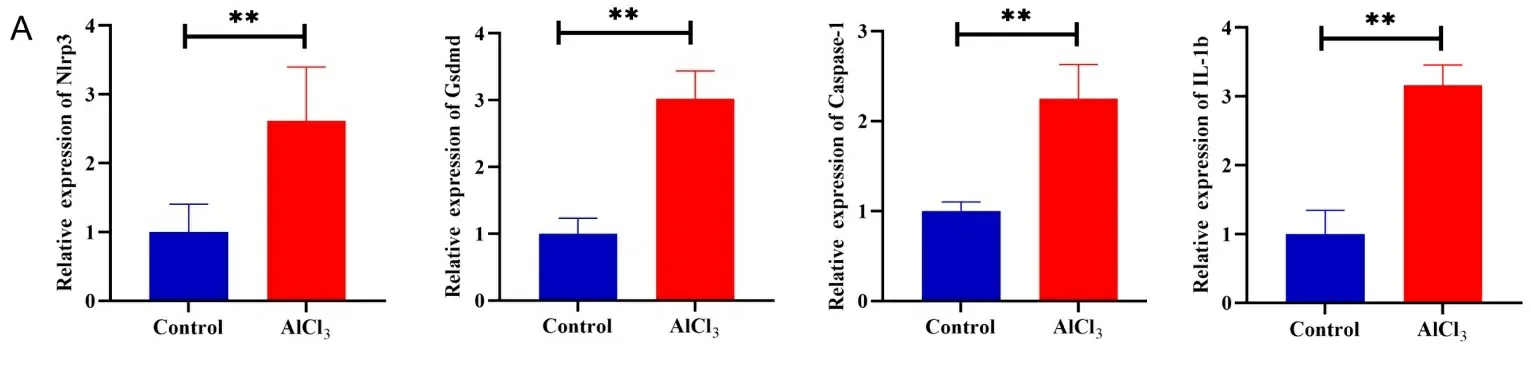
注:A.qRT-PCR检测铝暴露对小鼠睾丸组织中焦亡关键基因Nlrp3、Caspase-1、IL-1b、Gsdmd mRNA表达的影响; B.免疫组化检测铝暴露对小鼠睾丸组织中焦亡关键基因Nlrp3、Caspase-1、IL-1b、Gsdmd蛋白表达的影响。**P<0.01
3 讨论
本研究旨在探讨铝暴露对小鼠精子质量及睾丸组织细胞焦亡的影响,研究结果发现,与对照组相比,铝暴露组小鼠体重、睾丸重量、附睾重量均显著下降,与以往的研究相一致[15]。本研究中观察到铝暴露小鼠进食量下降,这是导致其体重下降的重要原因,过往文献也有类似发现[16]。睾丸重量是男性生育能力的关键,睾丸重量下降可致生精数量减少[17]。研究认为铝暴露小鼠睾丸、附睾重量下降可能是由于铝的作用引起组织坏死和萎缩[18]。另一种可能是在铝诱导下产生自由基,导致蛋白质、脂质和DNA氧化损伤,最终出现蛋白质消耗[19-20]。
精子质量下降是男性生殖毒性的标志之一[21],男性暴露于有毒物质的环境是导致精子质量下降和不孕不育的主要原因之一[22-23]。精子活力、精子数量、精子畸形率是精子质量的重要参数,本次研究结果显示铝暴露小鼠精子数量、活力显著下降,精子畸形率显著升高,这与先前的研究报道相一致[24]。精子质膜中多不饱和脂肪酸的含量极高,极易受到氧化应激的影响[25-26]。铝是一种促氧化剂,它可以通过增强氧自由基和改变酶活性对睾丸及精子产生氧化应激损伤[27],这可能是精子质量下降的主要原因。
睾丸的组织形态学特征是男性生育能力评估和生殖毒性评估的关键指标[28]。在本研究中,铝暴露小鼠睾丸组织形态学观察显示,生精小管缩小,生殖细胞滑脱、排列紊乱、层数减少,精子发生中断,管腔内精子数量减少,在附睾中成熟精子数量减少。之前的研究也报道了暴露于不同环境毒物后,睾丸的结构发生了类似的变化[29-30]。金属毒物对睾丸组织形态的改变可能是由于氧化应激引起的,睾丸组织学这些改变预示着精子发生和类固醇生成等重要过程受到干扰,上皮细胞的退化是睾丸损伤的主要原因[31-32]。有研究表明,铝暴露大鼠睾丸组织形态学观察证实了精原细胞、细线前精母细胞、粗线精母细胞减少,提示生精活性下降[33]。此外,暴露于毒物环境后,生精小管直径减小,同时伴有精子质量下降[34-35],本研究结果显示铝暴露小鼠生精小管面积及直径均减小,同样伴有精子质量下降。因此,认为生精小管直径及面积的减小可能是精子发生缺陷的一个评价指标。
细胞焦亡是近年来发现并证实的一种新的程序性细胞死亡方式,其特征为依赖于炎性半胱天冬酶,主要是Caspase-1、Caspase-4、Caspase-5、Caspase-11,并伴有大量促炎症因子的释放。焦亡经典途径是炎症小体NLRP3激活Caspase-1,Caspase-1将GSDMD裂解形成N-GSDMD,还能将IL-1b、IL-18前体加工成成熟的IL-1b、IL-18,成熟的IL-1b、IL-18并通过N-GSDMD形成的孔释放出,导致细胞焦亡[36]。在非经典焦亡途径中,Caspase-4、Caspase-5、Caspase-11直接结合胞质脂多糖,靶向和激活GSDMD,切割GSDMD,并间接激活Caspase-1,引发细胞焦亡[37-38]。铝引发炎症反应,nod样受体pyrin结构域介导的炎症小体NLRP3被激活[39]。细胞膜膜孔存在及焦亡小体的形成是细胞焦亡的重要标志。有研究报道,铝可引起小鼠神经元细胞膜孔及焦亡小体的形成,同时引起小鼠大脑皮层Nlrp3、Caspase-1、IL-1b和Gsdmd等焦亡关键蛋白水平的升高,导致神经元细胞焦亡[40]。同样,本研究发现在铝暴露小鼠睾丸组织中焦亡关键基因Nlrp3、Caspase-1、IL-1b和Gsdmd的mRNA及蛋白表达均显著升高,推测铝可导致睾丸细胞焦亡,但睾丸细胞膜膜膜孔和焦亡小体是否形成需要进一步研究。有研究表明,暴露于有毒重金属或其他有毒环境,睾丸及间质细胞发生焦亡,睾丸组织DNA断裂及类固醇的生成降低,影响精子的发生[41-42]。因此,推测铝暴露可能诱发睾丸细胞焦亡,导致精子质量下降,其发生机制尚不清楚,这将是下一步研究的内容。
铝暴露促进小鼠睾丸细胞焦亡关键因子的表达,降低小鼠精子质量,推测铝暴露诱发的睾丸细胞焦亡是雄性生殖系统损伤的潜在机制。

