湟水河流域秋季大型底栖动物群落结构及关键影响因子识别
郝韵 尚光霞 丁森 李小璇 于明乔 徐丽 张远 高欣


摘要:开展湟水河干支流大型底栖动物调查研究,为湟水河水生态保护修复提供参考依据。于2020年9月对湟水河流域25个样点进行了样品采集和调查,了解湟水河全流域大型底栖动物群落结构并识别影响其空间分布的关键环境因子。共采集并鉴定出大型底栖动物109(属)种;依据大型底栖动物群落结构相似性,湟水河25个样点在空间上可以分为3组:第1组样点主要分布在中上游支流,该组指示物种为朝大蚊属1种(Antocha sp.);第2组样点分布比较广泛,中上游干、支流均有,该组的指示物种为四节蜉属1种(Baetis sp.);第3组样点主要分布在中下游干流,该组指示物种为瑞士水丝蚓(Limnodrilus helveticusi)。大型底栖动物的物种丰度、香农威纳指数、Margalef丰富度指数、四节蜉属1种和瑞士水丝蚓的相对丰度在上下游和干支流之间的空间差异性较大。冗余分析(RDA)结果表明栖息地质量、电导率、亚硝态氮、总磷、浊度和水深是影响湟水河大型底栖动物的关键环境因子。湟水河水生态保护应当更多地关注次生盐化和营养盐污染,加强治理上游过度放牧造成的水土流失和农业面源污染。
关键词:大型底栖动物;群落结构;空间分布;指示物种;环境因子;湟水河
中图分类号:Q179.4 文献标志码:A 文章编号:1674-3075(2023)02-0064-09
目前,我国已进入水资源、水生态、水环境“三水”统筹的流域协同治理阶段,了解河流水生生物群落结构以及识别影响其分布的关键环境因子对于制定科学的流域水生态保护修复策略至关重要。由于大型底栖动物在河流中分布广泛(顾晓英等,2010)、物种多样性高(Jowett, 2003)且研究方法完善(Archaimbault et al, 2009),已经成为河流生态学研究中关注度最高的生物类群之一(蔡永久等,2010)。此外,大型底栖群落结构指数也常用来指示由于闸坝阻隔(刘志刚,2012)、水污染(张宇航等,2018)、物理生境丧失(胡威等,2021)等对河流健康造成的影响。因此,对大型底栖动物进行监测已经成为河流水生态健康评价中不可缺少的项目。
湟水河是黄河第二大支流,位于青藏高原与黄土高原交界地带,干流地区是青海省国民经济发展的主导地区(张调风等,2014;李宁等,2017)。湟水河相关研究多集中于地表水水质的变化情况(曹海英,2017;吴君,2012),对于大型底栖动物群落结构的研究也仅限湟水河干流(李宁等,2017;其木乐等,2019),而对于物种多样性较高的支流研究较少。研究表明,受水利工程和河岸带退化影响,湟水河干流从源头到西宁段水土流失程度逐步递增(张调风等,2014),水体氮、磷等营养盐浓度增加,敏感水生生物多样性降低,河流水生态健康状态下降(其木乐等,2019)。相对于干流来说,可涉水溪流生境异质性高,人类活动干扰类型单一且强度较低,EPT类(E:Ephemeroptera,蜉蝣目;P:Plecoptera,襀翅目;T:Trichoptera,毛翅目)等敏感水生昆虫多样性更高,对于全面了解区域大型底栖动物群落结构,制定评价指标参照状态更有参考意义。本研究旨在通过开展湟水河干流和主要支流大型底栖动物调查研究,进一步了解湟水河全流域大型底栖动物群落结构并识别影响其空间分布的关键环境因子,为湟水河水生态保护修复提供参考依据。
1 研究区域与方法
1.1 研究区概况及样点布设
湟水河位于青藏高原和黄土高原的交界地带,是黄河上游最大的支流,也是黄河上游主要径流补给水系,对维持黄河水资源平衡和建立生态保护屏障起到了至关重要的作用(毛爱华等,2021)。湟水河发源于青藏高原的包呼图山,流经青海和甘肃两省,在甘肃省永靖县和青海省民和县之间注入黄河。湟水河全长374 km,流域总面积16 100 km2。湟水河流域海拔落差较大(1 650~4 395 m),造就了区域独特的水文地貌和生物组成特征。较高的海拔和独特的自然环境决定了其生态系统的过渡性和脆弱性。
本研究于2020年9月在湟水河布设了25个点位(干流8个,支流17个)开展水生态调查(图1)。
1.2 样品采集与处理
选定河流上下游、左右岸没有明显人类干扰的河段,在100 m范围内挑选底质类型、流速、水深不同组合的生境进行采集。定量样品采用索伯网(开口面积0.09 m2,网兜孔径500 μm),共采集3个平行样本。采集到的样品用500 μm的分样筛进行筛选、冲洗,现场挑拣出所有生物样本并保存于95%乙醇中。根据相关鉴定资料(周长发,2002;辽宁省环境监测实验中心,2014;Merritt et al, 2008)将大型底栖动物样本鉴定至最低分类单元。
为降低生物样本采集对水质指标测定的干扰,在生物采集点上游50 m采集3个平行水样。现场采用HORIBA D-75水质分析仪测定水温(WT,℃)、电导率(EC,μS/cm)、pH、溶解氧(DO,mg/L)、盐度(SAL)和总溶解固体(TDS,mg/L);浊度(TUR,NTU)采用HACH 2100Q浊度仪进行测定;流速(Velocity,m/s)采用浮标法测定;可涉水河流的水深(Depth,cm)用皮尺测量,不可涉水河流水深用测深仪测量;河流底质测定参考Barbour等(1996)的方法(沙淤泥sand<2 mm、砾石pebble 2~42 mm、鹅卵石cobble 64~256 mm、大石boulder >256 mm)。物理生境质量评分(Habitat)选取底质、栖境复杂性、速度-深度结合、堤岸稳定性、河道变化、河水水量状况、植被多样性、人类活动强度和土地利用类型等10个指标进行人工现场判读,得分越高表示样点生境质量越好(郑丙辉等,2007)。现场采集的水样冷藏保存并当天送至实验室,按照《水和废水监测分析方法》相关方法对化学需氧量(COD,mg/L)、总氮(TN,mg/L)、总磷(TP,mg/L)、挥发酚(VP,mg/L)、总碱度(TA,mg/L)、硝酸态氮(NO3--N,mg/L)、亚硝酸态氮(NO2--N,mg/L)、钠离子(Na+,mg/L)、钾离子(K+,mg/L)和氯离子(Cl-,mg/L)等指标进行测定。
1.3 数据处理及方法
采用Bray-Curtis相似性测度系数,利用大型底栖动物群落结构数据对25个样点进行聚类分析(Cluster Analysis,CA),同时利用非度量多维标度法(Non-matric Multidimentional Scaling,NMS)进行空间排序分析。根据聚类分组结果,使用指示种分析(Indicator Species Analysis),通过判定各物种的指示值(Indicator value, IV)计算各分组大型底栖动物指示物种(IV>40且P<0.001)(Gilliam & Saunders, 2003)。以上计算分析均使用PC-ORD 5软件进行。
香农威纳多样性指数(H')、Margalef丰富度指数(d)、Pielou均匀度指数(J)、优势度(Y)的计算公式如下所示,
H' [=-i=1SPilnPi] ①
[d=(S-1)/lnN] ②
[J=] H'/H'Max ③
[Y=niNfi] ④
式中:S为某个点位的物种数,Pi代表第i种个体数比例,N为样本总个体数,ni为采集样品中第i种个体数,fi为该种在采断面出现的频率(Leps & Smilauer, 2003)。以Y≥0.02作为优势种的确定标准(Pielou, 1966)。
使用SPSS 20.0进行单因素方差分析(one-way ANOVA),比较各聚类分组之间环境因子和群落指数的组间差异性。
对湟水河环境因子进行主成分分析(Principal Component Analysis,PCA),以揭示主要环境梯度。对大型底栖动物群落数据进行除趋势对应分析(Detrended Correspondence Analysis,DCA),计算最长梯度值并确定群落结构和环境因子之间关系的分析方法。若最长梯度值>4.0,选择CCA(Canonical correspondence analysis);若最长梯度值介于3.0和4.0,则RDA(Redundancy analysis)和CCA均适用;若最长梯度值<3.0,则使用RDA(Yu & Xian, 2009)。每个变量的重要性及显著性用 Monte-Carlo 筛选法测试(999次非限制性筛选循环,P≤0.05)。所有排序分析之前对生物数据和环境因子数据(除pH)进行lg(1+x)转换,分析计算均使用Canoco 4.5。
2 结果与分析
2.1 大型底栖动物群落结构
本次在湟水河流域共采集鉴定出大型底栖动物109(属)种,隶属于4门7纲14目41科。节肢动物门物种最多,包括2纲7目31科89(属)种,占81.7%;软体动物门2纲4目6科11种,占10.1%;环节动物门2纲2目3科8(属)种,占7.3%;线形动物门1纲1目1科1种,占0.1%。按照优势度数值(表1),优势物种依次为四节蜉属1种(Baetis sp.)、纹石蛾1种(Hydropsyche sp.)、瑞士水丝蚓(Limnodrilus helveticusi)、朝大蚊1种(Antocha sp.)、角逐蚋(Simulium aemulum)和白色环足摇蚊(Cricotopus albiforceps)。
2.2 大型底栖动物空间分布特征
25个样点依据大型底栖动物群落结构相似性被划分为3组(图2)。其中,第1组共8个样点,全部分布在中上游支流,指示物种为朝大蚊(IV=90,P<0.05);第2组共13个样点,广泛分布在中上游的干、支流,指示物种为四节蜉属1种(IV=69,P<0.05);第3组共4个样点,主要分布在干流中下游区域,指示物种为瑞士水丝蚓(IV=93,P<0.05)。结合聚类分析结果,对NMS排序分析进行样点空间分组(图3),结果表明各组样点集中,3组样点之间无重叠 。
2.3 湟水河流域环境要素异质性
对各环境因子进行PCA分析,前2个轴的特征值分别为0.5795和0.1268,各环境因子在前4个轴上的负载值见表2。第1和第2主成分分别解释了总环境累积变量变异的58.0%和70.6%,前4个主成分共解释了总变异的87.6%。根据PCA结合聚类分析结果可知(图4),第1组样点基本分布于第1和第4象限,主要环境特征为较高的栖息地评分和卵石型底质类型;由于第2组样点主要分布在中上游干支流,空间上分布较广泛,该组样点的环境特征主要为较高的离子浓度和碱度;而第3组样点则主要以TN、NO3--N和NO2--N污染物为特征,底质类型则主要以泥沙为主。
对各个环境因子进行组间差异性比较,结果显示共有7个环境因子组间差异显著,主要为离子和营养盐浓度(EC、TDS、TUR、Na+、Cl-、NO2--N),且均是中下游显著高于上游点位,而栖息地评分则相反,上游点位状况要显著好于中下游点位(表3)。
2.4 湟水河大型底栖动物群落多样性
对湟水河流域大型底栖动物物种丰富度、多样性指数和优势物种在各聚类分组之间进行比较,见表4。结果显示S、H'、d和四节蜉属1种比例在中上游支流和部分干流河段要显著高于下游干流河段。表明随着从源头过渡到干流下游,大型底栖动物群落多样性和附石性水生昆虫比例逐渐降低,而以水丝蚓为代表物种的耐污类群比例则显著增加。
2.5 影响底栖动物空间分布的关键环境因子
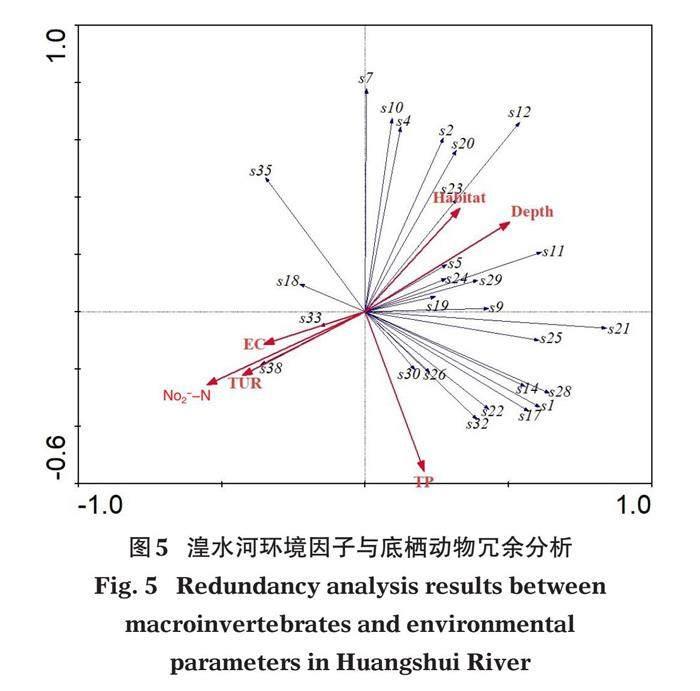
大型底栖动物群落数据DCA分析结果显示第一轴梯度长为2.079,因此选择线性模型RDA识别影响物种分布的关键环境因子。以P<0.05为标准进行Monte-Carlo筛选后,共有8个环境因子解释了主要的物种的变化(表5)。保留在轴1和轴2投影值较高的物种,并根据重要性的递减顺序,保留EC、Habitat、NO2--N、Depth、TUR和TP等作为显著影响湟水河流域大型底栖动物物种分布的关键环境因子。
大型底栖动物物种代码见表6,RDA分析如图5。结果表明,EC、NO2--N和TUR同轴1呈显著负相关,小云多足摇蚊(s33)和瑞士水丝蚓(s38)同EC、NO2--N和TUR呈正相关关系,表明随着水体中污染物浓度的增加,耐污类群逐渐成为优势类群,且群落向单一化发展。同物理生境质量评分(Habitat)相关性较高的主要是耐污值<7.0的中等敏感和极敏感的附石性水生昆虫(王备新和杨莲芳,2004;赵瑞等,2015),主要有蜉蝣目、襀翅目、毛翅目(s7、s10和s12)。水深和总磷主要影响了湟水河摇蚊幼虫的分布,随着水深的增加和总磷浓度的升高,摇蚊幼虫(s22、s32)逐渐成为群落中的优势物种(图5)。
3 讨论
3.1 物种分布特征
湟水河流域大型底栖动物主要以水生昆虫为主,物种相对丰度在85%以上(89.5%),这与孙瑜旸等(2018)(93.4%)、李宁等(2017)(92.1%)、其木乐等(2020)(86.0%)的调查结果较为类似,但是本次总物种数(109<属>种)要远多于以往在湟水河的研究结果,主要原因是本次调查范围不仅包括湟水河干流,而且64%的点位均位于湟水河支流,目的就是全面了解研究湟水河流域大型底栖动物群落空间分布特征。由于上游可涉水溪流受人类干扰相对单一且强度较低,流速、底质、河岸带植被覆盖度等生境异质性要高于中下游河流(孙瑜旸等,2018;其木乐等,2020),这不仅使上游大型底栖动物的多样性较中、下游更为丰富,还为更多敏感型水生昆虫提供了适宜的栖息场所(Sharma et al, 2005; Gao et al, 2014),主要表现为上游优势种为纹石蛾(s7),而下游的优势种为耐污物种瑞士水丝蚓(s38)。
3.1 影响湟水河底栖动物分布的关键环境因子
本研究所筛选出来的环境因子与以往研究结果较为一致,均是影响河流大型底栖动物物种分布的关键环境因子(Nathalie & Antoine, 1995; Reece & Richardson, 2000; Miserendino, 2001; Govenor et al, 2019)。物理生境质量是显著影响大型底栖动物物种分布的关键环境要素(Barnes et al, 2013; 阴琨等,2015),体现了人类对环境的干扰强度。生境质量能够反映生活在其中的大型底栖动物的变化情况。在湟水河流域也有所体现:92.1%的底栖动物都与生境质量呈显著正相关。近些年随着经济社会高速发展,湟水河流域城镇化速度有所提高,人口增加,导致大量生活污水、工业废水等排入河流。这一过程使进入河流的有机物质增多,进而电导率和氮、磷等营养盐浓度升高。水体中适量的氮、磷盐能够在一定程度上促进着生藻类等初级生产者的生长,为大型底栖动物提供了充足的食物来源,进而提高其密度和生物量(吴东浩等,2010;刘祥等,2016);但当浓度过高时,大型底栖动物的生长繁殖就会受到限制(Linda et al, 1997; Gao et al, 2005)。本文中NO2--N和TP显著影响了大型底栖动物的分布,除小云多足摇蚊(s33)和瑞士水丝蚓(s38)一些耐污种同NO2--N呈正相关之外,绝大多数物种都呈负相关关系;同TP相关性较高的也基本都是耐污的摇蚊幼虫(如s19、s32和s33),以上也证明了高浓度氮、磷盐对敏感物种(如:s1、s2、s5和s9等)有一定的限制作用,会导致耐污类群如水丝蚓(s37、s38)成为优势类群(沈宏等,2016)。此外,由于湟水河流域降雨量时空分布不均匀和农业耕种等人类活动,导致湟水河流域水土流失严重,面积占整个流域的47.3%(马琛林,2014)。大量泥沙进入河流,使水体中的颗粒物增多,水体浊度升高。一方面,颗粒物会对用鳃呼吸的敏感水生昆虫如四节蜉(s1)、花翅蜉(s2)、锯形蜉(s4)和倍叉[补] (s5)等造成物理性损伤,从而影响生物多样性(Thorpe & Lloyd, 1999; Lawler et al, 2006; 谭颖等,2021);另一方面,浊度升高会影响河流内一些植物的光合作用,使大型底栖动物的食物数量减少。电导率等表征河流次生盐化的指标也会影响湟水河中大型底栖动物。研究表明,当河流中盐离子浓度过高时,不仅会使底栖动物的群落结构产生变化,这些变化主要包括底栖动物分类单元数的减少、生物密度的降低等,还会对一些非耐盐物种如蜉蝣目、[补] 翅目、毛翅目和软体动物产生胁迫而造成物种多样性降低。底栖动物群落结构发生变化的实质是敏感种受到影响逐渐消失,被耐受种取代,而当盐离子浓度高过一定值后,耐受种也会消失。此外对高盐环境敏感的物种会通过增加漂移行为来进行躲避,一些底栖动物的生殖模式也会改变(Miserendino, 2001; 丁森等,2016)。由于河流自然岸线被放牧和农业耕种等侵占,导致河岸植被退化侵蚀强度增加。过量的泥沙在雨季随地表径流汇入河流,造成水体中的颗粒物增多,这会给用鳃呼吸的敏感水生昆虫造成物理性损伤,从而影响底栖动物物种多样性(Thorpe & Lloyd, 1999; Lawler et al, 2006; 谭颖等,2021)。因此,为保护恢复湟水河水生态质量,应重点关注流域氮、磷等营养盐污染、次生盐化和水土流失问题。
4 结论
(1)本次在湟水河共采集并鉴定出大型底栖动物109(属)种,水生昆虫为优势类群。湟水河大型底栖动物群落结构呈现明显的干支流和上下游差别,表现在上游支流主要以附石性水生昆虫为主,且物种多样性要显著高于中下游河流;随着生境和水质的退化,中下游样点优势物种过渡为中等敏感种和耐污种。
(2)影响湟水河大型底栖动物物种空间分布的关键环境因子为表征河流盐化特征的电导率和营养盐为主的亚硝态氮和总磷;随着河流物理生境质量的退化,物种由以EPT附石性水生昆虫为代表的敏感类群转变为以双翅目摇蚊幼虫和寡毛类水丝蚓为代表物种的耐污类群。
(3)影响湟水河大型底栖动物的关键环境因子主要是河流盐化和营养盐的升高,水生态保护修复应该主要加强治理上游过渡放牧造成的水土流失和农业面源污染。
参考文献
蔡永久,龚志军,秦伯强,2010. 太湖大型底栖动物群落结构及多样性[J].生物多样性,18(1):50-59.
曹海英,2017.湟水河湟源至西宁段水质评价与预测[J].环境研究与监测,30(3):60-63.
丁森,赵茜,张远,2016. 溪流生态系统次生盐化的生态学研究进展[J].环境科学研究,29(6):837-844.
胡威,王丽,莫康乐,等,2021.扬州市河网大型底栖动物群落结构及其生境特征研究[J].环境科学学报,41(4):1440-1448.
李宁,陈阿兰,杨春江,等,2017.城镇化对湟水河上游水质和底栖动物群落结构的影响[J].生态学报,37(10):3570-3576.
辽宁省环境监测实验中心,2014.辽河流域底栖动物监测图鉴[M].北京:中国环境出版社.
刘志刚,2012.橡胶坝对河流水质及大型底栖动物的影响[D].唐山:河北联合大学.
刘祥,陈凯,陈求稳,等,2016.淮河流域典型河流夏秋季底栖动物群落特征及其与环境因子的关系[J].环境科学学报,36(6):1928-1938.
马琛林,2014. 湟水河流域水土流失现状及思考[J].内蒙古林业调查设计,37(4):105-106.
毛爱华,毛红霞,李璇,等,2021.甘南黄河上游水源涵养区建设研究[J].资源节约与环保,(6):37-40.
其木乐,李宁,孙瑜旸,等,2019.青海湟水河上游大型底栖动物群落结构分析[J].青海大学学报,37(1):1-8.
其木乐,李宁,白露超,等,2020.湟水河上游底栖动物群落结构及其与环境因子间的关系[J].南京农业大学学报,43(1):72-79.
沈宏,石彭灵,吴耀,等,2016.梁塘河大型底栖动物群落及其水质生物学评价[J].水生生物学报,40(1):203-210.
孙瑜旸,李宁,陈阿兰,等,2018.湟水河上游大型底栖动物群落结构及水质生物评价[J].青海大学学报,36(2): 65-71.
谭颖,郑训皓,陈慈,等,2021.流溪河大型底栖动物群落的时空分布及其影响因子[J].生态学报,41(2):747-760.
王备新,杨莲芳,2004.我国东部底栖无脊椎动物主要分类单元耐污值[J].生态学报,24(12):2768-2775.
吴东浩,于海燕,吴海燕,等,2010.基于大型底栖无脊椎动物确定河流营养盐浓度阈值——以西苕溪上游流域为例[J].应用生态学报,21(2):483-488.
吴君,卢素锦,王淑玉,等,2012.湟水河西宁段水污染调查[J].环境与健康杂志, 29(12):1115-1116.
阴琨,赵然,李中宇,等,2015.松花江流域水生态环境中生物与生境和化学要素间的关联性研究[J].中国环境监测,31(1):17-23.
张调风,朱西德,王永剑,等,2014.气候变化和人类活动对湟水河流域径流量影响的定量评估[J].资源科学,36(11):2256-2262.
张宇航,张敏,张海萍,等,2018.北京河流大型底栖动物空间格局及其环境响应研究[J].生态毒理学报,13(4):101-110.
赵瑞, 高欣, 丁森,等,2015.辽河流域大型底栖动物耐污值[J].生态学报,35(14):4797-4809.
郑丙辉,张远,李英博,2007.辽河流域河流栖息地评价指标与评价方法研究[J].环境科学学报,(6):928-936.
周长发,2002. 中国大陆蜉蝣目分类研究[D]. 天津:南开大学.
Archaimbault V, Usseglio P P,Garric J, et al, 2009. Assessing pollution of toxic sediment in streams using bio-ecological traits of benthic macroinvertebrates[J]. Freshwater Biology,55(7):1430-1446.
Barbour M T, Gerritsen J, Griffith G E, et al, 1996. A framework for biological criteria for Florida streams using benthic macroinvertebrates[J]. Journal of the North American Benthological Society,15(2):185-211.
Barnes, Jacqueline B,Vayghan,et al, 2013. Reappraising the effects of habitat structure on river macroinvertebrates[J]. Freshwater Biology,58(10),2154-2167.
Gao Q F, Cheung K L, Cheung S G, et al, 2005.Effects of nutrient enrichment derived from fish farming activities on macroinvertebrate assemblages in a subtropical region of Hong Kong[J]. Marine Pollution Bulletin,51(8/12):994-1002.
Gao X, Niu C J, Chen Y S, et al, 2014.Spatial heterogeneity of stream environmental conditions and macroinvertebrates community in an agriculture dominated watershed and management implications for a large river (the Liao River,China) basin[J]. Environmental Monitoring and Assessment,186:2375-2391.
Gilliam F S, Saunders N E, 2003. Making more sense of the order: a review of canoco for Windows 4.5, PC-ORD version 4 and SYNTAX 2000[J].Journal of Vegetation Science,14(2):297-304.
Govenor H, Krometis L A H, Willis L, et al, 2019. Macroinvertebrate sensitivity thresholds for sediment in Virginia streams[J]. Integrated Environmental Assessment and Management,15(1):77-92.
Jowett I G, 2003. Hydraulic constraints on habitat suitability for benthic invertebrates in gravel-bed rivers[J]. River Research and Applications, 19(5/6),495–507.
Lawler D M, Petts G E, Foster I D L, et al, 2006. Turbidity dynamics during spring storm events in an urban headwater river system: the Upper Tame, West Midlands,UK[J]. Science of the Total Environment,360:109 -126.
Leps J, Smilauer P, 2003. Multivariate analysis of ecological data using CANOCO[M]. 2nd ed. Cambridge: Cambridge University Press.
Linda D, Peterson B J, Golden H, et al, 1997. Effects of fish density and river fertilization on algal standing stocks, invertebrate communities, and fish production in an Arctic river[J]. Canadian Journal of Fisheries and Aquatic Sciences,54(2):269-283.
Merritt R W, Cummins K W, Berg M B, 2008. An introduction to the aquatic insects of north America[M]. 4th ed. Dubuque: Kendall/ Hunt Publishing Company Press.
Miserendino M L, 2001. Macroinvertebrate assemblages in Andean Patagonian rivers and streams: Environmental relationships[J]. Hydrobiologia,444:147-158.
Nathalie B, Antoine M, 1995. Relationships between size structure of invertebrate assemblages and trophy and substrate composition in streams[J]. Journal of the North American Benthological Society,14(3):393-403.
Pielou E C, 1966. The measurement of diversity in different types of biological collections[J]. Journal of Theoretical Biology,13(1):131-144.
Reece P F,Richardson J S, 2000. Benthic macroinvertebrate assemblages of coastal and continental streams and large rivers of southwestern British Columbia, Canada[J]. Hydrobiologia,439(1/3):77-89.
Sharma C M, Sharma S,Borgstorm R, et al, 2005. Impacts of a small dam on macroinvertebrates: A case study in the Tinau River, Nepal[J]. Aquatic Ecosystem Health & Management,8(3):267-275.
Thorpe T, Lloyd B, 1999. The macroinvertebrate fauna of St. Lucia elucidated by canonical correspondence analysis[J]. Hydrobiologia, 400:195-203.
Yu H C, Xian W W, 2009. The environment effect on fish assemblage structure in water adjacent to the Changjiang(Yangtze) River estuary(1998-2000)[J]. Chinese Journal of Oceanology and Limnology,27:443-456.
(责任编辑 郑金秀)
Autumn Macroinvertebrate Community Structure and Identification of Key
Environmental Factors in the Huangshui River Basin
HAO Yun1,2, SHANG Guang‐xia2, DING Sen2, LI Xiao‐xuan2, YU Ming‐qiao2,3,
XU Li2, ZHANG Yuan2, GAO Xin2
(1. College of Environment, Liaoning University, Shenyang 110000, P.R. China;
2. Chinese Research Academy of Environmental Sciences, Beijing 100012, P.R. China;
3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, P.R. China)
Abstract: In this study, we characterized the autumn macroinvertebrate community structure in the Huangshui River basin and identified the key environmental factors affecting the spatial distribution, aiming to provide a reference for restoring the aquatic ecology of Huangshui River. Macroinvertebrate and aquatic environmental parameters were measured at 25 sampling sites (8 mainstream sites and 17 tributary sites) in the Huangshui River basin in September 2020. A total of 109 macroinvertebrate species (genus) were identified, including 4 phyla, 7 classes, 14 orders and 41 families, with absolute dominance of Arthropoda taxa (81.7%). The 25 sampling sites were divided into three groups according to similarity of macroinvertebrate community structure, based on Bray-Curtis distance. Group 1 included 8 sites distributed primarily in the upper and middle tributaries, with the indicator species Antocha sp.; Group 2 included 13 sites that were widely distributed in the upper and middle mainstream and tributaries, with the indicator species Baetis sp.; Group 3, with 4 sites primarily distributed in the middle and lower mainstream, with the indicator species Limnodrilus helveticusi. Species richness, Shannon-Weiner and Margalef indices, and the relative abundance of Baetis sp. and Limnodrilus helveticusi were very different between the upper and lower reaches and between the mainstream and tributaries. Redundancy analysis (RDA) shows that habitat, conductivity (TDS), nitrite (NO2-), total phosphorous (TP), turbidity and water depth were the key environmental factors affecting macroinvertebrates in the Huangshui River basin. Restoring aquatic ecology in the Huangshui River basin will require improved prevention and control of secondary salinization and nutrient pollution and strengthening soil and water conservation, based on a strategy of water quality protection and ecological restoration.
Key words:macroinvertebrate; community structure; spatial distribution; indicator species; environmental factors; Huangshui River

