青海湖入湖河流大型底栖动物时空分布及渔产潜力估算
谢廷锋 和雅静 赵永晶 徐东坡 俞录贤 王洪铸 崔永德

摘要:探究青海湖及其入湖河流底栖动物的群落结构与时空分布,根据底栖动物现存量估算渔产潜力,可为青海湖裸鲤(Gymnocypris przewalskii)的增殖放流和种群持续恢复提供科学依据。以青海湖5条主要入湖河流(黑马河、布哈河、泉吉河、沙柳河、哈尔盖河)为研究对象,于2019年在青海湖裸鲤洄游前期、中期和后期对18个断面进行采样调查。结果表明,调查共记录底栖动物101种(属),隶属于5门7纲9目44科。空间分布上,黑马河种类最多,有56种(属),哈尔盖河最少仅27种(属),且EPT(蜉蝣目、襀翅目和毛翅目)自上游至下游呈减少趋势;密度和生物量均以泉吉河最高(544 个/m2,4.77 g/m2),生物多样性各指数以黑马河最高。时间尺度上,青海湖裸鲤洄游前期、中期和后期,大型底栖动物种类数无明显变化,但密度和生物量均呈增加趋势,生物多样性各指数呈降低趋势。影响大型底栖动物密度和生物量分布的主要因素为底质类型、海拔高度、水温、浊度和电导率(P?0.05)。基于大型底栖动物估算的渔产潜力以布哈河最高(285 129 kg),其次是泉吉河(20 694 kg)和沙柳河(18 857 kg),与青海湖裸鲤密度及产卵场空间分布较为一致,这与亲鱼洄游产卵需要大量的食物来源有很大关系。
关键词:底栖动物;时空分布;渔产潜力;青海湖裸鲤
中图分类号:Q178 文献标志码:A 文章编号:1674-3075(2023)03-0070-09
青海湖流域位于青藏高原东部,是我国生态环境地位极其重要但同时又很脆弱的区域。由于自然环境条件变化和人为活动的综合影响,流域内生态环境不断恶化,主要表现为青海湖水质恶化、水土流失严重、珍稀野生动物濒临灭绝和渔业资源濒临枯竭(冯宗炜和冯兆忠,2004)。长期过度捕捞导致鱼类资源量锐减、鱼体变小、鱼类洄游通道受阻、天然产卵场丧失、资源再生能力下降(史建全等,2000;2004)。
青海湖裸鲤(Gymnocypris przewalskii)是青海湖流域特有鱼类,占渔获物总量的95%以上(陈民琦等,1990);其在咸水和淡水中均能生长,但生长缓慢,个体重达到500 g以上需要10年(中国科学院西北高原生物研究所,1989)。青海湖裸鲤具有明显的生殖洄游特性,入湖河流是亲鱼洄游产卵的重要通道和场所,每年4-7月溯河产卵,产卵场主要在黑马河、布哈河、泉吉河、沙柳河和哈尔盖河等入湖淡水河流,通常在砾石河滩处产卵,但繁殖力低(张信等,2005)。不同时期的裸鲤食性不同,幼鱼阶段对饵料有较为明显的选择性,成体阶段几乎摄食水中所有生物性食物(青海省生物研究所,1975)。蒋小明(2012)认为大型底栖动物在食物网中具有承上启下的作用,并成为许多鱼类的优质天然饵料;汪洋(2019)研究发现,摇蚊幼虫辅助饲喂明显提高青海湖裸鲤仔稚鱼增重率。
有关青海湖入湖河流大型底栖动物分布格局及时空动态的研究不多(孟星亮等,2014),渔产潜力也仅限于青海湖湖区(杨洪志和王基琳,1997;姚维志等,2011);而入湖河流作为青海湖裸鲤重要的产卵场亟需关注。国内关于渔产潜力估算的研究多针对湖泊(闫云君,1998),河流渔产潜力的研究相对较少。本文以青海湖5条入湖河流为研究对象,描述了大型底栖动物群落结构的时间动态与空间变化特征,计算大型底栖动物的现存量,并根据经验模型,估算入湖河流大型底栖动物的渔产潜力,以期为青海湖裸鲤的人工放流和种群资源恢复以及流域内生物多样性保护与生态治理提供技术支撑和科学依据。
1 材料与方法
1.1 区域概况
青海湖流域西北部面积辽阔,河网较为密集,较大的河流多分布于此;流域东南部陆地较为狭窄,河流短小,多为时令河,水量贫乏。湖周直接入湖且流域面积大于5 km2的河流有48条,本研究选取其中较大的5条河流,即黑马河、布哈河、泉吉河、沙柳河和哈尔盖河,这5条河流水量占据青海湖入湖总流量的80%(Li et al, 2007)。黑马河全长20 km,河道平均比降5.3%;布哈河全长286 km,河道落差1 318 m,河床多为砂卵石组成;泉吉河全长65 km,河道落差1 113 m,平均比降1.7%,上中游河道顺直,中游河床由砂卵石组成,下游流经广阔的湖滨滩地;沙柳河全长106 km,河道落差1 505 m,中上游河床主要由大卵石组成,下游河道比较平缓。5条河流汛期(6-9月)主要依靠降水补给(李岳坦等,2010;时盛博等,2017)。
1.2 采样断面设置
本研究分别于2019年在5条入湖河流的上游、中游及下游共设置18个采样断面,进行大型底栖动物调查(图1)。 调查时段分别为青海湖裸鲤洄游前期(5月)、洄游中期(7月)和洄游后期(8月)。
1.3 样品采集与处理
在每个采样断面100 m 范围内,用筛网孔径 420 μm、网口宽度 30 cm 的D型抄网采集大型底栖动物。定量样品在不同生境中采集,总样方面积为0.9 m2,定性样品通过D型抄网和手捡方式获得。采集到的底栖动物带回室内进行人工挑拣,分拣出的底栖动物标本放入样品瓶中,并加入75%的酒精固定保存。样品带回实验室后,参考相关文献资料(刘月英等,1979;Morse et al, 1994;王洪铸,2002;唐红渠,2006;崔永德,2008;何雪宝,2011;周长发等,2015),在体视镜和显微镜下进行种类鉴定、准确计数后,先用吸水纸吸干样品表面的液体,再用精度为万分之一的电子天平称重(软体动物为带壳湿重)。
1.4 环境因子测定
使用手持GPS测定海拔高度(Altitude);通过哈希HQ40D便携式多参数分析仪对电导率(Cond)、溶解氧(DO)、水温(WT)、pH等水体理化指标进行现场测定;浊度(Tur)使用哈希2100Q便携式浊度仪现场测定;水深(WD)用测深尺现场涉水测量。在采样点的表、底层取水样混合,带回实验室分析,化学需氧量(COD)、总氮(TN)、总磷(TP)、氨氮(NH4-N)、硝酸氮(NO3-N)、亚硝酸氮(NO2-N)等营养盐,根据《水和废水监测分析方法》测定(国家环保局,1989)。底质类型划分依据Barbour等(1999)的标准。
1.5 数据分析
采用多元统计软件PRIMER 6.1计算青海湖流域5条入湖河流大型底栖动物的Margalef丰富度指数(d)、Shannon-Wiener 多样性指数(H')、Pielou均匀度指数(J)、Simpson多样性指数(D)和优势度指数(Y),计算公式(Shannon & Weaver, 1949; Pielou, 1966; Margalef, 1968)如下:
式中:S 为样品物种总数,N 为总个体数,Pi为第 i 种的个体数与总个体数的比值,fi为第i 种在各点位的出现频率,Y≥0.02 的种类确定为优势种。
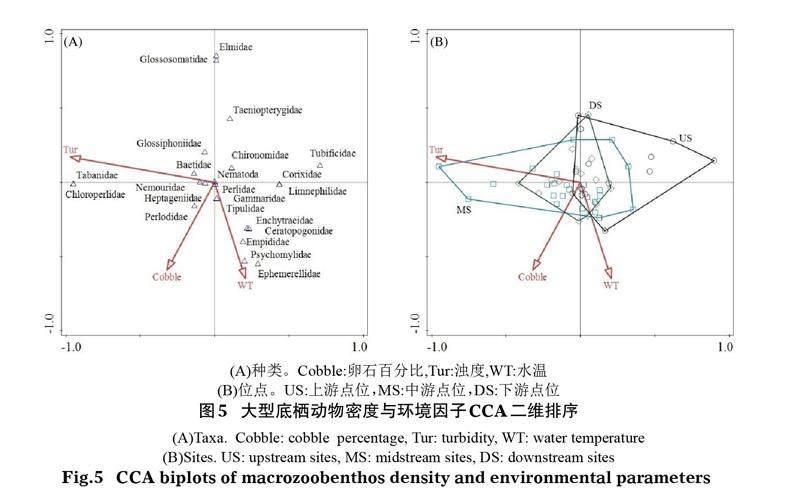
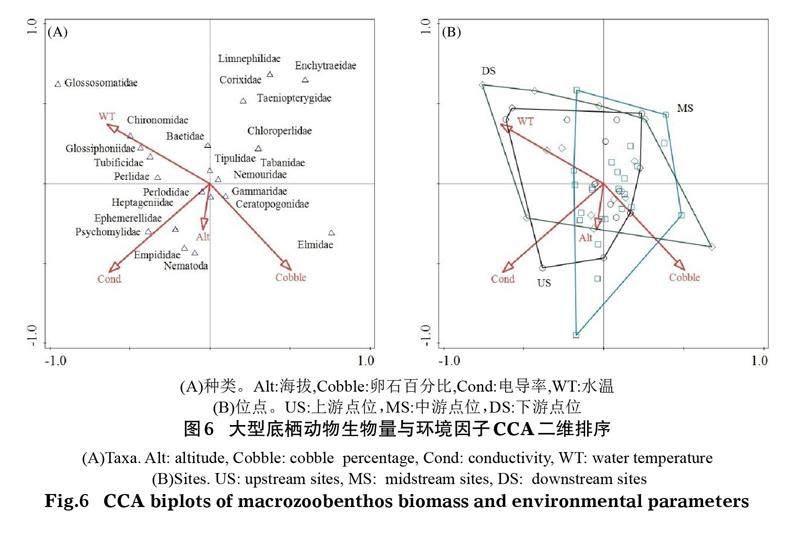
为探讨底栖动物群落结构与环境因子之间的关系,采用Canoco 5.1对数据进行约束性排序。分析前对环境参数和底栖动物密度、生物量数据进行lg(x+1)转化,以使数据呈正态分布,基于蒙特卡罗检验(Monte Carlo permutation test),通过前选法(Forward selection)排除贡献小的因子。采用典范相关分析(Canonical Correspondence Analysis, CCA)探究底栖动物群落结构与筛选出来的环境因子之间的关系。
1.6 渔产潜力估算
渔产潜力(F)由动物可利用的资源量(R),即其生产量(P,一般以年计)与其现存量(B)的差额,乘以其对鱼的转化效率(C,饵料系数之倒数)得到(阎云君等,2005)。基于以上算法的经验公式(王洪铸等,2005)如下:
Ftotal = FO+FG+FI = 0.7BO+0.4BG+0.4BI ⑥
式中:Ftotal 为总渔产潜力,FO、FG、FI分别为寡毛类、钩虾、水生昆虫的渔产潜力,BO、BG、BI分别为寡毛类、钩虾、水生昆虫的现存量。钩虾的换算系数参考水生昆虫。
根据《中国河湖大典》中提供的河长及河宽(不同河段均值)数据,计算出5条河流的面积,结合本次调查得到的平均生物量,计算各类群的现存量。调查已知渔获物中青海湖裸鲤平均体重为177.7 g/尾,计算底栖动物对各河流洄游亲鱼的载鱼量时,以此为参照。
2 结果
2.1 群落组成的时空分布
本次调查共采集到大型底栖动物101种(属),隶属于5门7纲9目44科。其中,寡毛类6科12种(属),占总数的11.9%;水生昆虫26科86种属,占总数的85.1%;软体动物、线虫和涡虫各有1种,共占总数的3%。空间分布上,黑马河大型底栖动物种类数最高,有56种(属),泉吉河次之,有49种(属),哈尔盖河最低,为27种(属)(图2);自上游到下游,EPT分类单元(蜉蝣目、襀翅目和毛翅目)减少,钩虾出现频率增加。时间动态上,从青海湖裸鲤洄游前期至后期,大型底栖动物种类数呈现递减的趋势。前期最高为101种(属),水生昆虫为86种属,占83%;中期为59种(属),水生昆虫47种(属),占79%;后期最低,为54种(属),水生昆虫44种(属),占81%。
2.2 密度和生物量
从底栖动物总密度的时空分布来看(图3-a),在青海湖裸鲤洄游后期最高,各样点平均密度为362 个/m2,中期次之,为253 个/m2,前期最低,平均密度只有149 个/m2。除哈尔盖河以外,其他河流的总密度变化趋势相一致,从前期至后期逐渐上升。从空间上看,泉吉河大型底栖动物全年各时期总密度均最高,平均密度达544 个/m2,布哈河和沙流河次之,哈尔盖河最低,平均密度为85 个/m2。
从底栖动物总生物量的时空分布来看(图3-b),裸鲤洄游后期最高,平均生物量为3.82 g/m2,中期最低,仅0.96 g/m2。各条河流平均生物量在3个时期无明显变化规律。空间分布上,泉吉河全年总生物量最高,为4.77 g/m2,布哈河与沙柳河次之,哈尔盖河最低,仅0.31 g/m2。
2.3 优势种及多样性时空变化
以优势度Y≥0.02为标准,青海湖裸鲤洄游前期、中期和后期的优势种分别为5种、4种和3种(表1)。其中,寡毛纲和软甲纲各1种(哑口仙女虫和钩虾属),其余4种均为昆虫纲。钩虾属、四节蜉属是不同时期的共同优势种,也是5条河流的广布种。
整体上看,Shannon-Wiener 多样性指数(图4-a)、Pielou均匀度指数(图4-c)和Simpson多样性指数(图4-d)在每条河流呈现出较为一致的时间变化趋势,而Margalef丰富度指数(图4-b)在3个时期无明显变化。除哈尔盖河外,其他河流的生物多样性几乎都呈现从洄游前期、中期到后期逐渐降低的趋势,哈尔盖河的生物多样性指数变化趋势相反。
2.4 底栖动物与环境因子的相关性
青海湖入湖河流各采样断面的环境特征差异较大。5条河流上游断面的底质中含有较多石块和卵石,生境异质性高,受干扰程度小;中下游底质类型逐渐过渡为以砾石和细沙为主,且下游河口段河岸带固化严重(表2)。上游断面水体溶氧(DO)总体高于河口段,而电导率(Cond)明显低于下游断面。但总氮(TN)、总磷(TP)、氨氮(NH4-N)含量并无明显差异(表3)。
典型对应分析的前选法和蒙特卡罗转置法分析表明,影响青海湖入湖河流大型底栖动物密度的关键环境因子有水温(WT)、卵石百分比(Cobble)和浊度(Tur)(P<0.05),第一轴和第二轴的特征值分别为0.192和0.166。从CCA二维排序图5可以看出,水温和卵石百分比主要贡献于第二轴,浊度主要贡献于第一轴,其中水温和卵石百分比与第二轴呈负相关关系,浊度与第一轴呈负相关关系。分析环境因子对大型底栖动物空间分布的影响,中游和下游底栖动物密度的空间分布与浊度密切相关,底栖动物种类主要包括舌蛭科(Glossiphoniidae)、虻科(Tabanidae)、绿襀科(Chloroperlidae)和颤蚓科(Tubificidae);上游断面则与卵石百分比和水温关系更密切,底栖动物种类主要包括小蜉科(Ephemerellidae)、舞虻科(Empididae)、管石蛾科(Psychomylidae)、舌石蛾科(Glossosomatidae)和溪泥甲科(Elmidae)。
相同方法分析还表明,影响青海湖入湖河流大型底栖动物生物量的关键环境因子有电导率(Cond)、海拔(Alt)、水温(WT)和卵石百分比(Cobble)(P<0.05)(图6)。第一轴和第二轴的特征值分别为0.401和0.324。从CCA二维排序图可以看出,卵石百分比、水温和海拔主要贡献于第二轴,电导率主要贡献于第一轴;其中卵石百分比和海拔与第二轴呈负相关关系,水温与第二轴呈正相关关系,电导率与第一轴呈正相关关系。从环境因子对大型底栖动物空间分布的影响看,上游大型底栖动物生物量的空间分布与水温和卵石百分比密切相关,底栖动物种类主要包括四节蜉科(Baetidae)、舌石蛾科和摇蚊科(Chironomidae);中游底栖动物生物量的空间分布与海拔密切相关,底栖动物种类主要包括沼石蛾科(Limnephilidae)、划蝽科(Corixidae)和线蚓科(Enchytraeidae);下游大型底栖动物生物量的空间分布与电导率密切相关,底栖动物种类主要包括小蜉科(Ephemerellidae)、舞虻科(Empididae)和蠓科(Ceratopogonidae)。
2.5 大型底栖动物的渔产潜力
根据渔产潜力经验公式估算,黑马河、布哈河、泉吉河、沙柳河、哈尔盖河大型底栖动物的年均渔产潜力差别很大。以布哈河最高,其次是泉吉河和沙柳河(表4)。在这些河流中,钩虾对渔产潜力的贡献比均最高,5条主要河流的大型底栖动物载鱼量也差别很大。
3 讨论
3.1 高海拔河流大型底栖动物的分布特点
黑马河、布哈河、泉吉河、沙柳河和哈尔盖河地处青藏高原东北部,属典型的高原河流,具有海拔高、水温低、日照时间长、水热同期、降水量年内分布不均、河道落差大、微生境异质性高和有机碎屑降解慢等特点(吴瑞琛,1990;崔步礼等,2011)。高海拔造成的水温、光照、地形等差异会塑造多样化的大型底栖动物群落(Tomanova et al, 2007)。高海拔地区,河流水温低,有机质降解慢,大型底栖动物食物来源多为粗颗粒有机碎屑,因此冷水性且功能摄食类群为撕食者的种类占优势(王昱等,2021),如本研究中的优势种钩虾属;另外,海拔高、光照强、河水浊度低、着生藻生长较快,加之河道落差较大、水流较急,一些行攀援或粘附生活的刮食者也是大型底栖动物主要组成,如身体扁平的微动蜉属和粘附基质生活的直突摇蚊属。高原河流的海拔落差较大,水流对河床底质的冲刷、搬运作用强烈,且河床底质多为卵石和大石块,因而生境异质性较高,生物多样性也相对较高,底栖动物主要为节肢动物(简东等,2015),如雅鲁藏布江流域大型底栖动物的种类组成中水生昆虫占比超过74%(Xu et al,2018)。本研究中,蜉蝣目、襀翅目、毛翅目、鞘翅目和双翅目等水生昆虫种类数占比大于80%,这也与其他高海拔河流大型底栖动物的相关研究一致(Mishra et al, 2013;赵娜等,2020)。
3.2 河流底栖动物渔产潜力与渔业资源保护
近年来,青海湖裸鲤资源量锐减,2004年青海湖裸鲤被列入《中国物种红色名录》濒危物种名单。鱼卵和仔鱼是鱼类资源补充和可持续利用的基础(武云飞,1992)。黑马河、布哈河、泉吉河、沙柳河和哈尔盖河等入湖河流是亲鱼产卵的重要通道,调查发现这些河流各河段均有产卵场存在(付生云等,2019)。摄食是影响鱼类早期资源生长发育、存活与死亡的重要因素(刘熠,2020),本次鱼类调查统计得出泉吉河与沙柳河洄游亲鱼总量分别为176万尾和121万尾左右,大型底栖动物的渔产潜力估算值折合能供给亲鱼量分别为12万尾和11万尾,分别占洄游亲鱼总量的6.8%和9.1%,是亲鱼重要的能量补给站。本次调查虽然未估算黑马河、布哈河和哈尔盖河的洄游亲鱼量,但从湖区青海湖裸鲤密度空间分布得知,布哈河入湖河口区域的密度最高,产卵场也最多,因而本研究估算出大型底栖动物渔产潜力空间分布最大值出现在布哈河是较为合理的。
青海湖裸鲤人工增殖放流工作于2002年开始,截至2020年,其资源量增加了38倍,其中增殖放流贡献占比约为23%。要想实现渔业的可持续发展,除增殖放流外,还需要合理利用渔产潜力(洪荣华等,2005),保护主要入湖河流水域生态系统的生物多样性和生态完整性,可为青海湖裸鲤完成世代繁衍提供优渥的生态环境。
参考文献
陈民琦,林建国,应百才,1990. 青海湖封湖3年对裸鲤种群结构的影响初探[J]. 青海大学学报(自然科学版), (1):50-56.
崔步礼,李小雁,李岳坦,等,2011. 青海湖流域河川径流特征及其对降水的滞后效应[J]. 中国沙漠, 31(1):247-253.
崔奕波,2005. 长江流域湖泊的渔业资源与环境保护[M]. 北京:科学出版社:304-307.
崔永德, 2008. 云南湖泊寡毛类环节动物研究[D]. 北京:中国科学院研究生院.
冯宗炜,冯兆忠,2004. 青海湖流域主要生态环境问题及防治对策[J]. 生态环境学报, 13(4):467-469.
付生云,周卫国,张涛,等,2019. 青海湖裸鲤洄游排卵、受精高峰期的繁殖特征[J]. 畜牧兽医科技信息, (11):35-36.
国家环保局,1989. 水和废水监测分析方法[M]. 3版. 北京:中国环境科学出版社.
何雪宝, 2011. 西藏和四条大型河流水栖寡毛类区系研究[D]. 北京:中国科学院研究生院.
洪荣华,刘其根,陈来生,2005. 千岛湖的渔产潜力估算及可持续发展途径[J]. 水产科技情报, 32(4):175-177.
简东,黄道明,常秀岭,等,2015. 拉萨河中下游底栖动物群落结构特征分析[J]. 水生态学杂志, 36(1):40-46.
蒋小明,2012. 中西部河流大型无脊椎动物多样性格局及其环境评价[D]. 北京:中国科学院研究生院.
李岳坦,李小雁,崔步礼,等,2010. 青海湖流域50年来(1956-2007年)河川径流量变化趋势——以布哈河和沙柳河为例[J]. 湖泊科学, 22(5):757-766.
刘熠,2020. 长江下游刀鲚(Coilia nasus)仔稚鱼的时空分布及其食性差异研究[D]. 上海:上海海洋大学.
刘月英,张文珍,王跃先,等,1979. 中国经济动物志:淡水软体动物[M]. 北京:科学出版社.
孟星亮,何玉邦,宋卓彦,等,2014. 青海湖区大型底栖动物群落结构与空间分布格局[J]. 水生生物学报, 38(5):819-827.
青海省生物研究所,1975. 青海湖地区的鱼类区系和青海湖裸鲤的生物学[M]. 北京:科学出版社:37-45.
时盛博,戴虎德,李万志,等,2017. 青海省海北州水分资源变化[J]. 中国农学通报, 33(35):119-127.
史建全,祁洪芳,杨建新,2004. 青海湖自然概况及渔业资源现状[J]. 淡水渔业, 26(5):3-5.
史建全,祁洪芳,杨建新,等, 2000. 青海湖裸鲤资源评析[J]. 淡水渔业, 30(11):38-40.
唐红渠,2006. 中国摇蚊科幼虫生物系统学研究[D]. 天津:南开大学.
汪洋,2019. 青海湖裸鲤仔稚鱼工厂化培育中投喂摇蚊幼虫对生长的影响[J]. 科学养鱼, (3):71-72.
王洪铸,2002. 中国小蚓类研究——附中国南极长城站附近地区两新种 [M]. 北京:高等教育出版社.
王昱,左一锋,冯起,等,2021. 黑河中上游大型底栖动物栖息地适宜度评估[J]. 生态学杂志, 40(4):1116-1127.
吴瑞琛,1990. 西藏高原水文特性[J]. 水文, (2):53-56.
武云飞,1992. 青藏高原鱼类[M]. 成都:四川科学技术出版社.
闫云君,1998. 浅水湖泊大型底栖动物生态能量学及生产量的研究[D] . 武汉:中国科学院水生生物研究所.
杨洪志,王基琳,1997. 青海湖底栖生物及其生产力分析[J]. 青海科技, 4(3):36-39.
姚维志,史建全,祁洪芳,等,2011. 2006-2010年夏季青海湖浮游植物研究[J]. 淡水渔业, 41(3):22-28.
张信,熊飞,唐红玉,等,2005. 青海湖裸鲤繁殖生物学研究[J]. 渔业科学进展, 26(3):61-67.
赵娜,周罕觅,李志威,等,2020. 黄河源典型卵石河床底栖动物的小尺度分布[J]. 水生态学杂志, 41(1):22-29.
中国河湖大典编纂委员会,2014. 中国河湖大典:西北诸河卷[M]. 北京:中国水利水电出版社.
中国科学院西北高原生物研究所,1989. 青海经济动物志:鱼篇[M]. 西宁:青海人民出版社.
周长发,苏翠荣,归鸿,2015. 中国蜉蝣概述[M]. 北京:科学出版社.
Barbour M T, Gerritsen J, Snyder B D, et al, 1999. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish[M]. Second Edition, Washington, USEPA DC.
Li X Y, Xu H Y, Sun Y L, et al, 2007. Lake-Level Change and Water Balance Analysis at Lake Qinghai, West China during Recent Decades[J]. Water Resources Management, 21(9):1505-1516.
Margalef R, 1968. Perspective in Ecological Theory[M]. Chicago: University of Chicago Press.
Mishra A S, Nautiyal P, Semwal P, 2013. Distributional patterns of benthic macro-invertebrate fauna in the glacier fed rivers of Indian Himalaya[J]. Our Nature, 11(1):36-44.
Morse J C, Yang L, Tian L, 1994. Aquatic Insects of China Useful for Monitoring Water Quality[M]. Nanjing: Hohai University Press.
Pielou E C, 1966. The Measurement of Diversity in Different Types of Biological Collections[J]. Journal of Theoretical Biology, 13(1):131-144.
Shannon C E, Weaver W, 1949. Mathematical Theory of Communication[M]. Illinois:University of Illinois Press.
Tomanova S, Tedesco P A, Campero M, et al, 2007. Longitudinal and altitudinal changes of macroinvertebrate functional feeding groups in neotropical streams: a test of the Stream Continuum Concept[J]. Fundamental and Applied Limnology, 170:233-241.
Xu M Z, Zhao N, Zhou X D, et al, 2018. Macroinvertebrate Biodiversity Trends and Habitat Relationships within Headwater Rivers of the Qinghai-Tibet Plateau[J]. Water, 10(9):1214.
(责任编辑 万月华)
Tempora-spatial Distribution and Potential Fish Production Capacity
of Macrozoobenthos in the Main Inflow Rivers of Qinghai Lake
XIE Ting‐feng1,2, HE Ya‐jing2,3, ZHAO Yong‐jing2, XU Dong‐po4, YU Lu‐xian5,
WANG Hong‐zhu2, CUI Yong‐de2
(1. Tibet University, Lhasa 850000, P.R. China;
2. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology,
Chinese Academy of Sciences, Wuhan 430072, P.R. China;
3. University of Chinese Academy of Sciences, Beijing 100049, P.R. China;
4. Freshwater Fisheries Research Center of Chinese Academy of Fishery Sciences, Wuxi 214081, P.R. China;
5. Qinghai Key Laboratory of Qinghai-Lake Naked Carps Breeding and Conservation,
Rescue and Rehabilitation Center of Naked Carps of Qinghai Lake, Xining 810016, P.R. China)
Abstract:In this study, the five primary inflow rivers to Qinghai Lake (Heima River, Buha River, Quanji River, Shaliu River, Ha'ergai River) were investigated. The temporal-spatial distribution characteristics of the macrozoobenthos community in the five rivers were characterized, and potential fishery production was then estimated based on the macrozoobenthos stock. The aim was to provide scientific guidance for resource enhancement and the sustainable recovery of Gymnocypris przewalskii in Qinghai Lake. In 2019, during the early, middle and late migration period of G. przewalskii, the microzoobenthos and environmental parameters were investigated at 18 sampling transects in the upper, middle and lower reaches of the five rivers. A total of 101 microzoobenthos taxa (species/genus) belonging to 44 families, 9 orders, 7 classes and 5 phyla were observed during the investigation, with absolute dominance by aquatic insects (86 species/genus, accounting for 85.1% of the total species). Spatially, species richness was highest in Heima River (56 species/genus) and lowest in Ha'ergai River (27 species/genus). The taxa number of EPT (Ephemeroptera, Plecoptera and Trichoptera) decreased from upstream to downstream. Microzoobenthos density and biomass were both highest in Quanji River (544 ind/m2, 4.77 g/m2) and lowest in Haergai River (85 ind/m2, 0.31 g/m2), while the Shannon-Wiener and Simpson diversity, Pielou evenness and Margalef richness indices were highest in Heima River. Temporally, total taxa number and biodiversity indices of microzoobenthos decreased with each of the three successive migration periods, while the density and biomass increased. The primary environmental parameters influencing the distribution of macrozoobenthos density and biomass were substrate, altitude, water temperature, turbidity, and conductivity. The estimated potential fishery production capacity, based on macrozoobenthos, was highest in Buha River(285 129 kg), followed by Quanji River(20 694 kg) and Shaliu River(18 857 kg), and consistent with the distribution of G. przewalskii density in the different spawning grounds. Our findings indicate that macrozoobenthos can provide an adequate source of food for parent G. przewalskii during migration and spawning.
Key words:zoobenthos; temporal-spatial distribution; potential fishery production; Gymnocypris przewalskii
收稿日期:2021-08-15 修回日期:2022-11-09
基金项目:农业农村部财政专项“西北地区重点水域渔业资源与环境调查”。
作者简介:谢廷锋,1994年生,男,硕士研究生,研究方向为底栖动物生态学与湿地生态系统生态学。E-mail:xietf@ihb.ac.cn
通信作者:崔永德,1978年生,男,副研究员,主要从事寡毛类分类学与生态学、底栖动物生态学及生态系统健康评价研究。E-mail:ydcui@ihb.ac.cn

