汾河太原段沉积物中细菌群落的分布特征
王倩 甄志磊 王春玲 马浩天 孙镱铭 曹凯丽


摘要:分析汾河太原段沉积物细菌群落结构,探讨细菌群落与典型环境因子的相关关系,丰富河流沉积物细菌群落资料,并为汾河太原段生态健康状况评价提供依据。于2020年10月枯水期,在汾河入城口至清徐段布设11个采样断面,采集汾河太原段表层沉积物,共采集到10份样本。采用Illumina高通量测序技术分析沉积物细菌丰度和群落结构,利用主成分分析(PCoA)、冗余分析(RDA)和相关性分析等方法探讨沉积物中细菌群落结构分布特征以及主要影响因素。结果表明,10个断面表层沉积物中5 422个细菌OTUs分属于61门140纲346目580科1 073属。细菌群落结构在断面fh6、fh7、fh8、fh9、fh10、fh11 和fh4相似度较高,fh1和fh2断面相似度较高,而fh3断面与其他断面差异显著。除fh3,沉积物细菌优势菌门均为变形杆菌门(Proteobacteria),次优势菌门为绿弯菌门(Chloroflexi),优势菌纲为γ-变形菌纲(Gammaproteobacteria)。Pearson相关性分析表明,TN、OM和Pb与OTUs、Shannon指数和Simpson指数相关性显著。TN、OM和Pb是细菌群落结构的主要影响因子。RDA和Spearman分析表明,变形杆菌门(Proteobacteria)丰度与TN和OM呈显著正相关(P<0.01),与Pb和Ni呈正相关(P<0.05);绿弯菌门(Chloroflexi)与Cr呈显著负相关(P<0.01),与OTC和TC呈显著正相关(P<0.01);放线菌门(Actinobacteria)与TN、OM和Cu呈负相关(P<0.05);厚壁菌门(Firmicutes)与pH呈负相关,与TP呈正相关(P<0.05)。
关键词:沉积物;细菌群落;重金属;抗生素;汾河
中图分类号:Q938.8 文献标志码:A 文章编号:1674-3075(2023)03-0110-10
流经城市的河水是城市水源重要的贡献者(Othman et al,2012)。随着我国城市化进程不断加快,城市河流生态系统污染问题日益突出。沉积物是城市河流生态系统的重要组成部分,是该流域陆源污染物的“汇”,也是水体各种污染物的“源”和“汇”(于小彦等,2020)。工业区和居民区附近的河流是排放废水的主要汇集地。这些废水中含有大量的重金属、抗生素、有机污染物和营养物质,改变了河水和沉积物的环境特性以及细菌的群落结构(Wang et al,2018)。
沉积物中的细菌群落在调节生物地球化学营养循环(例如C、N、P)中发挥着重要作用,有助于恢复和维护河流生态系统的健康和平衡(王晓丽和其勒格尔,2020)。同时,沿河水体的物理化学性质的空间变化也会影响细菌群落的多样性和群落结构的变化(Ge et al,2020)。因此,细菌群落变化可以作为评价生态状况的指标。然而,对城市河流沉积物中细菌群落结构的空间分布仍缺乏深入了解。
汾河是山西省工农业生产和人民生活用水的主要水源,是三晋人民的母亲河。汾河太原段生态环境的保护不仅对太原市人民生活品质有着重要的意义,也对下游人民的用水安全具有重要的影响。目前,针对汾河太原段土壤重金属(刘勇等,2008)、河水及沉积物中PFOS和PFOA(东口朋宽等,2013)、水华藻类(王捷等,2018)以及沉积物重金属与酶活性(裴海光等,2022)展开了大量的研究。然而,汾河太原段沉积物中细菌多样性和群落结构类型仍不明确,细菌群落结构与环境影响因子的关联特征仍不清晰。本文分析了汾河太原段沉积物细菌群落结构,进一步探讨了细菌群落结构与典型环境因子的相关关系,以期为汾河太原段生态健康状况评价及丰富河流沉积物细菌群落资料提供参考。
1 材料与方法
1.1 研究区概况与样本收集
汾河位于山西境内,是黄河的第二大支流,总流域面积约39 000 km2。发源于山西宁武县管涔山麓,由北向南贯穿太原市全境。汾河太原段从汾河水库出水后由兰村入太原城区,于清徐县韩武出境,全长188 km。太原市降水的年际变化较大,全年约70%的降雨量集中在6-9月,平常少雨干旱。汾河在太原段由北至南布建了7条橡胶坝,蓄水深度为2.5~4.0 m,平均水深为3.25 m。根据1965-2003年水文控制断面资料(谢洪等,2017),兰村月均径流量为10.5 m?/s。由于太原段河道加深、加宽,流速明显减小。
枯水期水体、底泥污染物受自然界降水影响小,更能够反映河水受外来污染的真实状况(Li et al,2018)。本研究于2020年10月枯水期采集了汾河太原段表层沉积物样本。根据对汾河入城口处至清徐段实地考察,从下游至上游共布设11个采样断面(图1),编号分别为fh1~fh11(fh5样品未能获取)。其中,fh2断面河道改向,不能获取河心样品,仅收集到岸边沉积物样品;fh1~fh4分别位于郊区段的温南社村桥、二坝桥、迎宾桥和晋阳桥下,周围以耕地和居民用地为主;fh6~fh11分别位于城区段的祥云桥、南中环桥、南内环桥、迎泽桥、漪汾桥、胜利桥下,周围广泛分布城乡居民用地,污染物主要以径流的方式输入。每个采样断面使用抓斗式采泥器(聚创华业仪器;JC-W-801)采集表层5 cm沉积物,在同一断面采集3份样品,混合均匀后装入密封袋中于液氮罐中保存运回实验室。一部分样品进行冷冻干燥后过100目筛,用于后续指标的检测;另一部分用于细菌群落的检测。
1.2 化学指标分析
沉积物样品经冷冻干燥后研磨,称取0.1 g样品于50 mL比色管中,加入25 mL碱性过硫酸钾溶液,在0.15~0.16 MPa压力下保持120~124 ℃的温度30 min,自然冷却后过滤,滤液定容到100 mL,测得总氮(TN)、总磷(TP)和有机质(OM)。其中,有机质采用重铬酸钾滴定法进行测量、总氮采用紫外分光光度法、总磷采用钼酸铵分光光度法测定(陈肖刚等,2012);沉积物中的铜(Cu)、锌(Zn)、铅(Pb)、铬(Cr)、和镍(Ni)的浓度用电感耦合等离子体-质谱仪(ICP/MS)进行测定(Hua et al,2017)。重金属的回收率在89%~110%,标准偏差控制在5%以内。
1.3 抗生素分析
称取样品3.0 g于50 mL离心管中,加入15.0 mL 0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液(pH=4.0),涡旋30 s,振荡10 min,超声20 min,8 000 r/min离心5 min。移取上清液至另一离心管中,重复提取2次,合并上清液。加入10 mL正己烷,振荡5 min,10 000 r/min离心5 min,移取下层溶液备用。
Waters Oasis HLB固相萃取柱依次用6 mL甲醇、6 mL 0.1 mol/L Na2EDTA-Mcllvaine缓冲溶液(pH=4.0)活化,移取全部备用液过柱,控制流速≤3 mL/min,水10 mL淋洗,抽干。甲醇8 mL洗脱,收集洗脱液,于40℃下氮气吹干,加入流动相1.00 mL溶解残余物,超声2 min,混匀后过0.22 [μ]m滤头,供液相色谱-串联质谱仪测定。
选取磺胺类磺胺嘧啶(SDZ)、磺胺甲噁唑(SMX)、磺胺二甲嘧啶(SMZ)、磺胺间甲氧嘧啶(SMM)、磺胺喹噁啉(SQ),四环素类四环素(TC)、金霉素(CTC)、土霉素(OTC),和多西环素(DOX)共9种抗生素,采用高效液相色谱-质谱仪(Agilent 1100)对沉积物中目标抗生素含量进行分析检测。
1.4 沉积物污染评估
地质累积指数(Igeo)最早由德国学者Müller提出,是利用重金属实测浓度值和背景值的关系确定重金属污染程度的参数,计算公式如下:
Igeo=log2(Cn/1.5Bn) ①
式中:Cn为沉积物样品中元素实测浓度值;Bn为元素的区域背景值;系数1.5是考虑到成岩作用引起的背景值变化的校正因子。本研究中Igeo分级标准:Igeo≤0为无污染;0< Igeo≤1为轻度污染;1< Igeo≤2为轻度-中度污染;2< Igeo≤3为中度污染;3< Igeo≤4为中度-重度污染;4< Igeo≤5为重度污染;Igeo>5为极度污染。
1.5 DNA提取和测序
根据E.Z.N.A.?soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)说明书进行总DNA 抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,PCR扩增及其高通量测序使用细菌引物338F(5-ACTCCTACGGGAGGCAGCAG-3)和806R(5-GGACTACHVGGGTWTCTAAT-3),扩增程序如下:95℃ 预变性3 min,27个循环(95℃ 变性30 s,55℃ 退火30 s,72℃ 延伸 30 s),然后72℃ 稳定延伸 10 min,最后在4℃ 进行保存(PCR仪:ABI GeneAmp? 9700型)。每个样本3个重复。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2% 琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer (Promega,USA)对回收产物进行检测定量。利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司)。
使用FASTP软件(v0.20.0)对原始测序序列进行质控,FLASH软件(v1.2.7)进行拼接。使用UPARSE软件(v7.1)以97%的相似度对序列进行操作分类单元(Operational Taxonomic Units,OTUs)聚类并剔除嵌合体。利用RDP classifier(v2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v132),设置比对阈值为70%。
1.6 数据处理与统计分析
利用EXCEL 2021对试验数据(沉积物理化性质、重金属含量、抗生素含量)进行初步处理。使用SPASS 17对数据进行单因素方差分析。Mothur 软件(v1.30.2)对97%相似度的操作分类单元(OTU)做多样性指数分析(Shannon、Simpson、Chao、Ace)。Heatmap图及主坐标分析(PCoA)由R语言(V3.3.1)的“Vegan和“gplots”包完成。冗余分析(RDA)采用CANOCO 5.0软件。绘图采用Origin 9.0完成。
2 结果与分析
2.1 细菌群落的空间分布
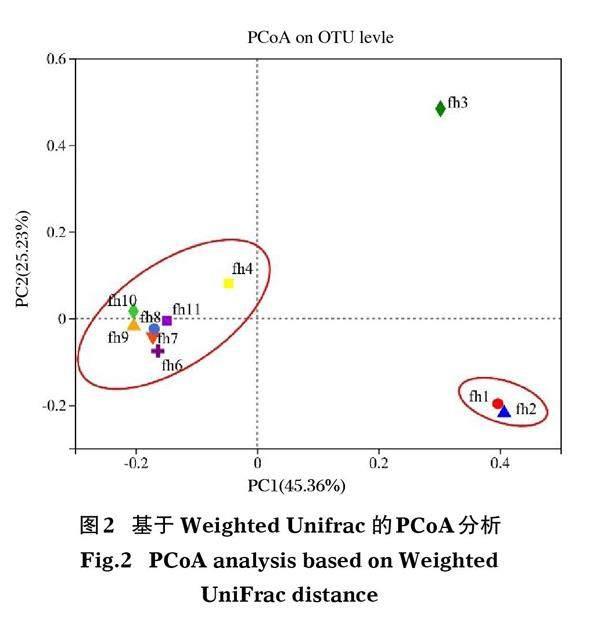
汾河太原段沉积物样品的高通量序列数范围为35 772~54 169,平均为44 984。总共观察到5 422个OTUs,相似度为97%。每个样本的最大和最小OTUs分别为2 713、2 068个,平均为2 297个。所有样本的覆盖率值(>95%)表明测序深度足以识别沉积物中的大多数细菌多样性。采用Shannon和Simpson多样性指数、丰富度指数(Chao和Ace)等4个α多样性指数评价细菌群落的多样性和丰富度。Shannon指数和Simpson指数分别为5.82~6.88、0.0026~0.0125。Chao指数和Ace指数分别为3 026~3 240、3 089~3 597(表1)。进一步分析样本间在细菌群落物种组成上的差异性,基于weighted Unifrac的PCoA分析衡量样本间细菌群落物种组成的相似度。结果表明,10个采样断面主要分布在2个不同的位置(图2)。PC1是造成样品差异性最大的主坐标成分,解释度为45.36%,其次为PC2,解释度为25.23%,对物种分布的总解释量为70.59%。在PC1和PC2维度上,将采样点分为2组,汾河城市段fh6、fh7、fh8、fh9、fh10、fh11 和fh4断面细菌群落结构相似度较高为一组,fh1、fh2断面相似度较高为一组,而fh3断面离其他断面相对较远。
5 422个细菌OTUs被划分为61门140纲580科。沉积物样品中的优势门(相对丰度> 5%)为变形杆菌门(Proteobacteria,40.63%)、绿弯菌门(Chloroflexi,18.41%)、放线菌门(Actinobacteria,9.84%)、拟杆菌门(Bacteroidetes,7.49%)、酸杆菌门(Acidobacteria,6.46%)、厚壁菌门(Firmicutes,4.80%),占总序列的85%以上(图3)。各优势门的相对丰度分别为23.89%~51.29%、11.14%~26.72%、6.65%~17.07%、4.34%~11.69%、3.86%~8.42%和1.71%~11.86%。其中,除fh3的优势菌门为Chloroflexi(26.72%),次优势菌门为Proteobacteria(23.89%)外,其他采样断面均以Proteobacteria为优势菌门。且城区段沉积物中Proteobacteria的相对丰度高于郊区段;而Bacteroidetes和Firmicutes在郊区段沉积物中相对丰度较高。
纲水平上,细菌优势分类群(相对丰度> 5%)为γ-变形菌纲(Gammaproteobacteria)、厌氧绳菌纲(Anaerolineae)、放线菌纲(Actinobacteria)、δ-变形杆菌纲(Deltaproteobacteria)、拟杆菌纲(Bacteroidia)、梭菌纲(Clostridia)、α-变形杆菌纲(Alphaproteobacteria)和KD4-96(图3)。其中,只有fh3断面的优势菌纲是Actinobacteria,其他采样断面均以Gammaproteobacteria为优势菌纲。城区段沉积物中Gammaproteobacteria相对丰度高于郊区段,而郊区段沉积物中Bacteroidia、Clostridia和Alphaproteobacteria相对丰度明显高于城区段。
在科水平上,检测到25组优势菌科(相对丰度> 2%),占总序列的37.29%~61.92%(图3)。结果表明,25个细菌科中有12个为分类数据库中的中级水平,由norank命名,推断出有许多未知细菌分布于汾河的沉积物中。其中,嗜氢菌科(Hydrogenophilaceae)的检出率较高,相对丰度为1.29%~14.30%,且城区段相对丰度明显高于郊区段。其次是厌氧绳菌科(Anaerolineaceae,2.28%~11.82%)和红环菌科(Rhodocyclaceae,1.50%~6.01%)。
2.2 沉积物中重金属含量
汾河太原段沉积物重金属浓度在不同采样断面的浓度差异明显(图4),重金属总体含量呈现出城区段高于郊区段,fh3断面浓度最低。
Cu、Zn、Pb、Cr、Ni的分布浓度分别为16.9~56.8、72.3~233.6、20.3~39.6、50.0~177.7、20.7~49.6 mg/kg。Cu在郊区段fh4断面达到最大值,Zn和Pb的含量在城区段fh8断面达到最大值,Cr和Ni分别在城区段入城口处fh11和fh10断面达到最大值。平均浓度大小顺序:Zn > Cr > Ni > Cu > Pb,5种重金属的平均浓度均高于山西土壤背景值(史崇文等,1996)、中国水系沉积物背景值(鄢明才等,1995)和黄河水系沉积物背景值(洪松等,2006)。其中,Zn的平均浓度比中国水系沉积物背景值高2倍,Cr高出1.6倍(表2)。
汾河太原段沉积物中重金属的地质累积指数见表3。结果表明该地区沉积物均处于重金属元素污染状态,城区段的fh6和fh11断面受到Zn和Cr的轻-中度污染。
2.3 沉积物中抗生素的丰度和分布
汾河太原段沉积物中只在fh1、fh3、fh4、fh6和fh7 5个采样断面检测出目标抗生素,其余5个采样断面均未测出(图5)。9种目标抗生素在沉积物中只检测到OTC、TC和SDZ,其中OTC和TC是沉积物中的主要抗生素。抗生素总浓度分布范围为0~16.65 μg/kg,平均浓度为3.38 μg/kg。其中四环素类抗生素总浓度范围为0~17.86 μg/kg,磺胺类抗生素总浓度范围为0~0.0623 μg/kg。检出的3种抗生素的平均浓度范围为0.0062~2.778 μg/kg,检出率范围为10%~50%。沉积物中平均浓度最高的抗生素为OTC,且检出率为50%。
2.4 细菌群落与环境因子的相关性
沉积物pH值为7.49~8.48,TN、TP和OM含量分别为0.55~3.37、0.53~0.90和12.23~76.08 g/kg(表1)。理化指标、重金属和抗生素与细菌群落多样性之间的关系见表4。Pearson相关性结果表明,OTUs与TN、OM、Pb和Ni呈负相关(P<0.05)。Shannon与TN、OM和Pb呈显著负相关(P<0.01)。Simpson与TN和OM呈显著正相关(P<0.01),与Pb正相关(P<0.05)。其中TN、OM和Pb是细菌群落结构的主要影响因子。汾河太原段沉积物理化指标、重金属和抗生素与门水平特定细菌丰度存在一定相关性(图6A)。TN和OM是与沉积物门水平细菌种类相关性最高的2种因子。TN和OM含量与门水平最丰富的Proteobacteria丰度呈显著正相关(P<0.01)。
基于细菌群落与理化指标的RDA分析(图6B),Proteobacteria与TN和OM呈显著正相关(P<0.01)。Actinobacteria与TN和OM呈负相关(P<0.05)。Firmicutes与pH呈负相关,与TP呈正相关(P<0.05)。细菌群落与重金属RDA分析中(图6C),Proteobacteria与Pb和Ni呈正相关(P<0.05)。Chloroflexi与Cr呈显著负相关(P<0.01),Actinobacteria与Cu呈负相关(P<0.05)。细菌群落与抗生素RDA分析表明(图6D),Chloroflexi与OTC和TC呈显著正相关(P<0.01)。
3 讨论
3.1 沉积物中重金属和抗生素的富集
随着人类活动对河流水质环境的持续影响,沉积到河流沉积物中的环境污染物日益增多。据统计,河流中99%以上的重金属以多种形式沉积到沉积物中(Peng et al,2009)。因此,汾河太原段沉积物中重金属的富集反映了整个太原市重金属的来源和地位。在汾河太原段沉积物中,重金属总体含量为城区段高于郊区段。Zn、Cr、Pb、Cu和Ni均处于污染状态,其中Zn和Cr部分样点受到轻度-中度污染。Zn的平均浓度比中国水系沉积物背景值高2倍,Cr次之高1.6倍,表明存在大量外源输入。这种现象可能是由于本研究采样位置靠近交通干线,交通流量大,尾气排放中含有大量Pb,汽车轮胎硬度添加剂、抗氧化剂和润滑油洗涤剂中含有Zn(李伟迪等,2019)。这些粉尘可经大气沉降作用对城市河流造成影响。汾河上游的太原北郊工业生产及城市污水排放导致汾河表层沉积物中Cr含量较高(郭掌珍等,2013)。霍雪萍(2017)发现整个汾河流域Cr、Cu、Cd和Pb污染较为严重,其中汾河水库Zn污染最为严重;Cu污染最为严重的地方为汾河二库和平遥铁桥;灵石南关Cd污染最为严重;甘亭Hg污染最为严重。杨国义等(2010)所研究的汾河太原段及市区内部分支流中重金属都处于中等以上污染水平,且Pb>Cr>Cu>Ni;其中,Cu处于较高的潜在生态风险,Pb、Cr和 Ni处于中、低潜在风险;污染最严重的是胜利桥和涧河。
河流是抗生素在环境中的重要归宿,抗生素可通过污水排放以及地表径流冲刷等途径进入水环境(Si et al,2018),水环境中的沉积物是抗生素和抗生素抗性基因(ARGs)繁殖和迁移转化的理想场所和主要载体(Yang et al,2018)。本研究中OTC和TC是汾河太原段沉积物中主要的抗生素。研究表明,河流中OTC和TC的浓度高于其他TCs抗生素(Liu et al,2018),这是由于四环素类抗生素可被悬浮颗粒和沉积物强烈吸附(Qiao et al,2018),且在沉积物中具有高消耗和持久性。沉积物中抗生素浓度随水流方向逐渐升高(fh2未检测到目标抗生素是由于汾河人为改道,没有获取河流中心样品)。这与广州市城市河流沉积物中抗生素变化趋势一致(Huang et al,2019)。然而,fh4采样断面OTC突增,可能是该处含有OTC抗生素的未知污染源排入。总体上,汾河沉积物中的抗生素污染水平相对较低。
3.2 环境因子对沉积物中细菌群落的影响
河流沉积物中的细菌群落是大多数河流生态系统中代谢活动的主要承担者(Aljerf & Almasri,2018),在物质循环和能量运输中发挥着关键作用(Ibekwe et al,2016),同时反映了不同的生态功能,是衡量水生生态系统稳定性的重要指标之一(Reed et al,2013)。细菌群落可作为潜在的生物指示剂,通过相关性分析监测河流沉积物中的环境污染物(Kaestli et al,2017)。本研究对汾河太原段沉积物中的细菌群落进行了表征,并探讨了它们与理化指标、重金属和抗生素等富集的关系。沉积物中最丰富的门是Proteobacteria,其次是Chloroflexi、Actinobacteria、Bacteroidetes、Acidobacteria和Firmicutes。在汾河入黄口的水体中也发现了相似的结果(刘峰等,2019)。Proteobacteria是淡水沉积物中常见的革兰氏阴性菌的代谢多样性类群(Chen et al,2018),在河流沉积物中普遍存在(Song et al,2012)。除fh3断面,沉积物细菌优势菌门均为Proteobacteria,次优势菌门为Chloroflexi,优势菌纲为Gammaproteobacteria(图3)。污水排放可导致河流沉积物Chloroflexi、Firmicutes和Acidobacteria增加,而Gammaproteobacteria降低(Marti & Balcázar,2014)。这指示了fh3断面有不同的细菌群落形态,与图2的PcoA分析一致。主要原因为fh3断面为新拓宽河道,河道底泥沉积较少,有机质和重金属含量相对较低。
细菌群落的协同选择机制与重金属富集之间的显著关系已得到证实(Ohore et al,2019)。其次,河流沉积物中的抗生素也与细菌群落存在显著相关(Deng et al,2020)。在本研究中,TN、OM、Pb与OTUs和细菌群落多样性指数(Shannon、Simpson)有显著的相关性,Ni与OTUs有一定的相关性(表4)。其中TN、OM和Pb是细菌群落结构的主要影响因子。重金属的高富集导致细菌群落的低多样性(Zhao et al,2014)。汾河城区段(fh6~fh11)的重金属污染程度相对较高(图4),导致城区段平均多样性指数低(Shannon=6.05),fh6断面最低(表1)。
从图6B可知,TN、OM与Proteobacteria正相关,与Actinobacteria负相关,TN和OM是细菌群落结构的主要影响因子。研究表明, OM、TN、TP等环境因子对沉积物细菌分布影响显著(王娜等,2012)。细菌主要利用有机质作为碳源,细菌生物量与沉积物中的有机质呈显著正相关(Boudreau,1999),与氮也呈显著正相关(Feng et al,2006),这与我们的研究结果一致。Gammaproteobacteria广泛分布在贫营养和富营养环境中,酸碱度和营养物质的可获得性可以调节它们的丰度(Shapovalova et al,2008),同时对沉积物中硫化物的去除起着重要作用(Collado et al,2013)。河流环境中的大多数细菌的生态过程容易受到重金属污染(Gans et al,2005),重金属可以破坏单链和双链,并改变生物体中的碱基(Ates et al,2004)。Ni和Pb与Proteobacteria正相关,Cr和Chloroflexi负相关,Cu和Actinobacteria负相关(图6C)。虽然高浓度的重金属降低了细菌群落的多样性,但Proteobacteria能够耐受高污染的环境,对Cu、Zn、Pb、Cd、Hg等重金属污染有一定的耐受力,其中对Cu 的耐受力较强(Feris et al,2003)。此外,河流中抗生素残留也可能改变细菌群落沿河流的分布。本研究中,抗生素OTC和TC与Chloroflexi正相关(图6D)。Chloroflexi在抗生素废水处理中对有机污染物的去除起着重要作用(Casas et al,2015),可以降解复杂的有机化合物(Chen et al,2014)。
不同河段沉积物细菌在门、纲、科水平上较明显地反映了不同河段土地利用方式对细菌群落结构的影响(赵君等,2020)。在本研究中,城区段中Proteobacteria的平均丰度高于郊区,而郊区段Bacteroidetes和Firmicutes相对丰度高于城区段。城区段城乡居民用地占比较大,生活污水、雨水径流等输入的有机物、重金属大于郊区段。另外,橡胶坝的布设使得城区段的重金属和有机质明显高于郊区,最终导致河道沉积物中细菌丰度有所差异。为了更好地了解单个环境变量(污染物和理化性质)的相对重要性,在今后进一步的研究中将需要长期监测和微观研究。
参考文献
陈肖刚, 李雅静, 李欣益, 2012. 南北方河流沉积物中污染物含量的对比分析[J].中国农村水利水电, (10):35-38.
东口朋宽, 史江红, 张晖, 等, 2013. 汾河流域太原段河水及沉积物中PFOS和PFOA的浓度分布特征[J].环境科学, 34(11): 4211-4217.
郭掌珍, 张渊, 李维宏, 等, 2013. 汾河表层沉积物中营养盐和重金属的含量、来源和生态风险[J].水土保持学报, 27(3):95-99.
洪松, 陈静生, 程兵岐, 2006. 黄河水系悬浮物和沉积物重金属质量基准研究[J]. 武汉理工大学学报, 28(12):61-65.
霍雪萍, 2017. 汾河流域沉积物中重金属分布及潜在风险评价[J].太原科技大学学报, 38(5):397-404.
李伟迪, 崔云霞, 曾撑撑, 等, 2019. 太滆运河流域农田土壤重金属污染特征与来源解析[J].环境科学, 40(11):334-342.
刘峰, 冯民权, 王毅博, 2019. 汾河入黄口夏季微生物群落结构分析[J].微生物学通报, 46(1):54-64.
刘勇, 张红, 尹京苑, 2008. 汾河太原段土壤中Hg、Cr空间分布与污染评价[J].农业工程学报, 24(5): 57-60.
裴海光, 贾自强, 杨静, 等, 2022. 汾河太原段沉积物氮、铜、铝含量及酶活性的分布特征及季节变化[J]. 山西大学学报(自然科学版), 45(1):237-246..
史崇文, 赵玲芝, 郭新波,等, 1996. 山西省土壤元素背景值的分布规律及其影响因素[J]. 农业环境保护, 15(1):24-28.
王捷, 石瑛, 刘琪, 等, 2018. 汾河太原河段水华藻类分类及分子系统研究[J].湖泊科学, 30(5): 1332-1342.
王娜, 徐德琳, 郭璇, 等, 2012. 太湖沉积物微生物生物量及其与碳、氮、磷的相关性[J].应用生态学报, 23(7):1921-1926.
王晓丽, 其勒格尔, 2020. 黄河内蒙古段表层沉积物细菌多样性及群落结构类型[J].生态学报, 40(2): 578-589.
谢洪, 肖娟, 范肖予, 等, 2017. 汾河上中游生态径流量计算研究[J]. 水电能源科学, 35 (9):25-27.
鄢明才, 迟清华, 顾铁新, 等, 1995. 中国各类沉积物化学元素平均含量[J].物探与化探, 19(6): 468-472.
杨国义, 闫雨龙, 何秋生, 等, 2010. 汾河沉积物中重金属污染及生态风险评价[J].太原科技大学学报, 31(4):339-344.
于小彦, 张平究, 张经纬, 等, 2020. 城市河流沉积物微生物量分布和群落结构特征[J].环境科学学报, 40(2): 585-596.
赵君, 王鹏, 徐启渝,等, 2020. 袁河流域不同土地利用方式下河流浮游细菌群落结构特征[J].环境科学学报, 40(3):890-900.
Aljerf L, Almasri N, 2018. A gateway to metal resistance: bacterial response to heavy metal toxicity in the biological environment[J]. Annals of Science, 2(1):32-44.
Ates I, Suzen H S, Aydin A, et al, 2004. The oxidative DNA base damage in testes of rats after intraperitoneal cadmium injection[J]. Biometals, 17(4):371-377.
Boudreau B P, 1999. A theoretical investigation of the organic carbon-microbial biomass relation in muddy sediments[J]. Aquatic Microbial Ecology,17:181-189.
Casas M E, Chhetri R K, Ooi G, et al, 2015. Biodegradation of pharmaceuticals in hospital wastewater by staged Moving Bed Biofilm Reactors (MBBR) [J]. Water Research, 83(15):293-302.
Chen Y, Jiang Y M, Huang H Y, et al, 2018. Long-term and high-concentration heavy-metal contamination strongly influences the microbiome and functional genes in Yellow River sediments[J]. The Science of The Total Environment, 637/638(1):1400-1412.
Chen Z, Wang Y G, Li K, et al, 2014. Effects of increasing organic loading rate on performance and microbial community shift of an up-flow anaerobic sludge blanket reactor treating diluted pharmaceutical wastewater[J]. Journal of Bioscience and Bioengineering, 118(3):284-288.
Collado N, Buttiglieri G, Marti E L, et al, 2013. Effects on activated sludge bacterial community exposed to sulfamethoxazole[J]. Chemosphere, 93(1):99-106.
Deng C X, Liu X W, Li L L, et al, 2020. Temporal dynamics of antibiotic resistant genes and their association with the bacterial community in a water-sediment mesocosm under selection by 14 antibiotics[J]. Environment International, 137:105554.
Feng F, Wang H, Fang T, et al, 2006. Correlation between microbial biomass and carbon, nitrogen, phosphorus in the sediments of Lake Donghu[J]. China Environmental Science, 26(3):342-345.
Feris K, Ramsey P, Frazar C, et al, 2003. Differences in hyporheic-zone microbial community structure along a heavy-metal contamination gradient[J].Applied and Environmental Microbiology, 69(9):5563-5573.
Gans J, Wolinsky M, Dunbar J, 2005. Computational improvements reveal great bacterial diversity and high metal toxicity in soil[J]. Science, 309(5739):1387-1390.
Ge Y, Lou Y, Xu M, et al, 2020. Spatial distribution and influencing factors on the variation of bacterial communities in an urban river sediment[J]. Environmental Pollution, 272:115984.
Hua Z, Jiang Y H, Ding M J, et al, 2017. Level, source identification, and risk analysis of heavy metal in surface sediments from river-lake ecosystems in the Poyang Lake, China[J]. Environmental Science and Pollution Research, 24(5):1-15.
Huang Y H, Liu Y, Du P P, et al, 2019. Occurrence and distribution of antibiotics and antibiotic resistant genes in water and sediments of urban rivers with black-odor water in Guangzhou, South China[J]. Science of the Total Environment, 670(20):170-180.
Ibekwe A M, Ma J, Murinda S E, 2016. Bacterial community composition and structure in an Urban River impacted by different pollutant sources[J]. The Science of The Total Environment,566/567(1):1176-1185.
Kaestli M, Skillington A, Kennedy K, et al, 2017. Spatial and temporal microbial patterns in a tropical macrotidal estuary subject to urbanization[J]. Frontiers in microbiology, 8:1313.
Li S, Shi W Z, Li H M, et al, 2018. Antibiotics in water and sediments of rivers and coastal area of Zhuhai City, Pearl River estuary, south China[J]. The Science of The Total Environment, 636(15):1009-1019.
Liu X H, Lu S Y, Guo W, et al, 2018. Antibiotics in the aquatic environments: A review of lakes, China[J]. The Science of The Total Environment, 627(15):1195-1208.
Marti E, Balcázar J L, 2014. Use of pyrosequencing to explore the benthic bacterial community structure in a river impacted by wastewater treatment plant discharges[J]. Research in Microbiology, 165(6):468-471.
Ohore O E, Addo F G, Zhang S H, et al, 2019. Distribution and relationship between antimicrobial resistance genes and heavy metals in surface sediments of Taihu Lake, China[J]. Journal of Environmental Sciences, 77(3):323-335.
Othman F, Eldin M E A, Ibrahim M, 2012. Trend analysis of a tropical urban river water quality in Malaysia [J]. Journal of Environmental Monitoring, 14(12): 3164-3173.
Peng J F, Song Y H, Yuan P, et al, 2009. The remediation of heavy metals contaminated sediment[J]. Journal of Hazardous Materials, 161(2/3):633-640.
Qiao M, Ying G G, Singer A C, et al, 2018. Review of antibiotic resistance in China and its environment[J]. Environment International, 110:160-172.
Reed H E, Martiny J B H, 2013. Microbial composition affects the functioning of estuarine sediments[J]. The ISME journal, 7(4):868-879.
Shapovalova A A, Khijniak T V, Tourova T P, et al, 2008. Heterotrophic denitrification at extremely high salt and pH by haloalkaliphilic Gammaproteobacteria from hypersaline soda lakes[J]. Extremophiles, 12(5):619-625.
Si L, Shi W Z, Liu W, et al, 2018. A duodecennial national synthesis of antibiotics in China's major rivers and seas (2005-2016)[J]. Science of The Total Environment, 615:906-917.
Song H, Li Z, Du B, et al, 2012. Bacterial communities in sediments of the shallow Lake Dongping in China[J]. Journal of Applied Microbiology, 112(1):79-89.
Wang L, Zhang J, Li H, et al, 2018. Shift in the microbial community composition of surface water and sediment along an urban river[J]. The Science of The Total Environment, 627(15): 600-612.
Yang Y Y, Song W J, Lin H, et al, 2018. Antibiotics and antibiotic resistance genes in global lakes: A review and meta-analysis[J]. Environment International, 116:60-73.
Zhao J, Zhao X, Chao L, et al, 2014. Diversity change of microbial communities responding to zinc and arsenic pollution in a river of northeastern China[J]. Journal of Zhejiang University-Science B, 15(7):670-680.
(责任编辑 郑金秀)
Distribution of the Bacterial Community in Sediments
of the Taiyuan Section of Fenhe River
WANG Qian, ZHEN Zhi‐lei, WANG Chun‐ling, MA Hao‐tian, SUN Yi‐ming, CAO Kai‐li
(College of Urban and Rural Construction, Shanxi Agricultural University, Jinzhong 030801, P.R. China)
Abstract:Fenhe River is the primary water source for industry, agriculture and domestic use in Shanxi Province. Conserving the ecological environment of the Taiyuan section of Fenhe River is significant not only for the quality life in Taiyuan city but also for protecting downstream water quality. In this study, we explored the bacterial community structure and its relationship with sediment environmental factors in the Taiyuan section of Fenhe River. In October 2020, sediment samples were collected at 11 transects of the river section (fh1-fh5 in the suburban area and fh6-fh11 in the urban area) for analysis of the bacterial community and determination of physiochemical parameters, heavy metals and antibiotics (no samples were obtained at site fh5). Illumina high-throughput sequencing technology was used to analyze bacterial abundance and community structure in surface sediments, and principal co-ordinates analysis (PCoA), redundancy analysis (RDA) and correlation analysis were applied to explore the distribution of the bacterial community and primary influencing factors. A total of 5 422 bacterial OTUs belonging to 1 073 genera, 580 families, 346 orders, 140 classes and 61 phyla were obtained in surface sediments of the 10 transects. Across the 10 transects the dominant phyla at all transects, except for fh3, was Proteobacteria (40.63%) and other prevalent phyla included Chloroflexi (18.41%), Actinobacteria (9.84%), Bacteroidetes (7.49%), Acidobacteria (6.46%) and Firmicutes (4.80%). The dominant class among the bacterial communities was Gammaproteobacteria. The Shannon, Simpson, Chao and Ace indices of bacterial diversity were in the respective ranges of 5.82-6.88, 0.0026-0.0125, 3 026-3 240 and 3 089-3 597. The similarity of bacterial community structure at sites fh6, fh7, fh8, fh9, fh10, fh11 and fh4 was high, clustering into one group, with fh1 and fh2 clustering into a second group, but there were significant differences in community structure between fh3 and the other transects. Pearson correlation analysis shows that total nitrogen (TN), organic matter (OM) and lead (Pb) were significantly correlated with the OTUs, and the Shannon and Simpson indices, indicating that they were the primary factors affecting bacterial community structure. Redundancy analysis and Spearman analysis show that Proteobacteria had a highly significantly positive correlation with TN and OM (P<0.01), and significant positive correlations with Pb and Ni (P<0.05); Chloroflexi was significantly negatively correlated with Cr (P<0.01) while significantly positively correlated with OTC and TC (P<0.01); Actinobacteria was negatively correlated with TN, OM and Cu (P<0.05). Firmicutes was negatively correlated with pH and positively correlated with TP (P<0.05). The results of this study provide data that will improve our understanding of the bacterial community distribution in the sediments of the Taiyuan section of Fenhe River and identified the environmental impact factors.
Key words:sediment; bacterial community; heavy metals; antibiotics; Fenhe River
收稿日期:2021-08-03 修回日期:2023-01-11
基金项目:山西省高等学校科技创新项目(2020L0143);山西农业大学科技创新基金(2017YJ04)。
作者简介:王倩,1996年生,女,硕士,主要从事景观生态修复研究。E-mail: wangqianed@163.com
通信作者:甄志磊,男,副教授。E-mail: zhencheng@sxau.edu.cn

