克氏原螯虾对3种不同生长型沉水植物清水态系统的影响
刘伟 张泽慧 高健 袁红 王铭 熊文
摘要:鉴于克氏原螯虾(Procambarus clarkii)是目前全球入侵最广、对淡水生态系统最具破坏性的物种之一,探究其对沉水植物清水态系统的影响,有助于防范克氏原螯虾入侵给浅水湖泊带来的生态风险。通过受控实验,研究了克氏原螯虾对直立型沉水植物轮叶黑藻(Hydrilla verticillata)、冠层型沉水植物穗花狐尾藻(Myriophyllum spicatum)和莲座型沉水植物密刺苦草(Vallisneria denseserrulata)的影响以及不同植物培养系统对理化因子的响应变化。结果显示,直立型轮叶黑藻相对生物减少量(60.5%)大于冠层型穗花狐尾藻(45.7%)和莲座型密刺苦草(39.0%);克氏原螯虾进入后导致3种生长型沉水植物清水态系统的总悬浮物浓度、叶绿素a和营养盐均极显著增高(P<0.01)。研究表明,水生态系统中的克氏原螯虾会直接降低沉水植物生物量,并扰动底泥增加水体的悬浮物、叶绿素a和营养盐浓度,导致水体由清水态向浊水态转变,也会通过直接牧食或扰动破坏,降低沉水植物生物量,最终影响草型清水态系统的稳定性。
关键词:克氏原螯虾;轮叶黑藻;密刺苦草;穗花狐尾藻;生长型;清水态
中图分类号:Q142 文献标志码:A 文章编号:1674-3075(2023)03-0129-07
克氏原螯虾(Procambarus clarkii)是全球入侵最广的物种之一(Oficialdegui et al, 2020),喜栖息在浅水湖泊岸边的水草丛中,在许多入侵的湖泊沿岸带形成优势类群(曾珍英等,2013;van der Wal et al, 2013)。克氏原螯虾是杂食性消费者,能够摄食碎屑、水生植物、藻类、底栖动物和腐肉等( Crandall & Buhay, 2008)。20世纪20年代克氏原螯虾被引入中国(戴爱云,1983),除青藏高原外,目前其他各省均有分布(Yi et al,2018);克氏原螯虾已在欧洲、北美洲和非洲等地成功入侵并导致沉水植物生物量急剧下降或沉水植物重建失败(Gherardi & Acquistapace, 2007; van der Wal et al, 2013);入侵栖息地水体悬浮物浓度显著增加,最终导致湖泊从草型清水态向藻型浑水态转变(Angeler et al,2001)。与欧、美、非等地针对入侵的生态负面效应研究相比,目前我国仅有少量研究关注了克氏原螯虾从养殖扩散到自然水体对生态系统可能带来的危害。江舒等(2007)在湖南毛里湖区调查发现,克氏原螯虾入侵后,湖中的苦草、菹草和黑藻等沉水植物大量减少;张燕萍等(2014)研究发现克氏原螯虾已成为鄱阳湖底栖动物优势种;曾珍英等(2013)认为大量的克氏原螯虾可能是导致鄱阳湖沉水植物面积减少、优势种发生改变的原因之一。
沉水植物按其生长型(Growth form)可分为底栖型(Bottom-dwelling)、莲座型(Rosette)、直立型(Erect)和冠层型(Canopy-forming)共4种类型(Chambers & Kalff,1987)。不同生长型沉水植物的性状特征各异,而植物的形态、韧性、表面特征以及化学特征又决定了其对不同生境的适应能力(Strand & Weisner,2001;Yang et al,2004;朱金格等,2019;杨诚等,2021)。例如,随着湖泊营养水平的升高,水体透明度下降,低光照逐渐限制了底栖型和莲座型沉水植物在竞争中能够吸收沉积物营养盐的优势,而直立型和冠层型沉水植物则可以利用其光合作用优势并逐渐成为优势种(Jana & Choudhuri,1979;涂克环等,2013)。因此,沉水植物受富营养化胁迫而消亡规律一般是从底栖型和莲座型向直立型和冠层型演替,直至最后全部消失;反之,沉水植物恢复重建往往是将耐低透明度、抗风浪能力强的冠层型、直立型种类作为先锋种首先进行恢复种植,成功重建后可以为其他种类沉水植物的生长创造条件,最后实现草型清水态系统重建(柴夏等,2008;杨桐等2021)。由此可见,不同生长型沉水植物的依序构建被认为是浅水富营养化湖泊恢复为清水型生态系统的关键措施( Scheffer & Jeppesen,2007;刘正文等,2020)。
在实施外源污染消减、底栖鱼类和草食性鱼类去除等措施后,通过在富营养化湖泊沿岸带移栽沉水植物,在欧美等地已被证明是一种有效的湖泊生态修复手段,冠层型和直立型的狐尾藻(Myriophyllum sp.)、伊乐藻(Elodea canadensis)和菹草(Potamogeton crispus)等作为先锋种被优先选择(Knopik & Newman, 2018)。然而,已有研究发现这些重建的沉水植物因为克氏原螯虾的入侵威胁而面临再度消亡的风险(Gheradi,2006)。
目前,黑藻、狐尾藻和苦草等我国本土物种因其景观效果好、耐污染能力强等特性,是浅水湖泊沉水植物重建的优选种。鉴于克氏原螯虾可能会从群落中选择性移除沉水植物(Carreira et al, 2014),其对不同生长型沉水植物的牧食和机械破坏以及对水体底泥的扰动可能会有所不同,开展相关研究可为富营养湖泊沉水植物重建种类优选提供参考依据。基于以上背景,项目组拟通过设置密刺苦草(Vallisneria denseserrulata)、轮叶黑藻(Hydrilla verticillate)、穗花狐尾藻(Myriophyllum spicatum)草型清水态系统,探究克氏原螯虾对3种生长型沉水植物及系统理化因子的影响。
1 材料与方法
1.1 实验材料
密刺苦草、轮叶黑藻和穗花狐尾藻均采集于湖北省武汉市的内沙湖,该湖2013年实施沉水植物重建,目前沉水植物覆盖度在80%以上,为典型草型清水态湖泊。
沉水植物培养底泥采自武汉市南湖出水河道巡司河,将底泥自然风干、混匀并剔除其中大块杂质后备用。克氏原螯虾采集于湖北孝感一池塘,挑选大小均匀的个体用于实验,克氏原螯虾个体重(26.0±6.0) g,体长(9.00±0.75) cm。在实验开始前,将克氏原螯虾饥饿处理24 h。
1.2 实验设计
参考克氏原螯虾类似研究(Aquiloni et al, 2010; Zhang et al, 2017),实验在18个聚乙烯塑料圆形大桶(上部直径60 cm,底部直径50 cm,高度80 cm)中进行,桶内放入约20 cm厚底泥(TN:1.90 mg/g,TP:0.52 mg/g),桶放置在带顶棚的室外实验水池内。将自来水(TN:1.08 mg/L,TP:0.11 mg/L)加入桶中至75 cm。自来水放置48 h后,分别种植3种沉水植物,即密刺苦草、轮叶黑藻和穗花狐尾藻各6桶。沉水植物种植株数选择约相同生物量的苦草30株、黑藻35株、穗花狐尾藻15株。
培养5周后,3种植物在其种植空间的覆盖度约100%,水体透明度清澈见底。因植物生长速度差异,放入克氏原螯虾前,初步观察实验桶中沉水植物生物量为轮叶黑藻>密刺苦草>穗花狐尾藻。在各组植物中分别选择3个桶,均加入2只克氏原螯虾为实验组(Treatment group);各组另外3个桶作为对照组(Control group)。
实验桶放置在搭建的防雨顶棚内,顶棚材质为透明PVC,四周用不透风塑料膜围住,并用暖气片对室内增温,实验期间水温控制在(20.7±0.9)℃,选择自然光照。实验时间为2020年10月7日至11月1日,持续到部分桶内沉水植物被克氏原螯虾大量摄食甚至完全消失时终止。
1.3 采样与分析
1.3.1 水质理化指标 每周从每个桶中采集表层下约10 cm处水样500 mL,用于分析总氮(TN)、氨氮(NH3-N)、总磷(TP)、叶绿素a(Chl-a)浓度(国家环境保护总局, 2002)。TN浓度采用碱性过硫酸钾消解紫外分光光度法测定,NH3-N浓度采用纳氏试剂分光光度法测定,TP浓度采用过硫酸钾消解紫外分光光度法测定,Chl-a浓度用90%丙酮避光提取后用分光光度法测定。
1.3.2 沉水植物指标 实验结束后,统计每个实验水桶内剩余沉水植物湿重,其中折断漂浮在桶水体表面的植物每3 d打捞1次。
1.4 数据处理及分析
实验组和对照组沉水植物生物量变化采用单因素方差分析,如果存在显著差异,则采用Bonferroni's Multiple Comparison Test分析其差异显著性程度。
实验组和对照组水质理化变化采用重复测量方差分析(Repeated measures analyses of variance with time as the repeated factor,RM-ANOVAs)。在进行方差分析之前,使用Levene's test检验数据是否满足方差齐性。如果观察到显著差异,则使用Bonferroni post hoc test分析差异显著性。
统计分析均采用SPSS19.0,数据以(平均值±标准差)表示,实验组与对照组有显著性差异和极显著差异用*(P<0.05)和**(P<0.01)在图上标注。
2 结果与分析
2.1 克氏原螯虾对沉水植物生物量的影响
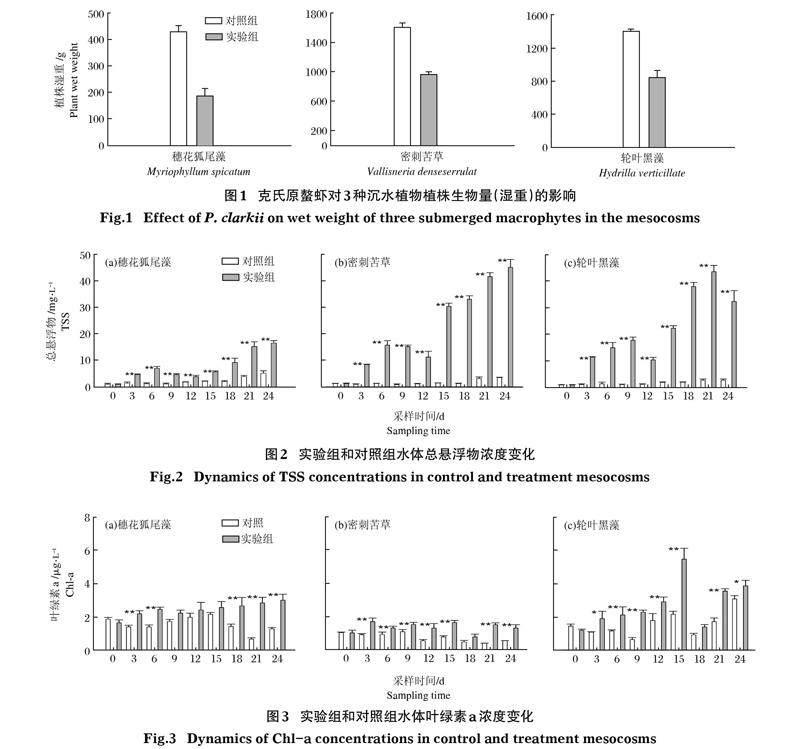
3种不同生长型沉水植物组在加入克氏原螯虾后,实验组沉水植物生物量较对照组均显著降低(P<0.05;图1),且实验组穗花狐尾藻和轮叶黑藻均只剩下茎,植物叶片全部被虾牧食。
在穗花狐尾藻组,实验结束时对照组沉水植物生物量为(432.0±22.0)g,而实验组内穗花狐尾藻生物量为(186.0±29.0)g,相对减少了45.7%;在密刺苦草组,实验结束时对照组沉水植物生物量为(1 610.0±64.0)g,而实验组生物量湿重降低,均值为(972.0±104.0)g,相对减少了39.0%;在轮叶黑藻组,实验结束时对照组沉水植物生物量为(1 400.0±32.0) g,而实验组生物量湿重降低,均值为(849.0±81.0)g,相对减少了60.5%。
2.2 克氏原螯虾对总悬浮物和叶绿素a的影响
沉水植物在加入克氏原螯虾后(图2),水体总悬浮物浓度均极显著升高(P<0.01),各采样时段总悬浮物浓度实验组均极显著高于对照组(P<0.01)。实验结束时,密刺苦草组水体总悬浮浓度极显著高于轮叶黑藻组(P<0.01),而轮叶黑藻组极显著高于穗花狐尾藻组(P<0.01)。
在加入克氏原螯虾后(图3),沉水植物实验组水体叶绿素a浓度相比对照组均极显著升高(P<0.01)。实验结束时,穗花狐尾藻组和轮叶黑藻组Chl-a浓度极显著高于密刺苦草组(P<0.01),而穗花狐尾藻和轮叶黑藻组间无显著差异。
2.3 克氏原螯虾对水体氮磷的影响
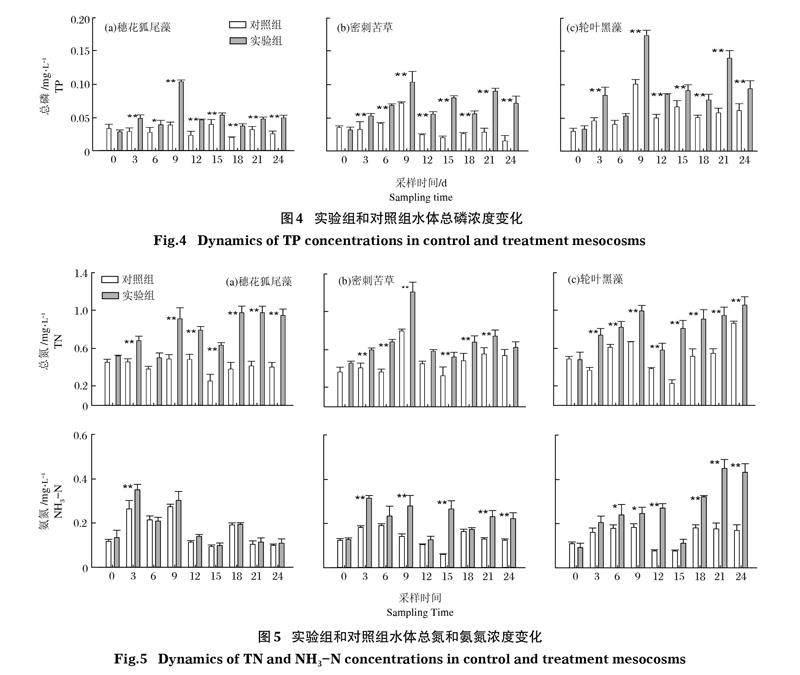
2.3.1 总磷 沉水植物在加入克氏原螯虾后,实验组水体总磷浓度均极显著升高(P<0.01)(图4)。除轮叶黑藻组第6天实验组和对照组总磷无显著区别,在加入克氏原螯虾后,各采样时段实验组的总磷浓度均极显著高于对照组(P<0.01)。实验结束时,穗花狐尾藻和密刺苦草组间水体总磷无差异,而密刺苦草和轮叶黑藻组间也无差异,但轮叶黑藻组极显著高于穗花狐尾藻组(P<0.01)。
2.3.2 总氮和氨氮 沉水植物在加入克氏原螯虾后,实验组水体总氮浓度均极显著升高(P<0.01)(图5)。穗花狐尾藻组与对照组在第6天无差异,密刺苦草组和对照组在第12天无差异,其他时间段3种沉水植物的实验组总氮浓度均极显著高于对照组(P<0.01)。实验结束时,穗花狐尾藻和轮叶黑藻组间总氮无差异,但二者极显著高于密刺苦草组(P<0.01)。
在加入克氏原螯虾后,穗花狐尾藻组和对照组水体氨氮浓度除第3天外均无显著差异,而密刺苦草和轮叶黑藻组氨氮浓度多数时间均显著(P<0.05)或极显著(P<0.01)高于各自对照组,其中密刺苦草和轮叶黑藻组间氨氮浓度无显著差异。实验结束时,轮叶黑藻组水体氨氮浓度显著高于密刺苦草组,而密刺苦草组极显著高于穗花狐尾藻组(P<0.01)。
3 讨论
克氏原螯虾对3种不同生长型沉水植物生长均有负面影响,不仅显著降低了沉水植物生物量,而且导致植物叶片严重受损。尽管不同生长型沉水植物所在水体营养盐和悬浮物浓度变化趋势有区别,克氏原螯虾进入水体后均导致水体悬浮物浓度、浮游植物生物量和营养盐浓度极显著上升,可见克氏原螯虾入侵后不利于草型清水态系统稳定。
3.1 克氏原螯虾对沉水植物的牧食选择性
作为淡水水体的生态系统工程师(Jones et al,1994),克氏原螯虾对大型植物的影响,既有直接牧食、又有生物扰动(Matsuzaki et al,2009)。克氏原螯虾能通过在底泥挖洞导致沉水植物悬浮,又能用螯钳直接切割沉水植物(van der Wal,2011;Haubrock et al,2019)。本研究中,实验期间3种生长型沉水植物均有大量折断的叶片和植物根系漂浮在水面上。在实验结束时,轮叶黑藻、穗花狐尾藻叶片脱落较严重,仅剩下茎;密刺苦草茎短不明显,但叶片折断较多。尽管穗花狐尾藻、轮叶黑藻和密刺苦草植物的结构(形态和硬度)、营养价值和次生代谢物等存在差异(Cronin et al,2002;杨诚等,2021),但3种植物均不能抵挡克氏原螯虾的牧食,植物因扰动导致茎叶折断。短期来说,冠层型穗花狐尾藻和直立型轮叶黑藻更易遭到破坏而消亡;长期来看,克氏原螯虾对3种生长型沉水植物的破坏均具有毁灭性。在自然水体中,克氏原螯虾可能主要是通过牧食过程中的生物扰动和机械撕碎行为间接影响水下植被,虽然克氏原螯虾对植物的牧食具有选择性(Cronin et al,2002;Gherardi & Barbaresi,2008;Matsuzaki et al,2009),但其对大型植物的破坏可能并无选择性(van der Wal,2011)。Carreira等(2014)认为克氏原螯虾可能会从群落中移除大型水生植物物种,从最喜欢的物种到最不喜欢的物种,最终导致植物全部消亡;此外,也有研究表明,杂食性克氏原螯虾会根据食物的可获得性而改变食性偏好,这种选择性取食对沉水植物多样性会产生强烈的负面影响(Gherardi & Acquistapace,2007;Usio et al,2009)。
3.2 克氏原螯虾对水生态的影响及作用机制
克氏原螯虾对水体营养盐的影响可来自扰动导致的底泥再悬浮,沉水植物生物量下降也会削弱对水体净化能力。本研究中,在放入克氏原螯虾之前,3种沉水植物覆盖度均高,植物生长良好,水质清澈,其水体营养盐较低且无显著差异。然而,在放入克氏原螯虾后,水体快速变浑浊。第3天时,3种生长型沉水植物的总悬浮物、叶绿素a、总磷、总氮、氨氮均显著升高,表明克氏原螯虾能导致水体悬浮物浓度和营养盐快速升高;第24天时,除穗花狐尾藻组与对照组氨氮无显著差异,加入克氏原螯虾的实验组悬浮物浓度、叶绿素a和营养盐浓度均显著高于对照组;而对不同生长型实验组间比较,第24天密刺苦草组总悬浮物浓度显著高于轮叶黑藻组,而轮叶黑藻组显著高于穗花狐尾藻组,表明冠层型和直立型沉水植物对悬浮物有更好的吸附作用。已有研究表明,不同生长型沉水植物对水体营养盐净化能力存在差异,金树权等(2017)认为水体氮磷的吸收效率为:轮叶黑藻(直立型)>金鱼藻(冠层型)>苦草(底栖型)>穗状狐尾藻(冠层型)>微齿眼子菜(直立型),且沉水植物吸附、提高微生物转化等作用对氮磷从水体去除的贡献率要大于直接吸收作用;任文君等(2011)研究表明,金鱼藻和黑藻对水体总磷主要为超量吸收,蓖齿眼子菜(直立型)和马来眼子菜(直立型)以吸附沉降为主,这与金树权等(2017)的研究结果有所不同;胡莲等(2008)通过围隔实验研究表明,狐尾藻对水体透明度的改善效果最好,金鱼藻对水体的增氧效果最好,苦草对总氮的吸收作用最明显,狐尾藻的去磷效果最好,狐尾藻和金鱼藻对有机质的去除效果较好。本研究中,尽管不同生长型沉水植物组在克氏原螯虾进入后的氮、磷营养盐变化趋势有区别,但3种生长型沉水植物的实验组中,氮、磷营养盐浓度均显著高于对照组。
目前,我国多数浅水富营养化湖泊治理的目标是恢复以沉水植物为主的清水态系统,而克氏原螯虾(van der Wal et al,2013)、福寿螺(杨诚等,2021)和罗非鱼(姚洁和刘正文,2010)等外来入侵物种,往往会阻碍沉水植物的恢复,导致重建后的沉水植物再度消亡。因此,这些外来入侵水生动物进入河湖后对沉水植物建立种群和种群扩增的影响巨大,可能会严重破坏沉水植物种子的萌发、繁殖和生长。本文针对克氏原螯虾对不同生长型沉水植物及系统理化因子的研究将有助于认识其入侵风险。
参考文献
柴夏,刘从玉,谢超,等,2008. 生态系统修复与构建过程中的水生植物品种选择——以惠州西湖生态系统的修复与构建工程为例[J]. 污染防治技术, 21(2):18-20,115.
戴爱云,1983. 介绍一种水产资源——蝲蛄[J]. 动物学杂志, 18(3):51-53.
国家环境保护总局,2002. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社.
胡莲,万成炎,沈振锋,2008. 云龙湖水库沉水植物净化水质的原位围隔试验[J]. 水生态学杂志, 29(2):17-21.
江舒,庞璐,黄成,2007. 外来种克氏原螯虾的危害及其防治[J]. 生物学通报, 42(5):15-16.
金树权,周金波,包薇红,等,2017. 5种沉水植物的氮、磷吸收和水质净化能力比较[J]. 环境科学, 38(1):156-161.
刘正文,张修峰,陈非洲,等,2020. 浅水湖泊底栖-敞水生境耦合对富营养化的响应与稳态转换机理:对湖泊修复的启示[J]. 湖泊科学, 32(1):1-10.
任文君,田在锋,宁国辉,等,2011. 4种沉水植物对白洋淀富营养化水体净化效果的研究[J]. 生态环境学报, 20(2):345-352.
涂克环,施文,古旭,等,2013. 淀山湖不同生长型沉水植物分布及其性状研究[J]. 上海海洋大学学报, 22(6):895-902.
杨诚,康玉辉,高健,等, 2021. 外来种福寿螺(Pomacea canaliculata)对3种沉水植物的牧食偏好及水体理化因子的响应[J]. 湖泊科学, 33(4):1241-1253.
杨桐,袁昌波,曹特,等,2021. 洱海沉水植物群落恢复与优化初探[J]. 湖泊科学, 33(6):1777-1787.
姚洁,刘正文,2010. 罗非鱼对富营养型水体中沉水植物苦草的影响[J]. 生态环境学报, 19(5):1063-1067.
张燕萍,陈文静,方春林,等,2014. 鄱阳湖区克氏原螯虾捕捞种群结构分析[J]. 江西水产科技, (2):6-9.
朱金格,胡维平,刘鑫,等,2019. 湖泊水动力对水生植物分布的影响[J]. 生态学报, 39(2):454-459.
曾珍英,吴和平,江艳,等,2013. 外来物种对鄱阳湖国家级自然保护区的入侵及其影响[J]. 能源研究与管理, (4):15-18.
Angeler D G, Sánchez-Carrillo S, García G, et al, 2001. The influence of Procambarus clarkii (Cambaridae, Decapoda) on water quality and sediment characteristics in a Spanish floodplain wetland[J]. Hydrobiologia, 464(1):89-98.
Aquiloni L, Brusconi S, Cecchinelli E, et al, 2010. Biological control of invasive populations of crayfish: the European eel (Anguilla anguilla) as a predator of Procambarus clarkii[J]. Biological Invasions, 12(11):3817-3824.
Carreira B M, Dias M P, Rebelo R, 2014. How consumption and fragmentation of macrophytes by the invasive crayfish Procambarus clarkii shape the macrophyte communities of temporary ponds[J]. Hydrobiologia, 721(1):89-98.
Chambers P A, Kalff J, 1987. Light and nutrients in the control of aquatic plant community structure: I. In situ experiments[J]. Journal of Ecology, 75:611-619.
Crandall K A, Buhay J E, 2008. Global diversity of crayfish (Astacidae, Cambaridae, and Parastacidae——Decapoda) in freshwater[J]. Hydrobiologia, 595(1):295-301.
Cronin G, Lodge D M, Hay M E, et al, 2002. Crayfish feeding preferences for freshwater macrophytes:the influence of plant structure and chemistry[J]. Journal of Crustacean Biology, 22(4):708-718.
Gheradi F, 2006. Crayfish invading Europe: the case study of Procambarus clarkii[J]. Marine & Freshwater Behaviour & Physiology,39(3):175-191.
Gherardi F, Acquistapace P, 2007. Invasive crayfish in Europe: the impact of Procambarus clarkii on the littoral community of a Mediterranean lake[J]. Freshwater Biology, 52:1249-1259.
Gherardi F, Barbaresi S, 2008. Feeding opportunism of the red swamp cray?sh, Procambarus clarkii, and invasive species[J]. Freshwater Cray?sh, 16:77-85.
Haubrock P J, Inghilesi A F, Mazza G, et al, 2019. Burrowing activity of Procambarus clarkii on levees:analysing behaviour and burrow structure[J]. Wetlands Ecology and Management, 27:497-511.
Jana S, Choudhuri M A, 1979. Photosyntheic, photorespiratory and respiratory behaviour of three submersed aquatic angiosperms[J]. Aquatic Botany, 7:13-19.
Jones C G, Lawton J H, Shachak M, 1994. Organisms as ecosystem engineers[J]. Oikos, 69:373-386.
Knopik J M, Newman R M, 2018. Transplanting aquatic macrophytes to restore the littoral community of a eutrophic lake after the removal of common carp[J]. Lake and Reservoir Management, 34(4):365-375.
Matsuzaki S S, Usio N, Takamura N, et al, 2009. Contrasting impacts of invasive engineers on freshwater ecosystems: an experiment and meta-analysis[J]. Oecologia, 158:673-686.
Oficialdegui F J, Sánchez M I, Clavero M, 2020. One century away from home: how the red swamp crayfish took over the world[J]. Reviews in Fish Biology and Fisheries, 30(1):121-135.
Scheffer M, Jeppesen E, 2007. Regime shifts in shallow lakes[J]. Ecosystems, 10(1):1-3.
Strand J A, Weisner S E B, 2001. Morphological plastic responses to water depth and wave exposure in an aquatic plant (Myriophyllum spicatum)[J]. Journal of Ecology, 89:166-175.
Usio N, Kamiyama R, Saji A, et al, 2009. Size-dependent impacts of invasive alien crayfish on a littoral marsh community[J]. Biological Conservation, 142(7):1480-1490.
van der Wal J E M, 2011. Effects of crayfish on the establishment of macrophytes in a shallow peat lake[D]. Wageningen: Wageningen UR.
van der Wal J E M, Dorenbosch M, Immers A K, et al, 2013. Invasive crayfish threaten the development of submerged macrophytes in lake restoration[J]. PLOS ONE, 8:e78579.
Yang Y Q, Yu D, Li Y K, et al, 2004. Phenotypic plasticity of two Submersed plants in responses to flooding[J]. Journal of Freshwater Ecology, 19:69-76.
Yi S K, Li Y H, Shi L L, et al, 2018. Characterization of population genetic structure of red swamp crayfish, Procambarus clarkii, in China[J]. Scientific Reports, 8(1):5586.
Zhang X F, Mei X Y, Gulati R D, 2017. Effects of omnivorous tilapia on water turbidity and primary production dynamics in shallow lakes: implications for ecosystem management[J]. Reviews in Fish Biology and Fisheries, 27(1):245-254.
(责任编辑 万月华)
Effect of Procambarus clarkii on Clearwater Lakes
with Submerged Macrophytes
LIU Wei1, ZHANG Ze‐hui1, GAO Jian1, YUAN Hong2, WANG Ming2, XIONG Wen1
(1. Key Laboratory of Ecological Remediation of Lakes and Rivers and Algal Utilization of Hubei Province,
Innovation Demonstration Base of Ecological Environment Geotechnical and Ecological
Restoration of Rivers and Lakes, School of Civil and Environment,
Hubei University of Technology,Wuhan 430068, P.R. China;
2. College of Eco-Environmental Engineering, Guizhou Minzu University, Guiyang 550025, P.R. China)
Abstract:Procambarus clarkii, native to the southern United States and north-eastern Mexico, is the most widely distributed invasive species globally and the most devastating to freshwater ecosystems. In this study, we investigated the effects of red swamp crayfish (P. clarkii) on the water of clear shallow lakes planted with three submerged macrophytes:Hydrilla verticillate, Myriophyllum spicatum, and Vallisneria denseserrulata. Our aim was to better understand the ecological risks posed by P. clarkii. From October 7 to November 1 of 2020, controlled experiments were conducted in large bucket mesocosms to simulate clearwater systems with macrophytes. Each plant species was tested separately, with and without crayfish, giving a total of 6 groups (3 treatment groups with crayfish and 3 control groups without crayfish). Water samples were collected each week to determine the physicochemical properties of the water and the wet biomass of the submerged macrophytes was measured at the beginning and end of the test. The macrophyte biomass in all treatment groups decreased significantly (P<0.05) compared to control groups, but the effects on H. verticillata and V. denseserrulata were larger than the effect on M. spicatum, with respective decreases in biomass of 60.5%, 45.7%, 39.0%. P. clarkii grazing and defecation disturbed the sediments and significantly increased total suspended solids, nutrients and chlorophyll a, transforming the water from a clearwater state to a turbid state. To summarize, invasive P. clarkii pose a significant risk to the stability of grass-type clearwater lakes.
Key words:Procambarus clarkii; Hydrilla verticillate; Vallisneria denseserrulata; Myriophyllum spicatum; growth form; clearwater lakes
收稿日期:2021-11-15 修回日期:2022-09-30
基金项目:湖北省自然科学基金面上项目(2020CFB537)。
作者简介:刘伟,1996年生,男,硕士研究生,研究方向为湖泊生态修复与保护。E-mail:1508578076@qq.com
通信作者:高健,1981年生,男,博士,副教授,主要从事湖泊生态学与生态修复教研工作。E-mail: jgao13@hotmail.com

