循环水养殖系统中高毒力嗜水气单胞菌的鉴定与药敏试验
焦锦彪 黄雷 林锋 姚嘉赟 袁雪梅 苏胜齐 张海琪
摘要:为探究中华鳖(Pelodiscus sinensis)循环水养殖过程中出现体表穿孔和溃疡的病因,对患病中华鳖的肝、脾、肺和肾等部位取样并进行病原菌分离及革兰氏染色,利用16S rRNA测序和生化鉴定相结合进行细菌鉴定,通过毒力基因PCR检测和人工回感试验评估细菌的致病性,以纸片扩散法评估几种抗生素的抑菌效果,利用琼脂打孔法评估中药提取物的抑菌效果。结果显示,从病鳖的脏器中分离到一株优势菌AH0421,该菌为革兰氏阴性菌,菌体呈短杆状;菌株AH0421与嗜水气单胞菌(Aeromonas hydrophila)模式菌株 ATCC 7966的16S rRNA序列相似性高达99.66%。菌株AH0421能利用葡萄糖、蔗糖和麦芽糖,具有O/129耐受性,其携带act、aerA、aha、ahh、ahp、ahpA、alt、ast、hlyA、lip、ompA毒力基因。回感试验出现与自然发病相似病症,菌株AH0421半致死浓度(LC50)为1.7×106 CFU/mL。中药五味子提取物、诺氟沙星、多西环素、恩诺沙星、新霉素以及头孢克肟、头孢曲松等头孢类抗生素对该菌有较强的抑制作用。研究表明,五味子和多数头孢类抗生素可作为治疗菌株AH0421感染的参考药物。
关键词:嗜水气单胞菌;中华鳖;中草药;抗生素;循环水养殖
中图分类号:S947.1+2 文献标志码:A 文章编号:1674-3075(2023)03-0136-08
中华鳖(Pelodiscus sinensis)是我国重要的淡水养殖品种,随着集约化养殖的发展,养殖环境不断恶化,各类疾病频频暴发,已严重阻碍中华鳖养殖业的健康发展。嗜水气单胞菌(Aeromonas hydrophila)是对中华鳖养殖危害最大的细菌性病原之一,可引发穿孔病、腐皮病等,主要表现为背腹部穿孔、皮肤糜烂、肝脏充血等症状,具有传染性强、死亡率高的特点(郑杰夫等,2016);嗜水气单胞菌的致病性与毒力因子有关,主要包括外毒素、外膜蛋白、胞外蛋白酶、脂多糖等(Nhinh et al,2021)。嗜水气单胞菌的外毒素普遍具有溶血性、细胞毒性及肠毒性,会破坏水生动物呼吸和消化器官等组织,造成机体抵抗力下降,从而导致肌体出现出血性败血症等疾病,进而造成其死亡(殷海成,2007)。
在养殖过程中,中华鳖嗜水气单胞菌源疾病的防控主要以施用抗生素和消毒剂为主。朱凝瑜等(2017)对10株分离自患病中华鳖的嗜水气单胞菌进行了耐药性研究,发现新霉素、多西环素、诺氟沙星等对嗜水气单胞菌均具有较强抑制作用。中草药因其具有毒副作用小、残留少的特点,被广泛用于增强水产动物免疫功能以及嗜水气单胞菌感染等防治(曹丽萍等,2011)。He等(2020)研究发现,在饲料中添加100 mg/kg的栀子苷可显著增强鲫的血清溶菌酶活性,并能提高其在嗜水气单胞菌感染下的存活率;黄东宇(2019)将白藜芦醇、姜黄素和黄芩多糖进行配伍,可显著提高嗜水气单胞菌感染下异育银鲫的抗氧化能力和存活率。目前,中药主要用在鱼病防治中,鲜有用于抗鳖源嗜水气单胞菌的报道。
室内循环水养殖系统具有产量高、污染少等特点,近年来在名优水产品养殖中的应用日趋广泛(李红艳等,2020)。由于循环水养殖集约化程度高,养殖病害问题也愈发突出。因此,建立针对该系统下的病原鉴定技术和病害防控方法显得尤为重要。2021年5月,浙江省湖州市某循环水养殖场的中华鳖出现体表穿孔、溃烂等症状并伴随大规模死亡,随即采集了病鳖样品进行病原菌分离、鉴定和毒力因子检测,通过回感试验确定病原菌的致病性,最后筛选出多种对病原有体外抑制作用的抗生素药物和中草药,以期为该病的诊断与治疗提供参考依据。
1 材料与方法
1.1 试验材料
患病和健康中华鳖均取自浙江省湖州市某中华鳖循环水养殖场。患病个体(约250 g/只)具有体表溃烂和背腹部穿孔等症状;健康个体(约200 g/只)活力、摄食正常,经检测无腮腺炎病毒、黄病毒、虹彩病毒等常见病毒感染,取内脏组织研磨后涂布未发现细菌感染。
TSA、TSB培养基购自青岛海博生物技术有限公司,革兰氏染色试剂盒购自北京索莱宝公司,细菌基因组DNA提取试剂盒、DNA Marker购自天根生化科技(北京)有限公司,PCR试剂盒购自New England Biolab公司。试验涉及引物的合成及细菌16S rRNA基因测序由苏州金唯智公司完成,药敏纸片购自杭州微生物试剂有限公司,中草药购自杭州华东中药饮片有限公司。
1.2 细菌分离与镜检
观察和记录患病中华鳖的体表症状。剖检病鳖,观察内脏器官病变情况,包括肝脏、脾脏、肾脏、肠道等,并拍照记录。在无菌条件下解剖患病中华鳖,获取肝、脾、肺、肾等病灶组织。部分组织进行核酸提取,用于腮腺炎病毒、黄病毒、虹彩病毒等常规检测;另取部分组织分别研磨后,划线接种于TSA平板,30 ℃培养48 h。挑取优势细菌菌落划线接种于TSA平板,进行菌种纯化培养,观察菌落形态。参照张娴(2014)的方法对优势细菌菌落进行革兰氏染色,在显微镜下放大1 000倍镜检。
1.3 细菌鉴定
1.3.1 16S rRNA基因扩增与测序 用细菌基因组DNA试剂盒提取分离细菌的DNA,通过NanoDrop 2000检测DNA浓度及纯度。采用细菌16S rRNA基因通用引物对细菌DNA进行聚合酶链式反应(PCR)扩增(表1)。设置25 μL的PCR反应体系,包括Taq Master Mix (2×) 12.5 μL,dd H2O 9.5 μL,正反向引物各1.0 μL,DNA模板1.0 μL。PCR反应条件为94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 40 s,35个循环;72 ℃延伸10 min。扩增产物送至苏州金唯智公司测序,下机序列输入EZbiocloud数据库,进行序列比对以获得物种分类信息;用MEGA7.0软件的邻接法(neighbor-joining, NJ)构建系统发育树。
1.3.2 生理生化鉴定 取试验纯化后的分离菌,利用梅里埃全自动鉴定仪VITEK进行生化反应,包括葡萄糖发酵,麦芽糖、蔗糖、甘露醇和柠檬酸盐利用以及O/129耐受等指标。鉴定依据参考《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》(布坎南,1984;东秀珠和蔡妙英,2001)。阳性菌株参考何亮银等(2022)从大黄鱼所分离的嗜水气单胞菌菌株NDLc-P。
1.4 毒力基因检测
以细菌基因组DNA为模板,参照1.3.1中的PCR反应体系与反应条件,稍作调整后,对分离菌的11种毒力基因进行扩增(表1)。PCR产物经1%琼脂糖凝胶电泳检测分析。
1.5 回感试验
试验设置4个不同浓度的细菌攻毒组以及1个未攻毒对照组,每个养殖缸随机放入10只健康中华鳖。将待测菌在30 ℃下培养12 h(浓度为6.8×109 CFU/mL),5 000 r/min离心5 min收集菌体,用无菌磷酸缓冲液(PBS)洗涤3次并重悬菌液,之后用PBS进行连续10倍梯度稀释,得到用于攻毒的4个菌悬液浓度(6.8×107、6.8×106、6.8×105、6.8×104 CFU/mL)。攻毒组每只鳖腹腔注射0.2 mL相应浓度的菌悬液,对照组注射等量的PBS。连续2周观察中华鳖的体表症状、活力等,记录死亡情况,用改良寇氏法(刁菁等,2018)计算半致死浓度(LC50)。选择活力减弱、四肢无力、浮于水面的濒死中华鳖进行解剖,观察内脏器官的病变情况,并分离鉴定其优势细菌。
1.6 药敏试验
采用琼脂纸片扩散法测定各类抗生素药物的抗菌活性,具体步骤如下:取100 μL培养12 h的菌液(约6×109 CFU/mL)均匀涂布于TSA培养基上,用无菌镊子夹取14种常用药敏纸片贴在含有菌液的培养基表面,30 ℃培养24 h,测定抑菌圈直径。
1.7 抑菌中草药筛选
1.7.1 中草药活性物提取 称取金银花、黄芩、连翘、大黄、五味子粉末各5 g,以6:100加入75%乙醇,55 ℃水浴孵育过夜,4 000 r/min离心10 min后取上清液,用旋转蒸发仪蒸去乙醇后定容至10 mL,即获得浓度为500 mg/mL的中药提取物母液。
1.7.2 抑菌试验 参考向双云等(2016)的琼脂平板打孔法,在无菌操作台中,将100 μL培养12 h的菌液均匀涂布于TSA平板上,用7 mm直径打孔器在平板上打孔,分别吸取等量的不同药物提取液加于孔内,正置平板至药液完全吸收后倒置培养12 h,观察细菌生长情况;同样,将有效药物按2倍梯度稀释至不同浓度(500、250、125、62.5、31.25 mg/mL)后加于孔内,培养12 h后记录抑菌圈直径。
2 结果与分析
2.1 自然患病的中华鳖症状
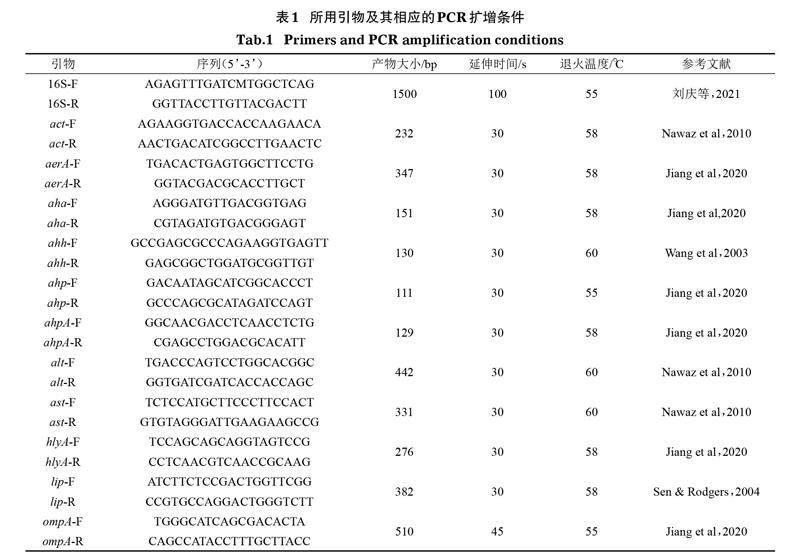
自然患病中华鳖个体背腹甲存在白斑和孔洞,背部出现溃烂,腹腔内有血性腹水,内脏均有明显的出血或充血,其中肝脏有明显的充血症状,充血点呈花斑状,肠道粘膜充血无弹性(图 1)。
2.2 优势细菌形态特征
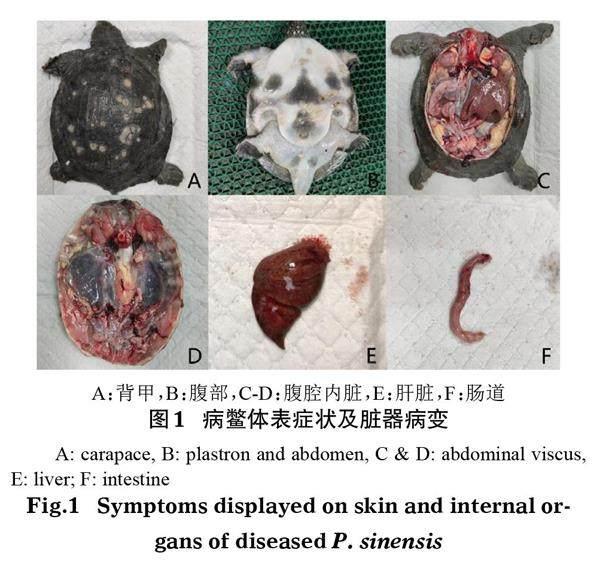
病毒检测显示,腮腺炎病毒、黄病毒、虹彩病毒在病鳖组织中均为阴性,因此怀疑可能是细菌感染。从肝、脾、肺、肾中分离到的优势细菌菌落形态一致,呈圆形、米白色半透明状,表面光滑湿润,直径1~2 mm(图 2-A);进一步将优势菌进行革兰氏染色和镜检,发现该菌为革兰氏阴性菌,呈两端钝圆的短杆状,大多单个排列,少有双个排列(图 2-B),将该株菌命名为AH0421。
2.3 细菌鉴定
2.3.1 16S rRNA基因 菌株AH0421的16S rRNA基因扩增产物大小约为1 500 bp,与EZbiocloud数据库中的Aeromonas hydrophila ATCC 7966(CP000462)序列相似性最高,达到99.66%;系统进化树显示,菌株AH0421与Aeromonas hydrophila ATCC 7966聚为同一分支(图 3)。
2.3.2 生理生化特征 生理生化鉴定结果显示,该分离菌能利用葡萄糖、蔗糖、麦芽糖、甘露糖、甘露醇,可利用柠檬酸盐,并具有O/129耐受性,而L-阿拉伯醇、H2S产生、α-葡萄糖苷酶、α-半乳糖苷酶、鸟氨酸脱羧酶、赖氨酸脱羧酶等指标显示为阴性(表 2)。AH0421的生理生化特征与大黄鱼源嗜水气单胞菌参考菌株NDLc-P(何亮银等,2022)基本一致。
2.4 毒力基因鉴定
毒力基因PCR扩增结果显示,act、aerA、aha、ahh、ahp、ahpA、alt、ast、hlyA、lip和ompA的毒力基因扩增结果呈阳性,其中ompA扩增出的条带较弱(图 4)。
2.5 分离菌的致病性
人工感染发病的中华鳖活力减弱并出现死亡,解剖后可见明显腹水,肝脏和肠道均存在充血,肠道韧性较差,与自然发病的病症一致(结果未展示)。从人工感染死亡的中华鳖脏器中再次分离到优势菌,其菌落形态以及16S rRNA基因序列信息与AH0421一致。中华鳖的死亡率与细菌攻毒浓度呈正相关,其中6.8×107 CFU/mL浓度感染组的死亡率为100%,6.8×106、6.8×105和6.8×104 CFU/mL浓度感染组的死亡率分别为70%、30%和10%,对照组无死亡(图5)。基于改良寇氏法计算得出该菌对中华鳖的半致死浓度(LC50)为1.7×106 CFU/mL。
2.6 药敏试验
菌株AH0421对头孢克肟、头孢曲松、拉氧头孢、头孢哌酮和头孢西丁等头孢类抗生素以及诺氟沙星、多西环素、恩诺沙星、新霉素等高度敏感,对氟苯尼考中度敏感,对头孢氨苄、新生霉素、复方新诺明、利福平表现出耐药性(表 3)。
2.7 中草药抑菌效果
中草药提取物的体外抑菌试验显示,金银花、连翘、大黄、黄芩4种中草药的提取物对该菌株AH0421无明显抑制作用(图 6-A);五味子提取物对菌株AH0421具有明显抑制作用,其最小抑菌浓度(MIC)为62.5 mg/mL(图 6-B)。
3 讨论
3.1 药敏与回感试验证实AH0421为嗜水气单胞菌
嗜水气单胞菌可通过消化道感染并引发人类食物中毒、肠胃炎和感染性腹泻等病症(Yamauchi et al,2021;Yuwono et al,2021),也能引发鱼类、蛙类、鳖等多种水生动物出现细菌性败血症(王贵平等,1999;Huys et al,2003)。本研究从患病中华鳖中分离到一株优势菌AH0421,经16S rRNA序列比对,发现该菌与Aeromonas hydrophila ATCC 7966相似度最高,初步判定为嗜水气单胞菌。菌株AH0421可利用D-葡萄糖、D-麦芽糖、D-甘露糖、D-甘露醇和蔗糖,β-半乳糖苷酶和ELLMAN呈阳性,这与何亮银等(2022)分离的大黄鱼源嗜水气单胞菌NDLc-P的生化特征基本一致,进一步说明菌株AH0421可能是嗜水气单胞菌。根据以往的研究报道,嗜水气单胞菌感染中华鳖主要表现为背腹部出现疮痂及孔洞、肝脏充血肿大(杜爱芳和蔡渭明,2000)以及体表皮肤糜烂坏死等症状(吴惠仙和杨志坚,2006)。这与本研究中自然患病的中华鳖症状一致,同时回感试验也得到了相似症状,这些结果表明此轮病害是由嗜水气单胞菌所引起。
3.2 菌株AH0421对水生动物的毒力效应
在人工感染试验中,菌株AH0421对中华鳖的半致死量为1.7×106 CFU/kg,低于之前的多项报道(徐先栋等,2016;左洋洋等,2019),说明菌株AH0421对中华鳖的毒力较强。本研究中,嗜水气单胞菌AH0421携带act、aerA、aha、ahh、ahp、ahpA、alt、ast、hlyA、lip、ompA毒力基因,多于以往鳖源嗜水气单胞菌所携带的毒力基因数量(黄钧等,2013)。aerA、ahpA、hlyA、act、alt等基因被认为是嗜水气单胞菌毒力强的重要指标。朱大玲等(2006)发现对鲫致病力强的嗜水气单胞菌菌株均表现为aerA、hlyA、ahpA基因阳性;陈婷婷(2014)研究也表明,嗜水气单胞菌对团头鲂的致病力与aerA、ahpA和hlyA等毒力基因存在显著相关性;刘杰等(2015)研究认为包含hly和act 4种以上毒力基因的嗜水气单胞菌为黄沙鳖的高致病性菌株。据报道,气溶素aer可破坏宿主细胞的膜通透性屏障,导致细胞死亡(Dong et al,2021);溶血素hly可通过插入细胞膜脂质双层并产生跨膜孔进而破坏细胞膜(Bhakdi et al,1986);act具有溶血功能,其可在红细胞细胞膜上形成孔洞导致裂解(Tomás,2012)。在本研究中,嗜水气单胞菌AH0421感染中华鳖也出现了血性腹水、肝脏和肠道充血等症状,这与aer、hly和act的致病作用相吻合,说明菌株携带的这些毒力基因可能发挥了致病作用。
3.3 抗生素类可用于中华鳖嗜水气单胞菌病治疗
抗生素是中华鳖中最常用的病害防治药物,对嗜水气单胞菌病具有良好的作用效果。在体外抑菌试验中,冷闯等(2012)认为中华鳖肝脏中分离的嗜水气单胞菌LCDJYC01对头孢曲松高度敏感,而对利福平表现出耐药性;林锋等(2014)从中华鳖肺部分离到的菌株对头孢西丁敏感,但对复方新诺明产生耐药性;本研究发现头孢曲松和头孢西丁对嗜水气单胞菌AH0421具有抑制性,而利福平和复方新诺明则无抑制效果,与上述研究结果一致。本研究还发现,嗜水气单胞菌AH0421也对恩诺沙星、多西环素、头孢克肟、新霉素、诺氟沙星高度敏感,这与异育银鲫(张荧荧等,2020)、鲫(高东民等,2017)中分离的嗜水气单胞菌的药敏试验结果一致。在中华鳖的体内药物试验方面,王高学和王英珍(1998)通过腹腔注射硫酸庆大霉素、硫酸丁胺卡那霉素和复方诺氟沙星,对嗜水气单胞菌引起的穿孔病起到良好的治疗效果。这些研究进一步说明,抗生素药物可用于中华鳖嗜水气单胞菌病的治疗。本研究药敏试验中涉及到水产养殖禁用药,仅限用于试验室水平对细菌的耐药性研究,在养殖生产中应严格依照法律法规选择合适药物并科学用药。
3.4 五味子是治疗嗜水气单胞菌的绿色候选药物
由于抗生素药物存在药物残留、耐药性等问题,寻求绿色安全的抗生素替代药物势在必行。中草药作为一种天然来源的药物,具有毒副作用小、无抗药性的特点,已被广泛用于水产病害的防治中(张平,2020)。在体外试验中,喻运珍等(1999)研究认为鳖源嗜水气单胞菌对五味子高度敏感;张文青等(2012)也发现五味子对嗜水气单胞菌产生体外抑制作用,并且与儿茶、五倍子、乌梅配伍的作用效果更好。在体内试验中,Wang等(2016)研究认为饲喂五味子多糖可显著提高鲫抵抗嗜水气单胞菌的能力。与这些研究结果一致,本研究同样发现五味子的乙醇提取物对嗜水气单胞菌具有明显的抑制效果;除抗病功能外,五味子还能增强水产养殖动物的免疫力,改善动物肠道菌群的平衡(徐良梅等,2008;路晶晶等,2018)。这些研究均表明,五味子可作为水产动物嗜水气单胞菌病治疗的绿色候选药物。
参考文献
布坎南,1984. 伯杰细菌鉴定手册[M]. 北京:科学出版社:482-486.
曹丽萍,丁炜东,殷国俊,2011. 玫瑰茄水提物对t-BHP诱导原代培养异育银鲫肝细胞损伤生化指标的影响[J]. 浙江农业学报, 23(2):273-277.
陈婷婷,2014. 团头鲂源嗜水气单胞菌流行病调查及致病性、耐药性研究[D]. 武汉:华中农业大学.
刁菁,李乐,王晓璐,等,2018. 虹鳟致病性杀鲑气单胞菌的分离鉴定及其毒力因子的检测[J]. 大连海洋大学学报, 33(4):435-443.
东秀珠,蔡妙英,2001. 常见细菌系统鉴定手册[M]. 北京:科学出版社.
杜爱芳,蔡渭明,2000. 鳖穿孔病病原的分离鉴定与药敏试验[J]. 浙江农业学报, 12(1):42-45.
高东民,宋亚娇,吕爱军,等,2017. 鱼源嗜水气单胞菌的分离鉴定及药敏试验[J]. 黑龙江畜牧兽医, 61(5):149-152.
何亮银,周逢芳,史晓丽,等,2022. 大黄鱼致病嗜水气单胞菌的分离鉴定及其多克隆抗体制备[J]. 水产科学:41(1):69-75.
黄东宇, 2019. 3种中草药提取物对异育银鲫抗嗜水气单胞菌感染作用研究[D]. 南京:南京农业大学.
黄钧,黄艳华,胡大胜,等,2013. 黄沙鳖白底板病病原菌的分离鉴定及6种毒力基因检测[J]. 水生生物学报, 37(5):844-854.
冷闯,邓舜洲,张文波,等,2012. 中华鳖致病性嗜水气单胞菌的分离鉴定及药敏试验[J]. 动物医学进展, 33(2):124-129.
李红艳,刘天红,姜晓东,等,2020. 工厂化循环水养殖珍珠龙胆石斑鱼营养成分、食用安全性和质构特性分析[J]. 食品安全质量检测学报, 11(12):4083-4090.
林锋,刘莉,曹铮,等,2014. 鳖源致病性嗜水气单胞菌的分离与鉴定[J]. 湖北农业科学, 53(22):5487-5489.
刘杰,黄艳华,黄钧,等,2015. 黄沙鳖源嗜水气单胞菌的致病力与毒力基因型相关性[J]. 中国水产科学, 22(4):698-706.
刘庆,辛玉华,东秀珠,2021. 基于16S rRNA基因和基因组序列对细菌物种的初步鉴定[S]. 微生物实验手册,Bio-101:e2003932. DIO:10.21769/BioProtoc.2003932.
路晶晶,郭冉,齐国山,等,2018. 复方中草药对大菱鲆幼鱼生长性能及非特异性免疫指标的影响[J]. 大连海洋大学学报, 33(6):722-728.
王高学,王英珍,1998. 中华鳖穿孔病感染途径与防治技术的研究[J]. 西北农业大学学报, 26(5):89-92.
王贵平,周莉,虞蕴如,1999. 鳖嗜水气单胞菌败血症[J]. 水产科技情报, 26(4):165-168.
吴惠仙,杨志坚,2006. 浙江地区中华鳖腐皮病的病原与药敏研究[J] .科技通报, 22(2):165-168, 172.
向双云,周珍辉,李玉冰,等,2016. 8种中草药对大肠杆菌的体外抑菌试验[J]. 黑龙江畜牧兽医, (10):167-169.
徐良梅,李牧,李满雨,等,2008. 五味子提取物对肉仔鸡生长性能和肠道微生物的影响[J]. 中国饲料, 369(13):19-20, 28.
徐先栋,付辉云,饶毅,等,2016. 草鱼暴发性出血病病原分离、毒力基因检测与药敏分析[J]. 上海海洋大学学报, 25(3):350-358.
殷海成,2007. 水产动物嗜水气单胞菌病病理分析[J]. 信阳农业高等专科学校学报, (1):109-111.
喻运珍,艾桃山,张生元,等,1999. 中草药对中华鳖主要致病菌的抑菌作用[J]. 水利渔业, 19(1):36-37.
张平,2020. 中草药在水产养殖病害防治的研究与应用分析[J]. 现代农业研究, 26(4):125-126.
张文青,龚一富,金思,等,2012. 中草药及其配伍对嗜水气单胞菌的抑菌作用[J]. 渔业科学进展, 33(1):114-121.
张娴,2014. 微生物染色实验[J]. 科技信息, (1):140-143.
张荧荧,刘张淮,朱春艳,等,2020. 一例异育银鲫病源细菌的分离、鉴定及药敏试验[J]. 水产养殖, 41(10):1-4.
郑杰夫,张一柳,钟蕾,2016. 中华鳖源嗜水气单胞菌的研究进展[J]. 水产科学, 35(2):191-198.
朱大玲,李爱华,汪建国,等,2006. 嗜水气单胞菌毒力与毒力基因分布的相关性[J]. 中山大学学报(自然科学版), 45(1):82-85.
朱凝瑜,郑晓叶,曹飞飞,等,2017. 鳖源嗜水气单胞菌的耐药性研究[J]. 浙江农业学报, 29(9):1445-1450.
左洋洋,朱永肖,罗晓雯,等,2019. 草鱼源嗜水气单胞菌的毒力与耐药性检测[J]. 河南水产, (1):26-29, 39.
Bhakdi S N, Mackman N, Nicaud J M, et al, 1986. Escherichia coli hemolysin may damage target cell membranes by generating transmembrane pores[J]. Infection and Immunity, 52(1):63-69.
Dong J, Zhang L S, Liu Y T, et al, 2021. Luteolin decreases the pathogenicity of Aeromonas hydrophila via inhibiting the activity of aerolysin[J]. Virulence, 12(1):165-176.
He M S, Liu G Y, Liu Y H, et al, 2020. Effects of geniposide as immunostimulant on the innate immune response and disease resistance in crucian carp[J]. Aquaculture, 529(2):DOI:10.1016/j.aquaculture.2020.735713.
Huys G, Pearson M, K?mpfer P, et al, 2003. Aeromonas hydrophila subsp. ranae subsp. nov., isolated from septicaemic farmed frogs in Thailand[J]. International Journal of Systematic and Evolutionary Microbiology, 53(Pt 3):885-891.
Jiang Z Y, Li X X, Gao X J, et al, 2020. Pathogenicity of Aeromonas hydrophila causing mass mortalities of Procambarus clarkia and its induced host immune response[J]. Microbial Pathogenesis, 147:104376.
Nawaz M, Khan S A, Khan A A, et al,2010. Detection and characterization of virulence genes and integrons in Aeromonas veronii isolated from catfish[J]. Food Microbiology, 27(3):327-331.
Nhinh D T, Le D V, Van K V, et al, 2021. Prevalence, virulence gene distribution and alarming the multidrug resistance of Aeromonas hydrophila associated with disease outbreaks in freshwater aquaculture[J]. Antibiotics, 10(5):532.
Sen K, Rodgers M, 2004. Distribution of six virulence factors in Aeromonas species isolated from US drinking water utilities: a PCR identification[J]. Journal of Applied Microbiology, 97(5):1077-1086.
Tomás J M, 2012. The main Aeromonas pathogenic factors[J]. ISRN microbiology, DOI:10.5402/2012/256261.
Wang E L, Chen X, Wang K Y, et al, 2016. Plant polysaccharides used as immunostimulants enhance innate immune response and disease resistance against Aeromonas hydrophila infection in fish[J]. Fish & Shellfish Immunology, 59:196-202.
Wang G H, Clark C G, Liu C Y, et al, 2003. Detection and characterization of the hemolysin genes in Aeromonas hydrophila and Aeromonas sobria by multiplex PCR[J]. Journal of Clinical Microbiology, 41(3):1048.
Yamauchi Y, Arai M, Akizue N, et al, 2021. Colonoscopic evaluation of diarrhea/colitis occurring as an immune-related adverse event[J]. Japanese Journal of Clinical Oncology, 51(3):363-370.
Yuwono C, Wehrhahn M C, Liu F, et al, 2021. The isolation of Aeromonas species and other common enteric bacterial pathogens from patients with gastroenteritis in an Australian population[J]. Microorganisms (Basel), 9(7):1440.
(责任编辑 万月华)
Identification and Antibiotic Susceptibility Test of Hypervirulent Aeromonas
hydrophila in a Recirculating Aquaculture System
JIAO Jin‐biao1,2, HUANG Lei2, LIN Feng2, YAO Jia‐yun2, YUAN Xue‐mei2, SU Sheng‐qi1, ZHANG Hai‐qi2
(1. Conservation and Research Center for Aquatic Biodiversity in the Upper Reaches of Yangtze River,
Research Center of Fishery Resources and Environment, College of Fisheries,
Southwest University, Chongqing 400715, P. R. China;
2. Agriculture Ministry Key Laboratory of Healthy Freshwater Aquaculture,
Key Laboratory of Fish Health and Nutrition of Zhejiang Province,
Key Laboratory of Fishery Environment and Aquatic Product Quality and Safety of Huzhou City,
Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, P. R. China)
Abstract:In May 2021, serious mortality of cultured Pelodiscus sinensis (Chinese softshell turtle) occurred in a recirculating aquaculture farm in Huzhou, Zhejiang Province and the infected turtles presented symptoms of perforations and ulcers. To identify the pathogen infecting the turtles and find effective inspection and prevention strategies for the disease, the dominant pathogenic strain was isolated from the liver, spleen, lung and kidney of diseased P. sinensis and labeled the AH0421 strain. Bacterial identification of the AH0421 strain was accomplished through gram staining, 16S rRNA sequencing and determination of the virulence factor, as well as morphological, physiological and biochemical characteristics. The AH0421 strain is rod-shaped and gram-negative, and phylogenetic tree analysis, based on 16S rRNA gene sequences, shows that the AH0421 strain clusters with a strain of Aeromonas hydrophila ATCC 7966 with homology of 99.66%. The AH0421 strain can utilize glucose, sucrose, and maltose and has O/129 tolerance. According to PCR amplification, the AH0421 strain possesses 11 virulence genes, including act, aerA, aha, ahh, ahp, ahpA, alt, ast, hlyA, lip, and ompA. Simultaneously, an artificial infection study was carried out on healthy P. sinensis by injecting different concentrations of a bacterial suspension of the AH0421 strain identified as A. hydrophila. P. sinensis (body mass, ~200 g) were randomly assigned to four treatment groups (6.8×107, 6.8×106, 6.8×105 and 6.8×104 CFU/mL) and a control group, with 10 P. sinensis in each group. The symptoms of the artificially infected turtles were identical to those of naturally infected turtles, and the concentration of strain AH0421 that was lethal for half of the test turtles (LC50) was 1.7×106 CFU/mL. Drug susceptibility of the AH0421 strain was tested by the paper extension and agar punch methods using antibiotics and Chinese herbal medicines. The results show that the A. hydrophila strain is highly sensitive to the antibiotics norfloxacin, doxycycline, enrofloxacin, neomycin, cephalosporin, cefixime and ceftriaxone, and to the extract of Schisandra chinensis. In conclusion, A. hydrophila (AH0421) was the pathogen responsible for the mortality observed in the P. sinensis recirculating aquaculture system and cephalosporin antibiotics can be considered as therapeutic agents for the treatment of P. sinensis infected with A. hydrophila.
Key words:Aeromonas hydrophila; Pelodiscus sinensis; Chinese herbal medicine; antibiotic; recirculating aquaculture
收稿日期:2021-10-04 修回日期:2023-02-02
基金项目:浙江省“十四五”育种专项水产协作组项目(编号:2021C02069);浙江省“三农六方”科技协作计划项目(编号:2021SNLF026)。
作者简介:焦锦彪,1998年生,男,硕士研究生,研究方向为水产动物病害防治。E-mail:jiaojinb@126.com
通信作者:张海琪,1977年生,男,教授级高级工程师,主要从事水产育种和病害防治教研工作。E-mail:zmk407@126.com

