不同鱼类和采样时间的养殖池塘环境微生物群落研究
王淼 黄秋标 李庆勇 朱德兴 王瑞宁 衣萌萌 卢迈新
摘要:微生物群落是养殖池塘生态系统的重要组成部分,了解环境微生物群落结构和功能,可有针对性地进行养殖环境微生态调控。在不同季节采集尼罗罗非鱼(Oreochromis niloticus)和斑点叉尾鮰(Ictalurus punctatus)池塘水样,分析硝酸盐氮(NO3-N)、亚硝酸盐氮(NO2-N)、氨氮(NH4-N)、总氮(TN)和总磷(TP)等理化指标,利用Biolog-Eco微平板技术分析水体中微生物对各类碳源代谢的平均颜色变化率,利用高通量测序技术分析其菌群结构。结果表明,1月淡水养殖池塘水质和菌群结构不同于其他采样时间,养殖鱼类种类对池塘理化指标和微生物菌群结构影响不大。不同采样时间的池塘理化指标差异显著,同一采样时间不同养殖鱼类池塘的理化指标之间无显著差异。其中,1月尼罗罗非鱼池塘中的NH4-N含量高于其他月份,且显著高于4月和7月(P<0.05);1月TP含量显著高于4月、7月和10月(P<0.05)。1月斑点叉尾鮰池塘的TP和NO3-N含量显著高于其他3个月份(P<0.05)。Biolog-Eco微平板技术检测到尼罗罗非鱼和斑点叉尾鮰池塘中的微生物群落对碳水化合物和氨基酸的利用能力较强,对酚胺类化合物的利用能力较弱,4月斑点叉尾鮰池塘微生物对碳源的利用率高于尼罗罗非鱼池塘。高通量测序发现,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是尼罗罗非鱼和斑点叉尾鮰池塘的绝对优势菌门。hgcI clade、CL500-29 marine group和C39等是参与池塘水体氮磷循环的主要菌属。研究结果可为了解淡水养殖环境微生物群落结构与变化规律、更有针对性地构建养殖池塘尾水的生态化处理方法提供科学依据。
关键词:尼罗罗非鱼;斑点叉尾鮰;养殖池塘;微生物群落
中图分类号:X172 文献标志码:A 文章编号:1674-3075(2023)03-0120-09
我国淡水渔业以池塘养殖模式为主。2020年我国淡水池塘养殖面积为262.54万hm2,占淡水养殖总面积的52.09%,养殖水产品产量为2 279.76万t,占淡水养殖总产量的73.81%;广东省淡水池塘养殖面积占全国淡水池塘总面积的9.41%,淡水养殖产量为415.41万t,其中池塘养殖产量占91.74%(农业农村部渔业渔政管理局,2021)。由于养殖过程不换水或换水不及时,亚硝酸盐(NO2-N)、氨氮(NH4-N)等有害物质不断累积,进而引起水质恶化,导致鱼类病害暴发。研究表明,水产养殖病害的发生大都与水质恶化相关(胡大胜,2011)。水质恶化使致病微生物快速繁殖,引起养殖鱼类因应激而导致抗病能力下降。如何改善养殖环境已成为池塘养殖的研究热点,养殖尾水的生态化处理需求也日益增加,目前已在全国很多地区推广“三池两坝”池塘养殖尾水处理系统(刘梅等,2021)。淡水养殖尾水处理也是广东省2021年渔业主推技术,掌握池塘不同养殖种类和不同季节水质状况及菌群结构,可为养殖尾水的生态化处理提供科学依据。
水产养殖饲料中氮的利用率只有11.7%~27.7%(Zhang et al,2015),水体中大量的NH4-N堆积影响鱼类健康,且易污染环境,NH4-N经微生物的硝化作用会转化为NO2-N,过量的NO2-N同样会危害养殖鱼类(肖炜等,2020)。微生物作为分解者,转化养殖池塘生态系统中的有机物和无机物,调节养殖环境条件(魏祥东等,2002);另一方面,有害微生物的增殖可改变水体菌相组成、影响水质,并导致养殖鱼类粘膜系统菌群失衡,增加其感病风险。因此,微生物群落对养殖池塘生态系统的健康有着重要作用。传统的微生物培养等研究方法只能获得少量信息,无法全面揭示菌群结构。Biolog-ECO微平板技术操作方便,用来测定菌群对31种单一碳源的利用能力,从而反应样品中微生物群落结构组成和功能多样性,是目前研究养殖池塘微生物群落代谢特征的一种有效方法(杨莺莺等,2014; Kurten & Barkoh,2016;赵琼等,2020)。随着分子生物学的快速发展,高通量测序技术能够更加全面准确地获得样品中微生物相对丰度的信息,也被广泛应用于养殖环境微生物群落结构和功能研究(Li et al,2020;Deng et al,2021)。
本研究以尼罗罗非鱼(Oreochromis niloticus)和斑点叉尾鮰(Ictalurus punctatus)养殖池塘为实验对象,分析水体理化指标的动态变化;利用Biolog-ECO微平板技术,研究不同采样时间和不同养殖种类淡水池塘微生物群落的碳源代谢功能,并采用高通量测序技术,探究不同采样时间和不同养殖种类池塘微生物的群落结构差异,以期了解养殖环境中菌群结构和功能,为更有针对性地调控养殖环境微生物提供参考。
1 材料与方法
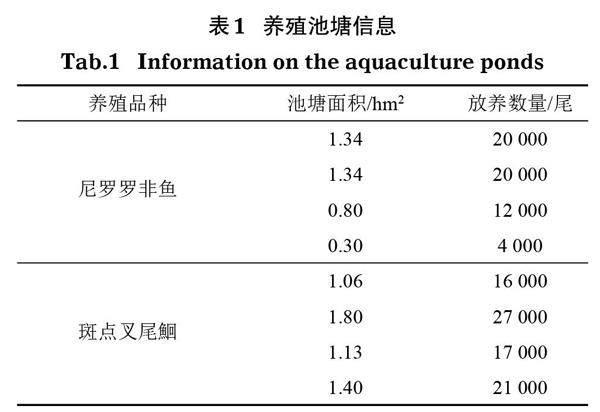
1.1 养殖品种与数量
本实验样品采自广东惠州振华渔业有限公司养殖池塘,监测8个池塘的水体理化指标及微生物变化,包括4个尼罗罗非鱼养殖池塘和4个斑点叉尾鮰养殖池塘。池塘平均水深约1.3 m,面积及放养量见表1。按照鱼体重的2%~3%进行投喂,每天投喂2次,养殖期间不换水,溶氧保持在3 mg/L以上。
1.2 样品采集与理化指标测定
本次实验分别于2019年1月、4月、7月和10月从2个不同品种的养殖池塘中采集水样。采集信息见表2。按照连华环保科技有限公司检测试剂盒说明书,测定水样中NO3-N、NO2-N、NH4-N、TN、TP的浓度。
1.3 微生物功能多样性测定
用无菌水将待测水样稀释10倍,加入到Biolog-ECO板中,28℃恒温培养216 h。每隔24 h使用多功能酶标仪(BioTek,US)记录ECO微平板在590 nm和750 nm下的光密度值。根据每孔的颜色变化,测定吸光值反映菌群对碳源底物的利用情况。单孔颜色平均值(average well colour development, AWCD)计算公式(Garland,1996)如下:
AWCD=∑[(Ci-R)590-(Ci-R)750]/n ①
式中:Ci为测定的第i个碳源孔光密度值,R为对照孔光密度值,n为碳源种类数,n值随所研究碳源种类数变化,分别为31(全部碳源)、12(碳水化合物)、6(氨基酸)、5(羧酸类)、4(多聚物)、2(酚胺类)、2(胺类)。
1.4 菌群16S rRNA测序分析
采用环境样本DNA纯化试剂盒(ZYMO Research 公司)提取样本总DNA。引物序列为:515F(5-GTGCCAGCMGCCGCGGTAA-3)和806R (5-GGACTACHVGGGTWTCTAAT-3)。PCR扩增程序:起始94℃、1 min,94℃变性20 s,54℃退火30 s,72℃延伸30 s,循环30次;72℃延伸5 min。每个样本重复3次。将PCR产物进行琼脂糖凝胶电泳检测。使用QIAquick Gel Extraction Kit(QIAGEN)试剂盒回收目的条带。使用Qubit@ 2.0 Fluorometer (Thermo Scientific)定量,等摩尔量混合。建库用TruSeq DNA PCR-Free Sample Prep Kit,测序用罗宁生物的Hiseq 2500平台PE250模式。对16S rRNA测序原始数据进行拼接(FLASH软件),用Uchime算法去除嵌合体,得到高质量的优化序列(Tags)。用Usearch软件对Tags在97%的相似度水平下进行聚类,得到操作分类单元(Operational Taxonomic Units, OTUs),基于Silva(Release132)和UNITE分类学数据库对OTUs进行分类学注释。测序结果使用R(v.3.2.0)进行数据统计和作图。
1.5 数据分析
数据采用(X-±SE)表示。用Sigmoplot软件对水质理化指标和菌群碳源代谢强度作图。用SPSS 21软件对数据进行双因素方差分析(Two way-ANOVA)。用Shapiro Test检验其正态性,或使用Levene Test检验数据的方差齐性,发现部分数据不具有正态性或者方差齐次性。因此采用两种方法,一是进行数据转换,使其正态或方差齐次;二是使用非参数检验方法,如卡方检验。使用第一种方法进行尝试,数据经过log10、开方等方法转换之后,再进行Shapiro检验或Levene检验,发现部分数据仍不具有正态性和方差齐性,无法进行方差分析。使用非参数的双因素差异检验方法Scheirer-Ray-Hare。
2 结果与分析
2.1 池塘水质理化指标
通过双因素方差分析季节和养殖种类对池塘水质的影响。结果表明,不同采样时间的池塘水体理化指标差异显著,同一采样时间、不同鱼类养殖池塘水体理化指标之间无显著差异(图1,图2,表3)。其中,1月尼罗罗非鱼养殖池塘中的NH4-N含量高于其他3个月份,并显著高于4月和7月(P<0.05);4月的NO3-N含量显著高于1月和10月(P<0.05);1月TP含量显著高于4月、7月和10月(P<0.05)。1月斑点叉尾鮰养殖池塘水体中的TP和NO3-N含量显著高于其他3个月份(P<0.05)。
2.2 池塘水体菌群对碳源的代谢强度
池塘水体中微生物AWCD值在各月之间相差不大(图3,表4),说明池塘水体微生物在各月之间的代谢活性相似。尼罗罗非鱼和斑点叉尾鮰池塘微生物对碳水化合物的利用率最高,对氨基酸、羧酸类和多聚物的利用率较高,对酚胺类的利用率最低。斑点叉尾鮰池塘微生物对碳源的利用率高于尼罗罗非鱼池塘,其中4月斑点叉尾鮰池塘微生物对全部碳源总和、碳水化合物、氨基酸、羧酸类和酚胺类的利用率显著高于尼罗罗非鱼池塘(P<0.05),4月和10月斑点叉尾鮰池塘微生物对胺类的利用率显著高于尼罗罗非鱼(P<0.05)。
2.3 养殖池塘水体菌群结构变化
2.3.1 测序深度及多样性 稀释曲线表明,本研究中的测序深度基本覆盖到各样品中的所有物种(图4)。利用PD、Chao、Shannon、Simpson等指数对池塘菌群的α多样性进行评估。结果表明,1月尼罗罗非鱼池塘菌群的PD和Chao指数平均值最低,说明1月养殖池塘菌群的物种丰富度最低(图5)。利用主坐标(PCoA)对池塘水体菌群的β多样性进行评估,结果表明,4月、7月和10月尼罗罗非鱼池塘的样点有明显聚集,1月的菌群与其他月份存在较大差异。斑点叉尾鮰池塘样点未出现明显聚集(图6)。
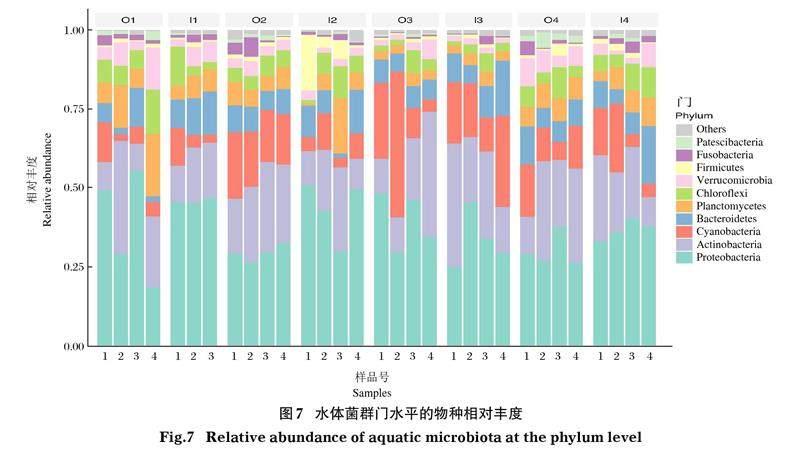
2.3.2 门水平的水体微生物群落结构 尼罗罗非鱼和斑点叉尾鮰池塘水体中均以变形菌门(Proteobacteria)和放线菌门(Actinobacteria)的相对丰度最高,其次为蓝菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)和梭杆菌门(Fusobacteria)(图7)。
2.3.3 属水平的水体微生物群落结构 尼罗罗非鱼和斑点叉尾鮰池塘水体中蓝细菌属(Cyanobium PCC-6307)、hgcI clade(鱼孢菌科Sporichthyaceae)、CL500-29 marine group(Ilumatobacteraceae)、C39(红环菌科Rhodocyclaceae)、Mycobacterium(分枝杆菌属)、Polynucleobacter、LD29(Chthoniobacteraceae)、鲸杆菌属(Cetobacterium)、微囊藻属(Microcystis PCC-7914)和小梨形菌属(Pirellula)为主要菌属(图8)。CL500-29 marine group的相对丰度在1月最低,C39的相对丰度在1月最高,C39也是1月尼罗罗非鱼养殖池塘水体中的差异标记微生物(图9)。
2.3.4 属水平的细菌群落相关性 相关性分析结果表明(表5),C39与NH4-N具有极显著相关性(r=0.68, P<0.01),C39与TN具有显著相关性(r=0.45, P<0.05),hgcI clade与NO2-N具有极显著相关性(r=0.51, P<0.01),C39与LD29和TP具有极显著相关性(r=0.60, P<0.01;r=0.52, P<0.01),hgcI clade与TP具有显著相关性(r=-0.37, P<0.05),CL500-29 marine group与TP具有极显著相关性(r=-0.56, P<0.01)。
3 讨论
3.1 不同养殖品种的池塘水质变化趋势比较
尼罗罗非鱼和斑点叉尾鮰养殖池塘水体中各理化指标的变化趋势基本相同,NH4-N和TP含量在1月最高,NO2-N含量在4月最低。尼罗罗非鱼池塘中的NO3-N含量在4月最高,而斑点叉尾鮰池塘的NO3-N含量在1月最高。广东地区淡水养殖池塘水质在冬季较差,这和董玉峰等(2014)对团头鲂养殖的季节变化研究结果一致。随着养殖时间的增加,尼罗罗非鱼和斑点叉尾鮰养殖池塘的氮磷等含量并未显著增加,说明在养殖密度合理的情况下,传统养殖池塘本身具有一定的自净能力。朱莉飞等(2020)研究也发现,罗非鱼在中等养殖密度下,保证足够的供氧量可促进水体中无机氮的降解。罗非鱼池塘中的无机氮在1月以NH4-N为主要形式,在4月和7月以NO3-N为主要形式。斑点叉尾鮰池塘中的无机氮以NH4-N和NO3-N为主要形式,钟立强等(2020)认为南京地区斑点叉尾鮰池塘的氮源也以这两种形式为主。相关分析也发现,养殖池塘水体中的TN与NH4-N、NO3-N含量呈正相关(表5)。这两种形式的氮盐是养殖尾水中需要去除的主要对象。
3.2 养殖池塘水体菌群对碳源的代谢强度比较
在碳源利用方面,尼罗罗非鱼和斑点叉尾鮰养殖池塘的菌群结构具有明显共性,其能更好地利用碳水化合物和氨基酸,而对酚胺类化合物的利用能力较低。随着时间的变化(1月、4月、7月和10月),尼罗罗非鱼和斑点叉尾鮰池塘微生物的主要群落组成大体稳定,但相对丰度却在不断变化,这解释了微生物群落代谢功能在不同月份之间具有差异的原因。曹煜成等(2014)研究了罗非鱼池塘中微生物碳源代谢的动态变化,发现在整个养殖季节(5-10月),虽然水体中微生物群落在对不同类型的碳源选择方面有所不同,但池塘微生物数量和碳源代谢水平处于较稳定状态。
3.3 养殖池塘水体菌群结构变化特征比较
高通量测序结果发现,变形菌门和放线菌门是尼罗罗非鱼和斑点叉尾鮰池塘中的优势菌门,这与之前对罗非鱼池塘的研究结果一致(王淼等,2020);南京地区斑点叉尾鮰池塘中相对丰度最高的菌门为蓝藻门,其次为放线菌门和变形菌门(钟立强等,2020)。在属水平上,尼罗罗非鱼和斑点叉尾鮰池塘中蓝细菌属、hgcI clade、CL500-29 marine group和C39为主要菌属。研究表明,CL500-29 marine group 可以利用多种碳源(Lindh et al,2015)。hgcI clade是凡纳滨对虾养殖水体的优势菌属(金若晨等,2020)。蓝细菌属、hgcI clade和C39是东加尔各答湿地鱼塘尾水的主要菌属,且hgcI clade和C39的相对丰度与水中的COD含量呈正相关(Tyagi et al,2021)。本研究也发现了这2个菌属的相对丰度与水中的氮盐含量呈正相关关系,表明水中营养物质的含量影响了池塘养殖尾水中的微生物群落结构。在污水处理中,红环菌目细菌具有除氮、除磷等功能(叶正芳等,2013;王峥嵘等,2019)。本研究发现红环菌科细菌C39的相对丰度与水体TP呈正相关关系,C39在冬季池塘的相对丰度较高,也是冬季尼罗罗非鱼养殖池塘中具有显著差异的标记物;可能由于冬季淡水养殖池塘的总磷含量较高,C39成为池塘中的主要菌属。在草鱼混养池塘的相关研究中发现,蜜糖的添加提高了水体中hgcI clade的相对丰度,降低了NO2-N含量(郭小泽等,2019),hgcI clade可以吸收碳水化合物和富氮化合物(Ghylin et al,2014);本研究也发现hgcI clade和NO2-N具有极显著的相关性。
参考文献
曹煜成,李卓佳,文国樑,等,2014. 罗非鱼主养池塘水体微生物群落对碳源代谢的动态变化[J]. 农业环境科学学报, 33(1):172-177.
董玉峰,李冰,李晓,等, 2014. 团头鲂养殖区水质的季节变化及评价[J]. 南方农业学报, 45(10):1876-1800.
郭小泽,唐艳强,侯玉洁,等,2019. 糖蜜对草鱼混养池塘水质和细菌群落结构的影响[J]. 水产科学, 38(5):38-45.
胡大胜,2011. 水质恶化成水产养殖病害罪魁祸首[J]. 海洋与渔业, (5):51-51.
金若晨,江敏,孙世玉,等,2020. 凡纳滨对虾养殖环境及肠道微生物群落特征分析[J]. 水产学报, 44(12):103-120.
刘梅,原居林,倪蒙,等,2021. “三池两坝”多级组合工艺对内陆池塘养殖尾水的处理[J]. 环境工程技术学报, 11(1):97-106.
农业农村部渔业渔政管理局,2021.中国渔业统计年鉴[M]. 北京:中国农业出版社.
王淼,卢迈新,衣萌萌,等,2020. 水体中泼洒复合乳杆菌对尼罗罗非鱼养殖池塘环境、肠道和鳃健康的影响[J]. 水产学报, 44(4):651-660.
王峥嵘,李建民,薛念涛,等,2019. CASS反应器中反硝化除磷污泥的微生物群落结构[J]. 安徽农业科学, 47(14):71-74,146.
魏祥东,吕军仪,杨大伟,等,2002. 养殖水体内生态环境的演变[J]. 信阳师范学院学报(自然科学版), 15(4):478-482.
肖炜,陈炳霖,祝璟琳,等,2020. 尼罗罗非鱼幼鱼对亚硝酸盐氮长期胁迫的生理功能响应[J]. 中国水产科学, 27(11):41-51.
杨莺莺,袁翠霖,李卓佳,等,2014. 罗非鱼养殖池塘底泥微生物群落代谢功能的动态变化[J]. 广东农业科学, 41(19):126-130.
叶正芳,王凤王中友,2013. 饮用水中硝酸盐的反硝化动力学及微生物群落研究[J]. 航天医学与医学工程, 26(3):234-238.
赵琼,张峰峰,周可,等,2020. 养殖水体Biolog Eco板培养时间对微生物多样性分析结果的影响[J]. 天津师范大学学报(自然科学版), 40(4):50-58.
钟立强,王明华,张世勇,等,2020. 南京地区斑点叉尾鮰养殖池塘水体微生物群落结构研究[J]. 农业环境科学学报, 39(7):1594-1604.
朱莉飞,李伟,周雨琪,等,2020. 罗非鱼养殖水体水质参数与菌群多样性分析[J]. 华北农学报, 35(S1):416-423.
Deng Y Q, Mao C, Chen H X, et al, 2021. Shifts in pond water bacterial communities are associated with the health status of sea bass (Lateolabrax maculatus)[J]. Ecological Indicators, 127(10):107775.
Garland J L, 1996. Analytical approaches to the characterization of samples of microbial communities using patterns of potential C source utilization[J]. Soil Biology and Biochemistry, 28(2):213-221.
Ghylin T W, Garcia S L, Moya F, et al, 2014. Comparative single-cell genomics reveals potential ecological niches for the freshwater acI Actinobacteria lineage[J]. Isme Journal, 8(12):2503-2516.
Kurten G L, Barkoh A, 2016. Evaluation of community-level physiological profiling for monitoring microbial community function in aquaculture ponds[J]. North American Journal of Aquaculture, 78(1):34-44.
Li Z F, Yu E M, Zhang K, et al, 2020. Water treatment effect, microbial community structure, and metabolic characteristics in a field-scale aquaculture wastewater treatment system[J]. Frontiers in Microbiology, 11:930. DOI:10.3389/fmicb.2020.00930
Lindh M V, Sjstedt J, Andersson A F, et al, 2015. Disentangling seasonal bacterioplankton population dynamics by high-frequency sampling[J]. Environmental Microbiology, 17(7):2459-2476.
Tyagi I, Tyagi K, Bhutiani R, et al, 2021. Bacterial diversity assessment of world's largest sewage-fed fish farms with special reference to water quality: a Ramsar site[J]. Environmental Science and Pollution Research, 28:42372-42386.
Zhang Y, Bleeker A, Liu J G, 2015. Nutrient discharge from China's aquaculture industry and associated environmental impacts[J]. Environmental Research Letters, 10(4):045002.
(责任编辑 万月华)
Environmental Microbial Community of Different Fish Aquaculture
Ponds at Different Sampling Times
WANG Miao1, HUANG Qiu‐biao2, LI Qing‐yong2, ZHU De‐xing2,
WANG Rui‐ning1, YI Meng‐meng1, LU Mai‐xin1
(1. Key Laboratory of Tropical & Subtropical Fishery Resource Application & Cultivation,
Ministry of Agriculture and Rural Affairs, Guangdong Provincial Key Laboratory of Aquatic Animal Immunology and Sustainable Aquaculture, Pearl River Fisheries Research Institute,
Chinese Academy of Fishery Science, Guangzhou 510380, P.R. China;
2. Fisheries Research and Extension Center of Huizhou, Huizhou 516002, P.R. China)
Abstract:The microbial community is crucial for maintaining aquaculture pond ecosystems. In this study, water samples from Nile tilapia (Oreochromis niloticus) and channel catfish (Ictalurus punctatus) aquaculture ponds were collected in different seasons to characterize the variation in microbial community structure and water physicochemical parameters, aiming to understand how the environmental microbial community functions in different types of aquaculture ponds. In January, April, July and October 2019, water samples were collected in four aquaculture ponds of each fish species for the analysis of microbial community and the determination of physicochemical parameters, including total nitrogen, ammonia nitrogen, nitrate nitrogen, nitrite nitrogen and total phosphorus. The microbial community structure in water was analyzed by high-throughput sequencing technology and average well color development (AWCD) of the aquatic microorganisms, using various carbon sources, was analyzed by Biolog ECO-plate technology. Results show that water quality and microbial community structure of the aquaculture ponds in January were different from those in other investigation time, and the fish species had little effect on the water quality and microbial community structure of pond water. There were significant differences in the physicochemical parameters in aquaculture ponds among sampling times, but there were no significant differences in the physicochemical parameters of Nile tilapia and channel fish ponds at the same sampling time. Among them, the content of NH4-N in Nile tilapia aquaculture ponds in January was higher than in other months, significantly higher than that in April and July (P<0.05), and the content of TP in January was significantly higher than that in April, July and October (P<0.05). The contents of NO3-N and TP in channel catfish aquaculture ponds in January were significantly higher than those in other months (P<0.05). Biolog-ECO plate detected that microorganisms in Nile tilapia and channel fish aquaculture ponds had high utilization rate of carbohydrates and amino acids and low utilization rate of phenolic amines. In April, the utilization rate of carbon sources by microorganisms in channel catfish ponds was higher than that in Nile tilapia ponds. High throughput sequencing shows that Firmicutes and Bacteroidetes were the dominant phyla in both Nile tilapia and channel catfish ponds. Actinobacteria (hgcl clade), the CL500-29 marine group and C39 were the primary genera involved in nitrogen and phosphorus cycling in the freshwater ponds. Our study helps to understand microbial community structure and variation in the aquaculture environment and provides scientific evidence for developing targeted measures for ecological treatment of wastewater in aquaculture.
Key words:Oreochromis niloticus; Ictalurus punctatus; aquaculture pond; microbial community
收稿日期:2021-09-15 修回日期:2023-01-09
基金项目:财政部和农业农村部:国家现代农业产业技术体系(No. CARS-46);广东省基础与应用基础研究基金(2019A1515111046);中国水产科学研究院中央级公益性科研院所基本科研业务费专项(2021ZX04)。
作者简介:王淼,1984年生,女,博士,主要从事水产健康养殖研究。E-mail:miaowfly@163.com
通信作者:卢迈新,1962年生,男,研究员,博士生导师,主要从事罗非鱼健康养殖与选育种研究。 E-mail:mx-lu@163.com

