EMR环境下电磁一生物信号转换介导运动神经保护作用的研究进展
关键词:电磁辐射;抑郁症;铁死亡;肠道菌群;运动
文章编号:1001-747X(2023)05-0594-13 文献标志码:A 中图分类号:G804.32
DOI:10.16063/j.cnki.issnl001-747x.2023.05.009
随着电子信息技术的高速发展,环境中电磁辐射(electromagnetic radiation,EMR)不断增加,人类日常生活和职业活动中暴露于EMR的安全性已成为公共卫生问题。世界卫生组织于1996年启动“国际电磁场计划”,对电磁场生物学效应进行评估。2011年国际癌症研究机构将EMR归类为2B类,认为对人类“可能致癌”。EMR暴露被认为会引发各种神经系统效应,包括头痛、睡眠模式的改变、神经元电活动的改变以及神经递质释放紊乱。研究还发现,4周的有氧运动可改善辐射导致的小鼠体重减轻、抑郁、运动能力降低、学习和记忆相关的认知功能障碍,还可保护小鼠海马齿状回颗粒下区新生及成熟神经元丢失,促进神经发生。运动和辐射之间存在协同相互作用,有研究发现暴露于辐射的运动训练组中抗炎化酶和线粒体酶活动明显增加,在非训练的动物中没有观察到此现象,这表明骨骼肌通过运动训练的预处理后对辐射暴露有更高的基础保护水平,此外,运动预处理后骨骼肌中抗氧化活性的增强可减少辐射暴露后ROS的产生。故长期暴露于高剂量的EMR是否增加神经损伤的风险及运动抗辐射的内在机制,均有待进一步探究。
铁是自然界感应电磁场变化的最敏感金属元素,生物体可能通过铁元素感应电磁场并产生相应的生理和病理学改变。研究发现,EMR可能通过铁死亡途径诱导了细胞死亡,铁死亡由自由基和氧化产物引发,涉及线粒体谷胱甘肽过氧化物酶4(glu-tathione peroxidase 4,GPX4)活性降低。GPX4缺失会导致过度的脂质氧化、细胞膜损伤和细胞死亡。脂质和蛋白质氧化会导致炎症和DNA变化,这是神经元功能丧失、结构破坏和早衰的影响因素。铁死亡抑制剂(Fer-1)作为一种铁死亡的小分子抑制剂,可抑制神经炎症从而减少神经细胞死亡。Fer-1相比酚类抗氧化剂可以有效地抑制铁死亡,其抗铁死亡活性是由于清除了脂质氢过氧化物产生的烷氧基自由基。另有研究发现,900 MHz微波辐射可诱发小鼠抑郁行为,且使小鼠肠道菌群在门、目、属水平上出现显著变化。此外,过量铁会破坏肠道屏障功能,改变肠道菌群结构。本课题组前期研究发现,运动可通过调节“微生物-肠-炎症一脑”轴改善肠道菌群紊乱,进而缓解ASMT基因敲除导致的抑郁行为。另有研究发现,运动能影响铁死亡相关基因表达并抑制细胞铁死亡。由此推测,“EMR-铁积累/肠道菌群-氧化应激-细胞死亡”可能构成EMR物理信号向细胞生理信号转换的基本通路。本文主要对EMR的电磁一生物信号转导产生生物学效应的可能机制以及运动的抗辐射作用研究进行综述。
1电磁辐射的物理学本质和神经生物效应
电场和磁场的交互变化产生电磁波,电磁波向空中发射或泄露,即电磁辐射。电磁辐射是一种能量形式,研究发现特定类型的电磁辐射可能会影响生物组织,尤其是大脑。WiFi、手机的广泛使用在人体周围构建了一个局域性不同于自然EMR的长时间高剂量(高频)EMR环境。手机通常在靠近头部的地方使用,产生的辐射会被大脑吸收,因此脑是EMR损伤的重要敏感靶器官。手机辐射在发射器中产生,并通过天线和附近的中继站以无线电波的形式发射出来,而我们的身体就像天线,吸收辐射并将其转化为交变的涡流。
国际非电离辐射保护委员会将手机的电磁波吸收比值(SAR)指南法定限制为2.0 W/kg,但各国的SAR水平仍有差异。SAR是指单位时间内单位质量的人体组织所吸收或消耗的电磁波功率,用来衡量能量在人体组织内的穿透情况。人体组织吸收的SAR量取决于生物物理参数,通过测量辐射的SAR可以确定EMR暴露的细胞辐射敏感性。理论上,EMR必须穿透暴露的生物系统并诱发内部电磁场引起生物反应。研究发现,在800~1000 MHz频率范围之间的EMR足以穿透大脑颅骨,其中近40%可以到达大脑深处,穿透深度约为4~5 cm。另一方面,穿透深度或辐射吸收取决于入射场参数(如强度、功率密度)、暴露区域、物体的形状、几何形状和方向、辐射的配置和与辐射源的位置。最重要的是使用时设备的位置,在打电话、把电话放在头部附近或放在裤子口袋里、在腿上使用连接WiFi的笔记本电脑以及经常使用微波炉时,辐射吸收率较高。现在使用的许多电子设备,最常见的辐射源是手机(850 MHz~2.4 GHz)、WiFi (2.4 GHz)、笔记本电脑(300 Hz~10 MHz)、手机信号塔(800~1900 MHz)、电视(54~700 MHz)、雷达(1~100 GHz)和微波炉(2.45 GHz)。公众会遇到的较低暴露强度/剂量的EMR,不存在实际健康问题。但国内外多数研究认为神经系统对高频的EMR更敏感,引起人体神经、内分泌、心血管和生殖系统变化,表现在神经行为指标异常、心悸、出生缺陷、流产率增高、免疫活性下降等;尽管也有研究结果与此不同。由此推测,EMR的暴露强度/剂量很可能是影响其生物学效应的关键。
越来越多的研究发现,EMR会对DNA完整性、细胞膜、基因表达、蛋白质合成、神经元功能、血脑屏障、褪黑激素的产生、生殖细胞和免疫功能造成一系列不利影响。在动物实验中发现EMR暴露会增加血脑屏障的通透性及脑组织中神经元损伤,影响细胞内钙稳态和神经递质水平。最近,Ramazzini研究所和美国国家毒理学计划在与人类研究联合进行的动物实验中,发现了长期暴露于EMR的啮齿动物易患神经胶质瘤和神经鞘瘤的新证据。一定剂量的EMR也会损害学习记忆功能,增加老年痴呆的发病风险,具体可表现为空间参考记忆能力和联合性学习记忆能力下降。EMR对行为认知功能的影响不仅与辐射频率等剂量参数密切相关,采用适宜的行为学实验方法也较为重要。Morris水迷宫、新物体识别实验对于研究EMR致学习记忆功能的影响可能较为理想。关于EMR对情绪行为影响的研究并不多见,通常采用经典的高架十字迷宫和旷场实验。一定条件EMR可引起动物情绪行为改变以及产生焦虑情绪,EMR对情绪行为的影响同样与辐射频率、比吸收率等辐射剂量条件有关,但EMR影响抑郁行为的阈值尚有待于进一步研究。
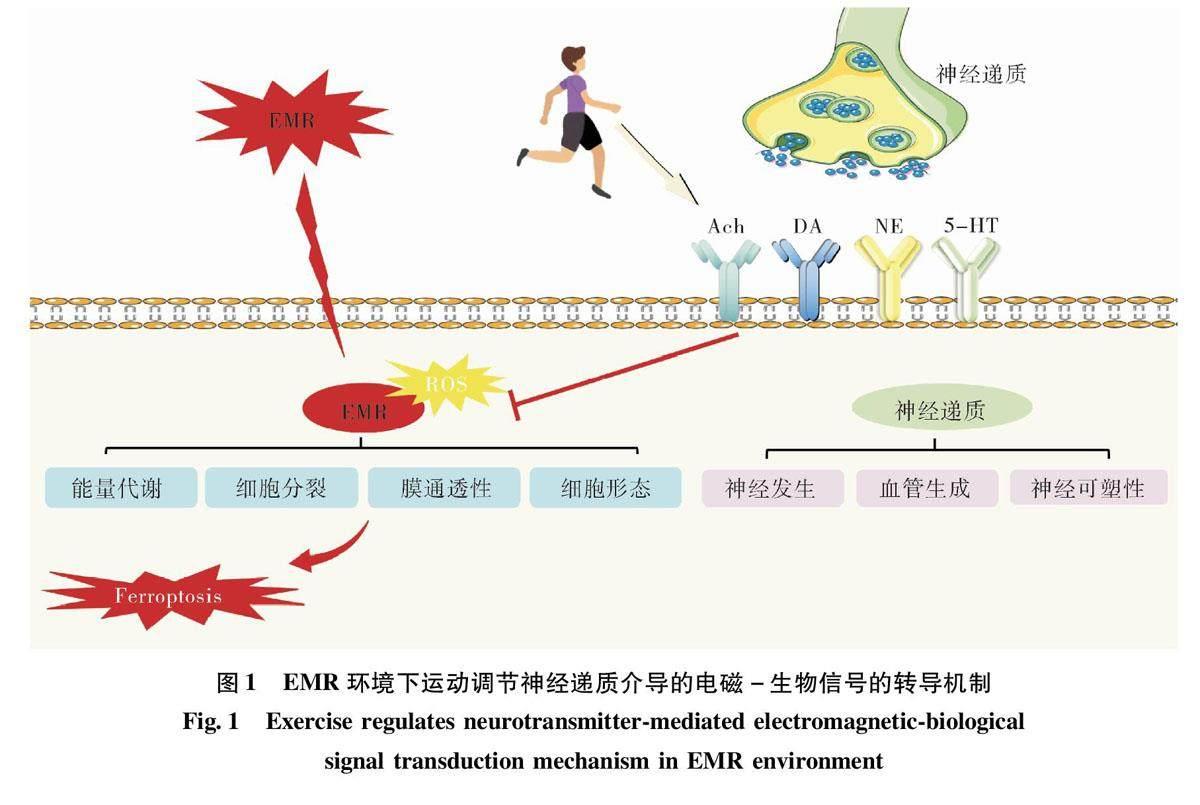
2运动通过调节神经递质减轻辐射危害的神经生物效应
研究表明,神经系统是对EMR敏感的重要靶器官,EMR对脑内神经递质代谢和受体有显著影响。行为功能受不同大脑区域和许多神经递质的相互作用控制,没有大脑区域是孤立工作的。因此,EMR对各种神经递质水平(在各个大脑区域)的调节作用是一个值得关注的问题。作为突触传递的信使,神经递质在认知和情绪行为中起关键作用。越来越多的研究集中在EMR的神经生物学效应上,包括神经递质的代谢和转运。运动抗辐射的一种可能的神经生物学机制是增加神经递质和神经营养因子的合成和释放,导致神经发生、血管生成及增加神经可塑性。对动物的研究表明,运动可调节与个体警觉状态(去甲肾上腺素)、愉悦和奖赏系统(多巴胺)和焦虑水平(血清素)相关的主要中枢神经系统(central nervous system,CNS)神经递质。此外,这些神经递质水平的变化具体取决于受体的类型和被激活的皮层区域。
2.1乙酰胆碱
乙酰胆碱(acetylcholine,ACh)广泛分布于CNS的大脑皮质、海马和纹状体等大脑缺氧缺血易损区,其在学习记忆中起到意识清醒的作用,ACh含量适当提高可促进脑神经传导功能激活,提高信息传递速度,增强大脑记忆能力。长期低剂量EMR可能导致脑内ACh含量下降,胆碱乙酰转移酶(choline acetyltransferase,ChAT)的活性下降及胆碱酯酶(acetylcholine esterase,AChE)活性增强。在一项暴露于900 MHz的EMR,每天辐照时间为th、2h和4h的实验中,暴露90 d后发现EMR会导致脂质过氧化增加和海马体中AChE活性耗尽。有关EMR对脑内ACh合成与代谢影响的量效关系及其动态变化规律和特点仍需进一步研究。ACh受体表达及活性的改变与EMR剂量密切相关,一定条件EMR可引起脑内ACh受体表达失调、胆碱能系统功能紊乱以及神经行为改变,其中ACh受体表达失调可能介导胆碱能神经传递异常及胆碱能系统功能紊乱,导致学习记忆和情绪行为的改变。
ACh是一种主要的神经调节剂,在注意力、运动和行为方面起着重要作用。研究发现,运动可以通过增加运动终板中ACh囊泡的数量、乙酰胆碱酯酶的表达和乙酰胆碱受体的数量使得乙酰胆碱水平升高。ACh浓度的升高与海马theta节律的持续时间呈正相关,有利于增强突触可塑性和记忆形成,推测ACh可能参与运动的抗辐射机制。
2.2多巴胺
多巴胺(dopamine,DA)是去甲肾上腺素的代谢前体。DA在CNS中的主要作用之一是调节神经元之间的电通讯。DA促进突触和神经回路结构组织的持续变化,并影响突触间电信号的瞬时流动。研究表明,一定强度的微波辐射(835 MHz,SAR值4.0W/kg,连续12周,5 h/d)可导致小鼠大脑纹状体的神经功能发生改变,从而导致DA水平降低以及纹状体神经元中酪氨酸羟化酶的表达降低[30]。在一项实验中孕鼠进行3次/d的EMR照射,持续20 d,评估手机辐射对胎鼠大脑氧化应激和神经递质水平的影响,结果发现高剂量照射组使得胎鼠脑组织中DA含量显著降低,提示长期手机辐射可导致胎鼠中枢神经系统DA含量异常,可能影响子代小鼠大脑发育。
运动可以提高DA效率,使得DA在突触中停留的时间更长,接收DA信号的细胞在DA受体上结合位点增多,接收信号能力增强。此外,运动可以通过多种机制调节DA能系统,这些机制包括影响DA能转换和调节酶功能,如酪氨酸羟化酶活性及钙水平。研究发现有氧运动会导致血清钙水平升高,血清钙被钙调蛋白系统输送到大脑,而大脑又可以通过钙调蛋白依赖系统增强大脑DA的合成,推测DA可能参与运动的抗辐射机制。
2.3去甲肾上腺素
去甲肾上腺素(norepinephrine,NE)是一种在中枢神经系统和交感神经中合成的单胺类递质。大脑的蓝斑在去甲肾上腺素的信号传导中起着至关重要的作用,蓝斑释放的NE通过其对许多突触前和突触后受体的作用调节中枢神经系统中的细胞过程和突触传递。研究表明,低强度(1mW/cm2)的EMR暴露会导致大脑NE及肾上腺素含量显著下降,导致神经递质产生障碍。总之,长期暴露于EMR可能导致大脑中的NE和肾上腺素含量异常,不同的频率暴露会导致不同的大脑反应。
NE是肾上腺在压力刺激下根据大脑信号产生的速效战斗或逃跑激素,在运动过程中来自大脑运动中心的冲动以及来自工作肌肉的传人冲动会调节神经信号从而增加NE的分泌。长期运动会导致全脑NE浓度增加。研究发现,运动降低促炎细胞因子水平,改善氧化平衡,同时可以逆转高盐摄人的高血压动物NE能过度活跃的抑制性和兴奋性神经传递之间的失衡。此外,一项针对小鼠的研究表明,运动引起的抑郁行为减少与海马NE的增加有关,推测NE可能参与运动的抗辐射机制。
2.4 5-羟色胺
5-羟色胺(serotonin,5-HT)是一种调节多种神经心理过程和神经活动的神经递质,靶向5-HT受体的药物广泛用于精神病学和神经病学。5-HT调节的行为和神经心理学过程包括情绪、知觉、奖赏、愤怒、攻击性、食欲、记忆、性欲和注意力等,这些生理功能已成为EMR所致脑损伤的指标。将Wist-ar大鼠暴露在2.856 GHz微波辐射下,每周3次,持续6周。结果显示,照射后28~6d,各组大鼠海马及脑脊液中5-HT含量均显著升高,且与学习记忆能力下降有关。在另一项研究中,单次暴露于900 MHz辐射45min会导致5- HT水平升高,而不会改变大鼠的血谷氨酸水平,且5-HT水平升高可能导致学习障碍和空间记忆缺陷。表明还需要进一步研究阐明5-HT在EMR诱导的学习记忆功能障碍和大脑形态学改变中的作用。
运动后的5-HT水平和5-HT受体mRNA表达增加,可以改善大脑多个区域的5-HT能代谢,包括脑干、大脑皮层、海马体。研究发现,有害刺激诱导的反应可以被髓质5-HT能核激活所抑制;色氨酸羟化酶抑制剂诱导的脑干中5-HT水平的降低,抑制了神经损伤后运动诱导的镇痛作用,故运动的镇痛作用可能与5-HT能神经传递有关。动物研究表明,大鼠运动后脑干和海马的5-HT合成和代谢增加,改善了抑郁和焦虑症状。长期运动会增加5-HT生物合成途径的限速酶色氨酸羟化酶,这是5-HT浓度增加的潜在机制。运动期间,游离脂肪酸取代色氨酸与白蛋白的结合,未结合的色氨酸能够透过血脑屏障形成5-Hr,推测5-HT可能参与运动的抗辐射机制。
综上所述,EMR对脑内神经递质合成、代谢和转运的研究很多,但由于EMR参数、实验对象和条件的不同,实验结果并不十分一致和具有可对比性。运动的神经生物效应升高大脑神经递质水平如ACh、DA、NE和5-HT等,可能可以修复EMR对神经可塑性造成的影响。EMR对神经递质代谢和转运的影响及运动是否能通过影响神经递质调节EMR的电磁-生物信号转换尚未明确。尽管抑郁症与神经递质合成、代谢和转运的关系十分密切,但EMR诱发神经行为功能障碍的作用及其机制依然十分模糊。在很多实验情境中,神经递质异常并不等于行为异常,反之,行为异常也不一定表现为神经递质异常。由于神经递质在大脑的复杂多样性,神经递质之间的相互作用、共传递和共调节使得很难区分各神经递质的主要和次要变化。因此,EMR引起脑神经递质紊乱可能并非行为异常的根源性机制。也即,在EMR与神经递质代谢紊乱之间必定还存在一种物理一生物信号转换机制。
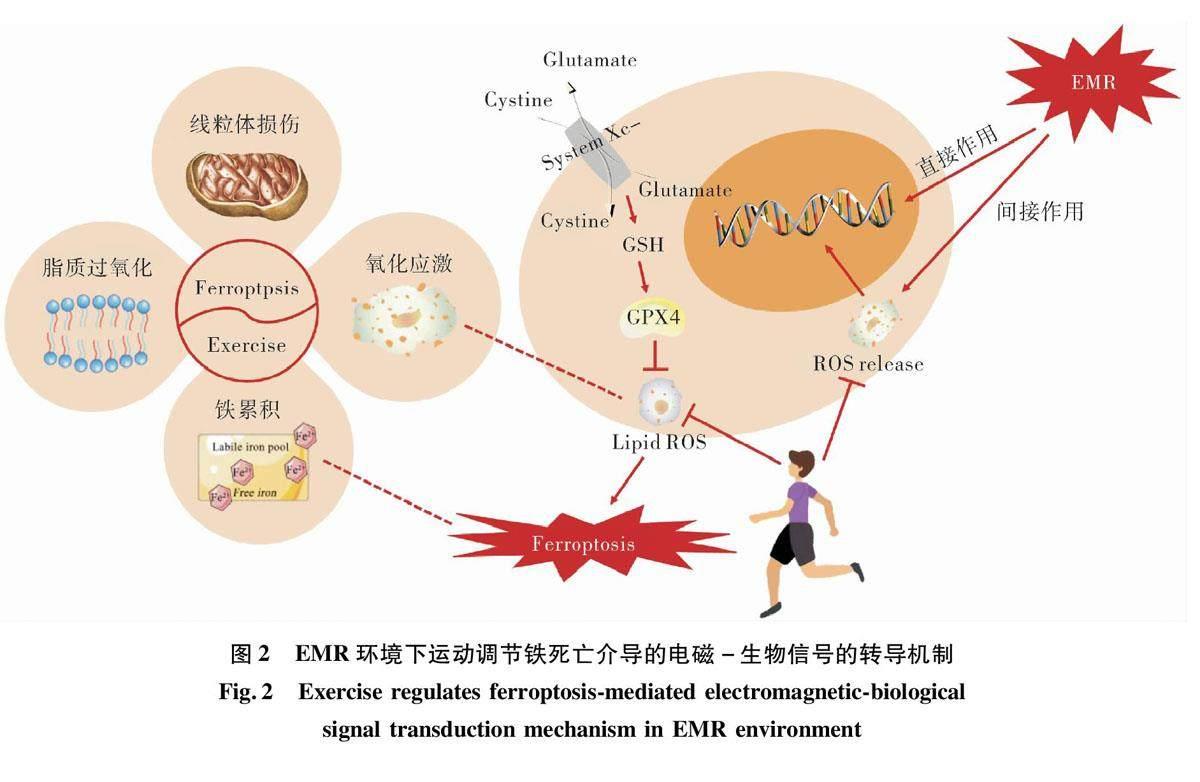
3运动调节铁死亡介导电磁-生物信号转换
EMR诱导的凋亡信号可能源白细胞死亡受体(外部凋亡途径),也可能来自细胞内DNA损伤机制(线粒体或内部途径)。大脑对铁稳态失衡特别敏感。缺铁会对突触可塑性产生负面影响,从而导致学习和记忆缺陷。另一方面,高水平的铁会导致ROS的积累,从而干扰线粒体功能。研究还发现EMR暴露会通过参与铁和形成羟基自由基的过程在脑细胞中引起DNA损伤。还有证据表明,EMR会改变血脑屏障通透性,推测血脑屏障完整性的变化可能导致重金属,特别是大脑中铁的过量积累,从而导致神经元损伤。所有这些导致细胞应激的原因最终都会导致铁介导的细胞死亡。运动对铁死亡的影响研究鲜见,仅有研究发现,运动组小鼠心肌缺血再灌注(MI/R)的铁死亡程度受到显著抑制,心肌的Ptgs2 mRNA、丙二醛(malondialde-hyde,MDA)和脂质过氧化程度均显著降低,心功能显著改善。
3.1铁死亡介导电磁-生物信号转换
2012年,有研究描述了一种独特的细胞死亡形式,是由依赖铁的脂质氢过氧化物积累到致死水平引发的,并将其命名为铁死亡(ferroptosis)。铁死亡这种细胞死亡方式一经发现,就被证明与多种神经系统疾病及神经损伤密切相关。体内外实验也发现,抑制铁死亡在神经系统疾病及神经损伤动物模型中有明显的神经保护作用。因此,研究铁死亡在神经系统中的作用对于评估神经系统功能是必要的。
近年来,越来越多研究集中在EMR的神经生物学效应上。神经系统机制与膜功能、神经元传递和突触携带有关,并受氧化应激的影响,EMR诱导氧化应激反应增加铁离子浓度,从而催化自由基反应的增加。由于铁催化高反应性羟基自由基的形成,高浓度的铁会在受神经精神疾病影响的大脑区域引发氧化应激机制。研究发现,使用手机50 min,靠近手机天线的脑组织中葡萄糖的代谢率要明显高于另一侧脑组织,结果提示EMR被大脑吸收可能会增强脑组织兴奋性及代谢水平。EMR在正常组织中诱导铁死亡、羟基自由基、游离铁和脂质代谢酶增加,铁积累随后协同启动高水平的脂质过氧化,使EMR成为铁死亡的外源性诱导剂。
还有研究发现,脂质过氧化物可以通过抑制GSH/GPX4轴减轻EMR诱导的海马神经元铁死亡。研究者在体内试验发现,EMR可诱导大鼠学习记忆障碍、线粒体铁死亡形态学损伤、MDA和铁的积累,在体外试验观察到EMR会增加神经元死亡,导致铁过载和MDA升高。值得注意的是,以上不利影响都可以被Fer-1逆转。在肿瘤放疗中,磁场通过ROS介导的DNA损伤诱导细胞凋亡和铁死亡。癌症免疫治疗中,磁场促进铁胞浆样细胞死亡,从而达到抗肿瘤的效果。上述研究表明,EMR可直接影响铁代谢和细胞存活。由于EMR近脑暴露导致脑铁积累、脂质过氧化加剧,诱导神经元死亡,这可能是EMR暴露损害脑功能、诱发多种神经系统疾病的有力证据。
最新的系列证据进一步证明,减轻铁氧化应激和铁死亡有助于改善抑郁行为。海马蛋白质组学分析显示,慢性不可预见性温和应激(chronic unpre-dictable mild stress,CUMS)诱导抑郁模型小鼠中被激活的细胞坏死和铁死亡与神经元丢失有关。该研究强调海马神经元铁死亡与CUMS诱导的抑郁症有关,部分解释了神经元丢失的原因,从而为抑郁症治疗提供了潜在新靶点。然而,抑郁症中神经元减少的具体分子机制和形式尚需进一步阐明。研究发现,酒精暴露可能通过激活小鼠铁死亡诱导抑郁和焦虑行为,并且Fer-1在体外可防止酒精诱导的神经元死亡。另有研究发现,CUMS诱导的小鼠海马中存在铁死亡的激活,PEBP1-GPX4介导的铁死亡可能参与了逍遥散抗抑郁作用,这也预示着铁死亡可能成为研究抑郁机制和抗抑郁药物的新靶点。还有研究发现硫氢化钠(NaHS)可以通过抑制炎症和铁死亡减轻1型糖尿病小鼠的焦虑和抑郁行为。上述证据充分表明,脑铁积累诱导细胞铁死亡是抑郁症的重要机制之一,但可导致脑铁积累的EMR剂量和强度尚需进一步明确。
3.2运动通过影响ROS调节EMR导致的铁死亡
EMR与生物体之间的关系反映了氧化应激与自由基的关系,因为EMR对生物系统的主要影响是改变自由基反应的平衡。铁作为大量代谢酶的重要辅助因子,是脂质过氧化物发生芬顿反应的催化剂,驱动氧化还原代谢和细胞ROS的产生。当ROS的产生超过机体抗氧化防御能力时,就会发生细胞氧化应激,导致细胞功能障碍及死亡。神经元膜对ROS非常敏感,引起的连锁反应会产生脂质自由基和广泛的膜损伤,因而在大脑中维持正常的氧化还原状态尤为重要。运动训练可诱导骨骼肌的有益适应,减少因暴露于ROS而造成的细胞损伤。运动对ROS水平的调控被认为是与运动训练相关的潜在适应机制,包括增加抗氧化酶活性与DNA修复能力及减少DNA损伤。
运动的抗辐射作用可以用ROS介导的信号传导来解释。有研究发现辐射会引起骨骼肌萎缩及纤维化,部分原因是由于辐射诱导的卫星细胞池的耗竭。相比之下,运动可以提高骨骼肌的抗氧化能力及增强肌纤维横截面积,最大限度地减少辐射暴露的有害影响,以及增加健康骨骼肌中的卫星细胞和干细胞数量。运动不仅可以通过调节抗氧化防御系统降低ROS水平及氧化应激严重程度,还可以直接减少ROS的产生。EMR可以激活核因子-кB(nuclear factor-кB,NF-кB)及其促炎细胞因子的靶基因。线粒体产生的ROS会诱导由NF-кB介导的信号传导。然后,кF-кB会诱导编码抗氧化酶基因表达,这些酶可以对抗自由基的积累。因此,运动会引发急性短暂的氧化应激状态,具有保护性的长期抗炎及其他潜在的辐射防护作用,运动诱导的这些有益的适应性机制也可以潜在地抵消EMR暴露产生的负面影响。
运动不仅可以增加抗氧化活性、减少炎症应激的下游效应,还可以在暴露于EMR时增强运动后的DNA修复。研究发现,EMR能够诱导单链DNA断裂。在EMR暴露的情况下,与不运动相比,运动对生物组织的各个层面(大分子、细胞/组织和器官/系统)都有积极的影响。在辐照之前、期间和之后进行的有氧运动和抗阻运动都可以增加抗氧化活性和DNA修复。在细胞和组织水平上,运动对辐射的防护作用表现为可以恢复前体细胞和神经发生水平,以及增加骨矿物质密度、造血干细胞和祖细胞。此外,在器官和系统水平,运动减少了辐射引起的疲劳、器官毒性和认知功能障碍。
综上所述,运动的辐射保护作用可能通过细胞适应的分子效应,增加抗氧化活性与DNA修复能力,以及增强对ROS及炎症损伤的抵抗力,减轻铁氧化应激和铁死亡(见图1)。
3.3运动通过影响线粒体功能调节EMR导致的铁死亡
线粒体DNA比核DNA更容易受到EMR的影响,因为它缺乏组蛋白,修复DNA的能力降低,并且不受线粒体活性氧物质的保护。线粒体是细胞自由基的主要来源和主要目标,自由基产生速率的增加或抗氧化酶含量的降低会导致氧化应激、酶失活以及线粒体和细胞功能障碍。神经元的糖酵解能力有限,故高度依赖线粒体的能量产生。突触中的线粒体参与突触传递,线粒体功能损伤可能会导致神经元退化或神经元铁死亡。线粒体在半胱氨酸剥夺诱导的铁死亡中起关键作用,半胱氨酸剥夺导致线粒体膜电位超极化和脂质过氧化物积累,抑制线粒体三羧酸循环或电子传递链可减轻线粒体膜电位超极化、脂质过氧化物积累和铁死亡。
急性有氧运动可以在短期内造成氧化应激,但规律的长时间运动会引起保护性细胞适应,包括线粒体生物合成和氧化磷酸化能力的增加,以及一系列积极的下游信号级联效应。适度运动会增加线粒体相关蛋白,同时减少氧化应激相关蛋白,并具有抗氧化活性,可保护神经元免受氧化应激的影响。在生化水平上观察到适度运动的3种作用,即抗氧化酶活性上调、氧化应激标志物降低和线粒体电子转移酶活性增加。抗氧化酶水平的升高会降低线粒体和细胞自由基反应的速率,从而降低自由基反应的副产物或标记物的水平。运动会增加ATP需求,并将细胞中的线粒体代谢状态从主要状态4(低ADP水平和缓慢呼吸的静息状态)转变为主要状态3(活跃状态,高水平ADP和快速呼吸作用及ATP合成)。在这种转变中,状态4相对较高的超氧自由基和过氧化氢产生率转变为状态3较低的超氧自由基和过氧化氢产生率。因此,运动的有益效果可能是因为线粒体超氧化物自由基的生成率较低以及线粒体Mn - SOD和其他抗氧化酶水平的增加。
运动可以选择性地调节大脑中线粒体抗氧化剂的活性,延缓甚至防止与神经疾病相关的氧化应激反应。运动诱导的大脑线粒体生物能适应包括增加参与能量产生的酶的含量或活性和提高线粒体产生能量的能力。故通过调节线粒体氧化磷酸化系统,运动可以提高线粒体氧化底物的能力和ATP合成的速率。虽然线粒体生物合成会随着运动增加线粒体数量,但线粒体生物发生和线粒体自噬之间的平衡是维持神经元内线粒体生理功能的关键决定因素。通过增加健康的线粒体池,运动可以促进健康线粒体的融合与受损线粒体的分离,从而阻止线粒体外膜渗透诱导的细胞铁死亡。运动可以通过多种信号刺激线粒体自噬,包括激活腺苷酸活化蛋白激酶(AMPK)及抑制哺乳动物雷帕霉素靶标(mTOR)复合物1和线粒体自噬抑制剂。运动诱导的线粒体生物发生和线粒体自噬是紧密耦合的,有助于维持健康的线粒体网络。推测运动可能通过改善线粒体整体功能,从而减轻与EMR暴露过程相关的神经元铁死亡。
如图2所示,EMR可以通过直接/间接作用引起DNA双链断裂和氧化损伤,诱导细胞内GSH水平降低和GPX4表达下调,并通过增加脂质引发铁死亡,加剧辐射损伤导致脂质过氧化;运动可抑制铁死亡途径,发挥辐射防护作用,生物过程涉及线粒体功能紊乱、脂质过氧化、氧化应激、铁积累等。综上所述,EMR通过诱导铁死亡产生生物学效应,运动的辐射保护作用可能归因于干预ROS产生、恢复受损线粒体功能和由此产生的神经保护作用。因此,现有数据表明,EMR导致的铁死亡会损害大脑功能,而在某些条件下,运动可以通过广泛的分子过程改善大脑功能调控铁死亡,包括上调抗氧化和氧化损伤修复系统,从而减轻损伤的积累。
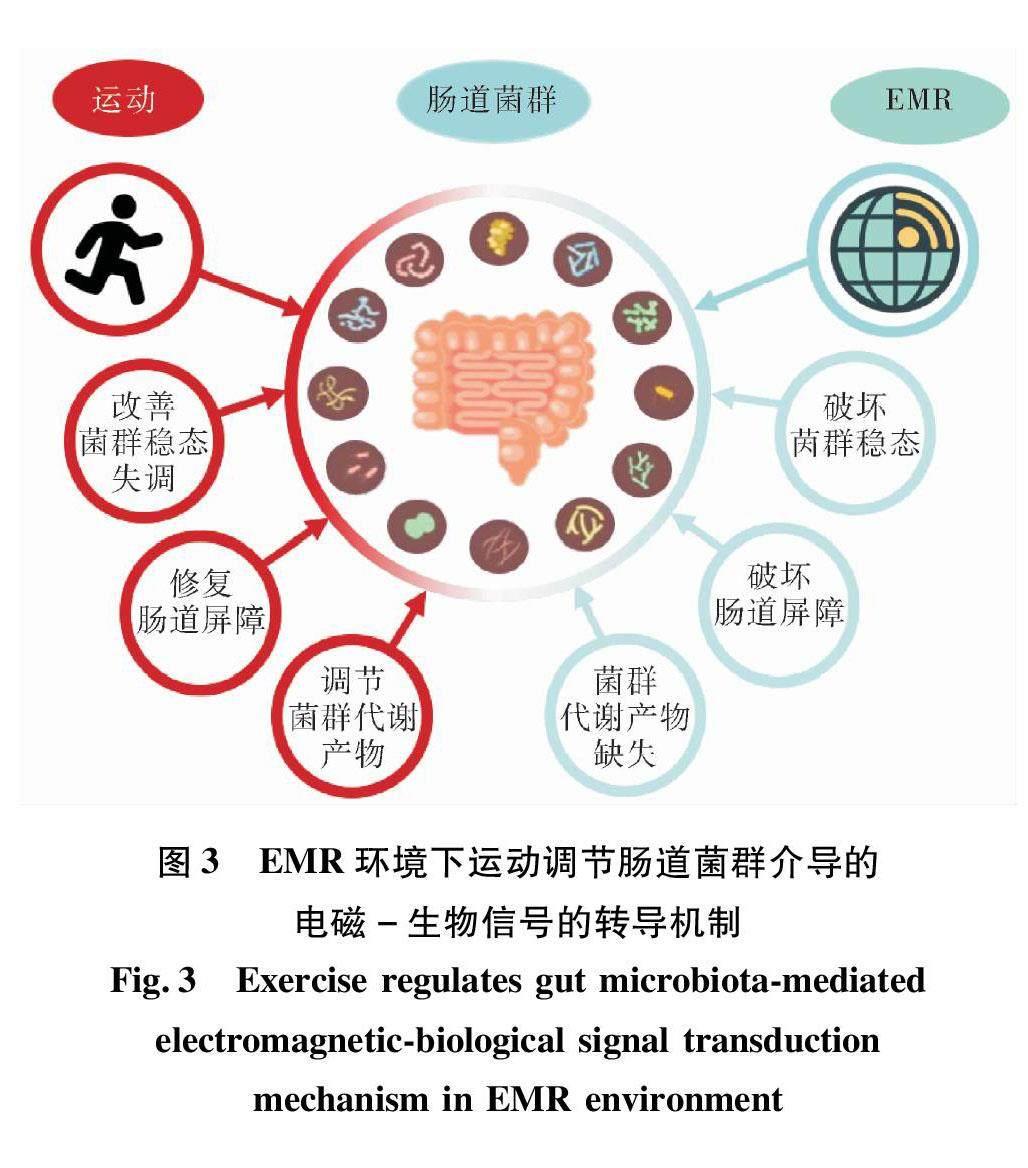
4运动调节肠道菌群介导电磁-生物信号转换
4.1肠道菌群介导电磁-生物信号转换
肠道是人体微生物的主要聚集处,也是EMR的靶器官。前面指出,中枢神经系统中DA、NE和5-HT水平降低是抑郁症发展的标志,而肠道菌群可以合成5-HT、DA和NE,并分泌到血液中,与抑郁症的治疗密切相关。本课题组曾提出,适度运动可以弱化“肠漏-免疫激活-抑郁性神经炎症”,缓解海马神经发生、神经营养因子的减少,运动对“肠漏-免疫激活”的调控是治疗抑郁行为的潜在靶点。近期报道表明,肠道菌群可提供防止辐射损伤的保护。肠道微生物以短链脂肪酸(SCFA)和色氨酸代谢物为代表的微生物衍生代谢物在调节宿主代谢和免疫方面具有重要作用。研究揭示,微生物群-代谢物轴在产生广泛的辐射防护方面发挥关键作用。
最近研究发现,通过重塑肠道微生物群的热适应可以减轻电磁场暴露引起的抑郁行为。研究显示,EMR会引起类似于抑郁症模型的肠道微生物群和代谢物紊乱,而热适应可以通过影响肠道菌群减轻由EMR引起的抑郁症。基于与血清代谢物相关的肠道菌群分析,热适应减轻EMR暴露所引起的抑郁特征,其关键机制也在于肠道菌群。推测肠道菌群也是生物体感应EMR产生相应电磁一生物学效应的关键环节。
实验室培养的大肠杆菌、铜绿假单胞菌和表皮葡萄球菌在静态磁场下的生长模式因物种不同而不同。来自4个使用不同手机受试者的皮肤微生物菌群分离菌也表现出不一致的生长反应。可见手机产生的电磁场会破坏人体皮肤微生物群。除了肠道,宿主的神经系统也可被永久性微生物占据。有学者认为,各种细菌都能从电磁场中受益,在电磁暴露中,这些细菌能增加进入细胞的离子形式化合物由于微生物利用电脉冲的能量,它们可能在宿主的神经回路中定植并削弱神经信号。当前的主要观点:(1)微生物定植宿主神经系统将导致神经信号减弱;(2)微生物对电磁场的敏感性允许肠道菌群在特定的EMR暴露中进行结构性重塑和微生物代谢衍生物的调节,这将使肠道菌群成为电磁一生物学效应中非常灵敏且显著的生物学标志物。
4.2运动通过影响肠道屏障调节EMR导致的肠漏
EMR诱发的炎症反应会破坏肠道屏障和肠道菌群稳态,导致胃肠道上皮壁通透性增加,也称为“肠漏”。通过肠道屏障进入血液的内毒素和炎症因子会破坏血脑屏障,加剧脑组织的氧化应激。当肠道完整性及通透性受到影响时,肠道黏膜免疫系统与肠腔和黏膜中的微生物接触增多,可能增加抑郁症等精神疾病风险。
运动因其可以改变肠道生态系统的功能活动已被研究作为肠道微生物组的重要调节剂。运动会影响肠道黏液层的完整性,以防止微生物粘附于肠道上皮细胞。研究发现有氧运动可以增加胃肠道转运,对肠道pH值、黏液分泌、生物膜形成和微生物对营养物质的吸收产生有利影响。研究发现,以30 min/d的频率游泳1周后可以减轻小鼠慢性应激引起的肠道屏障功能障碍,并减少细菌易位进入肠系膜淋巴结。还有实验表明,6周跑轮运动后,运动引起的微生物群的变化可以转移到无菌小鼠身上,从而改善结肠黏液层,减少结肠免疫细胞的浸润。还有研究表明身体活动水平更高的个体的微生物群落含有更多的嗜黏蛋白阿克曼菌,该菌群可以通过减少拟杆菌门细菌和增加微生物多样性降低肠通透性。且定期运动会降低热休克蛋白对热应激的反应,减少肠上皮细胞之间紧密连接蛋白的分解,可以防止微生物粘附到肠道上皮细胞影响肠道黏液层的完整性。
从免疫的角度来看,长期运动与减少循环炎症细胞因子有关,这些细胞因子会破坏肠道通透性,如IL-6和TNF-α。研究发现,运动过程中的骨骼肌通过释放肌动蛋白增加微生物多样性,从而抑制炎症,增加线粒体生物合成,加速脂肪酸氧化。且运动可以减少健康老年小鼠肠道中的炎症介质和肠淋巴细胞凋亡标记物的表达,表明运动对肠道健康有保护作用。除了免疫适应,抗氧化酶也可以通过增加ROS耐受性来减少运动过程中肠道上皮细胞的压力。以上研究都支持运动可以改善肠道通透性的观点,提示运动可能可以通过改善肠道通透性减轻辐射危害。
4.3运动通过影响短链脂肪酸调节EMR导致的肠道菌群失调
肠道菌群可以通过产生有益的代谢产物修复EMR造成的损伤,如抗氧化生物活性分子短链脂肪酸(short-chain fatty acids,SCFA),其抗炎和抗氧化作用可以改善代谢、免疫和屏障功能,进而调节宿主能量的平衡,增加营养物质的利用率。SCFA还参与肠脑轴,作为信号分子调节免疫和炎症反应,在维持血脑屏障完整性和中枢神经系统稳态的过程中起着核心作用。运动可以丰富微生物群的多样性,刺激调节黏膜免疫的细菌增殖,改善屏障功能,并刺激细菌和功能通路产生能够预防胃肠道疾病的SCFA。研究表明,运动可以通过产生神经递质和SCFA调节肠道菌群稳态,增加SCFA的含量是运动改善肠道屏障的另一种途径。一些动物研究就表明,运动训练增加了产生丁酸盐的细菌的相对丰度,丁酸盐是一种SCFA,可以促进肠道屏障完整性,增加结肠上皮细胞增殖,并调节宿主免疫系统。运动还可以增加乳酸菌并产生乳酸,调节黏膜免疫和清除病原体;B.coccoides和E.rectal的水平也随着运动增加,并且在肠道中,它们将来自乳酸菌的乳酸转化为SCFA从而保护肠道上皮。运动可能是改变EMR暴露后肠道菌群组成和恢复肠道共生的重要干预措施。因此,通过微生物群变化增加具有抗炎及神经保护特性的SCFA,可能是运动修复EMR导致的肠道菌群失调的机制之一。
综上所述,EMR通过影响肠道菌群产生生物学效应,而运动通过影响肠道屏障完整性、短链脂肪酸等产生保护效应。与运动相关的免疫调节作用和抗氧化能力都可以改善肠道完整性。因此,运动对肠道来说是一种刺激性压力源,可刺激有益的适应并提高肠道屏障的弹性,从而修复EMR导致的肠道通透性增加(见图3)。
5小结与展望
铁死亡与肠道菌群是EMR的电磁信号向生物信号转换的关键环节,推测铁死亡与肠道菌群同样介导了运动的抗辐射作用。肠道菌群与铁死亡之间也存在着相互介导关系。最近有研究首次揭示了铁死亡、脂质代谢和肠道微生物群代谢物在环境污染物暴露过程中的功能相关性,证实了铁死亡与肠道菌群结构间的复杂交互作用。当机体暴露于EMR时,铁代谢首当其冲受到影响,诱导细胞凋亡,为此肠道菌群可能发挥了重要的缓冲作用。以上结果提示,EMR这种电磁信号能直接作用于哺乳动物的脑和肠道,通过铁代谢和肠道菌群产生生物学效应,影响人体的情绪和行为。长期、充分的运动训练可以提高神经可塑性,对EMR诱发的负面情绪有积极影响。但是,运动训练的方法和时间对运动训练的效果也有不可忽视的影响。只有规律的、有效的、充分的运动训练才能缓解EMR环境导致的负面情绪。其中还有一系列问题没有解决:EMR达到怎样的频率和功率才能导致动物的异常情绪和行为?EMR电磁信号与生物信号的耦联机制是如何调节的?铁介质是否是生物体感受EMR过程中的关键分子?感受电磁信号的铁代谢与肠道菌群之间的交互作用如何?基于当前对EMR和神经疾病的认识,本综述提出一种科学假设:长时间高剂量EMR通过神经元铁死亡和/或肠道菌群重构产生生物学效应,但这种影响可能会因运动抑制神经元铁死亡和/或肠道菌群重构而有改善(见图4)。
对于未来的研究,为了保护人群免受不必要的暴露或获得更好的治疗效果,有一些基本问题需要探讨:电场和磁场的参数(强度、频谱、波形、持续时间)如何控制才能获得可观察到的生物学甚至健康效应?这些问题的答案归结为了解电磁场如何作用于生物体的机制。未来对EMR环境下运动是否及如何通过调控铁死亡或肠道菌群发挥抗辐射或神经保护作用的研究,有望进一步丰富对EMR与神经精神疾病之间关系的科学认识,揭示EMR影响人类情绪和行为的阈值以及转导机制,为运动抗辐射、预防神经疾病提供新的理论视角和干预方法。
作者贡献声明:
黄卓淳:提出论文选题,设计论文框架,撰写、修改论文。
漆正堂:凝练论文思路,指导、修改论文。
刘微娜:凝练论文思路,完善论文框架,指导、修改论文。

