胆汁酸与肠道菌群在原发性硬化性胆管炎中的作用及相关机制研究进展
梁秋利,尹毅霞,梁锦慧,覃金丹
(1.右江民族医学院附属医院消化内科,广西百色 533000;2右江民族医学院研究生学院,广西百色 533000;3.广西分子病理学〔肝胆疾病〕重点实验室,广西百色 533000)
原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)是一种相对少见、复杂的肝病,特征为肝内、外胆管发生炎症,逐渐纤维化使管腔狭窄、胆汁慢性淤积,最终进展为肝纤维化,甚至肝功能衰竭。其发病率和患病率在不同地区呈现不同的分布。PSC患者可能没有明显症状,也可能有瘙痒、乏力、右上腹疼痛、复发性胆管炎或门静脉高压后遗症,同时,该类患者常合并碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转移酶(Gamma-glutamyltransferase,γ-GGT)活性升高等血清学变化[1-4]。根据现有研究,目前对PSC的病因及发病机理仍然知之甚少,大多数研究成果更倾向于以遗传易感性、免疫因素、环境因素为PSC的发病机理[5]。近年来,随着人们对PSC研究的不断深入,PSC的发病与肠道菌群的关系逐渐成为研究热点,基于肠-肝轴,肠道菌群可能通过化合物的合成或宿主产生分子的共代谢而促进PSC发病,胆汁酸可能介导PSC中肠道菌群的作用,这些因素都可能参与了PSC发病机制的启动[6]。本文就PSC与胆汁酸、肠道菌群三者之间的关系主要研究进展进行综述。
1 PSC胆汁酸谱变化
胆汁酸分泌紊乱会影响肠道微生物群和免疫稳态,过多的胆汁酸在肝内蓄积,产生“胆汁酸毒性”,这是PSC发病机制中的一个因素[7]。研究发现[8],PSC患者、原发性胆汁性胆管炎(primary biliary cholangitis,PBC)患者、非胆汁淤积症患者体内的胆汁酸水平存在差异。PSC患者体内的初级胆汁酸浓度及总胆汁酸水平较非胆汁淤积症患者高;与PBC及非胆汁淤积症相比,PSC血清次级游离胆汁酸[石胆酸(lithocholic acid,LCA)和脱氧胆酸(dexyocholic acid,DCA)]水平的降低,提示PSC患者体内的胆汁酸代谢存在异常,胆汁酸的肠-肝循环受到一定程度影响,胆汁酸的代谢紊乱与PSC的发生可能有着一定的联系。同时发现PSC患者胆红素、ALP、谷丙转氨酶(ALT)、谷草转氨酶(AST)水平与血清胆汁酸水平呈正相关。TORRES等人[9]研究发现,原发性硬化性胆管炎合并炎症性肠病(PSC-IBD)患者初级胆汁酸含量较炎症性肠病(IBD)患者高,次级胆汁酸较IBD患者少。TABIBIAN等人[10]研究发现,无菌(ermfree animal,GF)Mdr2-/-小鼠(一种硬化性胆管炎的动物模型)胆汁酸排出减少,粪便中胆汁酸含量减少,胆囊和肠道中胆汁酸含量显著增多。同时,GF Mdr2-/-小鼠的肝脏酶学指标包括ALP、ALT、AST和胆红素明显增高,差异有显著性。FUCHS等人[11]研究发现,减少Mdr2-/-小鼠体内胆汁酸的再摄取和肝肠循环,可调节机体内胆汁酸代谢,改变胆汁酸稳态,使亲水性胆汁酸占比升高,最终此类小鼠肝组织损伤得到改善,胆管及肝组织炎症减轻,纤维化程度降低。由此可见,胆汁酸谱的变化可能影响着PSC的进展,并与胆汁淤积性肝损害存在着一定联系。
2 肠道菌群
肠道是一个营养丰富且拥有百万亿计微生物的环境,我们可将其看作是一个密集而充满竞争的微生物生态系统[12]。肠道内的益生菌可以改善肠道的生态环境,抑制细菌及其代谢产物移位,同时,益生菌还可充当“抗炎菌”的角色,可抑制细胞促炎因子的释放、抑制信号通路,从而发挥免疫调节的作用[13]。胃肠道微生物群落随着宿主的生长发育而不断更替优势菌群,各种因素(例如生活饮食习惯、肥胖等)都可影响并改变胃肠道菌谱[14]。肠道微生物群的组成和功能差异与人类健康有着密切联系[15]。寄居于宿主体内的微生物群在肝脏疾病中起着关键作用,肠道微生物可以通过多种方式互相影响肝脏疾病的发生[16]。
肠道微生物代谢异常会触发肠道屏障破坏,如粪肠球菌的共生菌株产生金属蛋白酶可损害宿主上皮屏障的完整性;肠道屏障受到破坏会导致细菌移位,从而连续激活免疫细胞,在肝脏中释放各种促炎因子和趋化因子[17]。研究表明[18],PSC发病机理与肠道微生物群和微生物因子的代谢产物有着密切的联系。LIAO等人[19]利用小鼠肝脏Mdr2基因敲除(Mdr2-/-)模型研究肠-肝循环对胆汁淤积性肝病(CLD)的功能作用,结果表明,肠道微生物群易位增加、肠道营养不良是Mdr2-/-小鼠患CLD的重要驱动因素。PSC患者的肠道微生物区系不同于无PSC的炎症性肠病患者和健康对照组,PSC患者肠道微生物多样性降低[20]。SABINO等人[21]的研究表明,PSC患者的粪便生态失调包括物种丰富度的降低和群落组成的改变。TROTTIER等人[8]研究发现,与单独的IBD相比,PSC-IBD患者粪便中细菌多样性发生改变,瘤胃球菌和梭杆菌丰度较高,罗氏菌、韦荣球菌、毛螺菌含量相对减少。TORRES等人[22]的研究表明,与健康人相比,PSC患者肠道菌群的特征为布鲁氏菌和巴尼西亚科的富集。改善PSC微生物组的多样性,增加PSC患者与健康人群微生物组的相似性,PSC患者的血清ALP、ALT和AST也有不同程度的下降,进一步证实了肠道微生物群在PSC病理生理中的作用[23]。
3 肠道菌群与胆汁酸的相互作用
人体内合成初级胆汁酸的途径有两条,一条是肝脏胆固醇7α-羟化酶(CYP7A1)诱导的,主要生成胆酸(CA)、鹅脱氧胆酸(CDCA)的经典途径,即胆汁酸合成的主要途径;另一条是胆固醇27-羟化酶(CYP27A1)诱导的,主要生成CDCA的途径,也称替代途径[24]。部分初级胆汁酸从胆道排出后进入肠道,并在肠道菌群的作用下转换为次级胆汁酸[25]。其中绝大部分胆汁酸于回肠末端被重新吸收,经门静脉系统进入肝脏,生成新的结合胆汁酸,并依次分泌到胆道、肠道中,这就形成了胆汁酸的肝肠循环(EHC)。同时,胆汁酸是我们体内重要的信号分子,可通过与G蛋白偶联胆汁酸受体(TGR5)、法尼醇X受体(FXR)和孕烷X受体(PXR)等胆汁酸受体结合参与调节机体内物质代谢调节和免疫应答的调节[26]。其中,FXR的负反馈在胆汁酸肝肠循环中起着重要作用。当肠道胆汁酸水平升高时,FXR可通过成纤维细胞生长因子19(FGF19)/CYP7A1轴负反馈降低其合成及稳态[27]。胆盐水解酶(BSH)对于宿主中的胆汁酸稳态是必需的[28]。肠道菌群的多样性与BSH活性呈负相关,而BSH的活性又进一步影响FXR的表达,最终影响胆汁酸合成过程[29]。胆汁酸的代谢可通过维持肠道微生态的平衡、减少肠道致病菌丰度来调控[30]。BEHR等人[31]研究结果表明,肠道微生物群落的变化会影响血浆和粪便中的胆汁酸池,胆汁酸谱的变化也可以反映出肠道微生物组的改变。相关研究表明[32],微生物菌群与胆汁酸有着潜在的相关性,肝脏通过胆汁酸或炎症信号因子影响微生物群,胆汁酸对维持肠道菌群的稳态也有着一定作用。由于胆汁酸的疏水性及结构也可损害细菌细胞膜的完整性,从而发挥了潜在的直接抗菌作用[33]。胆汁酸通过FXR激活来调节宿主肠道基因的表达,有助于胆汁酸的抗菌作用,促进对肠腔内细菌的先天防御,进而影响肠道微生物组成[34]。综上所述,胆汁酸与肠道菌群相互作用(图1),在肝肠循环的作用下调节机体代谢。
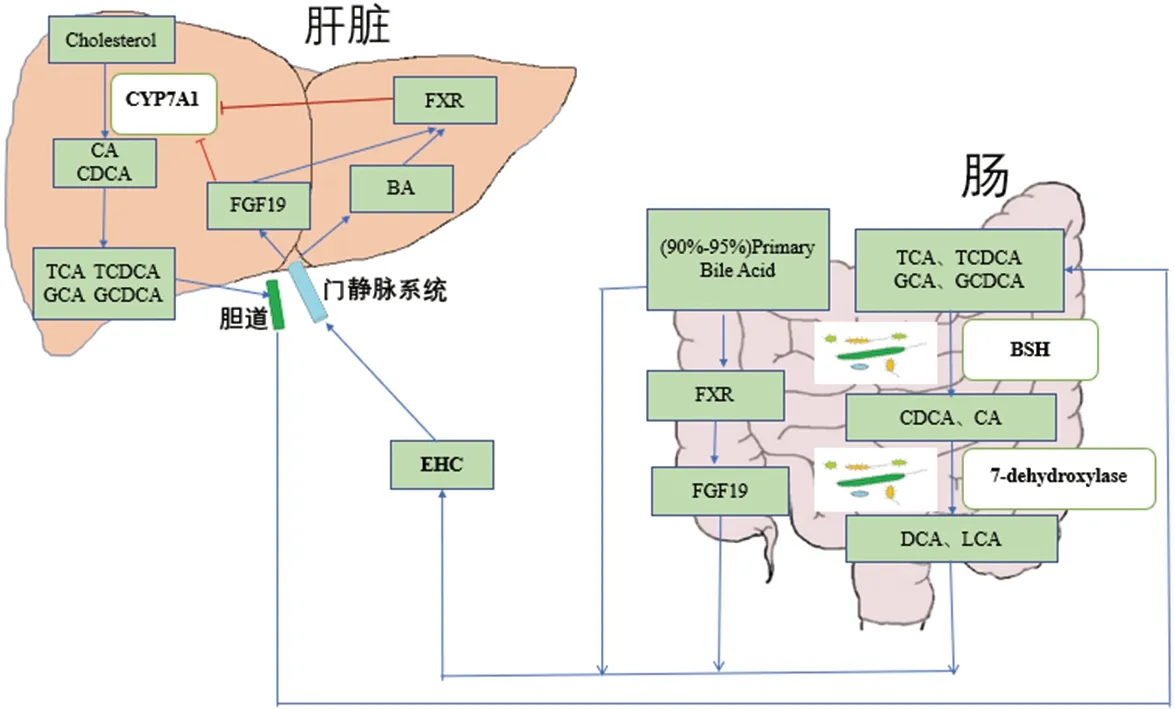
注:BSH(胆盐水解酶);CA(胆酸);CDCA(鹅脱氧胆酸);Cholesterol(胆固醇);CYP7A1(胆固醇7α-羟化酶);DCA(脱氧胆酸);7-dehydroxylase(7-脱氢酶);EHC(肝肠循环);FGF19(成纤维细胞生长因子19);FXR(法尼醇X受体);GCA(甘氨胆酸);GCDCA(甘氨鹅脱氧胆酸);LCA(石胆酸);TCA(鹅脱氧胆酸);TCDCA(牛磺鹅脱氧胆酸)
4 胆汁酸、肠道菌群与PSC的关系
肠道菌群与胆汁酸的关系被认为在PSC的发病机制中起着关键作用。国内外学者[35-37]认为“胆汁酸-肠道菌群-胆汁淤积三角”在胆汁淤积性肝病的发病机理中尤为重要,这也是了解PSC发病机制的重要一环。胆汁酸可能介导肠道菌群破坏免疫稳态,研究胆汁酸和肠道微生物群之间的联系为PSC的发病机制研究提供了一个新的视角。PSC患者表现出肝内外胆管的生态学改变,包括生物多样性减少和毒性胆汁酸增多。PSC中的微生物营养不良与促炎作用和潜在“毒性胆汁酸”的增加有关[38]。胆汁酸影响肠道菌群的细菌组成,而微生物的代谢作用又会反过来引起胆汁酸谱的变化,其中,肠道菌群被认为是促进脱氧胆酸、石胆酸等潜在毒性胆汁酸合成过程的主要驱动力[39]。SABINO等[21]应用16S rDNA测序发现与健康志愿者相比,PSC患者肠道菌群中肠球菌属、梭杆菌属、乳杆菌属及拟杆菌属明显增加,出现肠道菌群失衡现象,肝功能检测提示肝功能损伤,ALP、GGT上升明显。CORTEZ等[40]和KUMMEN等[41]的研究结果支持SABINO等[21]的结论。在不同PSC动物模型[常规饲养(conventional breeding,CV)Mdr2-/-小鼠、无菌(GF)mutltidrug抗药性基因敲除Mdr2-/-小鼠、Mdr2-/-小鼠]的研究中发现,PSC小鼠组与正常对照组相比,PSC小鼠肠道菌群组成结构、胆汁酸、肝脏酶学指标均有不同程度的改变,胆汁酸增加导致对肝脏毒性增加,引起肝功能异常[10-11]。有研究发现,PSC患者中出现了肠道真菌组成的改变,但肠道真菌多样性的改变是否参与了肠道炎症的发生、是否促进了PSC的发病仍需要进一步的研究加以证实[42]。
5 总结与展望
综上所述,肠道菌群与胆汁酸在PSC的发病机制中起着关键作用,它们之间的关系是双向的,既互相联系,又互相影响。目前,PSC发病机制仍未完全明了,且病情复杂、多变,给治疗方案的选择带来诸多的困难。“胆汁酸-肠道微生物群-胆汁淤积三角”让我们进一步了解了PSC的发病机制,为PSC靶向治疗提供了一定的理论依据。国内外探讨肠道微生物群的改变对PSC发生发展的影响及其机制的研究已有报道,但对PSC胆汁微生物群的改变及其与胆汁酸代谢相互作用的文献研究尚少,胆汁酸及胆道菌群对PSC发生的影响或将能为PSC发病机制及诊疗的研究提供一个新的思路和方向。

