深部热疗辅助安罗替尼治疗晚期肺腺癌的临床疗效及安全性
刘申吒 孙长春 崔丽华 王 钊 黄余峰 于立江 凌 锐 韩国虎
扬州大学附属靖江市人民医院1.肿瘤内科; 2.病理科,江苏 靖江 214500;3.江苏大学附属医院肿瘤研究院,江苏 镇江 212001
非小细胞肺癌是肺癌最常见的类型,占比超过80%[1]。肺腺癌是非小细胞肺癌的主要组织学亚型,早期肺腺癌患者的症状不明显,很难发现[2]。手术治疗是早期肺腺癌的首选治疗措施,但大多数肺腺癌患者就诊时已处于中晚期,失去了手术机会,晚期一、二线治疗多数采用含铂类、紫杉类等抗肿瘤药为基础的标准化疗方案,但全身化学治疗对于晚期肺腺癌疗效有限,且不良反应显著[3]。安罗替尼是一种新型的抗血管生成药,可高度选择性抑制血管内皮生长因子受体、血小板衍生生长因子受体、成纤维母细胞生长因子受体,使血管趋向正常化,亦或阻断肿瘤新血管生成,达到抗肿瘤的功效[4]。随着化疗、靶向治疗后耐药细胞株的出现,目前的治疗方式对肺腺癌的疗效已达瓶颈,寻找新的治疗方法迫在眉睫。其中深部热疗的抗肿瘤作用日益受到重视,其不仅能直接杀伤肿瘤细胞,还可联合放化疗提高疗效[5]。本研究采用深部热疗辅助安罗替尼的方案治疗晚期肺腺癌患者,探讨其临床疗效以及用药安全性。
1 资料与方法
1.1 研究对象
选取2020年6月至2021年12月扬州大学附属靖江市人民医院肿瘤内科收治的46 例晚期肺腺癌患者为研究对象,根据随机数字表法分为治疗组(安罗替尼联合深部热疗组,23 例)和对照组(安罗替尼组,23 例)。入组标准:(1)两组病例均为晚期且接受过 ≥ 2 种系统化疗后出现进展或复发的患者,且有组织病理学及影像学确诊;(2)生活质量卡式(Karnofsky performance status,KPS)评分≥ 70 分,预计生存期不小于3 个月,至少有1 个可测量的实体病灶;(3)血粪尿常规、生化全套无明显异常指标,临床资料完整。排除标准:(1)治疗禁忌(合并严重心、肺、肝、肾疾病)或合并其他原发性肿瘤;(2)具有精神障碍、凝血功能异常、无法控制的高血压病、伴明显咯血的患者。纳入研究的患者一般临床病理资料比较,差异无统计学意义(P> 0.05)。详见表1。本研究所有患者或其亲属均在知情同意书上签字,并通过扬州大学附属靖江市人民医院伦理委员会的批准(2021-03-029)。
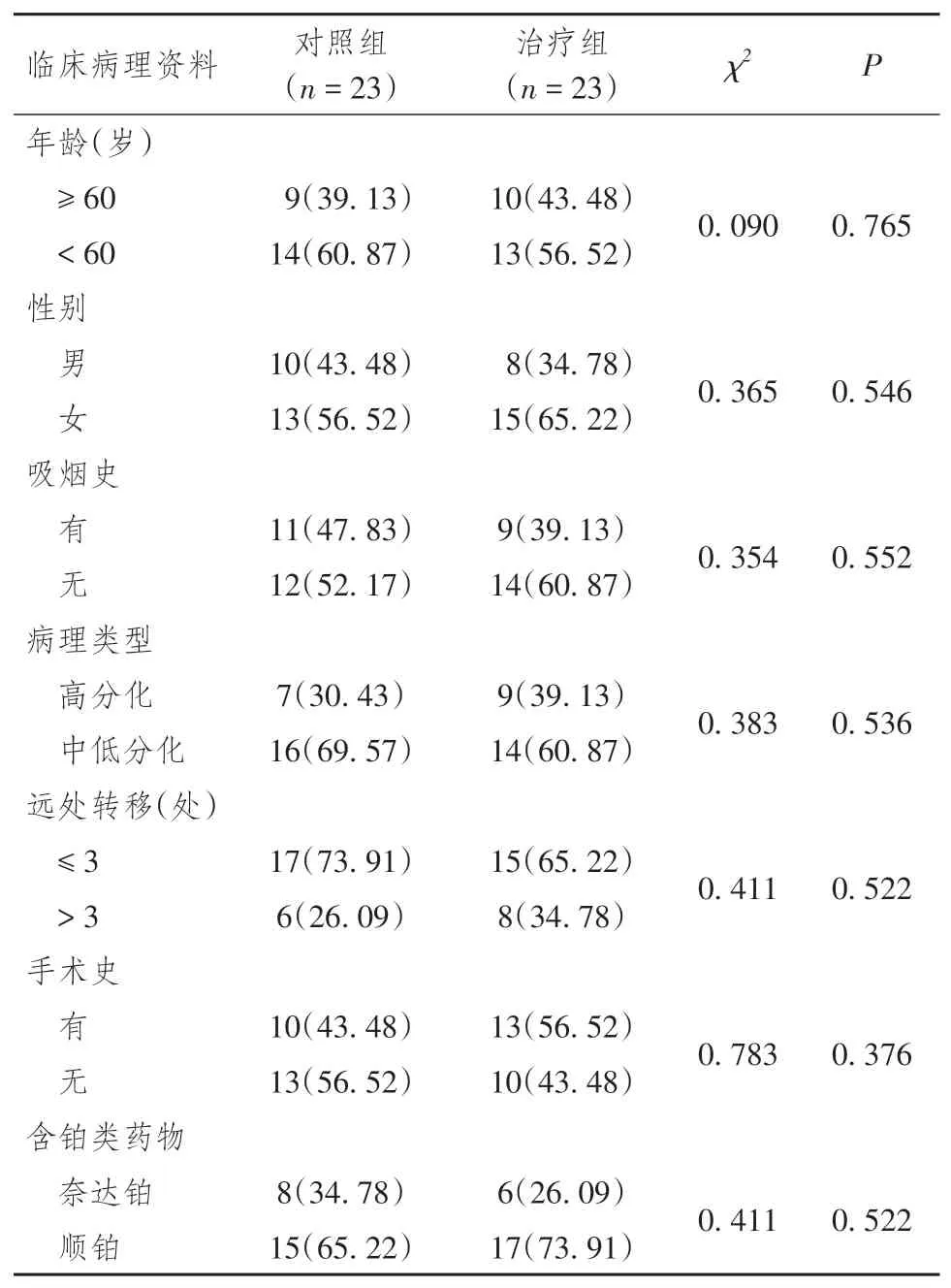
表1 两组晚期肺腺癌患者临床病理资料比较[n(%)]
1.2 研究方法
对照组患者单纯给予安罗替尼每日10 mg,早餐前口服,连续服药2 周,停药1 周,共治疗12 周。安罗替尼规格10 mg/粒,制造商:连云港正大天晴公司,国药准字号:H20180003。治疗组患者同时给予深部热疗,采用肿瘤热疗仪(品牌:SENMO,规格型号:HY7000-1),每周2次,达到预设温度后,每次治疗时间持续40 min,功率350 ~ 700 W,预设温度42~ 43 ℃,每次热疗均在口服安罗替尼后1 h内进行,连续治疗12周。
1.3 观察指标
疗效评价采用世界卫生组织实体瘤疗效评定标准,目标病灶依次分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)以及疾病进展(progressive disease,PD),以(CR+PR)/总病例数 × 100%为客观有效率(objective response rate, ORR),以(CR+PR+SD)/总病例数 × 100%为疾病控制率(disease control rate, DCR)。不良反应参照美国国立癌症研究所常见毒性分级标准(4.0版)实施。肿瘤患者生活质量评估采用KPS 评分标准,评分范围为0 ~ 100 分,评分越高表示该患者生活质量越好。收集检验报告单中治疗前后静脉血中癌胚抗原(carcinoembryonic antigen,CEA)、血 管 内 皮 生 长 因 子(vascular endothelial growth factor,VEGF)水平、免疫指标(CD3、CD4、CD8、NK)情况。
1.4 统计学分析
本研究应用SAS 9.2 统计软件分析数据,计数资料采用[n(%)]表示,两组间比较采用χ2检验,计量资料采用均数±标准差表示,两组间比较采用独立样本t检验。检验水准α= 0.05。
2 结 果
2.1 两组患者临床疗效比较
治疗12 周后,治疗组ORR(65.21%)优于对照组(34.78%),差异有统计学意义(χ2= 4.261,P=0.039)。治疗12 周后,治疗组DCR(91.30%)优于对照组(60.87%),差异有统计学意义(χ2= 5.855,P= 0.016)。详见表2。
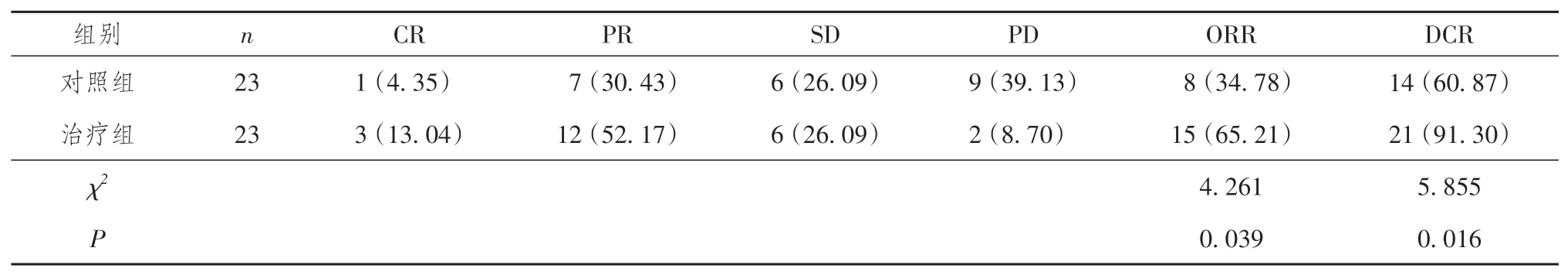
表2 两组晚期肺腺癌患者临床疗效比较[n (%)]
2.2 两组患者临床表现好转情况比较
治疗12 周后,治疗组患者的咳嗽、气急、胸痛、疲乏、咳血、食欲下降好转率均高于对照组,差异均有统计学意义(P均 < 0.05)。详见表3。
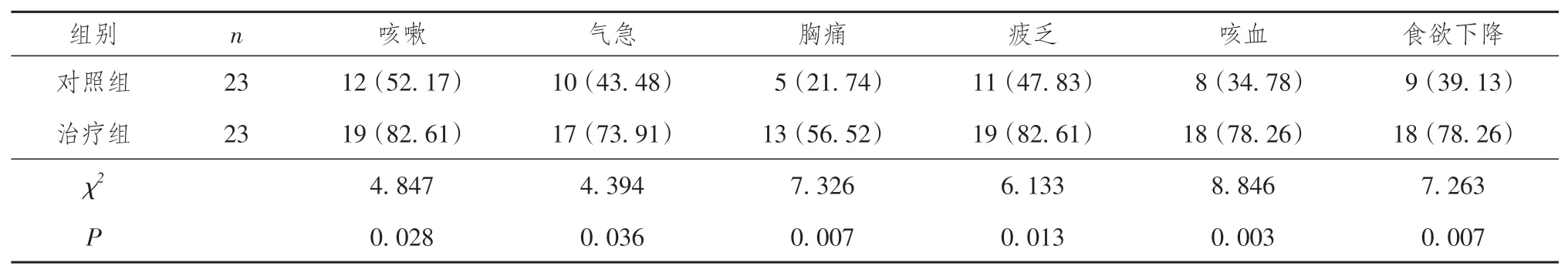
表3 两组晚期肺腺癌患者临床表现好转效果比较[n(%)]
2.3 两组患者治疗期间不良反应发生情况的比较
治疗期间,治疗组患者胃肠道反应发生率低于对照组(P< 0.05),而两组患者高血压、肝功能损伤、骨髓抑制、甲状腺功能减退发生率比较,差异均无统计学意义(P >0.05)。详见表4。
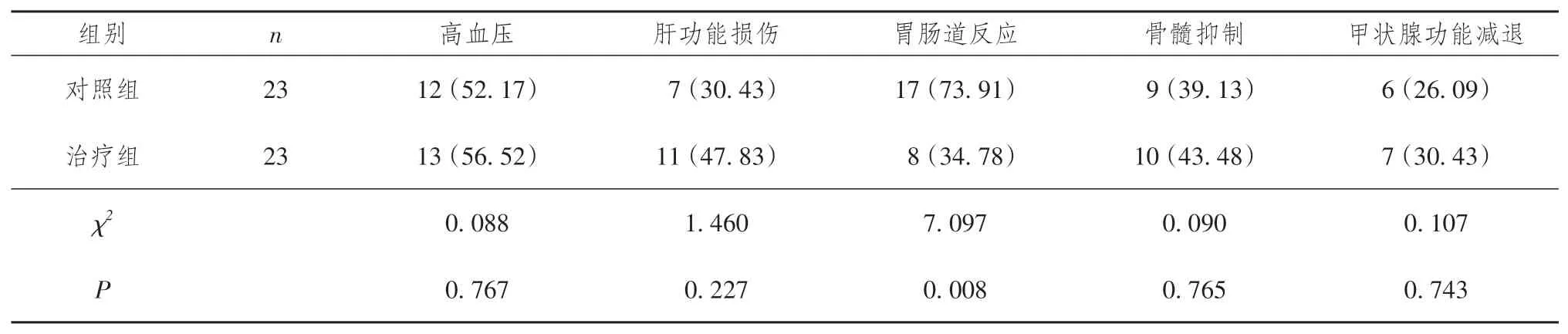
表4 两组晚期肺腺癌患者治疗期间不良反应发生比较[n (%)]
2.4 两组患者肿瘤标志物水平和阳性率比较
对照组与治疗组患者治疗后的CEA、VEGF 水平及其阳性率均低于治疗前,差异均有统计学意义(P均 < 0.05);治疗12 周后,治疗组患者的CEA、VEGF 水平及其阳性率均低于对照组,差异均有统计学意义(P均 < 0.05)。详见表5。
表5 两组晚期肺腺癌患者治疗期间肿瘤标志物水平及其阳性情况比较[± s,n(%)]
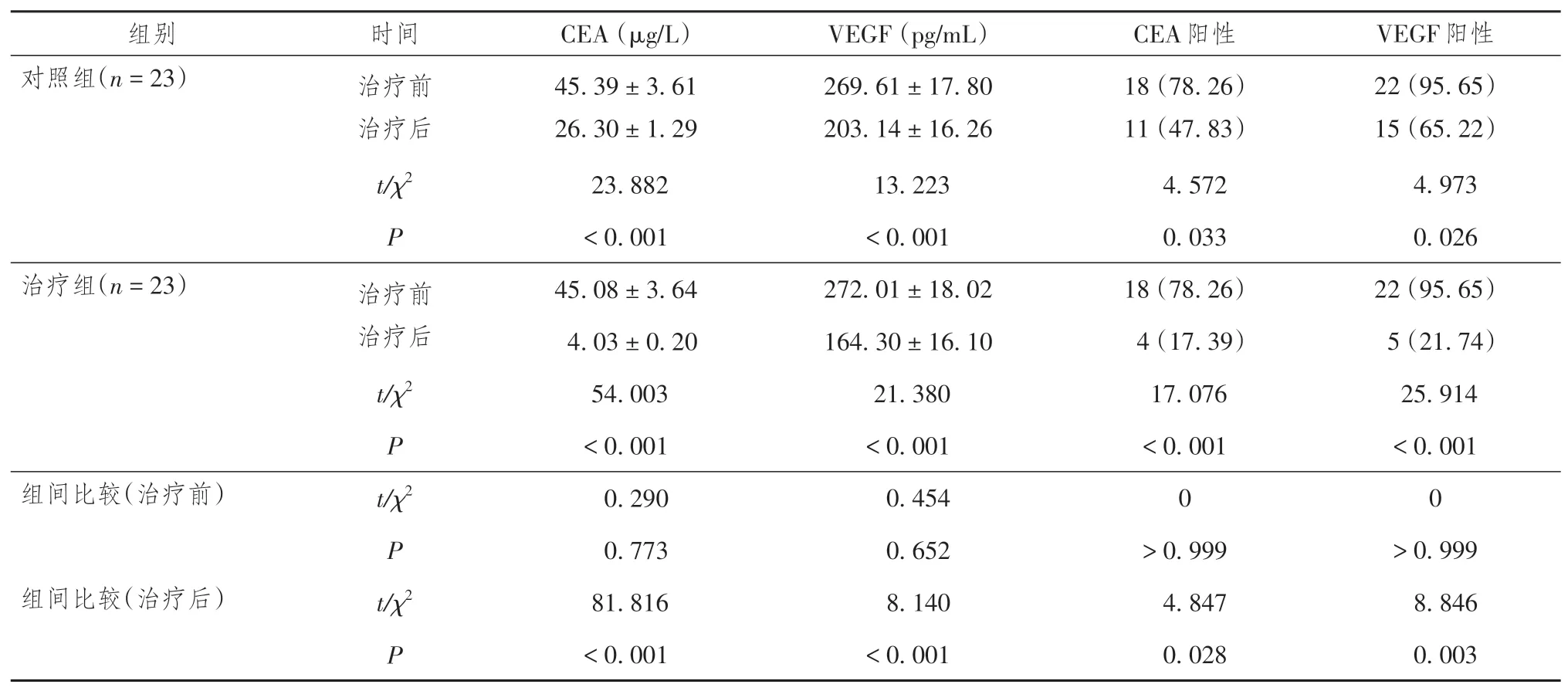
表5 两组晚期肺腺癌患者治疗期间肿瘤标志物水平及其阳性情况比较[± s,n(%)]
注:对照组给予安罗替尼治疗,治疗组给予安罗替尼联合深部热疗。CEA为癌胚抗原,参考值范围:≤ 5 μg/L;VEGF为血管内皮生长因子,参考值范围:6.25 ~ 142.2 pg/mL。
?
2.5 两组患者免疫指标比较
治疗前,两组患者的CD3、CD4、CD8、NK 细胞水平比较,差异无统计学意义(P> 0.05);治疗12 周后,治疗组患者的CD3、CD4 水平均高于对照组,差异有统计学意义(P< 0.05),而两组患者的CD8、NK 细胞水平差异无统计学意义(P> 0.05);两组患者治疗前的CD3、CD4水平均低于治疗后,差异有统计学意义(P< 0.05),但两组患者治疗前后的CD8、NK 细胞水平差异无统计学意义(P >0.05)。详见表6。
表6 两组晚期肺腺癌患者免疫指标情况比较(± s)
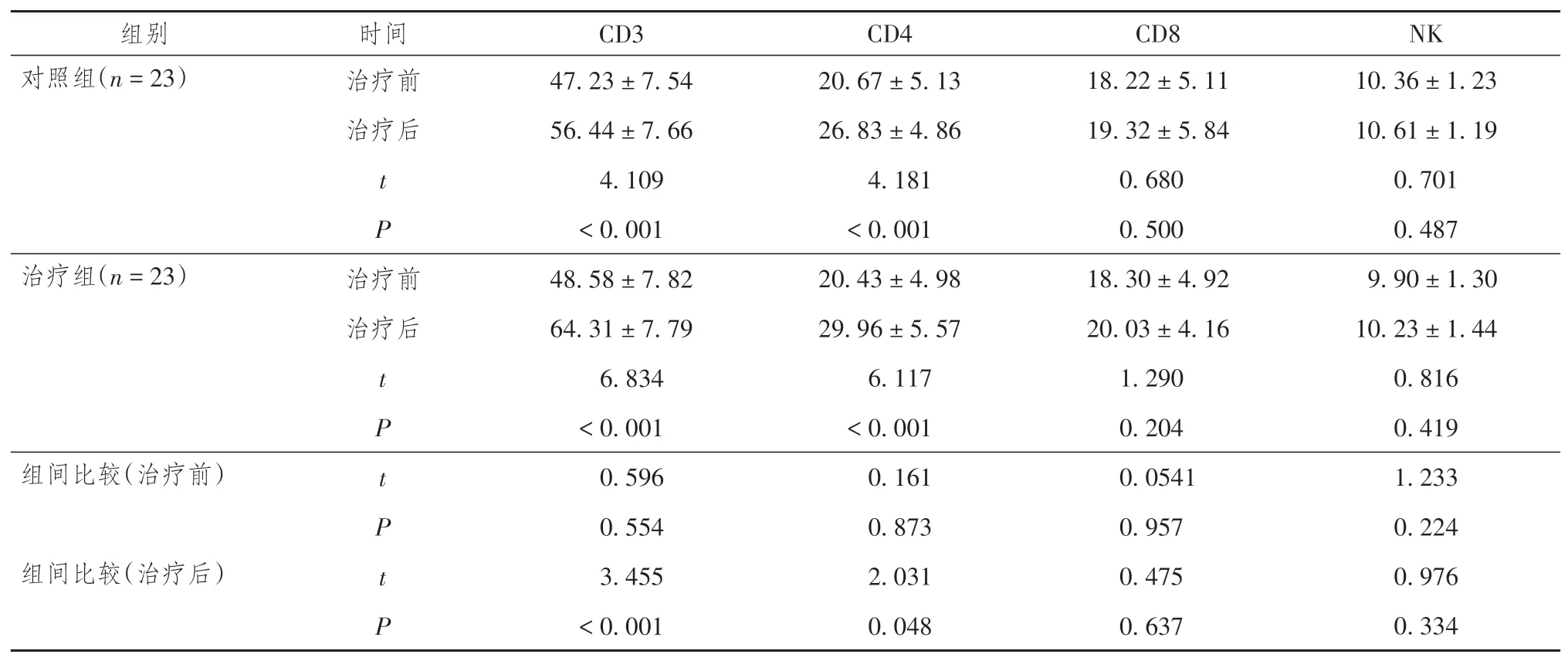
表6 两组晚期肺腺癌患者免疫指标情况比较(± s)
注:对照组给予安罗替尼治疗,治疗组给予安罗替尼联合深部热疗。
?
2.6 两组患者生活质量比较
治疗12 周后,治疗组KPS 评分升高率(65.22%)优于对照组(34.78%),差异有统计学意义(χ2= 4.261,P= 0.039)。详见表7。
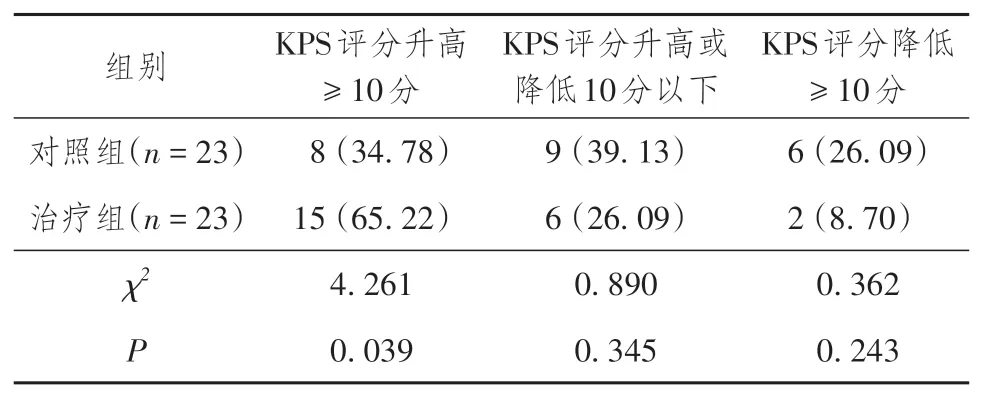
表7 两组晚期肺腺癌患者生活质量情况比较[n(%)]
3 讨 论
目前晚期肺癌治疗方式主要有姑息性放化疗、靶向治疗、免疫治疗。驱动基因阳性的肺癌患者可选择敏感的针对特定受体的靶向药物治疗。研究表明,对于EGFR、ROS、MET 等驱动基因突变阳性的晚期肺癌患者,合适的靶向药物治疗能明显延长患者总生存时间和无进展生存时间[6]。而对于驱动基因阴性的晚期肺癌患者,含铂类药物化疗为一线标准治疗,可以缩小肿瘤体积,延长患者生存期[7]。但是化疗药物会损害患者的骨髓、肝肾、消化道功能,化疗时间越长,化疗药物累积的毒副反应越大,患者的生活质量也越差,后期随着耐药的出现,疗效甚微,因此部分患者不得不停止化疗。深部热疗作为一种新型的抗肿瘤“绿色治疗”手段,能使肿瘤细胞内部升温直接杀伤肿瘤细胞,还可联合放化疗提高临床疗效,逐渐引起关注[8]。
肿瘤微环境中含有大量微血管,肿瘤细胞分泌VEGF,诱发新生血管向肿瘤提供营养和氧气,促进肿瘤生长、转移[9]。安罗替尼是首个被中国国家食品药品监督管理局批准用于非小细胞肺癌三线及以上治疗的多靶点抗血管生成药物。研究表明,安罗替尼单药应用于27 例三线及以上的晚期非小细胞肺癌患者的ORR 为51.85%,DCR 为85.18%[9]。另一项研究表明,安罗替尼单药治疗至少两线治疗失败的915 例晚期非小细胞肺癌患者的ORR 为50.00%,DCR 为61.00%[10]。范舒雅对热疗联合同步放化疗在晚期非小细胞肺癌患者中的疗效进行观察,发现同步放化疗联合热疗ORR 为90.6%,DCR 为96.9%,同步放化疗组ORR 仅为69.2%,DCR为92.3%,但是两组DCR比较差异无统计学意义[11]。本 研 究 结 果 显 示,安 替 罗 尼 组ORR 为34.78%,DCR为60.87%,安罗替尼联合深部热疗组ORR 为65.21%,DCR 为91.30%,提示深部热疗联合安罗尼可明显提高临床疗效。本研究病例纳入较少,可能导致了与以上研究结果的差异。热疗增敏安罗替尼的原理可能是利用肿瘤细胞的热敏感性,促使恶性肿瘤细胞膜性结构通透性增加,抗肿瘤药物聚集于肿瘤内部的浓度上升,加速细胞凋亡,最终有效杀灭肿瘤细胞,病灶周围的正常组织因血流正常、散热良好不会损伤[12]。抗血管生成治疗效果虽佳,但易引起高血压、出血、蛋白尿、骨髓抑制、呕吐、体力下降等不良反应,限制了其临床应用,但大部分经过间隔服药、减少药物剂量或者对症治疗等处理得以好转[13]。本研究中治疗组患者的咳嗽、气急、胸痛、疲乏、咳血、食欲下降、胃肠道反应较对照组明显改善。研究显示,深部热疗联合或不联合抗血管药物贝伐珠单抗治疗恶性腹水的肿瘤患者的DCR分别是83.33%和56.67%,相对于单用贝伐珠单抗,联合组治疗后的症状改善更明显、VEGF 水平更低[14]。提示深部热疗联合贝伐珠单抗可提高恶性肿瘤患者的抗血管生成能力和免疫水平。VEGF 可以刺激血管内皮增殖,是肿瘤血管生成的关键物质,CEA 是一种蛋白多糖复合物,属于常见的肿瘤标志物。研究表明,肺癌患者静脉血VEGF、CEA 过表达,与肿瘤复发、进展、预后有关[15]。随着肿瘤体积的降低,血清肿瘤标志物水平也随之下降。本研究显示,两组患者治疗前的CEA、VEGF 水平及其阳性率均高于治疗后;治疗后,对照组患者的CEA、VEGF水平及其阳性率均高于治疗组。原因可能是安罗替尼通过阻断其下游信号通路干扰血管生成,从而抑制肿瘤细胞增殖、转移,故患者静脉血CEA、VEGF水平降低。另一方面,热疗促进免疫细胞穿透血管壁,深入肿瘤微环境,增强免疫反应,一定程度上降低了CEA、VEGF的释放。免疫治疗(比如PD-1/PD-L1)是一种新型的抗癌疗法,通过防止免疫系统过度激活以及保持机体免疫平衡发挥抗肿瘤作用[16]。癌细胞在高温下增加其表面MHC Ⅱ分子的表达,增加适应性免疫细胞的成熟、抗原呈递,进而增强免疫反应[17]。研究证实,帕博利珠单抗单药使Ⅳ期肺癌中位总生存期达到了10.3 个月,不良反应可控,而含铂类化疗中位总生存期仅为6个月[16]。热疗联合贝伐珠单抗患者的静脉血中CD3、CD4水平更高[13],热疗联合免疫治疗使患者的ORR 提高了18.3%[18]。本研究表明,治疗后治疗组患者的CD3、CD4水平均高于治疗前,治疗组患者的CD3、CD4 水平均高于对照组;两组患者治疗前的CD3、CD4 水平均低于治疗后。说明热疗辅助安罗替尼治疗晚期肺腺癌患者可改善其细胞免疫水平,增强机体免疫力,改善患者生存质量,同时热疗属于无创性操作,患者易于接受,依从性好,临床可推广使用。
综上所述,对于晚期肺腺癌患者采用深部热疗辅助安罗替尼治疗可明显提高ORR和DCR,缓解患者的咳嗽、气急、胸痛、疲乏、咳血、食欲下降等不适表现,有效减轻相关药物不良反应,增强患者免疫力,可作为晚期肺腺癌患者的一种选择。本研究观察时间较短,单中心,病例数少,其生存时间和无进展时间还有待进一步探索。
利益冲突所有作者均声明不存在利益冲突

