lncRNA NUTM2B-AS1对口腔鳞状细胞癌细胞侵袭和迁移的影响及机制
鲁晓娟,沈玉芹,付应盼,陈海英,郭 迪(皖西卫生职业学院附属医院口腔科,六安 37005;山东大学附属医院口腔科;通讯作者,E-mail:ym0505@63.com)
口腔鳞状细胞癌是一种原发性的口腔内肿瘤,易发生早期远处转移和复发,患者总生存期较短[1]。口腔鳞状细胞癌的治疗方式包括手术治疗、化疗和放疗等,但多数患者预后不佳[2]。口腔鳞状细胞癌的发病机制并不清楚,在分子水平上明确其发生和发展机制,进行分子靶向治疗是口腔鳞状细胞癌研究的焦点。
长链非编码RNA(lncRNA)是一类无法编码蛋白的内源性RNA分子,其转录本通常大于200个核苷酸[3]。lncRNA作为细胞内的功能单位,主要定位在细胞质中,广泛参与正常细胞的分化、增殖、衰老等过程[4]。研究指出,lncRNA在多种恶性肿瘤如神经母细胞瘤、淋巴瘤、口腔鳞状细胞癌中异常表达,影响恶性肿瘤的进展[5-7]。研究显示,NUTM2B-AS1基因定位于10号染色体,包含两个外显子,NUTM2B-AS1参与宫颈癌的发生、发展[8]。有关NUTM2B-AS1在口腔鳞状细胞癌中的表达及对癌细胞生物学行为的影响尚未明确,NUTM2B-AS1可能在口腔鳞状细胞癌中发挥生物学功能。本研究旨在分析NUTM2B-AS1在口腔鳞状细胞癌组织和细胞系中的表达,探讨高表达NUTM2B-AS1对口腔鳞状细胞癌细胞侵袭和迁移的影响及其分子机制。
1 材料与方法
1.1 细胞株与主要试剂
口腔鳞状细胞癌细胞系Cal-27、SCC-25、SCC-9、HSC-3和口腔上皮角质细胞系HOK均购自中国科学院上海细胞所。pmirGLO-NUTM2B-AS1过表达载体和pmirGLO空载体购自上海吉凯基因有限公司。DMEM培养基、DMEM/F12培养基、胎牛血清、口腔角质细胞培养基购自美国Gibco公司。miR-NC、miR-770-5p、WT-NUTM2B-AS1载体、MUT-NUTM2B-AS1载体购自上海碧云天生物技术公司。Lipofectamine 3000转染试剂和基质胶购自美国Sigma公司。Transwell小室、双荧光素酶报告基因检测试剂盒购自美国Fermentas公司。BCA蛋白检测试剂盒购自北京索莱宝生物科技公司。一抗Sirt7、E-cadherin、Smad4、MMP-7、vimentin、β-actin和二抗均购自美国Cell Signaling公司。
1.2 生物信息学方法
通过TCGA数据库(https://www.genome.gov/Funded-Programs-Projects/Cancer-Genome-Atlas)分析口腔鳞状细胞癌组织和癌旁组织中NUTM2B-AS1的表达量。通过LncCeRBase生物信息学软件(http://www.insect-genome.com/LncCeRBase/front/)分析NUTM2B-AS1能够互补结合的微小RNA(miRNA)。
1.3 细胞培养和分组转染
口腔鳞状细胞癌细胞系Cal-27、SCC-25用含10%胎牛血清的DMEM培养基,HSC-3、SCC-9细胞用含10%胎牛血清的DMEM/F12培养基,口腔上皮角质细胞系HOK用含10%胎牛血清的口腔角质细胞培养基培养,37 ℃、5% CO2培养。取对数生长期的Cal-27细胞接种于12孔板,融合度为50%时,分别转染pmirGLO-NUTM2B-AS1载体(NUTM2B-AS1组)与pmirGLO载体(对照组),参照Lipofectamine 3000转染试剂盒说明书进行转染。转染后48 h,收集各组Cal-27细胞用于后续实验。
1.4 实时荧光定量PCR(qRT-PCR)检测NUTM2B-AS1和miR-770-5p表达
用PBS清洗细胞4次,加入Trizol试剂提取细胞总RNA。通过微量核酸仪分析RNA浓度以及纯度,反转录为cDNA。β-actin用于标准化NUTM2B-AS1表达量,U6用于标准化miR-770-5p表达量。qRT-PCR扩增条件:96 ℃ 8 min、59 ℃ 25 s、70 ℃ 25 s,共34个循环。NUTM2B-AS1上游引物序列为5′-CCCTCCCGTAGCTGTCATAC-3′,下游引物序列为5′-ACCCATTTTACATTTTGAGAACA-3′;β-actin上游引物序列为5′-TGGCACCCAGCACAATGAA-3′,下游引物序列为5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′;U6上游引物序列为5′-CCAGGTGGTCTCCTCTGA-3′,下游引物序列为5′-GCTGTAGCCAAATCGTTGT-3′;miR-770-5p上游引物序列为5′-ATCCAGTGCGTGTCGTG-3′,下游引物序列为5′-TGCTTCCAGTACCACGTGTC-3′。
1.5 Transwell侵袭实验检测细胞侵袭
预先用DMEM培养基稀释基质胶(稀释比例8 ∶1),培养箱内晾干。用PBS清洗NUTM2B-AS1组和对照组转染后的Cal-27细胞,用不含血清的培养基重悬细胞,分别取140 μl细胞悬液加入Transwell上室,在下室加入含15%的培养基640 μl。培养24 h,加入多聚甲醛固定细胞,加入结晶紫染液染色,采用棉签擦去上室底部的细胞,流水冲洗并晾干,在倒置显微镜观察、计数。
1.6 细胞划痕实验检测细胞迁移
将NUTM2B-AS1组和对照组转染后的Cal-27接种于24孔板,培养至融合度为85%,用200 μl移液器吸头在24孔板底直线划痕,用预冷PBS清洗6次,倒置显微镜拍照,测定细胞划痕宽度W0。培养24 h,在倒置显微镜拍照,测定细胞划痕宽度W1。细胞划痕愈合率=(W0-W1)/W0×100%。
1.7 双荧光素酶报告基因检测NUTM2B-AS1与miR-770-5p的互补结合
将对数生长期Cal-27细胞接种于24孔板,细胞贴壁后,分别将miR-NC、miR-770-5p或WT-NUTM2B-AS1载体、MUT-NUTM2B-AS1载体共转染至Cal-27细胞。培养48 h,收集各组细胞裂解液,根据双荧光素酶报告基因检测试剂盒说明书检测每组Cal-27细胞的相对荧光素酶活性。
1.8 Western blot法检测Sirt7/Smad4信号通路蛋白表达
采用细胞裂解液提取NUTM2B-AS1组和对照组Cal-27细胞总蛋白,采用BCA法检测每组蛋白含量,在100 ℃沸水中煮沸变性。聚丙烯酰胺凝胶电泳分离蛋白,湿转法转至硝酸纤维素膜。9%脱脂牛奶中封闭1.5 h,加入一抗Sirt7抗体(1 ∶1 000)、E-cadherin(1 ∶1 000)、Smad4(1 ∶2 000)、MMP-7(1 ∶2 000)、Vimentin(1 ∶3 000)、β-actin(1 ∶1 000),孵育14 h。加入HRP标记的二抗(1 ∶10 000),37 ℃孵育1 h。加入电化学发光液,在凝胶成像系统中曝光、显影、拍照。
1.9 统计学分析

2 结果
2.1 NUTM2B-AS1在口腔鳞状细胞癌组织中的表达量
TCGA数据库显示,与癌旁组织相比,口腔鳞状细胞癌组织中NUTM2B-AS1表达显著降低(P<0.01,见图1)。

与癌旁组织相比,**P<0.01图1 NUTM2B-AS1在口腔鳞状细胞癌组织中的表达量Figure 1 Expression of NUTM2B-AS1 in oral squamous cell carcinoma tissues
2.2 NUTM2B-AS1在口腔鳞状细胞癌细胞系中的表达
与口腔上皮角质细胞系HOK相比,口腔鳞状细胞癌细胞系Cal-27、SCC-25、SCC-9、HSC-3中NUTM2B-AS1的表达水平显著降低(P<0.01),NUTM2B-AS1在Cal-27细胞中表达水平最低(P<0.01,见图2)。

与HOK细胞相比,**P<0.01图2 NUTM2B-AS1在口腔鳞状细胞癌细胞系中的表达Figure 2 Expression of NUTM2B-AS1 in oral squamous cell carcinoma cell lines
2.3 NUTM2B-AS1质粒的转染效率
对照组和NUTM2B-AS1组Cal-27细胞中NUTM2B-AS1表达分别为0.18±0.08和1.03±0.29,NUTM2B-AS1组显著高于对照组(P<0.01),表明NUTM2B-AS1质粒转染成功。
2.4 高表达NUTM2B-AS1对Cal-27细胞侵袭的影响
Transwell侵袭实验结果显示,对照组和NUTM2B-AS1组Cal-27细胞侵袭数分别为(82.16±13.94)个/视野和(36.40±8.02)个/视野,NUTM2B-AS1组细胞侵袭数显著低于对照组(P<0.01,见图3)。

图3 高表达NUTM2B-AS1对Cal-27细胞侵袭的影响Figure 3 Effect of high expression of NUTM2B-AS1 on the invasion of Cal-27 cells
2.5 高表达NUTM2B-AS1对Cal-27细胞迁移的影响
细胞划痕实验结果显示,对照组和NUTM2B-AS1组Cal-27细胞划痕愈合率分别为(62.63±6.31)%和(26.86±12.88)%;与对照组比较,NUTM2B-AS1组划痕愈合率显著降低(P<0.01,见图4)。

图4 高表达NUTM2B-AS1对Cal-27细胞迁移的影响Figure 4 Effect of high expression of NUTM2B-AS1 on the migration of Cal-27 cells
2.6 NUTM2B-AS1能够靶向结合miR-770-5p
生物信息学数据库LncCeRBase预测结果显示,NUTM2B-AS1与miR-770-5p可能存在结合关系(见图5)。双荧光素酶报告基因实验显示,与miR-NC相比,miR-770-5p+WT-NUTM2B-AS1组的Cal-27细胞相对荧光素酶活性明显著降低(P<0.01),对于突变型NUTM2B-AS1,各组相对荧光素酶活性差异无统计学意义(P>0.05,见图6),证实miR-770-5p是NUTM2B-AS1的靶向调控基因。
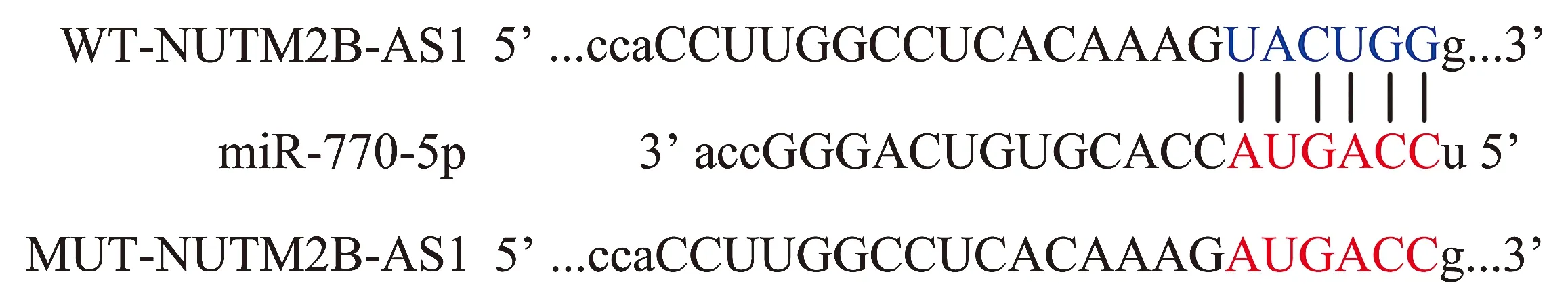
图5 NUTM2B-AS1与miR-770-5p的结合位点Figure 5 Binding site of NUTM2B-AS1 and miR-770-5p
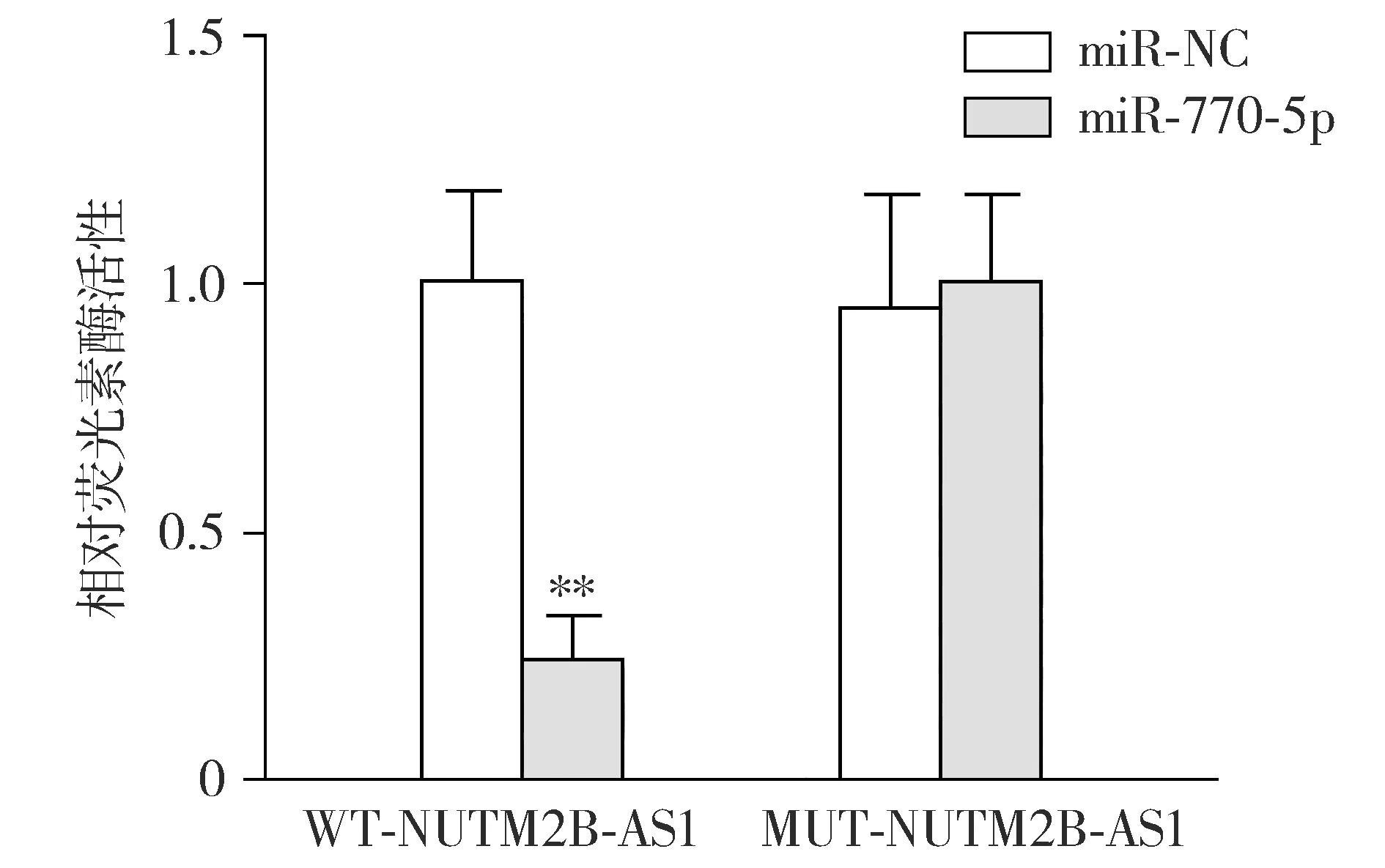
与miR-NC相比,**P<0.01图6 双荧光素酶报告基因实验验证NUTM2B-AS1与miR-770-5p互补结合Figure 6 Verification of complementary binding between NUTM2B-AS1 and miR-770-5p by dual-luciferase reporter gene assay
2.7 高表达NUTM2B-AS1对miR-770-5p表达的影响
对照组和NUTM2B-AS1组Cal-27细胞中miR-770-5p表达分别为9.36±2.79和1.01±0.38,与对照组比较,NUTM2B-AS1组miR-770-5p表达显著降低(P<0.01)。
2.8 高表达NUTM2B-AS1对Sirt7/Smad4信号通路蛋白表达的影响
Western blot实验结果表明,与对照组比较,NUTM2B-AS1组Cal-27细胞Sirt7/Smad4信号通路蛋白Sirt7、E-cadherin蛋白显著升高(均P<0.01),Smad4、MMP-7、Vimentin蛋白表达下降(均P<0.01,见图7)。

与对照组相比,**P<0.01图7 高表达NUTM2B-AS1对Cal-27细胞Sirt7/Smad4信号通路蛋白表达的影响Figure 7 Effect of high expression of NUTM2B-AS1 on protein expression of Sirt7/Smad4 signaling pathway in Cal-27 cells
3 讨论
lncRNA可在表观遗传水平发挥调控作用,影响细胞的代谢、氧化应激、凋亡等细胞活动,进而影响疾病的发展[9]。随着研究的深入,很多lncRNA被证实在口腔鳞状细胞癌组织和正常组织之间存在差异性表达,可能成为口腔鳞状细胞癌的潜在性生物学标志物和治疗靶点[10-12]。Tian等[13]研究发现,LINC00974在口腔鳞状细胞癌组织中表达上调,LINC00974高表达的患者生存率较低,LINC00974通过降低miR-122表达抑制口腔鳞状细胞癌细胞的迁移和侵袭。Tong等[14]研究发现,口腔鳞状细胞癌临床样本中lncRNA SNHG17的表达显著增加,并与病理指标相关,lncRNA SNHG17可显著促进口腔鳞状细胞癌细胞的增殖和转移,同时减少细胞的凋亡。Chen等[15]研究发现,lncRNA GACAT1在口腔鳞状细胞癌组织和细胞系中高表达,lncRNA GACAT1通过靶向结合miR-149加速口腔鳞状细胞癌细胞的增殖和迁移,抑制细胞凋亡和自噬。
NUTM2B-AS1由510个核苷酸组成,在宫颈癌组织中异常表达且与宫颈癌患者的总生存期相关[8]。本研究通过对TCGA数据库中口腔鳞状细胞癌组织和癌旁组织中NUTM2B-AS1表达量分析显示,口腔鳞状细胞癌组织中NUTM2B-AS1表达降低,qRT-PCR检测结果显示NUTM2B-AS1在口腔鳞状细胞癌细胞系中的表达低于口腔上皮角质细胞系,提示NUTM2B-AS1可能参与口腔鳞状细胞癌的进展。本研究结果显示,上调NUTM2B-AS1能够抑制口腔鳞状细胞癌细胞的侵袭和迁移。
目前研究发现,lncRNA能够作为竞争内源性RNA,与miRNA互补结合,从而调控肿瘤细胞的生物学行为[16-18]。本研究通过生物信息学方法和双荧光素酶报告基因检测显示,NUTM2B-AS1可以与miR-770-5p靶向结合。已有的研究显示,miR-770-5p在甲氨蝶呤抗性的结直肠癌细胞系中高表达,上调miR-770-5p显著抑制结直肠癌HT-29细胞对甲氨蝶呤的敏感性[19]。Jia等[20]发现,miR-770-5p在淋巴结转移患者的口腔鳞状细胞癌组织中高表达,与患者的生存率较低有关,miR-770-5p能够显著促进口腔鳞状细胞癌的迁移和侵袭。本研究证明,高表达NUTM2B-AS1后,miR-770-5p表达显著降低,NUTM2B-AS1靶向负调控miR-770-5p表达。在口腔鳞状细胞癌细胞中,miR-770-5p通过抑制Sirt7/Smad4信号通路活化起到促癌作用[20]。本研究中,高表达NUTM2B-AS1表达后,Sirt7/Smad4信号通路被激活,与相关研究报道一致[20]。
综上所述,本研究证实NUTM2B-AS1在口腔鳞状细胞癌组织和细胞系中低表达,高表达NUTM2B-AS1通过下调miR-770-5p抑制口腔鳞状细胞癌Cal-27细胞的侵袭和迁移。NUTM2B-AS1可能成为口腔鳞状细胞癌的生物学标志物和治疗靶点。

