CDC123在乳腺癌细胞中的表达及其机制
朱光正,张立功,杨中玉,李鹏飞,钱 军(蚌埠医学院第一附属医院肿瘤外科,蚌埠 33000;蚌埠医学院第一附属医院整形外科;通讯作者,E-mail:Qianjun5036@sina.com)
乳腺癌是当今全世界女性发病率最高的恶性肿瘤,中国新确诊的乳腺癌病例占全球新诊病例的12.2%,占全球所有乳腺癌死亡病例的9.6%[1]。截止2018年,乳腺癌已占全球各类型新发癌症病例的11.6%,在女性癌症死亡病例中占15%[2],已成为威胁女性生命健康的头号恶性肿瘤。因此聚焦乳腺癌新的诊疗及预测靶点具有重要意义。
CDC123(cell division cycle 123,C10orf7),位于人的第10号染色体(10p14-p13),是一种非典型ATP结合蛋白,是eIF2组装所需的细胞周期调控因子[3],为细胞周期进入S期所必需。CDC123可以促进eIF2g组装到eIF2a来参与eIF2的生物发生,从而参与细胞周期的调控[4]。在相关文献报道中CDC123被描述为乳腺癌的候选致癌基因[5],并与其他疾病的发生发展有关,如甲状腺癌[6]、胶质母细胞瘤[7]、二型糖尿病[8]等。然而,关于CDC123在乳腺癌中的作用机制研究却鲜有报道。
Wnt/β-catenin通路是一种高度保守的信号通路,在控制胚胎和器官发育以及癌症进展中起关键作用,其主要参与乳腺癌的增殖和转移过程[9]。有研究表明,Wnt/β-catenin信号通路在多数乳腺癌中被激活,致癌的关键是β-catenin在细胞质或核内积累[10]。上皮-间质转换(epithelial-mesenchymal transition,EMT)与肿瘤的发生、侵袭、转移和耐药性有关[11],研究认为癌症的发展和转移与E-cadherin表达下降和vimentin表达上调有关[12]。如Sun等[13]发现NuSAP1的高表达可以通过Wnt/β-catenin/EMT信号轴促进TNBC细胞的增殖和侵袭。综上,乳腺癌多靶点诊疗的探索和发生发展机制仍是亟待解决的热点问题。本研究通过探究CDC123在乳腺癌细胞和组织中的表达,聚焦于其在细胞层面对乳癌细胞生物学行为的影响,及其在乳癌发生发展中的具体作用机制,从而为乳腺癌预防、诊疗及预后评估开拓新的分子靶点。
1 材料与方法
1.1 细胞与主要试剂
正常人乳腺细胞MCF-10A和乳腺癌细胞MCF-7、SKBR3、MDA-MB-231均采购于武汉普诺赛生命科技有限公司;DMEM培养基、DMEM/F12(1 ∶1)培养基、Opti-MEM、1%青霉素-链霉素均采购于美国Gibco公司;CCK-8细胞增殖-毒性检测试剂盒、RIPA裂解液、PVDF膜、ECL化学发光底物试剂盒、BCA蛋白浓度测定试剂盒、4%多聚甲醛组织固定液均购自北京兰杰柯科技有限公司;si-RNA、NC均由上海吉玛基因有限公司构建;Lipofectamine2000和TRIzol Reagent购自美国Thermo Fisher Scientific科技公司;SYBR qPCR SuperMix Plus与Synthesis SuperMix试剂盒购自苏州近岸蛋白科技股份有限公司;Western快速封闭液、Western一抗和二抗稀释液、Annexin V-FITC细胞凋亡检测试剂盒均由上海碧云天生物技术有限公司提供;一抗(β-tubulin、β-catenin、c-myc、Cyclin D1、E-cadherin、N-cadherin、Vimentin)及二抗均购自美国Affinity Biosciences公司。
1.2 生物信息学分析
使用肿瘤免疫数据库Timer2.0(http://timer.comp-genomics.org/)对CDC123在不同癌症组织和相应癌旁组织中的表达量进行对比分析;在Kaplan-Meier plotter在线数据库(http://kmplot.com/analysis)中绘制乳腺癌CDC123高低表达组患者的生存曲线;运用Ualcan数据库(http://ualcan.path.uab.edu/)TCGA数据集,分析CDC123在不同乳腺癌类型中的表达;在Coexpedia数据库(https://www.coexpedia.org/)中查询CDC123可能参与的GO-BP过程;在GEPIA数据库(http://gepia.cancer-pku.cn/)TCGA数据集中分析CDC123和CTNNB1相关性。
1.3 组织来源
收集2022年4-8月期间在蚌埠医学院第一附属医院肿瘤外科手术的16例乳腺癌患者的乳腺癌组织及癌旁对照组织。所有患者术前均未接受过放、化疗,且病理确诊为乳腺癌。患者标本的收集已通过蚌埠医学院第一附属医院伦理委员会的批准(伦科批字[2022]第157号)。
1.4 实时荧光定量PCR检测CDC123在乳腺癌组织和癌旁组织的表达差异
取适量乳腺癌组织和相应癌旁组织,采用Trizol-氯仿-异丙醇三步法提取组织匀浆中的总RNA并逆转录cDNA模板,β-actin为内参,扩增条件为:95 ℃,20 s;60 ℃,30 s;72 ℃,60 s;共循环30次。使用2-ΔΔCt法分析CDC123 mRNA的相对表达量。CDC123上游引物:5′-TGTCATTCTTCCACTTCCTC-3′,下游引物:5′-TTCTGCTTCATCATCACTGT-3′;β-actin上游引物:5′-GTGGACATCCGCAAAGAC-3′,下游引物:5′-AAAGGGTGTAACGCAACTA-3′。
1.5 Western blot检测正常乳腺细胞和乳腺癌细胞CDC123的蛋白表达水平
分别收集MCF-10A、SKBr3、MDA-MB-231和MCF-7细胞株离心后的细胞沉淀,使用RIPA裂解液冰上裂解提取细胞总蛋白,使用BCA试剂盒测定蛋白浓度后,加入上样缓冲液,沸水浴使蛋白变性。取等体积上样进行凝胶电泳,转膜后,快速封闭液封闭15 min,随后在CDC123一抗(1 ∶1 000稀释)和β-Tubulin(1 ∶1 000稀释)一抗中4 ℃孵育过夜。次日在二抗(1 ∶3 000稀释)中孵育2 h后曝光显色,Image J行灰度值分析,得出各组细胞中CDC123基因蛋白的相对表达量。
1.6 细胞培养及分组转染
MCF-7、MDA-MB-231在含10%胎牛血清的DMEM/F12培养基中培养,SKBr3在含10%胎牛血清的DMEM培养基中培养,MCF-10A在MCF-10A特殊培养基中培养;培养环境为37 ℃和5%CO2饱和湿度的细胞培养箱。选取MCF-7细胞进行转染,转染对象为处于对数生长期的细胞,要求转染时细胞融合程度达到70%以上,实验分为control组(只转染Lipofectamine2000)、NC组(转染Lipofectamine2000和NC序列)及si-CDC123组(转染Lipofectamine2000和si-RNA1序列),其中si-CDC123组分为3个转染序列组(si-RNA1、si-RNA2、si-RNA3)行效率检测,详细转染构建的NC序列为F:5′-UUCUCCGAACGUGUCACGUTT-3′,R:5′-ACGUGACACGUUCGGAGAATT-3′;si-RNA1序列为F:5′-GCCAGACAGUGAUGAUGAATT-3′,R:5′-UUCAUCAUCACUGUCUGGCTT-3′;si-RNA2序列为F:5′-GCCGUUUAUUCAUUGUACUTT-3′,R:5′-AGUACAAUGAAUAAACGGCTT-3′;si-RNA3序列为F:5′-GUGGCUCAUUGACUUUAAUTT-3′,R:5′-AUUAAAGUCAAUGAGCCACTT-3′。转染步骤严格按照转染说明书进行,转染完成后同1.6项步骤用Western blot法检测转染后各处理组MCF-7细胞的CDC123蛋白水平。
1.7 CCK-8增殖实验
消化转染后的各组细胞并计数后,调整细胞密度为3 000个/孔,分别接种于5块96孔板培养。将CCK-8溶液分别在培养当天(Day0)、1 d(Day1)、2 d(Day2)、3 d(Day3)、4 d(Day4)加入各孔中,加入试剂后37 ℃孵育2 h。在波长450 nm下酶标仪检测control组、NC组和si-CDC123组MCF-7细胞吸光度(OD)值,绘制增殖曲线图。
1.8 Transwell和划痕实验
1.8.1 细胞迁移实验 分别取对数生长期的control组、NC组、si-CDC123组的MCF-7细胞,调整细胞密度为1×104/孔,用无血清培养基悬浮于上层小室,下室加入含10%胎牛血清培养基,培养24 h后,取出上层小室,4%多聚甲醛固定15 min后,结晶紫染色液染色15 min,洗去多余染料,200倍显微镜下观察透膜细胞数。
1.8.2 细胞侵袭实验 将Materigel胶与无血清培养基按1 ∶8的比例稀释,每孔加入60 μl的Materigel胶均匀覆盖Transwell上层小室底部,培养1 h使之呈半凝固状态,余步骤同Transwell细胞迁移实验。
1.8.3 细胞划痕损伤实验 分别取对数生长期的control组、NC组、si-CDC123组的MCF-7细胞,调整细胞密度为5×105/孔接种于6孔板,种板待细胞隔夜长满后,经孔底垂直划痕,PBS清洗后,37 ℃、5% CO2饱和湿度下培养0,24 h后取样、拍照。划痕愈合率=(1-24 h距离/0 h距离)×100%。
1.9 Annexin V/PI双染法检测细胞凋亡
取control组、NC组、si-CDC123组的MCF-7细胞悬液(消化细胞使用无EDTA胰酶),1 000 r/min离心10 min后收集细胞,PBS清洗2次,再次离心收集后染色,按照碧云天Annexin V-FITC细胞凋亡检测试剂盒说明书依次添加试剂,避光孵育15 min后上机检测,并使用Flowjo软件分析结果。
1.10 Western blot检测Wnt/β-catenin信号通路和EMT标识基因相关蛋白表达
按1.6项步骤分别检测control组、NC组和si-CDC123组MCF-7细胞中β-catenin、c-myc、Cyclin D1、E-cadherin、N-cadherin、Vimentin蛋白表达水平。
1.11 统计学分析

2 结果
2.1 生信结果显示CDC123在乳腺癌中表达上调并导致不良预后
肿瘤免疫数据库Timer2.0分析结果显示CDC123在乳腺癌和其他多种癌症中相对癌旁正常组织高表达(P<0.05,见图1)。同时UALCAN在线分析工具表明CDC123在乳腺癌组织中的表达明显高于正常乳腺组织,且无论在Luminal型、HER2阳型还是三阴型乳腺癌组织中表达均高于正常乳腺组织(P<0.001,见图2A)。进一步地,根据Kaplan-Meier plotter乳腺癌数据库分析显示,高表达CDC123的乳腺癌患者,其总生存期(OS)、无复发生存期(RFS)和无远处转移生存期(DMFS)均较低表达患者显著下降(P<0.05,见图2B)。

与癌旁组织相比,*P<0.05,**P<0.01,***P<0.001图1 Timer2.0数据库分析CDC123在各类癌症中的表达水平Figure 1 Expression level of CDC123 in various cancers in Timer2.0 database

B.Kaplan-Meier在线分析CDC123高表达与乳腺癌患者预后的关系图2 生物信息学分析CDC123在乳腺癌中的表达及预后Figure 2 Expression of CDC123 in breast cancer and its relationship with prognosis by bioinformatics analysis
2.2 乳腺癌组织与细胞中CDC123的表达水平
与癌旁组织相比,CDC123 mRNA的表达水平在乳腺癌组织中明显增加,同时,Western blot结果显示,与正常乳腺细胞MCF-10A相比,乳腺癌细胞SKBR3、MCF-7和MDA-MB-231的CDC123表达量显著升高且差异均有统计学意义(P<0.05,见图3)。由于MCF-7细胞中CDC123表达升高最显著,因此选择MCF-7细胞进行转染。结果显示,si-RNA1对MCF-7细胞中CDC123基因的敲减效率最高,与control组和NC组相比,si-RNA1组差异有统计学意义(P<0.05,见图4)。因此选择转染si-RNA1的MCF-7设为si-CDC123组进行后续实验。

与癌旁组织比较,***P<0.001;与MCF-10A细胞比较,#P<0.05,##P<0.01图3 CDC123在乳腺癌组织和细胞中的表达Figure 3 Expression of CDC123 in breast cancer tissues and cells

与control组比较,**P<0.01;与NC组比较,#P<0.05,##P<0.01图4 转染不同靶向的特异性si-RNA对乳腺癌MCF-7细胞CDC123干扰效果Figure 4 Effect of transfection of different targeted specific si-RNA on the interference of CDC123 in breast cancer MCF-7 cells
2.3 干扰CDC123表达抑制了乳腺癌细胞的增殖能力
CCK-8实验结果显示,与control组和NC组相比,si-CDC123组细胞增殖能力明显下降,差异有统计学意义(P<0.05,见图5),说明下调CDC123的表达抑制了MCF-7细胞的增殖活力。
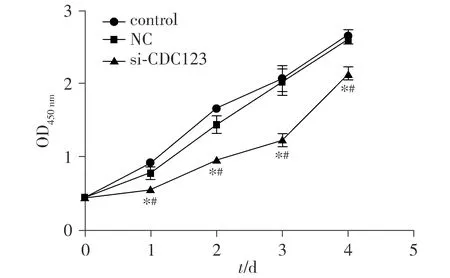
与control组比较,*P<0.05;与NC组比较,#P<0.05图5 干扰CDC123表达后对MCF7细胞增殖能力的影响Figure 5 Effect of interfering CDC123 expression on the proliferation of MCF7 cells
2.4 下调CDC123抑制了乳腺癌MCF-7细胞的侵袭、迁移能力
在细胞划痕实验中,si-CDC123组下调CDC123后MCF-7细胞24 h迁移距离较control组和NC组明显降低(P<0.01,见图6A)。Transwell迁移和侵袭实验结果显示,si-CDC123组MCF-7细胞的穿膜细胞数要显著低于control组和NC组(P<0.01,图6B、C)。以上结果表明,干扰CDC123表达后对乳腺癌细胞MCF7的侵袭、迁移能力有显著抑制作用。

与control组比较,*P<0.05;与NC组比较,#P<0.05图6 干扰CDC123抑制了乳腺癌细胞侵袭迁移能力Figure 6 Interference with CDC123 inhibits invasion and migration of breast cancer cells
2.5 敲低CDC123对乳腺癌细胞凋亡的影响
流式细胞仪检测结果显示,与control组和NC组相比,si-CDC123组乳腺癌细胞早期和晚期凋亡率均增加(P<0.05,见图7),提示敲低CDC123可促进乳腺癌细胞凋亡。

与control组比较,*P<0.05;与NC组比较,#P<0.05图7 干扰CDC123表达可促进乳腺癌细胞凋亡Figure 7 Interference of CDC123 expression promotes apoptosis of breast cancer cells
2.6 下调CDC123表达对Wnt/β-catenin信号通路相关蛋白的影响
在Coexpedia数据库中通过查询CDC123基因参与的GO-BP过程发现其高表达可能与Wnt信号调控呈正相关。同时,在GEPIA数据库的TCGA BRCA数据集中,分析提示CDC123和CTNNB1的基因表达存在相关性(见图8A)。基于此,我们检测了三组MCF-7细胞中Wnt/β-catenin信号通路相关蛋白的变化。Western blot结果显示,干扰CDC123表达后,MCF-7细胞中β-catenin、c-myc、cyclin-D1蛋白的表达量降低(P<0.05,见图8B)。

与control组比较,*P<0.05;与NC组比较,#P<0.05图8 下调CDC123表达对乳腺癌细胞Wnt/β-catenin通路相关蛋白的影响Figure 8 Effects of down-regulating CDC123 expression on Wnt/β-catenin pathway-related proteins in breast cancer cells
2.7 下调CDC123表达对EMT相关蛋白的影响
Western blot结果显示,与control组和NC组比较,si-CDC123组乳腺癌细胞中N-cadherin及Vimentin的表达下调,而E-cadherin表达增加,差异有统计学意义(P<0.05,见图9)。表明CDC123可能通过激活Wnt/β-catenin信号通路调控EMT促进乳腺癌细胞的增殖迁移能力。

与control组比较,*P<0.05;与NC组比较,#P<0.05图9 Western blot法检测下调CDC123对乳腺癌细胞EMT相关蛋白的影响Figure 9 Effect of down-regulation of CDC123 on EMT-related proteins in breast cancer cells by Western blot
3 讨论
乳腺癌作为全身性疾病[14],目前的主流治疗手段还是以手术为主,配合化疗、放疗、内分泌治疗的个体化综合治疗方式。但目前,转移性乳腺癌确定的相关生物标志物和已验证的治疗靶点只有ER、PR及HER2[15]。虽然内分泌治疗已经大大降低了乳腺癌的复发和死亡率,但这种治疗的原发性和获得性耐药仍然是一项重大难题[16]。针对复杂的乳腺癌发生发展机制,有限的内分泌和靶向治疗位点已无法满足需要,探究乳腺癌新的致病基因,为乳腺癌提供新的治疗靶标及预后监测至关重要。
CDC123作为真核细胞周期调节因子之一,其生理功能主要是通过富集eIF2并结合eIF2γ从而调控细胞周期[17],CDC123作为eIF2的“装配伴侣”,下调CDC123后会使eIF2结合GTP和Met-tRNAiMet形成的eIF2三元复合物水平降低,这种eIF2活性复合物的降低会使细胞在应激诱导时更易死亡[18]。近年来诸多研究认为CDC123是乳腺癌[5]、肝癌[19]、甲状腺癌[6]、绒癌[20]和胶质母细胞瘤[7]的潜在致癌基因并与2型糖尿病[21]有关。但其在乳腺癌的作用机制还未见报道。本研究中我们通过对TCGA在线数据库的分析发现CDC123在乳腺癌患者中表达上调,并与不良预后相关,同时对比我院乳癌患者的癌组织和癌旁组织中CDC123的表达量,也验证了这一结果。为进一步探究CDC123对乳腺癌细胞生物学机制的影响,我们选取不同乳腺癌细胞系对CDC123的表达量进行筛选,最终以MCF-7细胞为研究对象,我们将CDC123-siRNA-1转染其中后,发现干扰组较空白对照组和阴性对照组CDC123的相对表达量明显降低,因此用于后续实验。通过CCK-8实验验证干扰CDC123可以抑制乳腺癌细胞增殖能力;划痕实验和Transwell迁移、侵袭实验结果显示,干扰CDC123可以降低乳腺癌细胞的侵袭迁移能力;流式细胞仪检测结果显示下调CDC123后MCF-7细胞的凋亡率增加,同样提示我们CDC123可促进乳腺癌细胞的恶性增殖。
Wnt信号传导通路在超过50%的乳腺癌患者中被异常激活[22],异常激活的Wnt/β-catenin信号通路可以促进癌症干细胞更新、增殖和分化,从而在肿瘤发生发展和耐药性中发挥关键作用[23]。在经典Wnt信号通路中,转录因子β-catenin的异常积累会导致其与T细胞特异性因子(TCF)、淋巴增强子结合因子(LEF)和共激活因子(如Pygopus和Bcl-9)相互作用,以触发Wnt靶基因(如c-myc、Cyclin D1和CDKN1A),导致TCF/LEF靶基因上调,进而引发早期癌症[10]。本研究中我们发现在GEPIA TCGA BRCA数据集中CDC123的表达与β-catenin呈正相关,而Western blot结果也证实了这一点,说明CDC123的异常表达可能伴随β-catenin的异常积累,从而促进早期乳癌的发生。作为Wnt/β-catenin信号通路的下游位点,c-myc是控制各种生物过程(例如增殖、分化和凋亡)的关键转录因子,其信号的异常激活会引发癌症在体内外的生长和侵袭,此外,细胞凋亡抑制和细胞周期进程增强也被证明是与c-myc过表达有关[24]。同样的,Cyclin D1也在癌症中起到关键作用,Cyclin D1参与促进G1期的细胞周期进程,在肿瘤发生过程中具有多种生物活性,包括促进增殖、增强DNA损伤修复和刺激迁移[25]。而我们在细胞层面干扰CDC123基因的表达后,MCF-7细胞中c-myc、Cyclin D1的表达量也显著降低,这些结果都提示CDC123可能在乳腺癌细胞中对Wnt/β-catenin通路起到正向调控作用,从而促进乳腺癌细胞的恶性增殖并促进乳癌的发生与发展。
上皮-间充质转化(EMT)是指细胞失去其上皮特征而获得间充质特征的过程,EMT与多种肿瘤特性相关,包括肿瘤起始、恶性进展、肿瘤细胞干性、肿瘤细胞迁移和对治疗的耐药性等[11]。相关研究指出E-钙黏蛋白是一种重要的跨膜糖蛋白,是细胞黏附连接的关键成分,其表达缺失会导致细胞间失去接触抑制,从而引起细胞运动性增加和癌症晚期进展[26]。而N-钙黏蛋白是介导细胞黏附并促进细胞迁移和侵袭的跨膜蛋白,其异常表达与恶性肿瘤的转化、黏附、凋亡、侵袭和转移等方面密切相关[27]。此外,Vimentin波形蛋白有维持细胞质形状和完整性以及稳定细胞骨架的作用,通常在间充质细胞中表达,在癌症转移过程中普遍上调,在细胞黏附、迁移和信号传导中起重要作用[28]。Chen等[29]发现RCC2可通过调节Wnt信号通路和诱导EMT来促进乳腺癌的进展;Wang等[30]发现敲低KIF3B可通过调节Wnt信号通路和EMT来抑制乳腺癌细胞增殖、迁移和侵袭。故我们推测高表达的CDC123可能会通过抑制癌细胞的上皮黏附蛋白E-cadherin,并促进间充质标志蛋白N-cadherin与Vimentin的表达,来提高乳腺癌细胞的侵袭迁移能力。为了验证这一的猜想,我们用Western blot法检测发现下调CDC123之后,乳腺癌MCF7细胞中E-cadherin的表达上升而N-cadherin和Vimentin的表达下降,提示在乳腺癌细胞中干扰CDC123表达可以抑制肿瘤细胞EMT进程从而影响其侵袭迁移能力。
综上,CDC123作为乳腺癌发生发展中的促癌因子之一,其高表达可通过影响Wnt/β-catenin通路和EMT促进乳腺癌细胞的增殖、侵袭、迁移并抑制凋亡,同时高表达CDC123会造成乳癌患者的不良预后。因此我们推测CDC123可作为乳腺癌新的治疗靶点,及患者的预后监测指标。然而,本研究仍有一定的局限性,MCF-7不能代表所有的乳腺癌细胞,细胞实验也并不完全等价等效于临床实验,CDC123对乳腺癌致癌的直接机制及其他作用通路还需要进一步探究。

