酪蛋白GYLEQ抗氧化肽—钙螯合物的制备、表征及功能特性
厉荣玉 厉 红 郑 鹏 杨 成 钱森和
(1. 皖南医学院基础学院,安徽 芜湖 241002;2. 太仓市第一人民医院,江苏 太仓 215400;3. 安徽工程大学生物与食品工程学院,安徽 芜湖 241000)
目前,常见的钙补充剂有无机钙和有机钙,无机钙对胃肠道具有较大的刺激作用且在小肠碱性条件下发生沉淀而不易被吸收[1]。有机钙具有溶解性好、吸收时不需要过多胃酸支持以及生物利用度高等特点[2]。生物活性肽可以与钙离子配位结合形成肽钙螯合物[3]。肽钙螯合物能够使钙离子在胃及小肠等吸收部位以螯合态形式存在而不易形成磷酸钙沉积物;且能够利用肽转运系统吸收,提高钙的生物利用度[4]。另外,肽钙螯合物能够与机体内未配对的铜离子、铁离子等金属离子结合,阻断Fenton反应发生,从而减少自由基的产生,发挥抗氧化活性[5]。目前,肽钙螯合物的来源主要有从食源性蛋白质中分离提取,如已从乳清蛋白、鱼皮胶原蛋白等分离得到多种肽钙螯合物[6-7];另外,亦可以将制备的多肽与钙离子在一定的反应条件下螯合制得,如大豆多肽钙螯合、蚕蛹多肽钙螯合物等[8-9]。这些方法制备得到的肽钙螯合物虽然具有一定的补钙功能,但大多数的多肽仅作为钙离子的载体,缺乏相应的生物活性。GYLEQ肽(Gly-Tyr-Leu-Glu-Gln)是蛋白酶酶解酪蛋白分离得到的一种抗氧化肽,具有较强的自由基清除活性[10]。因此,将GYLEQ肽与钙离子螯合形成的螯合物可以协同抗氧化活性和补钙功能。
研究拟在固相合成GYLEQ肽的基础上,采用单因素和正交试验优化肽钙螯合物GYLEQ-Ca的制备工艺条件,并对GYLEQ-Ca螯合物进行结构表征及功能特性分析,以期为开发具有抗氧化活性和补钙功能的产品提供基础。
1 材料与方法
1.1 材料与试剂
Wang resin、Fmoc-Leu-OH、Fmoc-Gly-OH、 Fmoc-Tyr-OH、Fmoc- Glu -OH、Fmoc- Gln -OH,N,N-二异丙基乙胺、1-羟基苯并三唑、N,N′-二异丙基碳二亚胺:分析纯,吉尔生化有限公司;
二氯甲烷、1-羟基苯并三唑、哌啶、三氟乙酸、乙醚、二甲基甲酰胺、四硼酸钠、氢氧化钠、CaCl2、酸性洛兰K、CuSO4、磷酸氢二钠、磷酸二氢钠、FeCl3、水杨酸:分析纯,国药集团化学试剂有限公司;
铁氰化钾、DPPH、抗坏血酸等:上海展云化工有限公司。
1.2 仪器与设备
电子天平:BSA124S型,北京赛多利斯天平有限公司;
台式低速冷冻离心机:L2-4K型,湖南可成仪器设备有限公司;
酶标仪:Multiskan FC型,赛默飞世尔科技(中国)有限公司;
真空冷冻干燥机:LJGJ-12型,济南禾普仪器设备有限公司;
高效液相色谱仪:LC-20A型,日本岛津公司;
三重四极杆质谱仪:LCMS-8030型,日本岛津公司;
傅立叶变换红外光谱仪:IRPrestige-21型,日本岛津公司;
扫描电子显微镜:S-4800型,日立公司。
1.3 试验方法
1.3.1 GYLEQ肽制备 采用Fmoc固相合成法制备GYLEQ肽[11]。以Wang-resin为氨基酸载体,按照GYLEQ肽序列将第一个氨基酸固定在树脂上,以N,N-二异丙基乙胺、1-羟基苯并三唑和N,N′-二异丙基碳二亚胺为缩合剂,二甲基甲酰胺为溶剂,按照肽序列依次合成后续氨基酸。合成的产物采用液相进行分离纯化,冷冻干燥后采用液质联用检测分析其实际分子量。
1.3.2 钙含量测定 向6个100 mL容量瓶中分别加入0.0~2.5 mL(0.5位间隔)0.02 mol/L的氯化钙溶液,然后分别再加入10 mL 0.002 mol/L的酸性洛兰k和5 mL pH 11.5的四硼酸钠缓冲液,去离子水定容至100 mL,测定450 nm处的吸光值A450 nm。以氯化钙浓度为横坐标,以吸光值为纵坐标,绘制标准曲线。标准曲线回归方程为Y=0.140 2X+0.059 6,R2=0.989。并根据标准曲线计算钙含量。按式(1)计算钙离子螯合率[12]。
CCa=[(M-M0)/M]×100%,
(1)
式中:
CCa——钙离子螯合率,%;
M——反应前钙离子浓度,mol/L;
M0——反应后上清液中钙离子浓度,mol/L。
1.3.3 GYLEQ-Ca螯合物制备 将GYLEQ肽溶于去离子水中,在适宜的温度、时间、pH和肽钙质量比条件下与氯化钙溶液进行螯合。然后用5倍体积的无水乙醇沉淀螯合物,5 000 r/min离心15 min,弃去上清液,取沉淀,冷冻干燥后得到GYLEQ-Ca螯合物[13]。
1.3.4 单因素试验 GYLEQ-Ca螯合反应单因素试验的初始条件为:螯合温度45 ℃、螯合时间60 min、螯合pH 7.0 和肽钙质量比3∶1。优化时螯合温度分别为35,40,45,50,55 ℃;螯合时间分别为20,40,60,80,100 min;螯合pH分别为5,6,7,8,9;m肽∶m钙分别为1∶1,2∶1,3∶1,4∶1,5∶1。
1.3.5 正交试验 根据单因素试验结果,以螯合温度、螯合时间、螯合pH和肽钙质量比为自变量,以螯合率为应变量,设计四因素三水平正交试验。
1.3.6 红外光谱分析 分别将1 mg的GYLEQ肽和GYLEQ-Ca螯合物冻干粉与100 mg的溴化钾混匀后充分研磨,压片,采用傅立叶红外光谱仪在400~4 000 cm-1范围内分别扫描分析其红外光谱。
1.3.7 扫描电镜分析 将GYLEQ肽和GYLEQ-Ca螯合物冻干粉分别涂片、喷金后,采用扫描电镜分别对其表面形态进行分析。
1.3.8 DPPH自由基清除率测定 参照Wu等[14]的方法并稍作修改。用95%乙醇溶液配置0.1 mmol/L的DPPH溶液,备用。将1 mL不同浓度的样品与1 mL 0.1 mmol/L DPPH乙醇溶液混匀,室温下避光静置反应0.5 h后测定517 nm处的吸光值,记为A1;用1 mL不同浓度样品与1 mL 95%乙醇溶液混合,室温下避光静置反应0.5 h后测定517 nm处的吸光值,记为A2;1 mL 0.1 mmol/L DPPH乙醇溶液与1 mL 95%乙醇溶液混合,测定517 nm处的吸光值,记为A0。按式(2)计算样品的DPPH自由基清除率。
WDPPH=[1-(A1-A2)/A0]×100%,
(2)
式中:
WDPPH——DPPH自由基清除率,%;
A1——样品与DPPH乙醇溶液的混合溶液在517 nm处的吸光值;
A2——样品与95%乙醇溶液的混合溶液在517 nm处的吸光值;
A0——DPPH乙醇溶液与95%乙醇溶液的混合溶液在517 nm处的吸光值。
1.3.9 羟自由基清除率测定 参照Zhang等[15]的方法并稍作修改。将1 mL样品与0.3 mL 8 mmol/L FeSO4、1 mL 3 mmol/L 水杨酸以及0.25 mL 20 mmol/L过氧化氢混匀后于37 ℃恒温条件下反应30 min,反应结束后冷却,加入蒸馏水使体系总体积为3 mL,5 000 r/min离心15 min,测定上清液在510 nm处的吸光值,记为A3;用蒸馏水代替样品,按照上述方法处理后测定510 nm处的吸光值,记为A4。按式(3)计算样品的羟自由基清除率。
W羟自由基=[(A3-A4)/A3]×100%,
(3)
式中:
W羟自由基——羟自由基清除率,%;
A4——空白组在510 nm处的吸光值;
A3——样品在510 nm处的吸光值。
1.3.10 还原力测定 参照Akinyed等[16]的方法并略作修改。取样品溶液0.5 mL 于试管中,分别加入pH 6.6的0.2 mol/L磷酸盐缓冲液和1.0%铁氰化钾溶液各2.5 mL,混匀后于50 ℃保温20 min,冰浴中冷却后加入10%的三氯乙酸溶液2.5 mL,混合后于5 000 r/min 离心10 min。取上清液2.5 mL,分别加入0.1%三氯化铁溶液0.5 mL和蒸馏水2 mL,振荡均匀后静置10 min,测定700 nm处的吸光值。
1.3.11 模拟体外消化 参照龙芳[17]的方法并稍作修改。取5 mg/mL的GYLEQ-Ca溶液,调节pH至2.0,按VGYLEQ-Ca∶V胃蛋白酶=25∶1 加入2.0 g/mL的胃蛋白酶溶液,在37 ℃水浴条件下模拟胃消化2 h,每隔0.5 h 取一次样,并于沸水浴中灭酶15 min。随后将溶液pH调至7.0,按VGYLEQ-Ca∶V胰蛋白酶=25∶1 加入2.0 g/mL的胰蛋白酶溶液,在37 ℃水浴条件下模拟肠道消化,同样每隔0.5 h取一次样,沸水浴灭酶终止消化。消化液离心后取上清液测定钙含量,按式(4)计算GYLEQ-Ca持钙率。
RCa=[(mT-mS)/T]×100%,
(4)
式中:
RCa——持钙率,%;
mT——GYLEQ-Ca 样品溶液中总钙质量,mg;
mS——消化后上清液游离钙质量,mg。
1.3.12 细胞活性测定 采用MTT法评价GYLEQ-Ca螯合物对小鼠胚胎成纤维细胞(MEF细胞)活力的影响[18]。将MEF细胞接种于10%胎牛血清的DMEM培养基中,并置于37 ℃、5% CO2培养箱中培养。取100 μL对数生长期(每毫升1×105个细胞)的MEF细胞悬液接种于96孔板中培养24 h,然后每孔分别加入2,4,6,8,10 mg/mL 的GYLEQ-Ca螯合物100 μL,继续培养24 h后每孔加入20 μL MTT,继续培养4 h,弃上清,每孔加入150 μL二甲基亚砜,震荡10 min后用酶标仪测定490 nm吸光值,按式(5)计算细胞活力。
V=[(ODt-ODb)/(ODc-ODb)]×100%,
(5)
式中:
V——细胞活力,%;
ODt——含有GYLEQ-Ca螯合物、MEF细胞和DMEM培养基组的光密度值;
ODc——含有MEF细胞和DMEN培养基组的光密度值;
ODb——仅含有DMEM培养基组的光密度值。
1.4 数据整理与分析
采用Excel 2010软件进行数据整理与作图,采用SAS 10.0软件对正交试验结果进行统计分析。
2 结果与分析
2.1 GYLEQ抗氧化肽分子量
由图1可知,保留时间45.7 min和47.8 min处各出现了一个峰,且在47.8 min处的峰面积较大。收集两处峰的样品,采用液质联用检测其质荷比,分析其实际分子量。由图2可知,47.8 min处的样品的实际分子量为609.65,与GYLEQ肽实际分子量608.64相接近,表明47.8 min处的样品为GYLEQ目标肽。

图1 GYLEQ肽的高效液相色谱分析Figure 1 HPLC analysis of GYLEQ peptide

图2 GYLEQ肽的质荷比分析Figure 2 Mass-charge ratio analysis of GYLEQ peptide
2.2 GYLEQ-Ca螯合反应条件优化
2.2.1 螯合温度对GYLEQ-Ca螯合率的影响 由图3可知,随着温度的升高,GYLEQ-Ca螯合物的产率呈先增加后减小趋势,可能是因为温度的升高增加了分子的热运动,提高了钙离子与肽的碰撞概率,有利于其螯合反应的进行[13],但当温度超过50 ℃时,肽的结构被破坏,导致钙离子结合位点减少,螯合率降低[19]。

图3 螯合温度对GYLEQ-Ca螯合率的影响Figure 3 Effects of reaction temperature on GYLEQ-Ca chelation rate
2.2.2 螯合时间对GYLEQ-Ca螯合率的影响 由图4可知,随着螯合时间的增加螯合率也逐渐增加;但当螯合时间超过60 min时,GYLEQ-Ca的螯合率增速趋于平稳,表明GYLEQ肽与钙离子已经充分结合。

图4 螯合时间对GYLEQ-Ca螯合率的影响Figure 4 Effects of reaction time on GYLEQ-Ca chelation rate
2.2.3 pH对GYLEQ-Ca螯合率的影响 由图5可知,随着pH值的增大,GYLEQ-Ca螯合率呈先增大后下降趋势,当pH为8时,螯合率达最高值。在酸性条件下,H+与Ca2+竞争—COO—供电子基团,导致螯合反应受阻;而过高的pH导致溶液中的OH-与Ca2+发生反应生产氢氧化钙微溶物,导致螯合物产率降低[9]。

图5 pH对GYLEQ -Ca螯合率的影响Figure 5 Effects of pH on GYLEQ-Ca chelate rate
2.2.4 肽—钙质量比对GYLEQ-Ca螯合率的影响 由图6可知,随着肽—钙质量比的增加,GYLEQ-Ca螯合率逐渐增加,且肽—钙质量比为1∶1~3∶1时,螯合率增加幅度较大,可能是由于随着肽浓度的升高,肽与钙离子碰撞的几率增加,促进了螯合物的形成[20]。而当肽—钙质量比超过3∶1时,螯合率增加幅度逐渐变小,可能是因为随着肽浓度的增加,溶质扩散受阻,限制了螯合物的形成[21]。
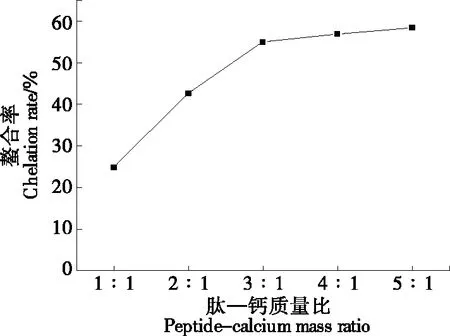
图6 肽—钙质量比对GYLEQ-Ca螯合率的影响Figure 6 Effects of peptide-calcium ratio on GYLEQ-Ca chelation rate
2.2.5 GYLEQ-Ca螯合反应的正交试验 根据单因素试验结果,设计四因素三水平的正交试验,进一步优化GYLEQ-Ca螯合反应条件。正交试验因素水平设计如表1 所示,其结果如表2所示。由表2可知,不同因素对GYLEQ-Ca螯合率影响不同,其中螯合温度对螯合率的影响最大, pH次之,再次为肽—钙质量比,而螯合时间对GYLEQ-Ca螯合物产率的影响最小。最优的螯合反应条件为:A3B1C1D2,即反应温度为50 ℃,反应时间为40 min,pH为7.5,肽—钙质量比为4∶1。对优化得到的最佳条件进行验证,3次实验得到的平均GYLEQ-Ca螯合率为61.56%。

表1 GYLEQ-Ca螯合反应正交试验因素水平表

表2 GYLEQ-Ca螯合反应正交试验结果
为了判断各因素对GYLEQ-Ca螯合率影响的差异显著性,对正交试验结果进行方差分析,结果见表3。由表3可知,模型差异达到了极显著水平,说明螯合因素对螯合率有重要影响;其中螯合温度对螯合率有极显著影响,pH和肽—钙质量比对螯合率有显著影响,而螯合时间对其影响不显著。

表3 GYLEQ-Ca螯合反应正交试验结果方差分析
2.3 GYLEQ-Ca螯合物的结构表征


图7 GYLEQ-Ca螯合物的红外吸收光谱Figure 7 Infrared absorption spectrum of GYLEQ-Ca chelate
2.3.2 GYLEQ-Ca螯合物的电镜分析 由图8可知,GYLEQ-Ca螯合物与GYLEQ肽在形态结构上存在明显差异,GYLEQ肽为分散的小颗粒;而GYLEQ-Ca螯合物为网状的聚集体,这可能是GYLEQ肽与钙离子作用后发生聚集而形成的寡聚体[26]。两者形貌差异同样能够证明GYLEQ肽与钙离子发生螯合生成了新的化合物。

图8 GYLEQ-Ca螯合物的扫描电镜分析Figure 8 SEM analysis of GYLEQ-Ca chelate
2.4 GYLEQ-Ca螯合物的抗氧化活性分析
2.4.1 DPPH自由基清除能力 由图9可知,GYLEQ-Ca螯合物的DPPH自由基清除率明显高于GYLEQ肽;在质量浓度为0~4 mg/mL时,GYLEQ肽及GYLEQ-Ca螯合物的DPPH自由基清除率均随着质量浓度的升高而逐渐增大;当质量浓度为4 mg/mL时,GYLEQ与其钙螯合物的DPPH自由基清除率分别为63.1%和73.6%;而当质量浓度高于4 mg/mL时,两者DPPH自由基清除率增加不明显。通过拟合曲线得到GYLEQ肽及其钙螯合物的DPPH自由基清除率的IC50分别为2.31,1.43 mg/mL,由此可知,GYLEQ肽在与钙螯合后,其对DPPH自由基清除能力增强。

图9 GYLEQ-Ca螯合物的DPPH自由基清除率Figure 9 DPPH free radical scavenging rate of GYLEQ-Ca chelate
2.4.2 羟自由基清除能力 由图10可知,随着质量浓度的升高,GYLEQ肽及GYLEQ-Ca螯合物的羟自由基清除率均逐渐增大;当GYLEQ肽的质量浓度为0~3 mg/mL时,其羟自由基清除率增加较为迅速,而GYLEQ-Ca螯合物浓度为0~2 mg/mL时,其羟自由基清除率增加较为明显;GYLEQ肽及GYLEQ-Ca螯合物的羟自由基清除率的IC50值分别为2.13,1.19 mg/mL,表明GYLEQ-Ca对羟自由基的清除效果优于GYLEQ肽。
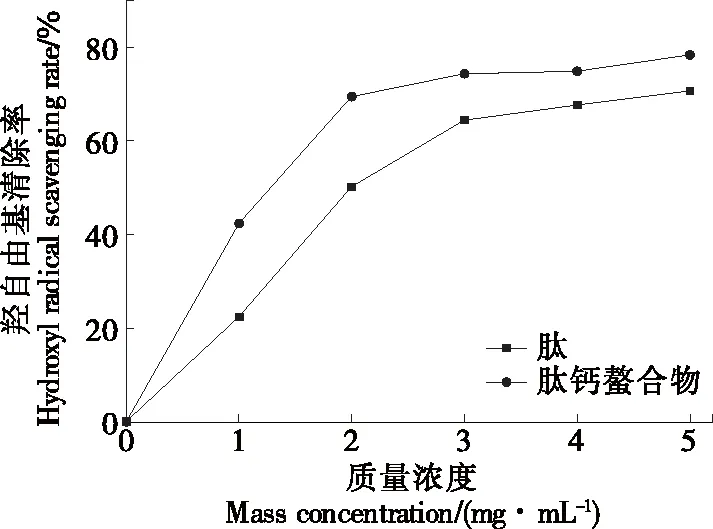
图10 GYLEQ-Ca螯合物的羟自由基清除率Figure 10 Hydroxyl radical scavenging rate of GYLEQ-Ca chelate
2.4.3 还原力 由图11可知,GYLEQ肽与GYLEQ-Ca螯合物的还原力均随质量浓度的增加而增大;当GYLEQ肽质量浓度为0~4 mg/mL时,其还原力随着质量浓度的增加而迅速增加,当质量浓度高于4 mg/mL时,其还原力随着浓度的增加而增加得较慢。相对于GYLEQ肽,GYLEQ-Ca螯合物的还原力在质量浓度为0~2 mg/mL 时随着浓度的增加而增加得较快,而之后还原力增加得较为缓慢。

图11 GYLEQ -Ca螯合物的还原力Figure 11 Reducing power of GYLEQ-Ca chelate
综上,GYLEQ-Ca螯合物的DPPH自由基和羟自由基清除率以及还原力总体高于GYLEQ肽,这可能与GYLEQ-Ca能够与金属离子结合,阻断自由基产生和阻碍金属与脂类和过氧化物的相互作用有关[7]。
2.5 模拟体外消化对GYLEQ-Ca螯合物持钙率的影响
由图12可知,GYLEQ-Ca螯合物在模拟胃液中消化0~1.5 h时,持钙率逐渐降低,1.5 h后持钙率基本保持不变,表明pH 和胃蛋白酶对GYLEQ-Ca螯合物稳定性具有一定的影响,可能是因为较低的pH使螯合过程发生了可逆反应和胃蛋白酶的酶解作用破坏了螯合物的结构[20]。但加入模拟肠液消化后,持钙率逐渐上升,且在肠液消化1.5 h后,持钙率基本维持不变,可能是因为进入肠液后 H+浓度逐渐降低,而OH-浓度逐渐升高,钙离子与肽的螯合能力增强,也可能是在胃液中消化的肽又重新与钙离子发生了螯合,从而导致持钙率上升[17]。钙离子在肠道中容易被草酸盐、植酸盐以及OH-所沉淀,形成难以吸收的沉淀物;而GYLEQ肽与钙离子形成的GYLEQ-Ca螯合物具有较好的肠道吸收性。

图12 模拟体外胃肠液消化对GYLEQ-Ca螯合物持钙率的影响
2.6 GYLEQ-Ca螯合物对细胞活力的影响
由图13可知,当GYLEQ-Ca螯合物质量浓度低于3 mg/mL时,随着浓度的增加MEF细胞活力逐渐增加,当质量浓度高于3 mg/mL时,细胞活力呈下降趋势,表明GYLEQ-Ca螯合物并无细胞毒性,且适宜的浓度能够促进细胞的增殖。钙离子能够与细胞内的钙调节蛋白结合形成钙—钙调节蛋白复合物,从而激活胞内多种酶的活性,调控细胞的生长代谢,但过高浓度的钙离子会导致细胞功能异常[27]。

图13 GYLEQ-Ca螯合物对MEF细胞活力的影响Figure 13 Effects of GYLEQ-Ca chelate on the viability of MEF cell
3 结论
采用固相法合成了GYLEQ抗氧化肽,GYLEQ抗氧化肽与Ca2+螯合反应的最佳工艺条件为螯合温度50 ℃,螯合时间40 min,pH 7.5和肽—钙质量比4∶1,在此条件下,GYLEQ-Ca螯合物产率为61.56%。通过红外光谱和扫描电镜表征分析比较GYLEQ肽与GYLEQ-Ca螯合物结构,发现GYLEQ-Ca螯合物为一种新生成的化合物。优化制备的GYLEQ-Ca螯合物具有较好的抗氧化活性、较高的肠液持钙率和生物安全性。相比较常见的混合肽与Ca2+形成的螯合物,GYLEQ-Ca螯合物具有更为稳定的结构和生物学特性。但后续仍需要对GYLEQ-Ca螯合物的体内抗氧化活性、促进钙吸收的分子机制以及转运途径进行研究。

