Circ_0013745靶向调控miR-126-5p对慢性髓系白血病细胞K562的迁移、侵袭和增殖的影响
焦卫云, 刘媛媛, 鲍扬漪
(合肥市第一人民医院血液内科, 合肥 230000)
慢性粒细胞白血病(Chronic myeloid leukemia, CML)是一种由9q34和22q11易位引起的费城(Ph)染色体为特征的骨髓增生性疾病。实验证实位于9q34的c-ABL基因易与位于22号染色体和位于22q11的BCR基因形成BCR-ABL融合基因[1]。BCR-ABL是一种构成性活性酪氨酸激酶,能够将造血干细胞转化为白血病干细胞(LSCs)[2]。现阶段CML的标准分子靶向治疗是酪氨酸激酶抑制剂(TKI),它能根除大部分疾病,但不能根除静止的白血病干细胞[3]。有研究表明,低存活率和化疗耐药仍是CML治疗过程中存在的主要问题[4]。环状RNA(circRNA)是近年来发现的一类非编码RNA,具有包括调节细胞增殖、侵袭、凋亡等多种生物学功能[5]。Liu等[6]微阵列分析筛选出CML患者治疗前的肿瘤干细胞和相应的正常间充质干细胞中差异表达的circRNA发现,基因circ_0013745在肿瘤干细胞中显著上调,故探寻CML的诊断生物标记物及其调控机制对提高CML的诊断和治疗水平至关重要。本研究探讨基因circ_0013745靶向调控miR-126-5p对CML细胞K562迁移、侵袭和增殖的影响,为CML治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 临床标本 收集2019年7月—2021年1月在合肥市第一人民医院诊断治疗的慢性髓系白血病患者与健康捐赠者外周血样本30对,并置于-80℃超低温冰箱保存。本研究已通过合肥市第一人民医院伦理委员会审核批准,患者及家属均知情同意。
1.1.2 试剂与仪器 293T细胞、慢性髓系白血病细胞株K562购自中国科学院细胞库(上海)。RNA提取试剂Trizol试剂、miRNA、 cDNA第一链合成试剂盒、cDNA合成试剂盒、定量聚合酶链反应(PCR)试剂、Lipofectamine 3000均购自美国Invitrogen公司。DMEM培养基、胎牛血清由美国Gbico公司提供。小干扰RNA (siRNA)对抗circ_0013745 (si-circ_0013745)及其阴性对照(si-NC),miR-126-5p mimic或inhibitor及其相应的对照(mimic NC或inhibitor NC)购自广州锐博生物科技有限公司。细胞计数试剂盒8(Cell counting kit-8,CCK-8)购自上海碧云天(Beyotime)公司。Transwell小室购自美国Corning公司。荧光素酶报告基因试剂盒购自美国Promrga公司。
1.2 方法
1.2.1 细胞培养与转染 用含10%胎牛血清和1%青霉素-链霉素溶液的DMEM培养基培养K562、293T细胞。所有细胞保存于37C°、5%CO2的加湿培养箱中。前一天在6孔板加入消化后的细胞悬液,每孔约6×105个细胞,待细胞贴壁后,用Lipofectamine 3000将siRNA、模拟物、inhibitor和载体转染至K562细胞中,并分为si-NC组、si-circ_0013745组、si-circ_0013745+miR-126-5p inhibitor组;标本组分为健康人组、CML组。
1.2.2 实时荧光定量PCR实验(Real time quantitative PCR,RT-qPCR) 按照说明书,利用Trizol试剂盒从各组细胞中分离出总RNA,All-in-One miRNA RT-qPCR检测试剂盒检测miR-126-5p的表达量。采用Prime Script RT试剂盒逆转录总RNA为cDNA。用SYBR Premix Ex TaqTM试剂盒进行RT-qPCR。引物采用Primer 5设计。热循环条件:95℃ 5 min、95℃ 30 s、65℃ 45 s。实验重复3次,分别以U6和GAPDH作为miR-126-5p和circ_0013745的内部对照。利用2-ΔΔCq方法对相关基因进行分析和归一化。引物设计见表1。

表1 引物序列设计
1.2.3 平板克隆实验 将转染后的K562细胞接种于6孔板(800细胞/孔)中,在含10%胎牛血清的完全培养基中培养2周。用4%多聚甲醛固定细胞,0.1%结晶紫染色30 min,PBS洗涤1次。对直径大于1 mm的集落进行计数。
1.2.4 细胞增殖实验 根据说明书要求使用CCK-8试剂盒。转染后的K562细胞置于96孔板(2 000细胞/孔)中培养0、24、48和72 h。在指定时间点,每孔加入CCK-8溶液(10 μL),用酶标仪在450 nm处检测光密度(OD)值。
1.2.5 细胞迁移和侵袭实验 Transwell迁移实验中,将转染后无血清培养基悬浮的K562细胞加入至Transwell上室,同时将血清培养液灌满下室。24 h后,用多聚甲醛固定细胞,结晶紫染色。随机选取3个视野,在显微镜下(×100)拍照,计数迁移细胞的数量。Transwell侵袭实验中,将Matrigel加入Transwell小室上室,37℃过夜,使Matrigel聚合成凝胶。其余步骤同迁移实验。
1.2.6 双荧光素酶报告基因检测 使用Starbase数据库(http://starbase.sysu.edu.cn) 预测circ_0013745的潜在靶点。根据说明书,使用双荧光素酶报告基因检测系统进行检测。将circ_0013745的野生型(wt)和突变型(mut)序列分别克隆至pmirGLO载体上。将293T细胞接种于12孔板。构建的载体与miR-126-5p mimic或mimic NC共转染293T细胞,并分为mimic NC与circ_0013745-WT/circ_0013745-MUT共转染组、miR-126-5p mimic与circ_0013745-WT/circ_0013745-MUT共转染组,48 h后用双荧光素酶报告基因分析系统(Promega)定量荧光素酶活性。所有实验重复3次。
2 结果
2.1 circ_0013745在慢性髓系白血病中的表达情况circ_0013745位于1号染色体上,由MAN1A2基因的3个外显子组成,呈环状结构(图1A)。RT-qPCR检测结果发现,CML患者的外周血中circ_0013745的表达量(8.91±3.88)显著高于健康人的表达量(2.68±2.39),差异有统计学意义(t=7.369,P<0.001)(图1B)。
2.2 K562细胞平板克隆能力及增殖能力比较平板克隆实验结果显示,si-circ_0013745组的K562细胞克隆个数(264.33±7.57)较si-NC组的细胞克隆个数(384.67±14.57)显著降低,差异有统计学意义(P<0.001)(图2A)。CCK-8增殖实验结果显示,si-circ_0013745组细胞增殖能力(1.12±0.02)较si-NC组细胞增殖能力(1.43±0.06)显著降低,差异有统计学意义(t=8.413,P<0.01)(图2B)。
2.3 K562细胞迁移和侵袭实验结果比较Transwell迁移实验结果显示,si-NC组、si-circ_0013745组迁移的K562细胞个数分别为(197.33±26.40)、(74.67±7.51)。si-circ_0013745组细胞迁移能力低于si-NC组迁移能力,差异有统计学意义(t=7.739,P<0.01)(图3A)。Transwell侵袭实验结果显示,si-circ_0013745组的侵袭细胞个数较si-NC组显著降低(t=4.679,P<0.01)(图3B)。

注:A,circ_0013745的环状结构图;B,circ_0013745的表达量;与健康人比较,***P<0.001。
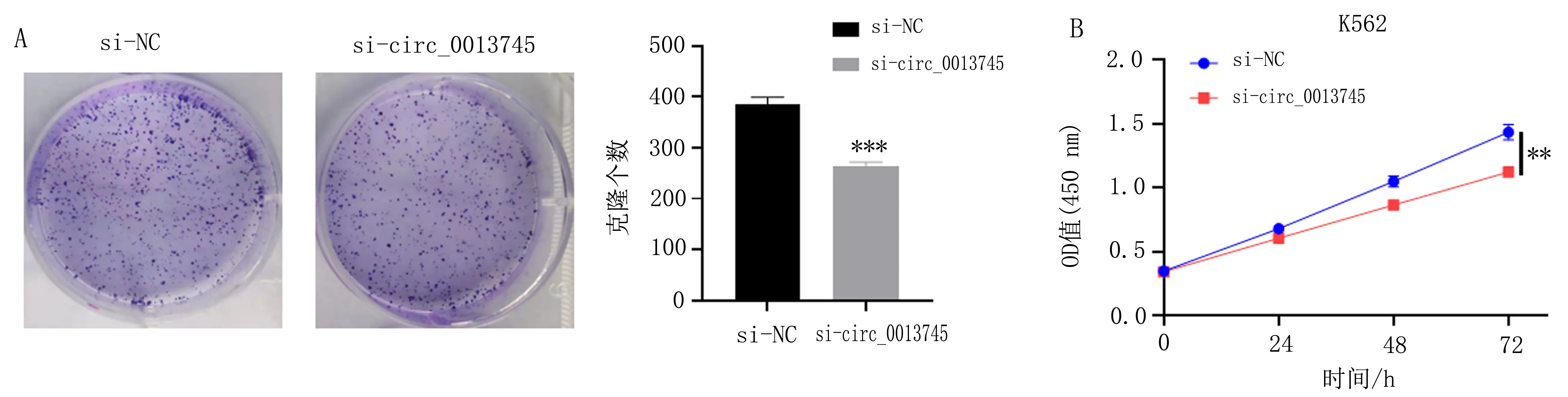
注:A,不同组平板克隆试验;B,不同组CCK-8增殖实验;与si-circ_0013745组比较,**P<0.01; 与si-NC组比较, ***P<0.001。

注:A,不同组K562细胞迁移能力;B,不同组K562细胞侵袭能力;与si-NC 组比较, **P<0.01。
2.4 双荧光素酶报告基因检测结果比较Starbase数据库分析结果显示,miR-126与circ_0013745 3’UTR结合,结合序列见4A。双荧光素酶报告基因检测结果表明,与NC组(1.06±0.07)比较,miR-126-5p mimic与circ_0013745-WT共转染组(0.48±0.06)的荧光素酶活性显著降低(t=11.130,P<0.001),而miR-126-5p mimic与circ_0013745-Mut共转染组的荧光素酶活性无明显变化(t=0.316,P>0.05)(图4B)。证明circ_0013745与miR-126-5p结合。
2.5 K562细胞挽救实验结果比较敲除circ_0013745后,miR-126-5p的表达量显著上升(P<0.001)(图5A)。进一步挽救实验发现,与si-circ_0013745组细胞增殖率(1.06±0.03)比较,si-circ_0013745+miR-126-5p inhibitor组细胞增殖率(1.27±0.03)显著增高,差异有统计学意义(t=7.175,P<0.01)(图5B)。

注:A,结合序列;B,双荧光素酶报告基因实验结果;与miR-126-5p mimic比较, ***P<0.001。

注:A,敲除circ_0013745后miR-126-5p表达量;B,各组CCK-8增殖实验。与si-circ_0013745组比较,si-circ_0013745组与si-circ_0013745+miR-126-5p inhibitor组比较, **P<0.01; 与si-NC组比较,***P<0.001。
3 讨论
CML是一种获得性骨髓增生性恶性肿瘤,分布于多个年龄段,且发病率随年龄增加而增加[7]。尽管酪氨酸激酶抑制剂可改善大多数患者的预后并延长其生存期,但CML的患病率仍在上升[8]。白血病的发展包含多种生物学过程,目前针对白血病的发病机制研究尚不清楚,本研究通过评估circ_0013745在CML中的表达及机制,为探索CML的发病机制提供理论基础。
circRNA已被证实是胃癌[9]、肝癌[10]等癌症恶性进展的生物标志物。现阶段已有多项研究表明,circRNA参与CML的发生发展,强调circRNA作为CML潜在生物标志物的重要性[11]。Ping等[12]用circRNA微阵列评估CML中的circRNA谱发现,CML患者细胞和血清中的hsa_circ_100053水平均升高。此外,本研究探索发现一种位于1号染色体上的circRNAcirc_0013745在CML发展中的作用。经RT-qPCR发现,circ_0013745在CML患者外周血中高表达,提示circ_0013745可能是区分CML患者与健康个体的生物标志物。本研究还发现,敲除circ_0013745可抑制CML细胞K562的平板克隆能力、增殖能力、迁移和侵袭能力,证实circ_0013745对CML的进展发挥着促癌作用,进一步证实circRNA对CML进展发挥癌基因作用。Xia等[13]发现,沉默circ-CBFB可显著抑制慢性白血病细胞的增殖能力,阻滞细胞周期进展,并通过结合miR-607诱导细胞凋亡,导致β-catenin通路失活,从而影响白血病的进展。这与本研究结果类似。此外,有学者发现,高circHIPK3与CML患者预后差相关,抑制circHIPK3可抑制细胞增殖并诱导细胞凋亡[14],以上研究均证实circRNA参与CML的发生发展。
circRNA作为miRNA海绵被许多研究结果证实[15-16]。在本研究中,通过生物信息学分析发现,circ_0013745与miR-126-5p相互作用并靶向结合,沉默circ_0013745可抑制CML细胞的增殖,但该作用可通过沉默miR-126-5p发生逆转,表明circ_0013745通过靶向调控miR-126-5p促进CML细胞的增殖、侵袭。其它研究发现,miR-126-5p在许多癌症中低表达,并作为肿瘤抑制因子调节癌症进展[17-18]。急性髓系白血病中靶向调控miR-126可抑制白血病的发展和白血病干细胞的维持[19]。另外,miR-126在CML患者血液中的表达量下调[20],可靶向调控细胞周期、MAPK、生长抑制、TGF β、p53信号通路的相关基因[21]。本研究后续将深入分析临床病理学特征和完善挽救实验等细胞功能实验、动物实验方法,进一步证实circ_0013745影响CML的作用机制。
综上所述,circ_0013745在CML患者外周血中高表达,且通过靶向调控miR-126-5p促进CML细胞的增殖、迁移和侵袭。这一发现为探究CML的发生机制提供理论基础。

