LncRNA H19在THP-1来源泡沫细胞脂质蓄积中的作用及机制
阿曼古丽·如则, 王雪梅, 尼鲁帕尔·谢甫开提, 赵 翎, 赵帮豪, 霍 强, 高晓明
(1省部共建中亚高发病成因与防治国家重点实验室; 2新疆医学动物模型研究重点实验室, 乌鲁木齐 830054;3西安医学院公共卫生学院卫生学教研室, 西安 710021; 4新疆医科大学第一附属医院心脏中心, 乌鲁木齐 830054)
心血管疾病是严重威胁人类健康的主要疾病,我国心血管疾病导致的死亡居城乡居民总死亡原因的首位[1]。动脉粥样硬化(Atherosclerosis, AS)是冠心病、心力衰竭、房颤等心血管疾病的病理基础[2],其早期标志性的病理特征是血管内皮下大量巨噬细胞内脂质的蓄积及泡沫细胞的形成[3-4]。探讨巨噬细胞脂质吞噬的分子机制,对于动脉粥样硬化的早期治疗具有重要的意义。长链非编码RNA (Long non-coding RNA, LncRNA) 是无明显的蛋白质编码功能的非编码RNA[5]。H19基因位于人类11号染色体上,在RNA聚合酶II的催化作用下可转录生成LncRNA H19[6]。LncRNA H19在多种肿瘤疾病[7-11]及代谢性疾病[12-15]发生发展中发挥重要作用。近期研究表明,动脉粥样硬化患者中,LncRNA H19表达升高,且血浆LncRNA H19水平升高与冠状动脉疾病风险增加相关[16-18],提示LncRNA H19可能参与动脉粥样硬化的发生发展,但其分子机制尚不明确。
过氧化物酶体增殖物激活受体 α(PPAR-α)是配体激活的转录因子,在脂质和葡萄糖代谢相关基因的转录调节中发挥重要作用[19-20]。研究证实,LncRNA H19的抑制通过miR-675/PPAR-α轴的调节来减轻缺血再灌注对心肌造成的损伤[21],但LncRNA H19是否通过抑制PPAR-α活性介导动脉粥样硬化中的脂质蓄积尚不清楚。本研究在细胞水平,运用RNA干扰技术探讨LncRNA H19在THP-1来源巨噬细胞脂质吞噬中的作用以及与脂代谢相关转录因子PPAR-α之间的关系。
1 材料与方法
1.1 材料人外周血单核细胞系(THP-1)购自中国科学院细胞库,胎牛血清、RPMI-1640培养基、Opti-MEM培养基、青链霉素、PBS购自Gibco公司,siRNA由上海吉玛制药技术有限公司设计合成,Lipo-fectamineTM3000转染试剂、TRIzol总RNA抽提试剂购自Invitrogen公司,佛波酯(PMA),油红O染料购自Sigma-Aldrich®公司,氧化型低密度脂蛋白(ox-LDL)购自广州奕元生物技术有限公司,高效RIPA裂解液购自索莱宝公司,FastKing一步法RT-PCR试剂盒购自天根生化科技公司、SYBR Green荧光定量试剂盒购自QIAGEN公司,PPAR-α抗体、β-actin 抗体均购自Cell Signaling Technology公司。
1.2 方法
1.2.1 细胞培养及泡沫细胞模型的建立 将THP-1细胞置于含15%胎牛血清以及1%青-链霉素的RPMI1640细胞培养基中,在37℃、5% CO2恒温细胞培养箱中进行培养。1~2天换液,待细胞融合度达到80%~90%时进行传代。取生长状态良好的细胞按5×105个/孔接种于6孔培养板上。用200 nmol/L的PMA处理THP-1细胞24 h,诱导其分化为巨噬细胞。使用LipofectamineTM3000转染试剂,分别将H19小干扰RNA(siRNA)(5′-CCCGUCCCUUCUGAAUUUATT UAAAUUCAGAAGGGACGGGTT-3′)和阴性对照组siRNA(5′-ACAGAACAUAACGACGAACTTGU-UCGUCGUUA UGUUCUGUTT-3′)转染至THP-1源性巨噬细胞中,转染6 h后换培养基,用含50 μg/mL ox-LDL的培养基培养48 h,使其吞噬脂质形成巨噬细胞源性泡沫细胞。
1.2.2 油红O染色及脂质含量测定 ox-LDL刺激48 h后,吸去上清液。PBS洗3遍,4%多聚甲醛固定30 min(37℃)。去除固定液,用蒸馏水清洗3遍,油红O染色液染色15 min(37℃);蒸馏水洗3遍,显微镜下观察并拍照。此后,去除蒸馏水加入异丙醇,37℃孵育箱中放置5 min,抽提油红O。吸取每孔中的液体加入至96孔板中,酶标仪测定560 nm波长的OD值。
1.2.3 实时荧光定量PCR(real-time qPCR) 实验结束后,用TRIzol试剂提取细胞总RNA。用NanoDrop 2000超微量分光光度计测定RNA浓度及纯度,并取1 μg RNA进行逆转录和实时荧光定量PCR。H19引物:上游序列5′-CTTTCATGTTGTGGGTTCTGG-3′,下游序列5′-CGGGTCTGTTTCTTTACTTCC-3′,内参18S引物:上游序列5′CAGCCACCCGAGATTGAGCA-3′,下游序列5′-TAGTAGCGACGGGCGGTGTG-3′。反应条件为:95℃预变性10 min,95℃变性15 s,60℃退火延伸1 min,循环40次。样本均设置3个复孔,以18S为内参,用2-ΔΔCT的方法来计算LncRNA H19的相对表达量。
1.2.4 Western blot检测 用RIPA裂解液提取细胞总蛋白,BCA法进行定量,100℃加热使蛋白变性。取20 μg蛋白提取液,室温下行SDS-PAGE电泳。用湿转法将蛋白电转到PVDF膜上,5%脱脂奶粉封闭。加入相应的一抗(均1∶1 000稀释),4℃孵育过夜。0.1%TBST洗膜3次,每次5 min。加入碱性磷酸酶标记的二抗(1∶3 000稀释),室温避光孵育2 h,洗膜后显色。用Image Lab图像分析系统对Western印迹图片进行定量分析,以目的蛋白与内参照蛋白GAPDH条带的灰度比值表示。
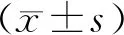
2 结果
2.1 THP-1来源泡沫细胞中LncRNA H19表达升高正常的THP-1为悬浮生长细胞,形态呈圆形,折光度良好,无颗粒。经200 nmol/L的PMA处理24 h后,由悬浮式生长变成贴壁生长,由圆形变成不规则形态,体积进一步增大,代表细胞已分化为巨噬细胞(图1)。经50 μg/mL 的ox-LDL处理48 h后,油红O染色,显微镜下观察,发现细胞质内出现大量的红色脂滴颗粒(图2B),符合泡沫细胞形态特点,表明泡沫细胞模型建立成功。
与对照组相比,ox-LDL处理组脂滴含量明显增加(图2A,B),异丙醇抽提定量结果显示,脂质含量增加1.25倍(图2C,P<0.01)。qPCR检测结果显示,ox-LDL处理后泡沫细胞中的LncRNA H19 mRNA表达量比对照组升高1倍(图2D,P<0.01)。
2.2 LncRNA H19的基因沉默减轻THP-1来源泡沫细胞的脂质吞噬为了进一步明确LncRNA H19在THP-1来源巨噬细胞脂质吞噬中的作用,分别用阴性对照H19 scramble和H19 siRNA转染THP-1源巨噬细胞48 h,qPCR检测转染效率。结果显示,H19 siRNA组LncRNA H19基因表达比阴性对照组降低了83%(P<0.01,图3A)。油红O染色及异丙醇定量结果显示,与阴性对照组相比,H19 siRNA组脂质含量减少了28%(P<0.01,图3B,C),说明LncRNA H19在THP-1源巨噬细胞脂质吞噬中发挥重要作用。
2.3LncRNAH19的基因沉默抑制PPAR-α的表达 Western blot检测结果显示,ox-LDL刺激后,THP-1源巨噬细胞中的PPAR-α蛋白表达水平相比对照组降低了36%,LncRNA H19敲低后,PPAR-α蛋白表达水平恢复到对照组水平(P<0.01,图4A,B)。提示LncRNA H19可能通过抑制PPAR-α的表达来增加THP-1源巨噬细胞的脂质吞噬。

图1 THP-1来源泡沫细胞的建立,放大倍数(×50)

图2 THP-1来源泡沫细胞模型中的脂质含量及LncRNAH19的基因表达变化(×200)
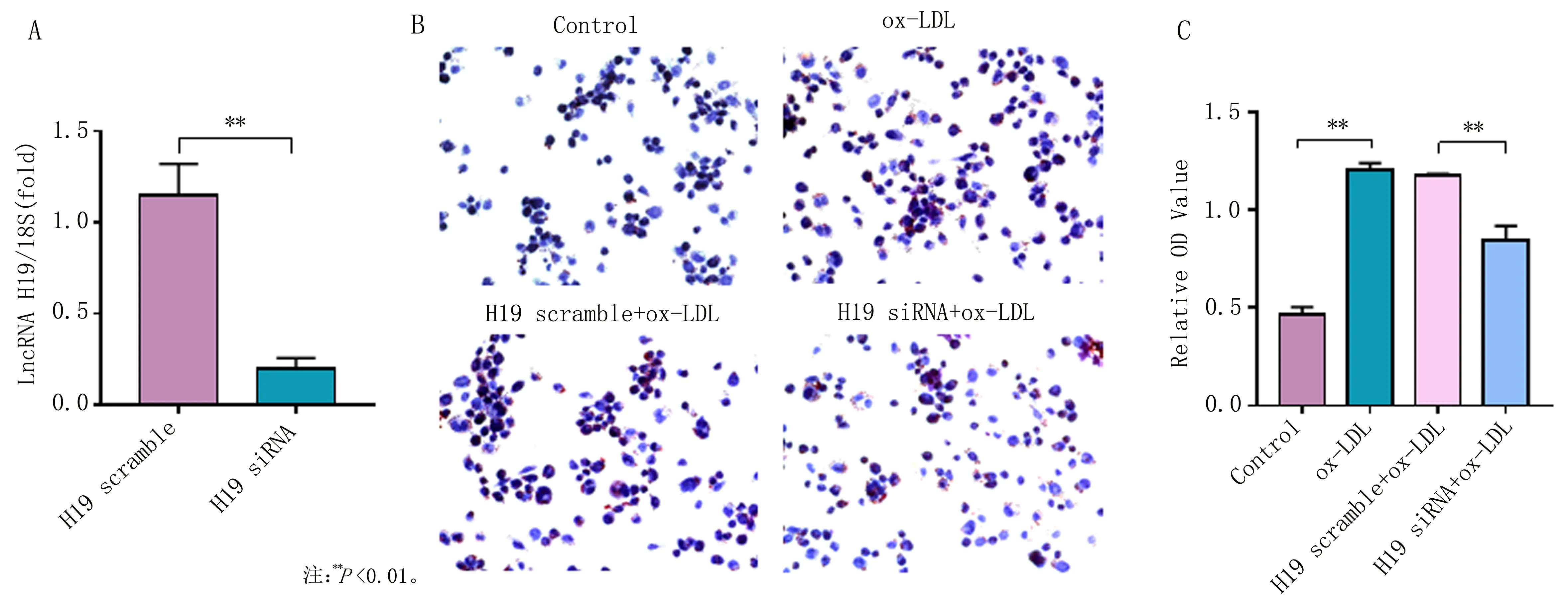
图3 H19 siRNA转染后THP-1源巨噬细胞中LncRNA H19基因表达及脂质含量的测定,放大倍数(×200)
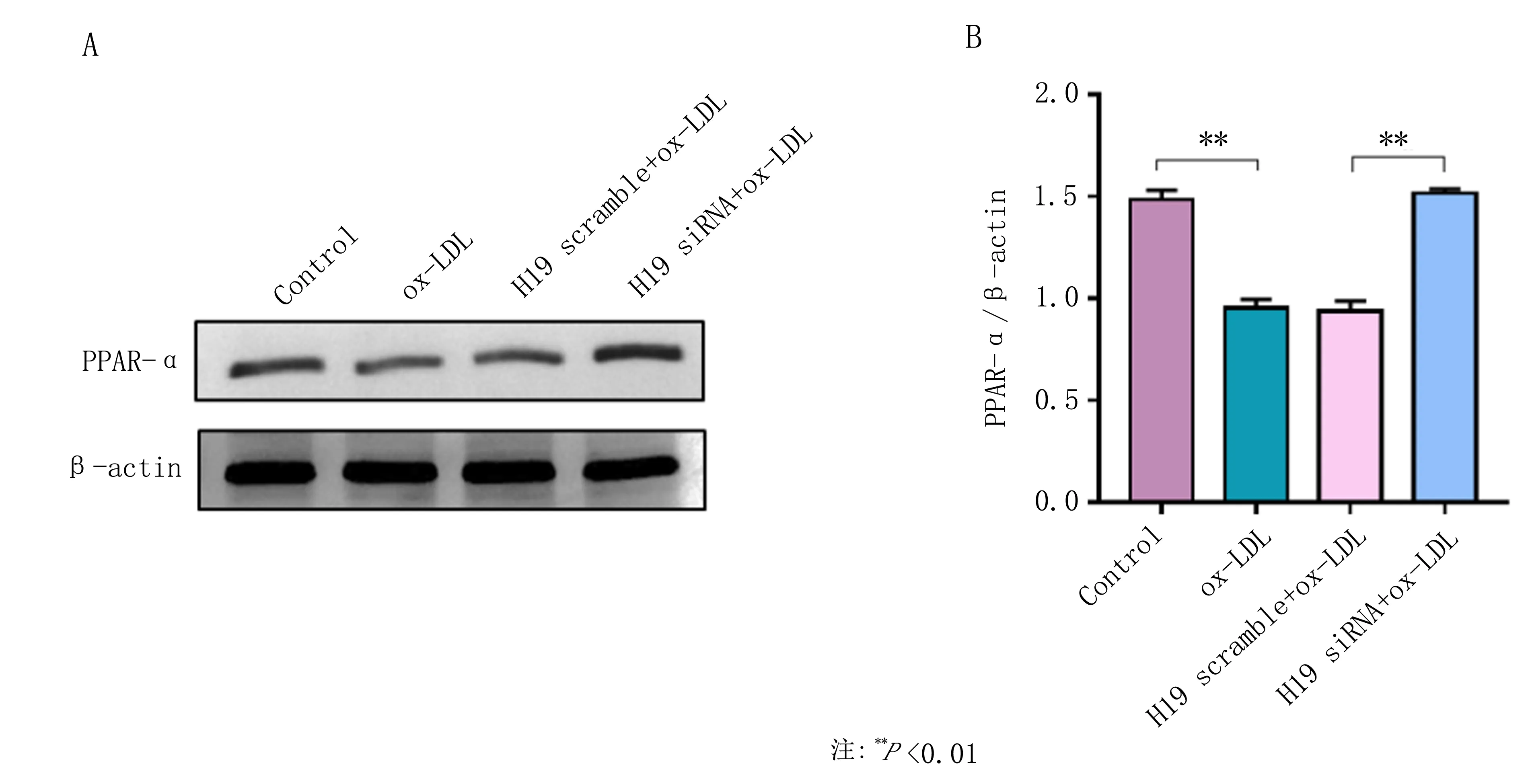
图4 不同处理后THP-1源巨噬细胞中PPAR-α蛋白表达测定
3 讨论
动脉粥样硬化发生的早期,血管内皮损伤分泌趋化因子和黏附分子,促使外周血中的单核细胞迁移进入内膜下,活化成为巨噬细胞。随后,在炎症介质的作用下巨噬细胞表面清道夫受体(Scavenger receptor,SR)的表达增加,使巨噬细胞大量吞噬ox-LDL形成泡沫细胞。泡沫细胞的形成是动脉粥样硬化发生发展过程中的关键起始步骤[3]。因此建立稳定的体外泡沫细胞模型,对研究动脉粥样硬化的发病机制至关重要[22]。本研究用ox-LDL处理THP-1源巨噬细胞的方法建立体外泡沫细胞模型,并用油红O染色及异丙醇定量来鉴定模型。结果显示,ox-LDL处理后细胞质内有大量的红色脂滴颗粒,脂质含量明显增加,表明泡沫细胞模型建立成功。
LncRNA参与机体多种生物学及病理生理过程,与人类疾病的发生、发展和防治都有着密切联系[23]。研究表明,共354个差异表达LncRNA与ApoE-/-小鼠高脂饮食的病理变化密切相关[24],可能在动脉粥样硬化的炎症和代谢过程中发挥作用,提示LncRNA是参与动脉粥样硬化形成和发展的重要因素,但其在动脉粥样硬化中的功能和机制尚不清楚。近期研究报道,LncRNA H19在冠心病等多种动脉粥样硬化性疾病中发挥重要作用[12, 16, 25],但其在动脉粥样硬化发展进程中发挥的具体作用及相关的分子机制仍未阐明。本研究发现,THP-1源泡沫细胞模型中LncRNA H19表达明显增加。用小干扰RNA敲低LncRNA H19表达后,THP-1源泡沫细胞模型中脂质含量明显降低,说明LncRNA H19在THP-1源巨噬细胞脂质吞噬中发挥重要作用。
过氧化物酶体增殖物激活受体包含的三个亚型(PPAR-α、PPAR-β/δ和PPAR-γ)是核受体超家族的成员,作为配体活化的转录因子,在葡萄糖和脂质代谢中起着至关重要的作用[20]。PPAR-α为脂质代谢的主要调节因子,调控多个脂代谢相关靶基因的转录表达,这些基因包括脂肪酸活化相关激酶酰基辅酶A氧化酶、硫酶,长链脂肪酸运输相关蛋白脂肪酸转运蛋白(FATP),脂肪酸氧化过程的限速酶肉碱棕榈酰转移酶I(CPT1)和糖脂代谢关键酶过氧化物酶体增殖物激活受体γ-辅激活物1-α(PGC-1α)等[19],因此PPAR-α可能作为肥胖、动脉粥样硬化、血脂异常、2型糖尿病和非酒精性脂肪肝等多种类型脂质代谢综合征的有效治疗靶点[26]。为了进一步探索LncRNA H19促进THP-1源巨噬细胞脂质吞噬的调控机制,本研究在不同处理组中检测了PPAR-α的蛋白表达,结果显示,THP-1源泡沫细胞模型中,PPAR-α表达水平降低,而在LncRNA H19基因沉默后,PPAR-α表达显著回升,脂质含量显著减少。这些结果表明在高脂条件下LncRNA H19可能通过抑制PPAR-α的表达来促进THP-1源巨噬细胞的脂质吞噬。

