基于分子对接及网络药理学探讨加减当归六黄汤治疗肺炎的作用机制
【摘要】目的 利用网络药理学和分子对接方法,探讨加减当归六黄汤治疗肺炎的有效成分、作用靶点及信号通路。方法 基于中药系统药理学技术平台(TCMSP)收集加减当归六黄汤的活性成分及靶点,通过蛋白数据库(Uniprot)筛选基因名称。使用GeneCards、OMIM、PharmGKB、Drugbank数据库筛选肺炎相关基因并与加减当归六黄汤靶基因取交集。将交集基因上传到 String数据库,构建蛋白质相互作用网络图(PPI),采用CytoNCA对PPI进行网络拓扑分析筛选核心靶基因。使用Cytoscape(3.7.2)软件构建加减当归六黄汤治疗肺炎的网络图(药物-有效成分-靶点)。最后利用R语言及Bioconductor平台对交集靶基因进行基因本体(GO)富集分析和基因相互作用(KEGG)通路分析;并借助AutoDock、Pymol软件对核心成分和核心靶点进行分子对接及可视化分析。结果 通过筛选,预测出加减当归六黄汤治疗肺炎的有效活性成分共有81个,作用于疾病的有效基因有73个,主要通过调控丝裂原活化蛋白激酶(MAPK)、蛋白激酶B(AKT1)、白细胞介素-6(IL-6)、半胱氨酸-天冬氨酸蛋白酶3(CASP3)、前列腺素内过氧化物合酶2(PTGS2)、JUN激酶(JUN)等核心靶基因及调控细胞凋亡、人巨细胞病毒、肿瘤坏死因子(TNF)、低氧诱导因子1(HIF-1)、IL-17(白细胞介素-17)、Toll样受体信号通路等而发挥对肺炎的治疗作用。结论 通过分子对接及网络药理学论证了加减当归六黄汤治疗肺炎具有多成分、多靶点、多途径的特点,未来我们可以从MAPK、AKT1、IL-6、CASP3、PTGS2、JUN等靶点及相关信号通路来探究加减当归六黄汤治疗肺炎的作用机制,为后续药物研发、分子生物学实验及相关临床研究奠定理论基础。
【关键词】加减当归六黄汤、肺炎、网络药理学,分子对接,信号通路
中图分类号:R2-031 文献标识码:A 文章编号:2096-2665.2023.24.0.05
DOI:10.3969/j.issn.2096-2665.2023.24.043
肺炎是人体终末气道、肺泡及肺间质的一种炎症性疾病,多由病原微生物、理化因素、免疫损伤、过敏、药物等所致,临床上主要以咳嗽、咳痰、发热、呼吸困难为主要表现,严重者常伴有呼吸衰竭、心力衰竭。肺炎为一种感染性疾病,具有高致病性和高死亡率,我国入住重症加强护理病房(ICU)的肺炎病死率高达53%[1]。抗感染治疗是目前仍是治疗肺炎的主要手段,但由于抗生素的滥用及耐药菌株不断出现,给肺炎治疗带来了严峻挑战。中医的辨证理论及其中药复方的多成分、多靶点、整体调节作用特点对肺炎的治疗有独特的优势,临床上常采用中西医结合的方法治疗肺炎。
肺炎在中医上多属“肺炎喘嗽”“咳嗽”“风温”等病症范畴,本病早期以外邪入侵,痰热内蕴为主要病机,后期由于正气不足为本,伏气化热,易形成气虚血瘀的病理基础。临床上对肺炎恢复期的患者采用加减当归六黄汤进行治疗,效如桴鼓[2]。加减当归六黄汤由金代李东垣的《兰室秘藏》中当归六黄汤化裁而来,其药物组成为生地黄,熟地黄,当归,炙黄芪,黄连,黄柏,黄芩,白术,辛夷,苍耳;诸药合用共奏“益气养阴、化瘀解毒”功效[3]。为进一步探讨加减当归六黄汤治疗肺炎的作用机理,本文利用网络药理学和分子对接法构建药物、靶点、基因、通路、疾病之间的多重网络,从分子层面剖析加减当归六黄汤与肺炎间相互作用关系,为疾病治疗提供新的思路。
1 资料与方法
1.1 加减当归六黄汤有效活性成分及靶点的筛选 通过中药系统药理学技术平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)检索加减当归六黄汤中生地黄、熟地黄、当归、炙黄芪、黄连、黄柏、黄芩、白术、辛夷、苍耳的化学成分及靶点;以(生物口服利用度)OB≥30%、(类药性)DL≥18%作为筛选条件[4],对中药的化学成分进行筛选。运用Perl语言获取药物有效成分的靶点,并联合Uniprot数据库(https://www.uniprot.org/),得到药物有效成分靶点所对应的基因简称。
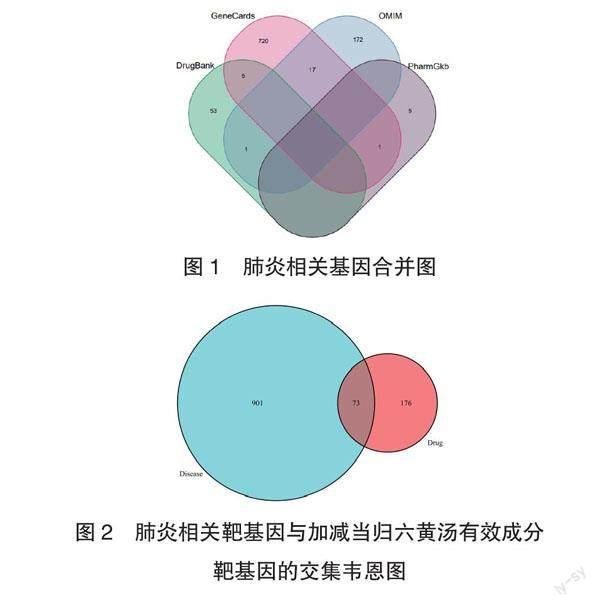
1.2 肺炎相关基因的筛选 使用GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、PharmGKB(https://www.pharmgkb.org/)、Drugbank(https://www.drugbank.ca/)数据库检索疾病,检索词设置为“pneumonia”“inflammation of the lungs”,将4个数据库所得到的检索结果合并,删除重复靶点,获得肺炎的全部靶基因;利用R语言筛选出加减当归六黄汤与肺炎共同作用的靶基因,并绘制出韦恩图。
1.3 绘制“药物-有效成分-靶点”网络图 选取加减当归六黄汤有效活性成分及与肺炎的共同靶基因,利用Perl语言对数据节点进行属性标识,然后将所得数据输入Cytoscape3.7.2制图软件,进行可视化分析,绘制药物与疾病间的网络图。
1.4 蛋白互作网络模型的构建及筛选核心靶基因 将加减当归六黄汤与肺炎共同作用靶基因导入STRING数据库(https://string-db.org/)中,物种选择为人类“homo sapiens”,选取最小作用得分(minimum required interaction score)>0.4,并设置隐藏游离点,获得蛋白相互作用网络(PPI),下载PPI图形,并将蛋白互作关系以TSV格式保存;采用CytoCNA对PPI进行网络拓扑分析筛选核心靶基因。
1.5 基因本体(GO)富集分析和基因相互作用(KEGG)通路分析 首先,选取加减当归六黄汤与肺炎的共同作用的靶基因,在R语言上安装#install.packages("RSQLite")#if(!requireNamespace("BiocManager", quietly = TRUE)) #install.packages("BiocManager")#BiocManager::install("org.Hs.eg.db", version = "3.8")程序包,然后运用R语言将靶基因symbol转为基因ID;在R语言上安装#install.packages("colorspace")#install.packages("stringi")#install.packages("ggplot2")#BiocManager::install("DOSE")#BiocManager::install("clusterProfiler")#BiocManager::install("enrichplot")程序包,运行R语言,获得GO和KEGG富集分析图,进一步说明中药化合物的靶点蛋白在基因功能和信號通路中的作用关系。
1.6 构建KEGG“主要信号通路与靶点”的网络关系图 利用Perl语言选取KEGG通路中前20个主要信号通路,并对其通路及基因数据节点进行属性标识,然后把所得数据输入Cytoscape3.7.2制图软件,进行可视化分析,绘制KEGG“主要信号通路与靶点”的网络关系图,结合该数据库对网络图作出注释,从分子水平阐述加减当归六黄汤治疗肺炎的作用机理。
1.7 活性成分与核心靶点的分子对接 利用Cytohubba插件筛选药物核心成分,与核心靶基因进行分子对接。利用Autodock进行小分子与蛋白对接,对对接结果(Blind energy)进行打分,并用Discovery Studio Visualizer和PyMOL将对接结果可视化。
2 结果
2.1 加减当归六黄汤有效活性成分及潜在靶基因 在TCMSP数据平台,依据筛选条件OB≥30%、DL≥18%,共获取加减当归六黄汤的有效活性成分142个,其中黄芪20个、黄芩36个、黄连14个、黄柏37个、地黄
2个、当归2个、辛夷19个、陈皮5个、白术7个;筛选结果中有些活性成分共属于两个或者三个中药,删除重复化合物20个,最后共获取122个无重复的有效活性成分;在TCMSP数据库检索药物活性成分相关的作用靶点(related targets),结合Perl语言以及Uniprot数据库,获得其有效成分所对应的基因symbol,共1 834个。
2.2 加减当归六黄汤治疗肺炎潜在作用靶点基因的预测 检索GeneCards、OMIM、PharmGKB、Drugbank数据库,结合R语言,共得到肺炎相关基因974个(GeneCards数据库743个、 OMIM数据库190个、DrugBank 数据库59、PharmGkb数据库6个);与药物靶基因取交集,得到73个共同作用的靶基因;绘制韦恩图(图1、图2)。
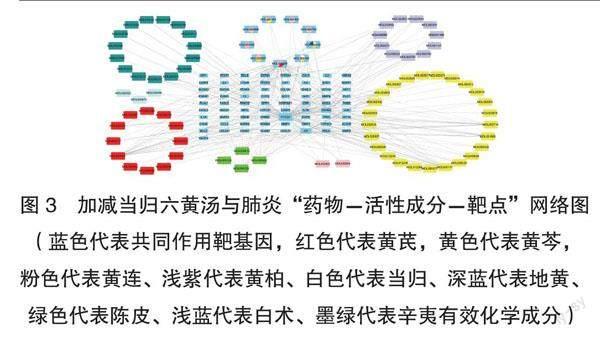
2.3 绘制加减当归六黄汤与肺炎“药物-活性成分-靶点”网络图 将上述81个药物有效活性成分、73个共同作用靶基因,导入Cytoscape3.7.2制图软件,绘制网络图(见图3),可直观地反映这些药物、化合物与靶标的相互作用。分析此网络拓扑结构,发现此网络包含了154个节点和306条边,两连接节点数目越多,基因所对应的图形则越大。
图3 加减当归六黄汤与肺炎“药物-活性成分-靶点”网络图(蓝色代表共同作用靶基因,红色代表黄芪,黄色代表黄芩,粉色代表黄连、浅紫代表黄柏、白色代表当归、深蓝代表地黄、绿色代表陈皮、浅蓝代表白术、墨绿代表辛夷有效化学成分)
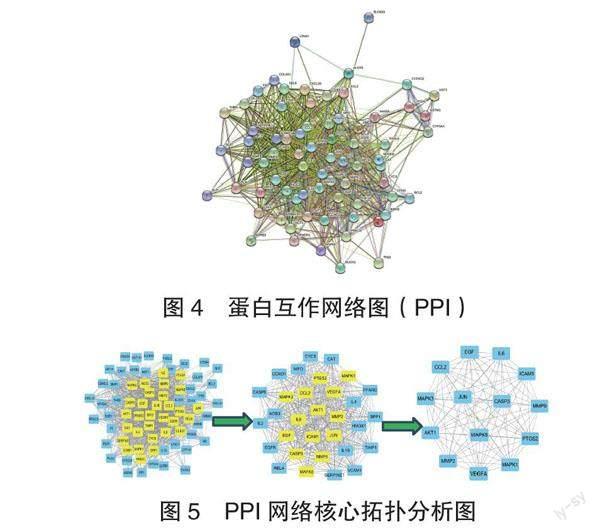
2.4 蛋白互作网络图(PPI)及筛选核心靶基因 将73个潜在作用靶基因导入STRING数据库,获取蛋白互作网络图(见图4)。图中每个圆形节点代表一个基因蛋白,节点间的直线表示所连接的2个蛋白存在互作关系,线条越粗表示两者关系越强;采用CytoNCA对73个共同靶基因进行网络拓朴分析,筛选出14个核心靶基因,分别为趋化因子配体2(CCL2)、基质金属蛋白酶9(MMP9)、JUN激酶(JUN)、基质金属蛋白酶2(MMP2)、前列腺素内过氧化物合酶2(PTGS2)、丝裂原活化蛋白激酶1(MAPK1)、白细胞介素-6(IL-6)、蛋白激酶(AKT1)、半胱氨酸-天冬氨酸蛋白酶3(CASP3)、表皮生长因子(EGF)、细胞间黏附分子-1(ICAM1)、丝裂原活化蛋白激酶3(MAPK3)、血管内皮生长因子(VEGFA)、丝裂原活化蛋白激酶8(MAPK8)(见图5)。
2.5 GO与KEGG富集分析 对73个共同靶基因进行GO富集分析。结果包括生物过程(BP)1 336条、分子功能(MF)100条、细胞组分(CC)56条。
本文选取前10个GO功能富集的柱状图进行分析,P值代表富集的显著性,显著性越高,P值越小,其对应的颜色越偏向红色,反之则偏向蓝色;横坐标表示富集数目。从图6中BP富集区域包括对脂多糖的反应、对细菌源分子的反应、活性氧的响应、对金属离子的响应、对营养水平的反应、氧化应激反应、对抗生素的反应等;CC富集主要细胞中的膜筏、膜微区、膜区、质膜筏、囊腔等;MF富集结果主要为细胞因子活性、细胞因子受体结合、受体配体活性、受体激活剂活性、蛋白酶结合、蛋白磷酸酶结合等。
对73个共同靶基因进行KEGG富集分析,共得到153条富集结果。
选取P值较小、关键靶基因数较多前30条通路进行分析,主要涉及糖尿病并发症中的AGE-RAGE信号通路、肿瘤坏死因子信号通路、流体剪切应力与动脉粥样硬化、IL-17信号通路、卡波西肉瘤相关疱疹病毒感染、C-型凝集素受体信号通路、麻疹、前列腺癌、甲型流感、HIF-1信号通路、Toll样受体信号通路、人巨细胞病毒感染、NOD样受体信号通路、细胞凋亡、EB病毒感染、Th1和Th2細胞分化,NF-κB信号通路,PI3K-Akt信号通路等(见图7),图中纵坐标代表信号通路名称,横坐标代表富集的基因数量,气泡的颜色代表显著性,颜色越红,显著性越高。
绘制KEGG“主要通路-关键靶点”网络图(见图8),可直观看出基因与通路的关系,两连接节点数目越多,通路和基因所对应的图形则越大,并绘制相关性较大IL-17信号通路图(见图9)。
2.6 分子对接结果 分子对接在临床药物研究中具有重要意义,主要是通过匹配原则算法模拟蛋白质与小分子受体相互作用,预测受体与配体间的作用细节和反应机制,进而确定结合位点[5]。一般认为配体与受体结合的构象越稳定能量越低,发生的作用可能性越大[6],能量最低的结构为最优结构,当结合能小于0 kcal/mol说明大分子蛋白与小分子化合物之间可以自主结合;小于-5.0 kcal/mol表明有较好的结合活性;小于-7.0 kcal/mol表明有强烈的结合活性[7]。
本文将筛选出的14的核心靶基因与加减当归六黄汤中排名前5的核心成分(degree>10):槲皮素(quercetin)degree 59、山柰酚(kaempferol)degree 21、汉黄芩素(wogonin)degree 15、柚皮素(naringenin)degree 12与黄芩素(baicalein)degree 12进行分子对接,结果显示(见表1)结合能(binding energy)均小于-5 kcal/mol,表明加减当归六黄汤的核心成分与疾病的核心靶蛋白具有较好的结合活性;并对其具有强烈的结合活性的化合物与受体分子对接模式进行可视化分析,具体见图10。
3 讨论
从筛选出的图表数据可以看出加减当归六黄汤中有81个有效成分参与治疗肺炎,与肺炎潜在作用的共同靶基因共有73个。根据相互作用靶点数,排名前5的药物有效活性成分依次是槲皮素、山柰酚、汉黄芩素、柚皮素与黄芩素,5个化合物均属于黄酮类化合物,黄酮类具有抑制黄嘌呤氧化酶活性、抗肿瘤、清除自由基及抗病毒等生物学作用[8]。黄酮类化合物可抑制 NOX4/NF-κB/MLCK途径,减轻甲型流感病毒诱导的屏障功能障碍,维持肺内皮屏障功能稳定[9],协同参与抗炎、抗病毒、免疫调节、改善肺损伤等功能,可作为加减当归六黄汤治疗肺炎的主要药效群。
将CytoNCA拓朴分析得到的14个核心靶基因与药物有效活性成分进行分子对接显示均有较好的结合活性,表明此为加减当归六黄汤治疗肺炎的主要蛋白。MAPK1、MAPK3和MAPK8可介导免疫/炎症反应,调节细胞的生长、分化、炎症反应等,加重气道炎症和黏液分泌增加[10]。CASP、JUN、AKT1均可参与细胞凋亡过程。CASP3、CASP8是半胱氨酸蛋白酶家族成员,CASP8可作用于CASP3的天冬氨酶,激活凋亡下游的执行蛋白酶,最终导致细胞凋亡[11]。JUN激酶(JUN)是能够促使MAPK发生信号转导级联反应,调节特定的基因表达,参与细胞凋亡;JUN可介导巨噬细胞炎性反应,对急性肝损伤、急性炎症反应具有抗炎及免疫调节作用[12]。蛋白激酶(AKT1)基因在缺氧条件下能通过抑制凋亡相关因子的表达,从而抑制细胞凋亡,相关动物实验表明转染AKT1基因可以提高大鼠细胞耐缺氧能力[13]。PTGS是花生四烯酸合成前列腺素的关键限速酶,主要包括PTGS1和PTGS2在受一些炎性介质、细胞因子的刺激,可迅速表达,合成过量的前列腺素(PGs),促进其炎症反应[14]。血管内皮生长因子(VEGFA)可激活上皮下血管内皮细胞MAPK信号通路促进介质分泌,从而维持血管内皮环境稳定[15]。基质金属蛋白酶(MMPs) 是一组与ECM降解有关的蛋白水解酶家族,可参与细胞增殖、分化、凋亡、组织修复、血管生成、炎症反应及免疫应答等过程。MMP-9的含量增加,可促进ECM的降解速度,基底膜断裂,促进炎症细胞溢出扩散,聚集于呼吸道壁及呼吸道腔,加重其炎性反应及肺部炎性疾病的发生发展[16]。有研究指出,婴幼儿肺炎急性期外周血血清中MMP-9及MMP-9/TIMP-1水平可反映疾病严重程度、病原体种类和肺功能损伤的程度[17]。促血管生成因子(MMP2)可以直接调节细胞的黏附和迁移,主要是依靠MMP2剪切细胞-细胞受体来实现。CCL2是趋化因子CC亚家族成员,CCL2表达的增加可加重肺部炎症反应[18]。IL-6属白细胞介素家族,是重要的炎症因子,具有广泛的生物学活性,对机体细胞免疫和体液免疫均有调节作用,可参与炎症的病理过程。有研究表明,肺部感染包括支原体感染(MP)、呼吸道合胞病毒感染(RSV)及其他类型感染患者血清的白细胞介素水平均会明显升高,引起严重的炎症与肺组织损伤[19]。结合GO功能分析可知,加减当归六黄汤治疗肺炎的靶蛋白主要是通过炎症反应、细胞凋亡、免疫应答等过程而发挥作用。
综上所述,加减当归六黄汤中黄酮类化合物:槲皮素、山柰酚、汉黄芩素、柚皮素与黄芩素,可能是治疗肺炎的主要有效成分,分别与MAPK、AKT1、IL-6、CASP3、PTGS2、JUN等核心靶基因以氢键结合,发挥治疗作用,但后期仍应加以临床和实验验证,使其应用更具有指导意义。
参考文献
张鹏飞. 重症肺炎的病原菌构成及耐药性分析[D]. 南宁: 广西中医药大学, 2017.
周楚山. 李可老中医学术思想及其在肺炎的临床应用规律研究[D]. 广州: 广州中医药大学, 2018.
王静. 当归六黄汤加味对反复呼吸道感染瘀热内结模型小鼠免疫功能影响[D]. 北京: 北京中医药大学, 2016.
LE D H, PHAM V H. HGPEC: A Cytoscape App for prediction of novel disease-gene and disease-disease associations and evidence collection based on a random walk on heterogeneous network[J]. BMC Systems Biology, 2017, 11(1): 61.
李子真, 黃洋, 俞海, 等. 分子对接预测病毒表位的研究进展[J]. 中国病毒病杂志, 2019, 9(4): 296-302.
姚卫峰, 翟园园, 林丽丽, 等. 融合“成分-靶点-共有通路”网络和分子对接技术的清肺口服液抗新型冠状病毒肺炎的活性成分初探[J]. 南京中医药大学学报, 2020, 36(2): 174-178.
KUN Y H, SAMIK G, HIROAKI K, et al. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS ONE, 2013, 8(12): e83922.
郝悦, 焦安妮, 于敏, 等. 30种黄酮抑制黄嘌呤氧化酶活性的筛选[J]. 中成药, 2019, 41(1): 55-59.
YU W Y, LI L, WU F, et al.Moslea Herba flavonoids alleviated influenza A virus-induced pulmonary endothelial barrier disruption via suppressing NOX4/NF-κB/MLCK pathway[J]. Journal of Ethnopharmacology, 2020, 253: 112641.
DUAN J, XIE J,DENG T, et al.Exposure to both formaldehyde and high relative humidity exacerbates allergic asthma by activating the TRPV4-p38 MAPK pathway in Balb/c mice[J]. Environ Pollu, 2020, 256: 113375.
許嘉慧, 薛艳, 张炜, 等. 基于网络药理学的疏风解毒胶囊治疗新型冠状病毒肺炎(COVID-19)的分子机制探析[J]. 中草药, 2020, 51(8): 2015-2023.
李敬贤. 中药在重症肺炎康复中的应用规律及网络药理学分析[D]. 北京: 北京中医药大学, 2019.
于风旭, 陈永恩, 陈枫, 等. Akt1基因转染对BMSCs缺氧耐受影响的实验研究[J]. 中国修复重建外科杂志, 2016, 30(4): 479-484.
刘春琳. PTGS2基因单核苷酸多态性与肝细胞癌临床病理特征及预后关系研究[D]. 南宁: 广西医科大学, 2013.
窦双. (一)慢性阻塞性肺疾病合并支气管扩张临床特征的研究(二)慢性阻塞性肺疾病气道基底细胞TROP2对上皮间质营养单元调节作用的研究[D]. 济南: 山东大学, 2019.
董婷婷. 过表达THBS2对宫颈鳞癌SiHa细胞中MMPs家族表达差异的影响及过表达MMP1/MMP2对SiHa细胞侵袭迁移的影响[D]. 南宁: 广西医科大学, 2019.
李利平. 婴幼儿重症肺炎血清中MMP-9、TIMP-1的表达及意义[D]. 郑州: 郑州大学, 2017.
刘相良, 原铭贞, 刘笑玎, 等. 趋化因子及其受体在急性肺损伤中作用的研究进展[J]. 吉林大学学报(医学版), 2014, 40(4): 908-912.
张宏亮, 黄振光, 蒋霞, 等. 基于网络药理学研究加减麻杏石甘汤治疗重型新冠肺炎的作用机制[J]. 中药材, 2020, 43(7): 1777-1783.
基金项目:北京市中医妇幼名医传承工作室建设项目(编号:2020-46)
作者简介:王静,硕士研究生,主治医师,研究方向:中西医结合儿科。

