膳食结构对鞭虫感染人群肠道菌群的影响研究
张艺馨,王龙江,刘建成,刘萍萍,王用斌,许艳,闫歌,卜秀芹,张佃波,李曰进,张本光
1.山东省寄生虫病防治研究所,山东第一医科大学(山东省医学科学院),山东 济宁 272033;2.临沂市疾病预防控制中心;3.日照市岚山区疾病预防控制中心
毛首鞭形线虫(Trichuristrichiura)简称鞭虫,其寄生于人体盲肠和结肠,常引起肠道菌群紊乱,表现为肠球菌、肠杆菌和瘤胃球菌等机会致病菌增多[1-2],引发肠黏膜炎症、腹泻和肠梗阻等疾病[3]。膳食结构是影响肠道菌群的重要因素[4-5]。据文献报道,摄入蔬菜会提高布氏瘤胃球菌属和双歧杆菌属等优势菌种的数量[6-8];摄入50%粗蛋白含量的奶制品会导致大肠杆菌属和梭菌属细菌数量增加,双歧杆菌属数量降低,降低有害化合物的浓度[9];摄入高脂食物后会引起肠细菌总量、双歧杆菌属细菌减少[10],拟杆菌目和梭菌目细菌丰度相对增加,引起促炎因子分泌,产生肥胖[11]。另有研究报道,膳食结构可通过肠道菌群的中介作用影响鞭虫感染情况,介导肠道炎症性疾病[12-15]。这些既往研究大多为严格的干预试验,给予干预组的膳食结构较为单一,难以客观反映日常膳食摄入水平对肠道菌群的调节作用。为此,本研究基于山东省寄生虫病流行病学调查,收集居民鞭虫感染状况及膳食摄入情况,结合16S rDNA高通量测序技术探讨鞭虫感染人群膳食结构与肠道菌群的关系,为研究鞭虫感染人群肠道疾病与饮食关系奠定基础。
1 材料和方法
1.1 调查点及调查对象选择 在山东省日照市岚山区按照地理方位分为东、西、中、南、北五个片区,抽取安东卫街道、虎山镇、碑廓镇、高兴镇和黄墩镇5个镇(街道),每个镇(街道)各选取1个行政村为调查点(每个调查点不少于200人),开展鞭虫感染情况调查。采集人群粪便,并对所有人群进行问卷调查。问卷包括姓名、性别、年龄和身高体重等基本信息,蔬菜、奶制品和肉制品等膳食摄入频次等。鞭虫感染诊断依据《肠道蠕虫检测改良加藤厚涂片法》(WS/T 570—2017)[16]。
纳入标准:①经镜检证实为鞭虫感染者;②近1个月内未口服抗生素;③采样前至少保持一周的规律饮食。符合上述全部条件则纳入。排除标准:①近1个月手术治疗糖尿病、关节炎、消化系统疾病、心血管疾病、肿瘤等;②近半个月感冒发热并口服退烧药;③近3个月口服驱虫药。符合上述其中任意一项则排除。
1.2 调查对象分组 调查前对居民日常膳食种类及摄入量进行调研,根据研究对象所勾选的频次转化为平均每日摄入频次,乘以每份食物重量得出该食物项的日均摄入量[17],按照《中国居民膳食指南》[18]推荐摄入量对膳食结构进行分组,膳食结构分为蔬菜、奶制品、肉制品三类,PD表示鞭虫感染人群,V表示蔬菜,D表示奶制品,M表示肉制品,具体分组见表1。
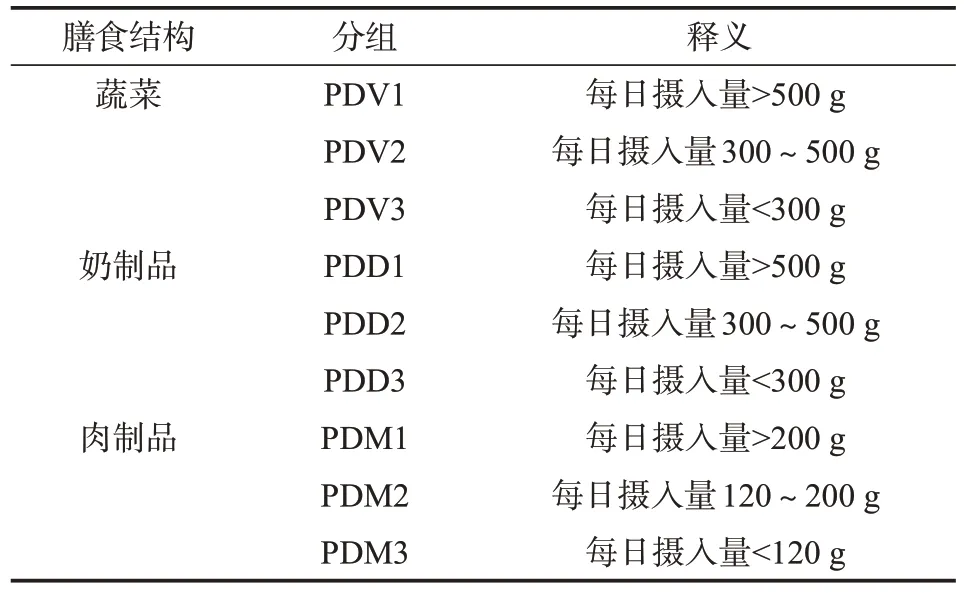
表1 不同膳食结构下鞭虫感染人群膳食摄入量分组情况Table 1 Grouping of dietary intake in whipworm-infected people under different dietary structures
1.3 主要试剂和仪器 TruSeq DNA PCR-Free试剂盒购自Illumina公司;Phusion®High-Fidelity PCR Master Mix with GC Buffer酶和缓冲液购自New England Biolabs公司;AxyPrepDNA凝胶回收试剂盒购自AXYGEN公司;QuantiFluor™-ST蓝色荧光计为Promega公司产品;Bio-rad T100梯度PCR仪。
1.4 人肠道细菌DNA提取 根据DNA试剂盒说明书从粪便样本中提取细菌DNA,对提取后的DNA产物经琼脂糖凝胶电泳进行检测(琼脂糖凝胶浓度:1%;电压:150 V;电泳时间:40 min)。取适量的样品于离心管中,使用无菌水稀释样品至1 ng/μL。实验重复3次。采用荧光计和琼脂糖凝胶电泳分别检测样本的浓度和完整性。
1.5 PCR扩增与建库 选择细菌引物片段341F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对 细 菌16S rRNA基因V3-V4高变区进行PCR扩增[19]。PCR反应体系包括:模板DNA 10 ng,正向和反向引物各0.8 μL,2×Phusion Master Mix 15µL,2µmol/L Primer 3µL。反应条件为:98℃预变性1 min;98℃变性10 s;50℃退火30 s;72℃延长30 s,共30个循环;最后72℃延长5 min,4℃保存。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测。PCR扩增产物经纯化、定量和均一化形成测序文库,送至深圳海一时代基因科技有限公司,在Illumina PE250平台上进行高通量测序。
1.6 数据处理与统计学分析 根据Barcode序列将下机数据拆分去杂后得到最终的有效数据[20]。将所有样品的全部有效序列按照97%的相似度进行可操作性分类单元(operational taxo-nomic unit,OTU)分类,使用QIIME软件中的assign_taxonomy.py和RDP Classifier方法[21],比对获得物种注释信息(置信度阈值默认为0.8以上);获得OTU的注释信息,通过Ribosomal Database Program(RDP)(version 2.2)软件[22]在不同分类水平(门、纲、目、科、属)进行分类注释,并绘制Veen图。基于数据均一化后的OTU物种丰度谱,使用QIIME软件中的alpha_diversity.py进行Observed species、Chao、Shannon和PD whole tree四种α多样性指数的计算[23]。采用SPSS 22.0统计学软件对α多样性指数进行单因素方差分析。基于数据均一化后的OTU物种丰度谱,使用QIIME软件中的jackknifed_beta_diversity.py进行Bray Curtis、Weighted Unifrac和Unweighted Unifrac三种β多样性距离的计算,将主坐标分析(principal coordinate analysis,PCoA)降维并进行可视化,通过R软件进行置换,利用MetaStat方法对组间的物种丰度数据进行假设检验,筛选具有组间差异的物种。检验水准α=0.05。
1.7 伦理学声明 该研究得到中国疾病预防控制中心寄生虫病预防控制所(国家热带病研究中心)伦理审查委员会批准(2021006),所有参与者均知情同意。
2 结果
2.1 研究对象基本特征 本次调查共采集人粪便1012份,镜检检出鞭虫感染者75人,符合条件人群共34人,其中男性19例,女性15例;年龄11~83岁,年龄中位数为68.5(60.5,70.0)岁;职业以农民最多,占94.1%(32/34);文化程度以文盲或半文盲和小学最多,均占34.3%(12/34)。在蔬菜膳食结构中,摄入量为300~500 g最多,占61.8%(21/34),其次为<300 g(11.8%,4/34)和>500 g(26.5%,9/34)。在奶制品膳食结构中,摄入量<300 g最多,占58.8%(20/34),其次为300~500 g(29.4%,10/34)和>500 g(11.8%,4/34)。在肉制品膳食结构中,摄入量>200 g最多,占58.8%(20/34),其次为<120 g(29.4%,10/34)和120~200 g(11.8%,4/34)。见表2。
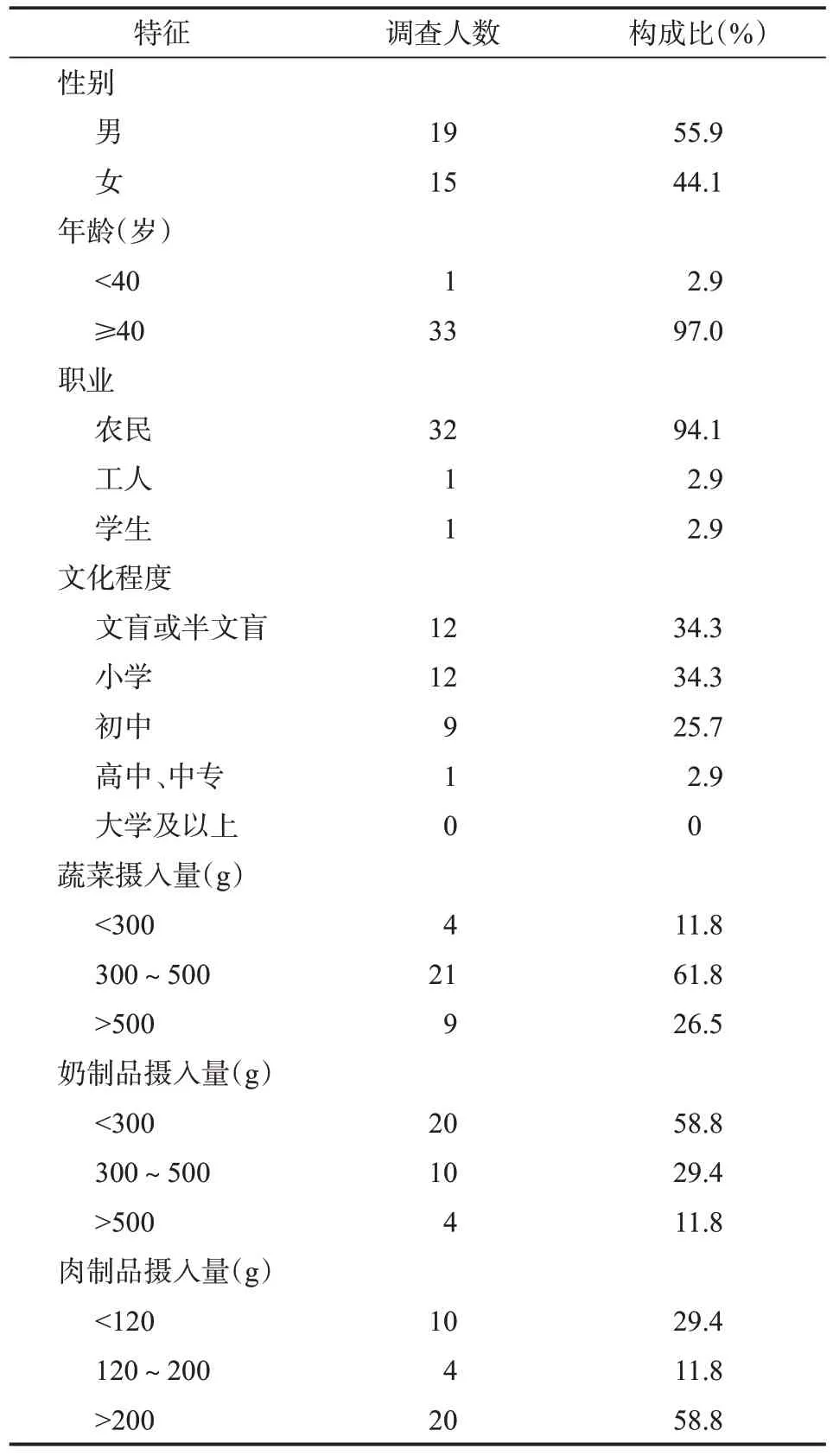
表2 鞭虫感染人群基本信息(n=34)Table 2 Basic information of whipworm infected population(n=34)
2.2 蔬菜膳食结构下鞭虫感染人群肠道菌群的特征
2.2.1 不同蔬菜摄入量鞭虫感染人群肠道菌群多样性分析 本研究所有样本经检测后质量良好,满足分析,在97%的相似度水平下对序列进行聚类,共有1348个OTUs,PDV1特有的OTUs有104个,PDV2特有的有480个,PDV3特有的有67个,见图1。α多样性分析显示,PDV2组肠道菌群α多样性低于PDV1组和PDV3组,不同蔬菜摄入量鞭虫感染人群肠道菌群Shannon、Chao1、Observed species和PD whole tree指数差异均无统计学意义(P>0.05),见表3。β多样性分析显示,降维后第一主成分解释了总差异的72%,第二主成分解释了总差异的26%,结果表明95%置信区间(95%CI)分组椭圆高度重叠,群落结构差异较小,不同蔬菜摄入量鞭虫感染人群肠道菌群无明显的分离和聚集现象,见图2。
表3 不同蔬菜摄入量鞭虫感染人群肠道菌群的α多样性指数(±s)Table 3 Alpha diversity index of intestinal bacteria in whipworm-infected people with different vegetable intake(±s)
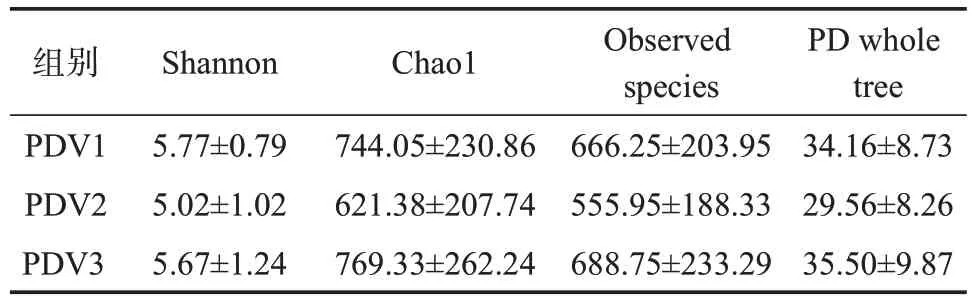
表3 不同蔬菜摄入量鞭虫感染人群肠道菌群的α多样性指数(±s)Table 3 Alpha diversity index of intestinal bacteria in whipworm-infected people with different vegetable intake(±s)
组别PDV1 PDV2 PDV3 Shannon 5.77±0.795.02±1.025.67±1.24 Chao1744.05±230.86621.38±207.74769.33±262.24 Observed species 666.25±203.95555.95±188.33688.75±233.29 PD whole tree 34.16±8.7329.56±8.2635.50±9.87
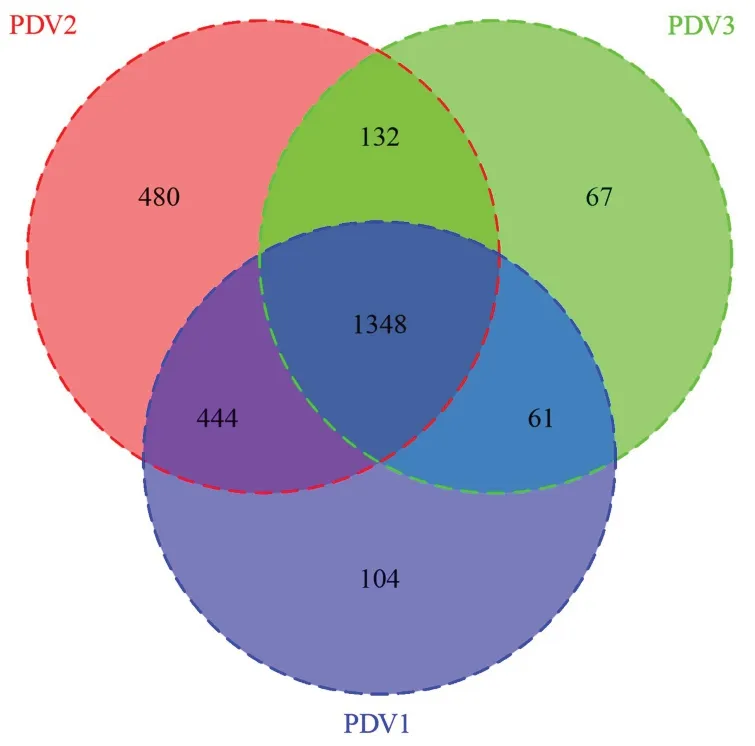
图1 不同蔬菜摄入量鞭虫感染人群肠道菌群的Veen图Figure 1 Veen of intestinal bacteria in whipworm-infected people with different vegetable intakes
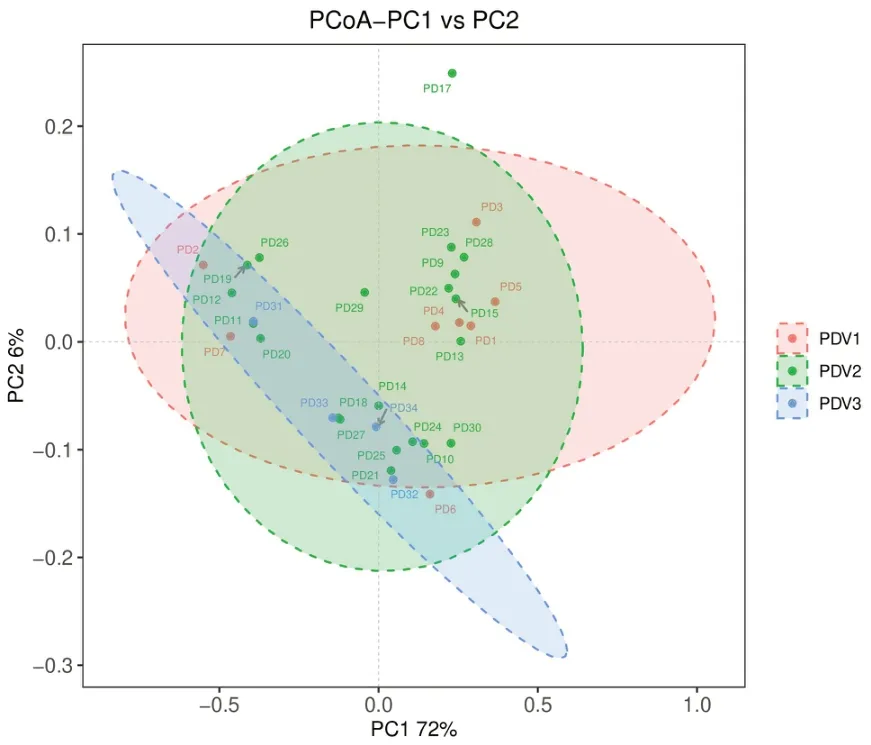
图2 不同蔬菜摄入量鞭虫感染人群肠道菌群的β多样性分析Figure 2 Beta diversity analysis of intestinal bacteria in whipworm-infected people with different vegetable intake
2.2.2 不同蔬菜摄入量鞭虫感染人群肠道菌群群落结构差异分析 在属分类水平上,PDV1组肠道菌群检测出157个属,PDV2组肠道菌群检测出177个属,PDV3组肠道菌群检测出140个属,普氏菌属9(Prevotella9)和粪杆菌属(Faecalibacterium)为不同蔬菜摄入量分组共有的主要菌属。MetaStat分析结果显示,PDV3组狭义梭菌属1(Clostridiumsensu stricto1)相对丰度为0.0070±0.0023,高于PDV1组的0.0036±0.0011,差异有统计学意义(t=2.211,P<0.05),PDV3组瘤胃球菌属(Ruminococcus)相对丰度为0.0046±0.0022,低于PDV1的0.0089±0.0045,差异有统计学意义(t=2.246,P<0.05),PDV3组双歧杆菌属(Bifidobacterium)相对丰度为0.0015±0.0022,低于PDV2的0.0135±0.0204,差异有统计学意义(t=2.610,P<0.05),见图3和图4。

图3 不同蔬菜摄入量鞭虫感染人群肠道菌群物种相对丰度图Figure 3 Relative abundance of intestinal bacteria species in different vegetable intakes in whipworm-infected people

图4 不同蔬菜摄入量鞭虫感染人群肠道菌群的差异物种丰度图Figure 4 The difference in species abundance of intestinal bacteria among different vegetable intakes in whipworm-infected people
2.3 奶制品膳食结构下鞭虫感染人群肠道菌群的特征
2.3.1 不同奶制品摄入量鞭虫感染人群肠道菌群的多样性分析 本研究所有样本经检测后质量良好,满足分析要求,经聚类获得1308个共有OTUs,PDD1特有的OTUs有69个,PDD2特有的有155个,PDD3特有的有358个,见图5。α多样性分析显示,PDD1组肠道菌群α多样性低于PDD3组,不同奶制品摄入量鞭虫感染人群肠道菌群Shannon、Chao1、Observed species和PD whole tree指数差异均无统计学意义(P>0.05),见表4。β多样性分析显示,降维后第一主成分解释了总差异的25%,第二主成分解释了总差异的29%,结果表明95%CI分组椭圆高度重叠,不同奶制品摄入量鞭虫感染人群样本较为混杂,难以通过群落特征鉴别三组,见图6。
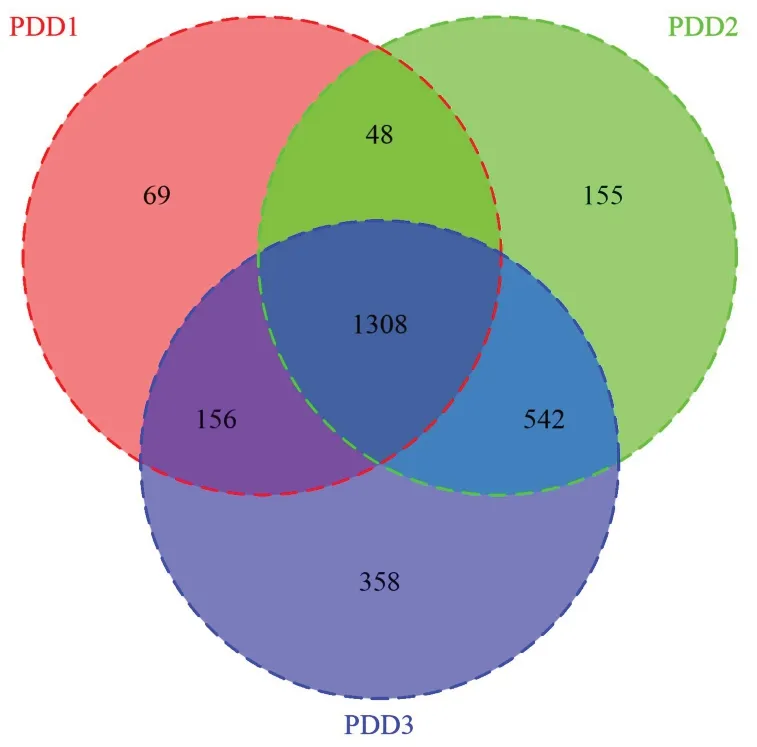
图5 不同奶制品摄入量鞭虫感染人群肠道菌群的Veen图Figure 5 Veen diagram of gut microbiota in whipworminfected people with different dairy intake
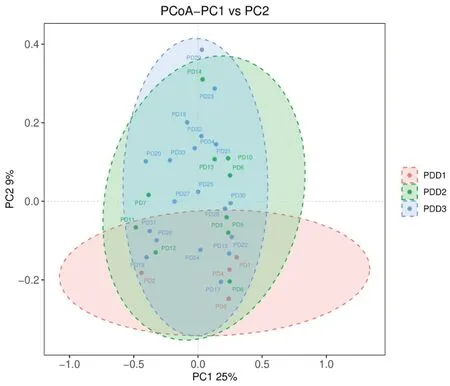
图6 不同奶制品摄入量鞭虫感染人群肠道菌群的β多样性分析Figure 6 Beta diversity analysis of intestinal bacteria in whipworm-infected people with different dairy intake
表4 不同奶制品摄入量鞭虫感染人群肠道菌群的α多样性指数(±s)Table 4 Alpha diversity index of intestinal bacteria in whipworm-infected people with different dairy intake(±s)
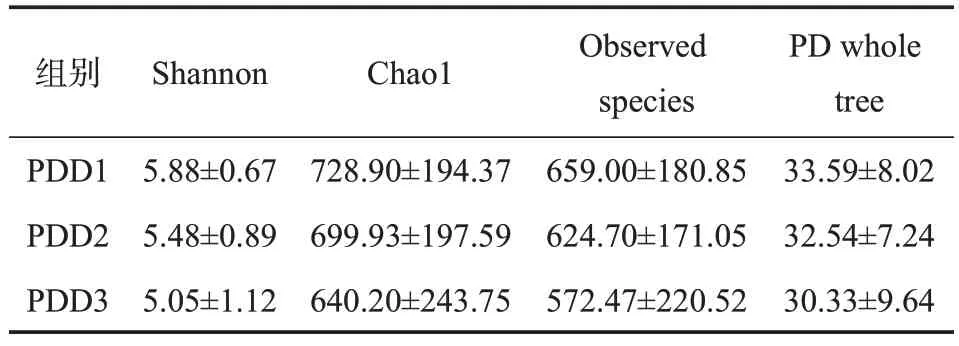
表4 不同奶制品摄入量鞭虫感染人群肠道菌群的α多样性指数(±s)Table 4 Alpha diversity index of intestinal bacteria in whipworm-infected people with different dairy intake(±s)
组别PDD1 PDD2 PDD3 Shannon 5.88±0.675.48±0.895.05±1.12 Chao1728.90±194.37699.93±197.59640.20±243.75 Observed species 659.00±180.85624.70±171.05572.47±220.52 PD whole tree 33.59±8.0232.54±7.2430.33±9.64
2.3.2 不同奶制品摄入量鞭虫感染人群肠道菌群群落结构差异分析 在属分类水平上,PDD1组肠道菌群检测出148个属,PDD2组肠道菌群检测出160个属,PDD3组肠道菌群检测出175个属,普氏菌属、拟杆菌属(Bacteroides)和粪杆菌属为不同奶制品摄入量分组共有的主要菌属。MetaStat分析结果显示,PDD2组狭义梭菌属1相对丰度为0.0087±0.0067,高于PDD1组的0.0020±0.0006,差异有统计学意义(t=3.025,P<0.05);PDD3组另枝菌属(Alistipes)相对丰度为0.0051±0.0063,低于PDD1的0.0117±0.0028,差异有统计学意义(t=3.234,P<0.05);PDD3组瘤胃球菌科UCG-014属(RuminococcaceaeUCG-014)相对丰度为0.0070±0.0089,低于PDD2的0.0403±0.0462,差异有统计学意义(t=2.255,P<0.05),见图7和图8。
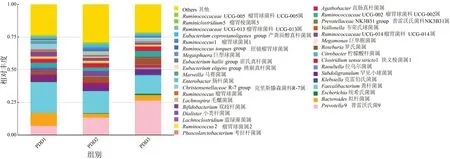
图7 不同奶制品摄入量鞭虫感染人群肠道菌群物种相对丰度图Figure 7 The relative abundance of intestinal bacterial species in whipworm-infected people with different dairy intake

图8 不同奶制品摄入量鞭虫感染人群肠道菌群的差异物种丰度图Figure 8 Species abundance map of intestinal bacteria in whipworm-infected people with different dairy intake
2.4 肉制品膳食结构下鞭虫感染人群肠道菌群的特征
2.4.1 不同肉制品摄入量鞭虫感染人群肠道菌群多样性分析 本研究所有样本经检测后质量良好,满足分析,经聚类获得1262个共有OTUs,PDM1特有的OTUs有405个,PDM2特有的有48个,PDM3特有的有146个,见图9。α多样性分析显示,PDM3组肠道菌群α多样性高于PDM1组,不同肉制品摄入量鞭虫感染人群Shannon、Chao1、Observed species和PD whole tree指数差异均无统计学意义(P>0.05),见表5。β多样性分析显示,降维后第一主成分解释了总差异的25%,第二主成分解释了总差异的29%,结果表明95%CI分组椭圆高度重叠,不同肉制品摄入量鞭虫感染人群样本较为混杂,难以通过群落特征鉴别三组,见图10。
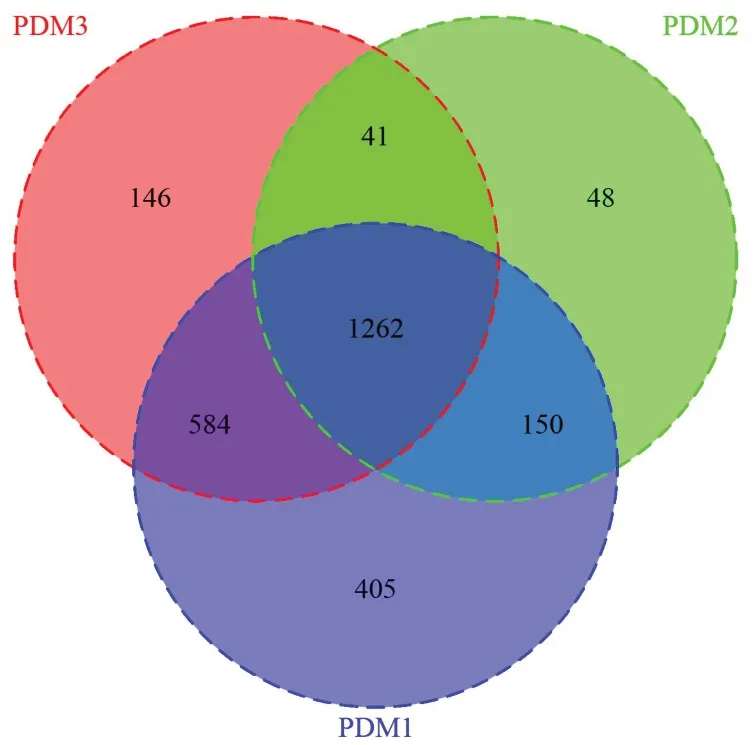
图9 不同肉制品摄入量鞭虫感染人群肠道菌群的Veen图Figure 9 Veen diagram of gut microbiota in whipworminfected people with different meat intake
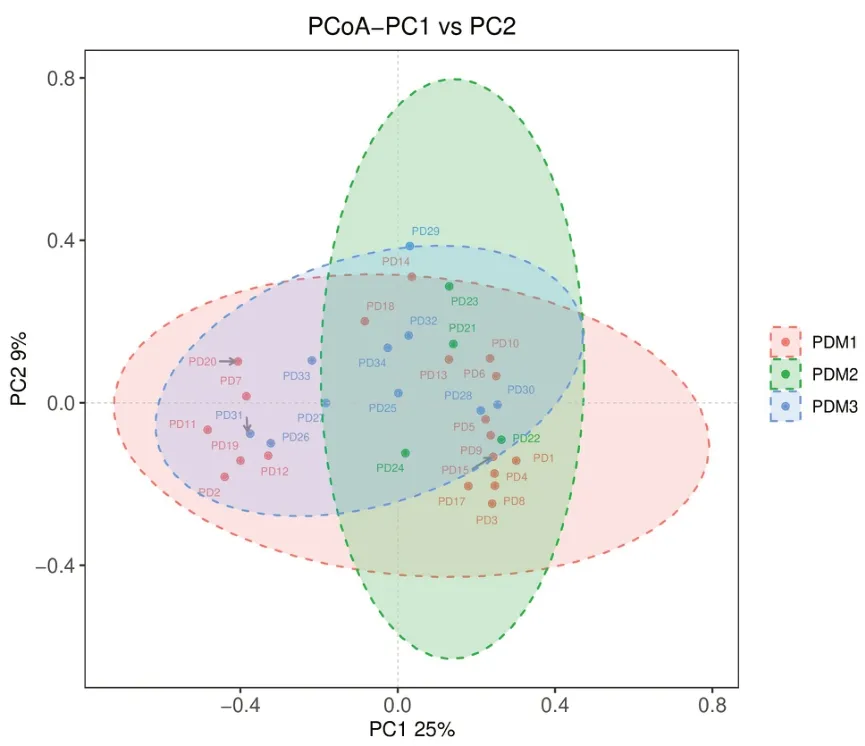
图10 不同肉制品摄入量鞭虫感染人群肠道菌群的β多样性分析Figure 10 Beta diversity analysis of intestinal bacteria in whipworm-infected people with different meat intake
表5 不同肉制品摄入量鞭虫感染人群肠道菌群的α多样性指数(±s)Table 5 Alpha diversity index of intestinal bacteria in whipworm-infected people with different meat intake(±s)
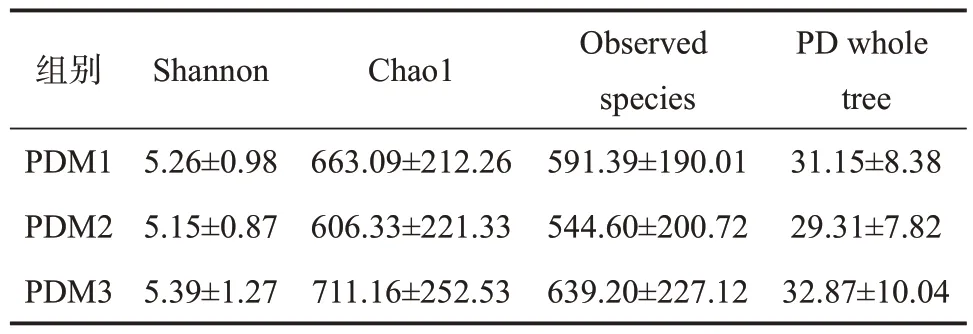
表5 不同肉制品摄入量鞭虫感染人群肠道菌群的α多样性指数(±s)Table 5 Alpha diversity index of intestinal bacteria in whipworm-infected people with different meat intake(±s)
组别PDM1 PDM2 PDM3 Shannon 5.26±0.985.15±0.875.39±1.27 Chao1663.09±212.26606.33±221.33711.16±252.53 Observed species 591.39±190.01544.60±200.72639.20±227.12 PD whole tree 31.15±8.3829.31±7.8232.87±10.04
2.4.1 不同肉制品摄入量鞭虫感染人群肠道菌群群落结构差异分析 在属分类水平上,PDM1组肠道菌群检测出177个属,PDM2组肠道菌群检测出139个属,PDM3组肠道菌群检测出162个属,普氏菌属和粪杆菌属为不同肉制品摄入量分组共有的主要菌属。MetaStat分析结果显示,PDM2组考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属2(Ruminococcus2)相对丰度分别为0.0016±0.0020和0.0024±0.0018,低于PDM1组的0.0078±0.0092和0.0120±0.0034,差异有统计学意义(t=2.672、2.731,P均<0.05);PDM3组小类杆菌属(Dialister)相对丰度为0.0028±0.0027,低于PDM2组的0.0281±0.0102,差异有统计学意义(t=2.402,P<0.05),见图11和图12。

图11 不同肉制品摄入量鞭虫感染人群肠道菌群物种相对丰度图Figure 11 The relative abundance of intestinal bacterial species in whipworm-infected people with different meat intake
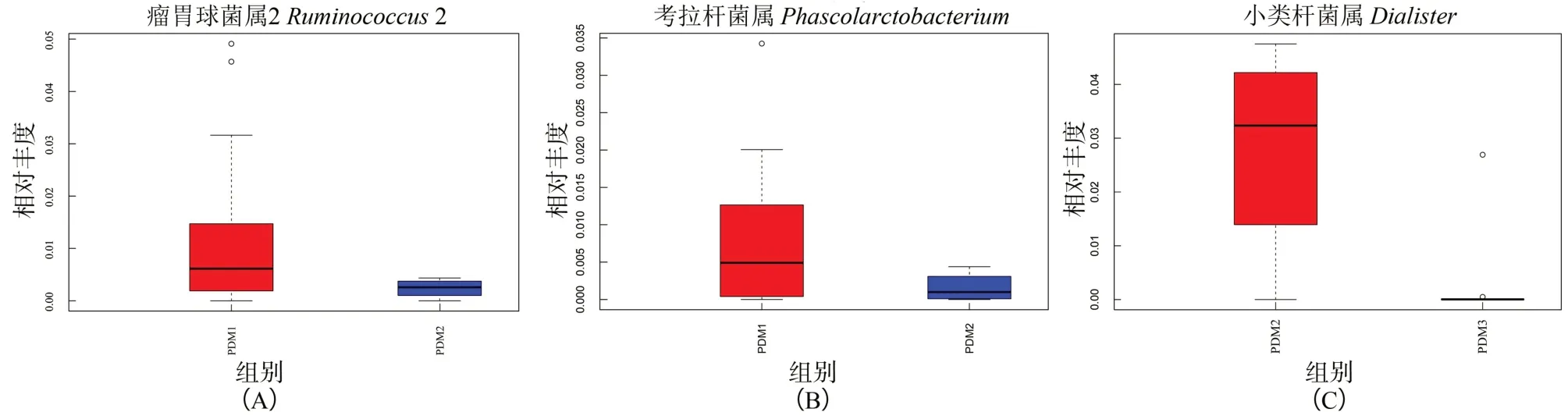
图12 不同肉制品摄入量鞭虫感染人群肠道菌群的差异物种丰度图Figure 12 The difference of species abundance of intestinal bacteria in whipworm-infected people with different meat intake
3 讨论
膳食是影响肠道微生物群落的组成、多样性和丰富度变化的重要因素[24],其中碳水化合物、蛋白质和脂肪三大宏量营养素的数量、类型和平衡都对肠道菌群有显著影响[25]。本研究结果显示,在蔬菜、奶制品和肉制品膳食结构下,不同摄入量鞭虫感染人群肠道菌群组成存在显著差异。在蔬菜膳食结构中,每日蔬菜摄入量<300 g的鞭虫感染人群瘤胃球菌属和双歧杆菌属丰度降低,与Goff等[26-27]研究结果相似。瘤胃球菌属和双歧杆菌属是产丁酸盐微生物的标志菌属,丁酸盐等短链脂肪酸具有维持人体健康的多重作用,例如充当肠道上皮特殊营养和能量组分、增强胃肠道运动机能、保护肠道黏膜屏障和调节免疫等作用[28],其丰度降低导致机体免疫抑制和抗炎功能降低[29-30],肠壁的通透性增加,使更多的内毒素进入血液循环,容易引起炎症[31-32]。因此,蔬菜摄入量较低时,对于鞭虫感染人群可能增加了发生肠道炎症性疾病的机会。每日蔬菜摄入量>500 g的鞭虫感染人群狭义梭菌属1相对丰度显著低于每日蔬菜摄入量<300 g组。有研究发现[33-34],感染鞭虫的猪在摄入大量膳食纤维后,狭义梭菌属1有所减少,有利于抑制溃疡性结肠炎,增强抗炎应答,与本研究结果相一致。在奶制品膳食结构中,不同奶制品摄入量的鞭虫感染人群狭义梭菌属1、另枝菌属和瘤胃球菌科UCG-014属相对丰度差异有统计学意义,其中每日奶制品摄入量<300 g的另枝菌属相对丰度显著低于每日奶制品摄入量>500 g组,与Gong等[35]研究一致。另枝菌属是拟杆菌门的一种革兰氏阴性细菌,与奶制品膳食中的氨基酸含量呈正相关,可以调节炎症反应[36],本研究中奶制品摄入量较高组拥有更加丰富的另枝菌属和瘤胃球菌科UCG-014属,有利于鞭虫病患者调节炎症反应,维持肠道稳态。在肉制品膳食结构中,每日肉制品摄入量120~200 g的鞭虫感染人群考拉杆菌属和瘤胃球菌属2相对丰度显著低于每日肉制品摄入量>200 g组,每日肉制品摄入量<120 g鞭虫感染人群小类杆菌属相对丰度显著低于每日肉制品摄入量120~200 g组。考拉杆菌属、瘤胃球菌属2和小类杆菌属均为肠道有益菌,考拉杆菌属和瘤胃球菌属2可有效利用琥珀酸,与短链脂肪酸含量呈正相关[37],小类杆菌属为消化道内重要的产γ-氨基丁酸(Gamma-aminobutyric acid,GABA)菌属[38],其中考拉杆菌属和小类杆菌属常作为预测免疫相关性腹泻的标志菌属,其丰度下降与腹泻发病密切相关[39-41]。
本研究的主要优势在于关注鞭虫感染人群日常饮食中多种膳食摄入量对肠道菌群的影响,排除了药物和其他疾病等混杂因素的影响。但本研究只在蔬菜膳食、奶制品膳食和肉制品膳食这三个维度进行膳食结构对肠道菌群影响分析,影响肠道菌群的膳食结构还包括纤维素和矿物质膳食等,下一步可以将多种膳食结构纳入多因素进行综合评价,为研究人体感染鞭虫后肠道菌群的变化奠定基础。
综上所述,本研究发现鞭虫感染者蔬菜、奶制品和肉制品三种膳食结构摄入量可以影响肠道菌群构成。在蔬菜膳食结构中,蔬菜摄入量较低组的瘤胃球菌属、双歧杆菌属丰度显著下调,狭义梭菌属1丰度显著上调,蔬菜摄入量较低组对于鞭虫感染人群可能增加了发生肠道炎症性疾病的机会,蔬菜摄入量较高组有利于抑制溃疡性结肠炎,增强抗炎应答反应。在奶制品膳食结构中,奶制品摄入量较高组的另枝菌属和瘤胃球菌科UCG-014属丰度显著上调,狭义梭菌属1丰度显著下调,有利于鞭虫病患者调节炎症反应,维持肠道稳态。在肉制品膳食结构中,肉制品摄入量较高组的考拉杆菌属、瘤胃球菌属2和小类杆菌属丰度显著上调,提示肉制品摄入量可能影响鞭虫感染人群腹泻的发生与发展。因此,应重视日常膳食摄入对鞭虫感染人群肠道疾病的调节作用,鞭虫感染人群在日常膳食摄入时应遵循《中国居民膳食指南》推荐摄入量,通过补充蔬菜、奶制品、肉制品膳食来降低狭义梭菌属1等有害菌,提高双歧杆菌属和另枝菌属等有益菌,提高机体免疫力,来减轻或避免鞭虫感染人群发生腹泻和肠道炎症性疾病,预防和控制鞭虫病。
利益冲突声明全部作者声明无利益冲突
作者贡献声明张艺馨负责数据整理、统计、分析和论文撰写;王龙江、刘建成、刘萍萍、王用斌、许艳、闫歌、卜秀芹、张佃波、李曰进负责数据收集;张本光负责研究设计和论文撰写指导

