WO3-CaSO4 在HCl-Na2SO4 溶液中的平衡溶解
徐略渭,何秉轩,徐国钻,雷 鑫,胡皓东,梁 勇✉,刘德刚
1) 江西理工大学材料冶金化学学部,赣州 341000 2) 崇义章源钨业股份有限公司,赣州 341300
钨是一种重要的战略金属,在采矿、金属加工、石油、航空航天工业等方面有着广泛的应用[1-5],素有“工业牙齿”的名誉.我国是钨冶炼大国,拥有丰富的钨矿石资源,据统计,2020 年中国钨矿储量(以WO3计)达222.49 万吨[6],随着优质黑钨的不断消耗,白钨矿已成为我国当前主要钨矿石原料[7-8].
碱压煮-离子交换工艺作为目前国内主流的钨冶炼工艺,具有金属收率高、工艺成熟等特点,但也存在用水量大、废水量大、生产成本高等问题[9-10],尤其是2016 年《国家危险废物名录》[11]颁布后,传统碱分解工艺所产生的碱分解渣、除钼渣、废水处理污泥均被定义成危废,给企业带来了经济与环境的双重压力[12],严重滞缓了钨冶炼行业的发展,其根本原因之一就在于碱分解工艺必须先生成中间产品粗钨酸钠溶液,后经离子交换转型成钨酸铵[13-14],该过程用水量大、废水量大、工序冗长繁琐.针对以上问题,国内科研工作者开发了Na2CO3压煮-碱性萃取[15]、氟盐铵盐分解白钨[16-17]、硫磷混酸分解白钨[18-19]等钨冶炼新技术,皆在无离子交换工序的前提下实现了钨矿冶炼,对缓解钨行业压力做出了一定贡献,但随着国内优质黑钨的不断消耗,钨矿品位整体呈下降趋势,钨矿浮选过程所添加的浮选药剂增加,导致残留在钨矿中的浮选药剂增加,而上述钨冶炼新工艺与传统碱分解工艺皆为湿法技术,生产过程均存在冒槽风险[20],给生产带来不便.对此,本团队在大量白钨焙烧分解工艺研究基础上,创新性提出酸法焙烧思路,高温焙烧去除浮选药剂,绕过钨酸钠阶段,钨矿与硫酸盐焙烧一步转型生成WO3,无需离子交换,所得焙烧产物经过钨钙分离后得到WO3富集物,再采用氨溶手段,将WO3转化为钨酸铵溶液,除去少量的不溶杂质,最后经过成熟的除杂-蒸发结晶工序可生产出零级品APT,工艺所得渣为一般固废,具有分解率高、原料适用性广等优点.由于硫酸盐与钨矿混合焙烧后,白钨矿焙烧产物的主要杂质为可溶性Na2SO4与难溶性CaSO4,焙烧产物中,约含27%的WO3以及23%的CaSO4,若不能及时去除硫酸钙,后续氨溶工序中极有可能出现反钙现象,导致钨金属收率降低[21-22],因此,钨钙分离十分必要,本文在文献调研后发现,CaSO4在盐酸中的溶解度远高于WO3在盐酸中的溶解度[23-25],利用盐酸浸出白钨焙烧产物可以较好地实现钨的富集,而目前CaSO4与WO3在HCl-Na2SO4溶液中的溶解规律未见报道.
基于此,本文采用等温平衡法[26-27],围绕WO3-CaSO4在HCl-Na2SO4溶液中的溶解规律展开研究,分别考察并对比了WO3、CaSO4和WO3-CaSO4在盐酸溶液与HCl-Na2SO4溶液中的溶解行为,以期为硫酸盐焙烧分解白钨工艺钙钨分离技术奠定理论基础.
1 实验
1.1 实验原料
为了排除白钨矿中杂质对实验的干扰,对比突出WO3、CaSO4在HCl-Na2SO4溶液中的溶解差异,本文采用纯物质进行溶解实验,实验所用试剂为CaSO4、铬蓝黑R 指示剂、EDTA、WO3、Na2SO4、盐酸等,皆为分析纯.
1.2 过程与分析
由于盐酸在常压下即可溶解部分硫酸钙,因此本文实验着重考察常压条件下,不同因素对WO3-CaSO4在HCl-Na2SO4溶液中平衡溶解的影响趋势,按条件称取硫酸钙、硫酸钠、三氧化钨加入一定体积的盐酸溶液中,置于恒温常压水浴锅中加热溶解,溶解完成后抽滤,对滤液进行钙离子滴定检测,对酸浸产物进行烘干收集.
实验采取钙离子螯合滴定法检测滤液的钙离子浓度[28-29],采用钨酸铵灼烧重量法[30-33]检测相关酸浸产物中钨的含量,并基于以上检测结果计算出物质溶解度.
2 结果与讨论
2.1 CaSO4 在HCl-Na2SO4 溶液中的溶解度
首先考察CaSO4在盐酸溶液中的溶解规律,控制溶解温度40~80 ℃、盐酸浓度0~4 mol·L-1,使CaSO4在盐酸中充分溶解,考察盐酸浓度及溶解温度对硫酸钙溶解效果的影响,结果如图1 所示:

图1 盐酸浓度、温度对CaSO4 在盐酸中溶解的影响Fig. 1 Influence of hydrochloric acid concentration and temperature on the solubility of CaSO4 in hydrochloric acid
图1 表明,当盐酸浓度小于3 mol·L-1时,CaSO4在盐酸中的溶解度随温度升高而增大,大于3 mol·L-1后,CaSO4在盐酸中的溶解效果反而变差,由德拜-休克尔理论[34]可知,低浓度盐酸条件下,盐酸浓度增大,溶液离子强度随之增大,而平均活度系数γ±减小,再由电势v以及阴阳离子电势v-与v+计算活度CaSO4质量摩尔浓度m相对增大,即溶解度增大;继续增大盐酸浓度,此时CaSO4作为一种2∶2 价型电解质形成正负离子对,短程静电作用加强,溶解度降低.
继续考察Na2SO4对CaSO4在盐酸中的溶解影响,分别控制溶解时间0.5~2.5 h、盐酸浓度1~5 mol·L-1、n(HCl):n(Na2SO4)=1∶2~2∶1、溶解温度40~80 ℃,考察CaSO4在HCl-Na2SO4溶液中溶解效果,并与CaSO4在盐酸溶液中的溶解情况相比较,结果如图2 所示.
对比图1、图2 发现,升高温度对CaSO4在盐酸或HCl-Na2SO4溶液中均可以起到促进溶解的作用,升高温度至80 ℃时,CaSO4在HCl-Na2SO4溶液中溶解度最大仅为10.59 g·L-1,与CaSO4在盐酸中的溶解度相比,降低了68%;另外,由于同离子效应,Na2SO4促进了CaSO4饱和,相比于CaSO4在盐酸溶液中,硫酸钙在HCl-Na2SO4溶液中的饱和时间由2 h 缩短至1 h;相同的n(HCl):n(Na2SO4)比例下,盐酸浓度越大,Na2SO4含量越少,越有利于CaSO4溶解,提高盐酸浓度带来的溶解增益越大,当盐酸浓度为2 mol·L-1、n(HCl):n(Na2SO4)=2∶1 时,CaSO4在HCl-Na2SO4溶液中溶解度达到峰值17.04 g·L-1.
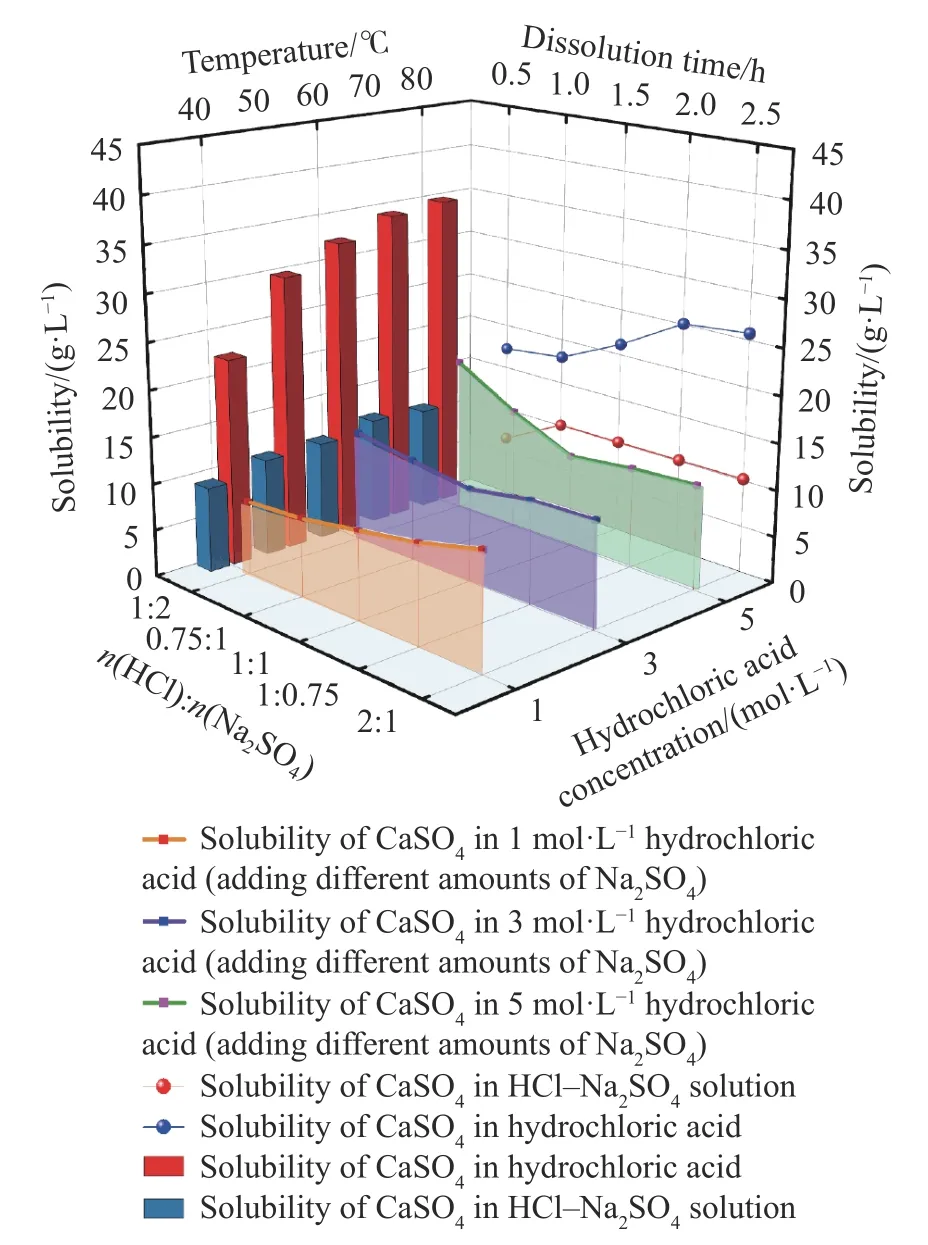
图2 CaSO4 在HCl-Na2SO4 溶液中的溶解情况Fig. 2 Dissolution of CaSO4 in HCl-Na2SO4 solution
总体来看,CaSO4在HCl-Na2SO4溶液中的溶解受盐酸浓度与n(HCl):n(Na2SO4)影响较大,由于同离子效应,Na2SO4显著抑制了CaSO4的溶解,使其溶解度在5~18 g·L-1范围内上下波动.
2.2 WO3 在盐酸溶液中的溶解度
为研究WO3在盐酸溶液中的溶解规律,控制盐酸浓度1 mol·L-1、溶解温度60 ℃,设定溶解时间为0.5~2.5 h,考察溶解时间对WO3在盐酸中溶解的影响,结果如图3 所示.
图3 表明,随着溶解时间加长,WO3在盐酸中的溶解度逐渐增高,当溶解时间达到1.5 h 时,WO3在盐酸中的溶解趋于饱和,溶解度为0.7 g·L-1.
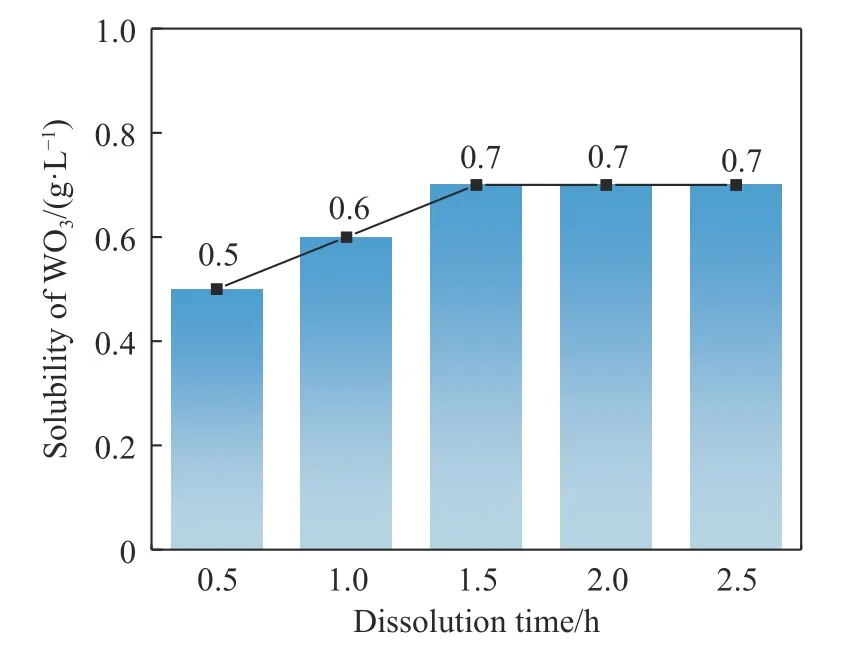
图3 时间对WO3 在盐酸中溶解的影响Fig. 3 Influence of time on the solubility of WO3 in hydrochloric acid
控制盐酸浓度1 mol·L-1、溶解时间1.5 h,分别设置溶解温度为30~70 ℃,考察温度对WO3在盐酸中溶解的影响,结果如图4 所示.
由图4 可知,随着温度逐渐上升,WO3在盐酸中的溶解度总体保持缓慢上升趋势,当温度升至50 ℃时,WO3溶解度提升至0.7 g·L-1.
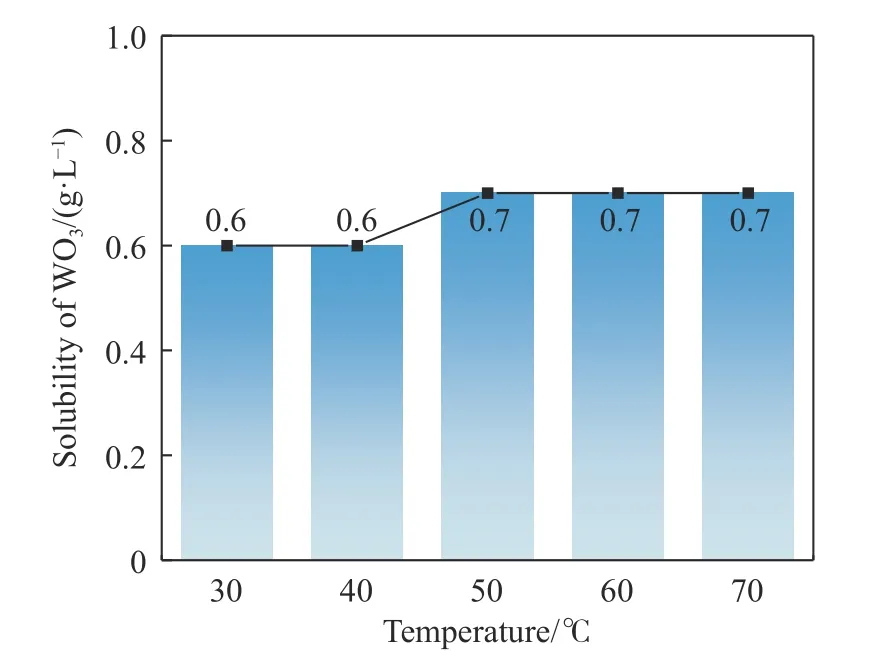
图4 温度对WO3 在盐酸中溶解度的影响Fig. 4 Influence of temperature on the solubility of WO3 in hydrochloric acid
控制溶解时间1.5 h、溶解温度60 ℃,分别设置盐酸浓度为1~5 mol·L-1,考察盐酸浓度对WO3在盐酸中的溶解度的影响,结果如图5 所示.

图5 盐酸浓度对WO3 在盐酸中溶解度的影响Fig. 5 Influence of hydrochloric acid concentration on the solubility of WO3 in hydrochloric acid
图5 表明,随着盐酸浓度的升高,WO3在盐酸中的溶解度始终恒定在0.6~0.7 g·L-1之间,盐酸浓度对WO3的溶解影响较小.
在盐酸浓度1 mol·L-1、温度60 ℃的前提下,控制n(HCl)∶n(Na2SO4)分别为1∶2、1∶1、2∶1,选取溶解时长分别为0.5 h、1 h,相互比对,继续考察Na2SO4对WO3在盐酸中溶解的影响,结果如图6 所示.

图6 n(HCl):n(Na2SO4)对WO3 在盐酸中溶解度的影响Fig. 6 Influence of n(HCl):n(Na2SO4) on the solubility of WO3 in hydrochloric acid
由图6 可知,Na2SO4对WO3在盐酸中溶解影响较小,随着Na2SO4含量增多,WO3在盐酸中的溶解度保持缓慢上升趋势,最终稳定在0.7 g·L-1.
2.3 WO3-CaSO4 在HCl-Na2SO4 溶液中的溶解度
上述研究表明,CaSO4、WO3单独在盐酸中的溶解度确实存在较大差异,且Na2SO4对两者的影响程度各不相同,若CaSO4与WO3同时在盐酸溶液或HCl-Na2SO4溶液中溶解,其溶解规律表现尚不明确,因此有必要对WO3-CaSO4在盐酸溶液与HCl-Na2SO4溶液中的溶解规律展开研究.首先考察WO3-CaSO4在盐酸溶液中的溶解规律,控制盐酸浓度1~5 mol·L-1、溶解温度30~70 ℃、Ca/W摩尔比1∶1~3∶1,溶解时间0.5~2.5 h、并对数据进行梳理,结果如图7 所示.
图7 表明,CaSO4、WO3同时在盐酸溶液中溶解时,溶解度差异依然较大.控制其他条件不变的前提下,延长溶解时间与提高溶解温度皆能促进CaSO4在盐酸溶液中的溶解;此外,由于溶解实验所加入的溶质量,都足以满足溶质达到饱和溶解平衡,因此Ca/W 比对两者溶解度影响均较小;随着盐酸浓度逐渐提高,CaSO4的溶解表现与CaSO4单独在盐酸中时相似,出现了溶解度先增后减的变化趋势,当盐酸浓度为3 mol·L-1时,溶解度达到峰值42.1 g·L-1,而不同浓度盐酸对WO3的溶解度仍然影响不大,溶解度始终保持在0.7 g·L-1附近.
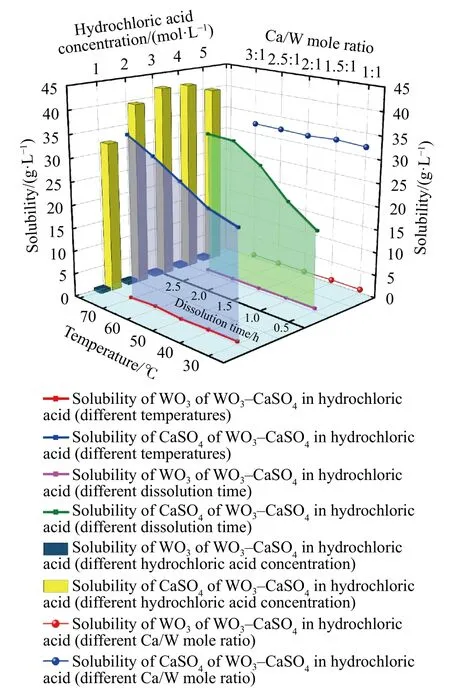
图7 WO3-CaSO4 在盐酸溶液中的溶解情况Fig. 7 Dissolution of WO3-CaSO4 in HCl-Na2SO4 acid solution
综合来看,与CaSO4、WO3单独在盐酸溶液中相比,WO3-CaSO4在盐酸溶液中溶解时,CaSO4溶解度远大于WO3的情况基本不变,两者溶解基本互不干扰.相应的,为了系统考察Na2SO4对WO3-CaSO4在HCl-Na2SO4溶液中溶解的影响,分别设置溶解时间0.5~2.5 h、溶解温度40~80 ℃、W/C摩尔比为1∶1~2∶1、盐酸浓度1~5 mol·L-1、n(HCl):n(Na2SO4) 1∶2~2∶1,结果如图8 所示.

图8 WO3-CaSO4 在HCl-Na2SO4 溶液中的溶解情况Fig. 8 Dissolution of WO3-CaSO4 in HCl-Na2SO4 solution
图8 表 明,当WO3-CaSO4在HCl-Na2SO4溶液中溶解时,溶解特性与两者单独在HCl-Na2SO4溶液中的溶解情况基本相同:随着溶解温度与时长的增加,两者溶解度总体上保持上升趋势;随着盐酸浓度的增大,WO3在HCl-Na2SO4溶液中的溶解度缓慢上升,CaSO4溶解度则表现为先降后升趋势;WO3溶解度始终维持在3 g·L-1以内,后续通过成熟的低钨回收工艺[35-36],可有效回收酸浸液中的溶解钨,大幅减少钨的损失,CaSO4溶解度则受同离子效应影响较大,其溶解度随Na2SO4浓度增大而逐渐降低,因此Na2SO4含量越少,CaSO4与WO3在盐酸中的溶解度差异越大,越有利于钨钙分离.
以上研究表明,不论是在盐酸还是在HCl-Na2SO4溶液中,WO3与CaSO4的溶解度差异较大,为钨钙分离创造了基础条件,由于Na2SO4对WO3的溶解无明显影响,但其同离子效应却会明显抑制CaSO4的溶解,使CaSO4溶解度降低,提前饱和,不利于钨钙分离.
3 结论
(1)硫酸钙、WO3单独存在于HCl-Na2SO4溶液中时的溶解规律表明:WO3溶解度基本稳定在0.3 至3 g·L-1之间,基本不受Na2SO4与CaSO4影响;而CaSO4溶解度受温度、盐酸浓度的影响较大,溶解度最高可达55 g·L-1,Na2SO4会显著抑制其在盐酸中的溶解.
(2)WO3-CaSO4在HCl-Na2SO4溶液中的溶解规律表明:当CaSO4与WO3在HCl-Na2SO4溶液中共存时,两者的溶解情况基本不变,提升盐酸浓度与溶解温度、减小Na2SO4含量可增大两者的溶解度差异,因此,调控一定的溶解条件可实现钨钙的高效分离.

