复合益生菌发酵对全混合日粮品质的影响
王光辉, 杨连玉, 王 丹, 刘 博, 杨文艳, 张庆华*
(1.吉林农业大学教研基地管理处,吉林长春 130118;2.吉林农业大学动物科学技术学院,动物生产及产品质量安全教育部重点实验室,吉林省动物营养与饲料重点实验室,吉林长春 130118;3.正大永吉实业有限公司,吉林永吉 132100)
全混合日粮(TMR)是根据反刍动物的不同发 育时期所需要的营养水平,将粗饲料与精料补充料充分拌匀混合,制成的营养相对均衡的日粮。TMR相对于传统饲喂方式,具有提高适口性,增加干物质采食量,避免反刍动物由于挑食精料而导致的瘤胃代谢失调,降低疾病发生等优点(杨连玉等,2018)。但研究报道由于TMR本身含水量高、易发霉变质、难贮存的特点,限制了TMR的应用(刘海燕等,2009)。本研究对TMR进行益生菌发酵处理(乳酸菌、蜡样芽胞杆菌、枯草芽孢杆菌、米曲霉和酵母菌),探究其对TMR营养成分、贮存时间、霉菌毒素等指标的影响,为TMR在实际生产中的应用推广提供实践依据。
1 材料与方法
1.1 试验材料 试验菌种:复合益生菌制剂采用乳酸菌(Lactobacilli,CCTCC HB 20082747菌株),枯 草 芽 孢 杆 菌 (Bacillussubtitles,CCTCC HB 20082795菌株),蜡样芽孢菌 (Bacilluscereus,CCTCC CB 20081773),米曲霉(Asopergiilusoryza,CCTCC CF 2008970菌株)和酿酒酵母菌(CCTCC AY 2019005菌株)混合,以上菌种来自中国典型培养物保藏中心。试验各处理组的菌种规格及混合比例见表1。

表1 菌种规格及混合比例
1.2 试验设计及管理 试验采用完全随机设计,试验分为3组,即对照组(未添加复合益生菌),试验1组(TMR+0.5%乳酸菌,枯草芽孢杆菌,蜡样芽胞杆菌和米曲霉复合物),试验2组(TMR+0.5%乳酸菌,枯草芽孢杆菌,蜡样芽孢杆菌,米曲霉和酵母菌复合物),每组处理设置6个重复,每个重复1个贮存罐,共18个贮存罐,室温密闭保存。
试验在吉林省动物营养与饲料科学重点实验室进行,将3组日粮加入贮存罐中,每罐2 kg,含水量调至50%,密封发酵至30 d,并在试验期间对其进行观察、采样、测定和记录。
1.3 试验日粮 TMR由吉林省广泽农牧科技有限公司提供,并按试验设计添加复合微生物制剂,日粮组成及营养水平见表2。
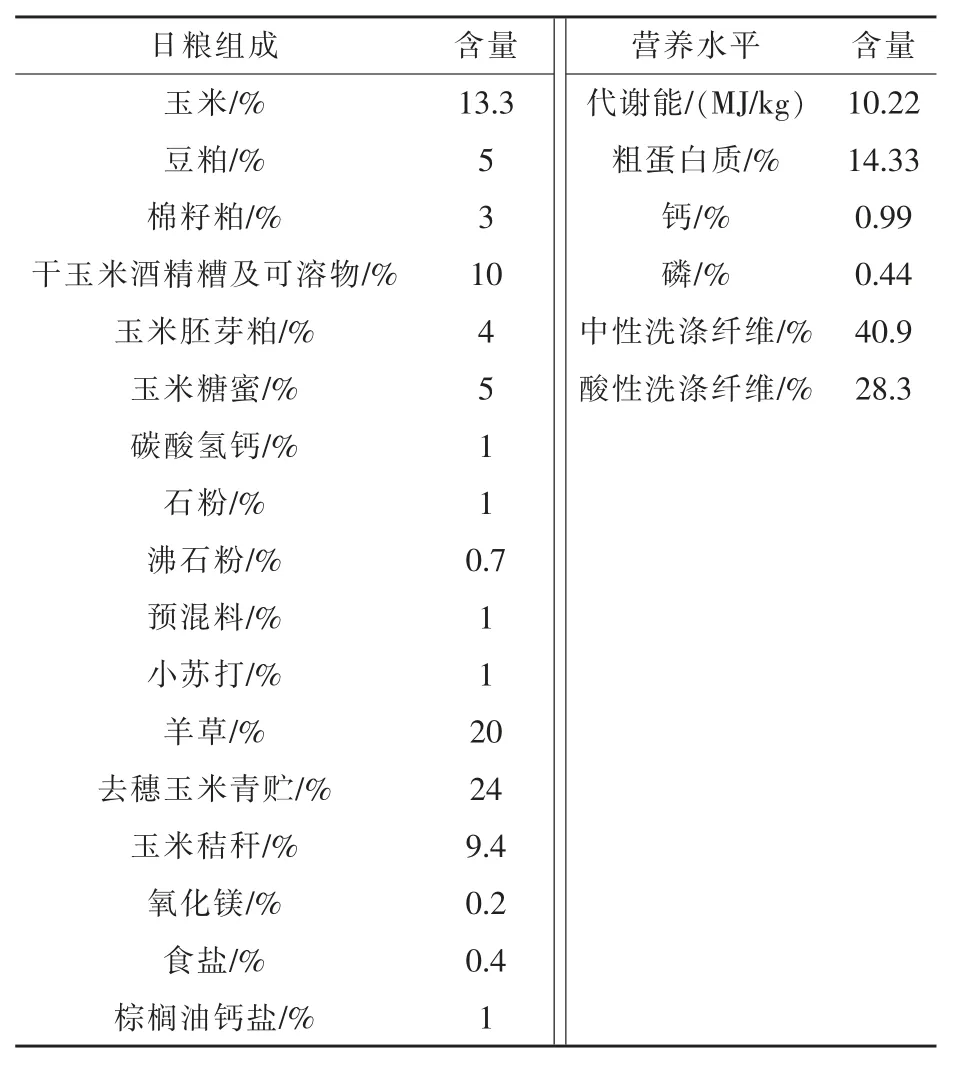
表2 日粮组成及营养水平(风干基础)
1.4 样品采集及分析 试验期间,分别在贮存后0、3、5、7、15、30 d开罐,首先对其表面及内部进行感官鉴定,对试验样品8个部位进行多点取样,每罐共取3份样品(100 g/份),其中一份用于常规数据测定,一份置于-20℃保存,用于发酵指标的测定,另一份样品用于有氧稳定性测定。
1.5 pH、氨态氮和霉菌毒素含量测定 试验样品的pH,氨态氮(NH3-N)和霉菌毒素含量均参照杨文艳等(2016)测定方法。
1.6 营养成分测定 首先测定初水,再粉碎后过40目筛。饲料中干物质(DM)、粗蛋白质(CP)、酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)均参照杨胜(1993)的饲料分析及饲料质量检测技术中的方法进行测定。
1.7 挥发性脂肪酸测定 参照赵红艳(2014)的测定方法,采用Agilent Technologies 7890A气相色谱仪进行测定。
1.8 有氧稳定性测定 将采集的1 kg TMR鲜样置于塑料皿中,使其与空气充分接触,置于22~25℃恒温条件下,每隔6 h对样品及室温进行检测并记录,若样品中心温度超出室温2℃,则判定其在有氧状态下不稳定。
1.9 数据分析 使用SPSS 19.0一般线性模型进行数据统计分析,采用Duncan’s法进行多重比较,以P<0.05作为差异显著判断标准,试验结果以“平均值±标准差”表示。
2 结果
2.1 不同贮存时间TMR霉菌毒素含量变化根据表3数据可知,各处理组黄曲霉毒素B1、玉米赤霉烯酮、赭曲霉毒素A含量均随时间增加而上升。在第5、7、15、30天,试验2组的黄曲霉毒素B1含量较对照组和试验1组分别显著降低77.46%和61.90%(5 d),80.51%和61.22%(7 d),95.92%和87.19%(15 d),97.18%和86.09%(30 d)(P<0.05)。各处理组赤霉烯酮含量结果显示,在第5、7、15、30天,试验1组和试验2组较对照组分别显著降低5.41%和18.04%(5 d),25.83%和39.56%(7 d),34.39%和44.55%(15 d),37.81%和47.68%(30 d)(P<0.05)。试验1组和试验2组的赭曲霉含量在第7、15、30天分别较对照组显著降低8.27%和4.94%(7 d),14.66%和29.83%(15 d),51.48%和64.09%(30 d)(P<0.05)。
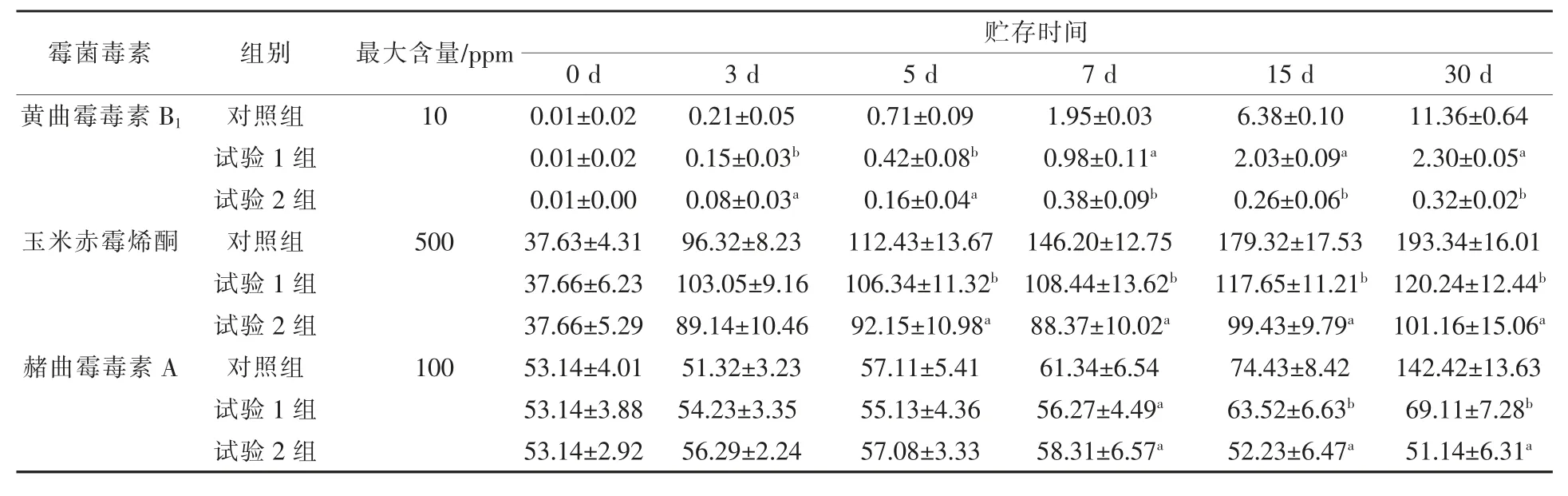
表3 不同贮存时间TMR霉菌毒素的变化
2.2 有氧稳定性、pH、氨态氮的变化 由表4可知,有氧稳定性结果中,TMR自5 d开始,试验组均表现出了较好的有氧稳定性,试验1组在30 d时有氧稳定性超过了7 d,而试验2组在15 d时,表现了更好的有氧稳定性。由TMR的pH结果可知,3组的pH均随着贮存时间增加而下降,贮存0~5 d,各组pH差异不显著(P>0.05)。在7、15 d和30 d,试验1组和2组pH分别较对照组显著下降3.25%和4.88%(7 d),2.49%和4.15%(15 d),5.67%和5.25%(30 d)(P<0.05)。在TMR的NH3-N含量结果中,各组NH3-N含量变化差异不显著(P>0.05),7~15 d时,有较高的变化,对照组与试验2组的NH3-N均随着时间的增加而升高,但试验1组在5~7 d和15~30 d时表现为下降。

表4 不同贮存时间TMR的有氧稳定性(6 h/单位)、pH及NH3-N变化
2.3 主要营养成分变化 根据表5中数据可知,TMR中DM含量随贮存时间的延长而减少,试验组较对照组,3~15 d期间DM变化差异不显著(P>0.05),而在30 d,试验1组和2组的DM较对照组显著降低1.39%和3.90%。CP结果显示,在15 d和30 d,对照组CP降解程度较试验1组和2组分别显著提高了2.64%和3.31%(P<0.05)。NDF和ADF结果显示,各组的NDF及ADF含量均随着时间的推移而降低,其中在第7、15天和30天,试验1组的NDF和ADF水平显著低于其他两组(P<0.05),且试验1组和试验2组的NDF水平较对照组分别显著降低了1.42%和3.45%(7 d),2.79%和4.82%(15 d),2.50%和6.16%(30 d)(P<0.05);试验1组和试验2组的ADF水平较对照组分别显著降低了2.52%和3.58%(7 d),3.58%和4.38%(15 d),5.49%和7.23%(30 d)(P<0.05)。在TMR有机酸结果中,各组随着贮存时间的增加,TMR中乙酸和丙酸的含量不断升高。其中,试验2组在5~30 d的各时间点的乙酸含量显著高于其他两组(P<0.05)。在第3、5、7、15天和30天,试验1组和试验2组乙酸含量较对照组显著提高了12.5%和55.36%(3 d),58.12%和71.36%(5 d),47.97%和65.48%(7 d),26.14%和50%(15 d),75.55%和127.38%(30 d)(P<0.05);试验2组在15 d和30 d的各时间点的丙酸含量显著高于其他两组(P<0.05);此外,在第5、7、15天和30天,试验1组和试验2组丙酸含量较对照组显著提高了48.28%和44.83%(5 d),117.24%和124.14%(7 d),293.75%和362.50%(15 d),429.73%和535.14%(30 d)(P<0.05)。

表5 不同贮存时间TMR营养成分的变化
3 讨论
TMR在生产应用中,由于其水分含量过高,易变质而导致的贮存品质低是阻碍其推广的重要原因(张广凤等,2014)。而霉菌毒素含量是影响贮存品质的关键因素。本试验中,试验组较对照组,3种霉菌毒素的含量均未超出国家标准,是因为在发酵过程中,复合益生菌与有害霉菌存在竞争作用,从而抑制了霉菌的生产,减少了毒素的产生(Kimura等,1988)。此外,在发酵过程中乳酸菌的生长与繁殖会对黄曲霉的生长有着显著的抑制作用,这与曹冬梅等(2008)、Maing等(1973)的研究结果一致。此外,试验2组对黄曲霉毒素B1和玉米赤霉烯酮的抑制效果显著优于试验1组。张秀江等(2016)研究表明,酵母菌对黄曲霉毒素B1有降解和脱除作用。也有研究证明了酵母菌对玉米赤霉烯酮有着同样的脱除作用(吴晖等,2009;Bakutis等,2005)。
添加复合益生菌发酵后的TMR的pH显著降低,NH3-N上升趋势缓慢,原因可能是益生菌群在发酵过程中会产生有机酸,使TMR的pH降低,这与此前其他研究结果基本一致(Li等,2013;王旭明等,2002)。在TMR酸化的同时,益生菌群也会与有害菌群竞争,抑制有害菌群的生长与繁殖,减少其对TMR中营养成分的消耗,进而降低NH3-N含量的上升,Weinberg等(2003)的研究也证明了这一点。有害菌群的减少也是TMR有氧稳定性明显延长的重要因素。
DM、CP、NDF、ADF是饲料营养价值评定的重要指标(曹志军等,2015)。本研究发现,复合微生物能够降低日粮DM的含量,可能是因为有益菌群在发酵的过程中,会将TMR中的一部分粗蛋白质降解为氨基酸及NPN等营养物质。其他的营养物质也会随着微生物发酵时间的增加而降低,从而导致TMR中DM的进一步下降(Joshi等,1997)。此外,复合微生物在降解TMR中粗蛋白质的同时,会生成一部分菌体蛋白,这也是本试验中试验组较对照组CP含量降低程度低的主要原因,菌体蛋白相较于TMR中粗蛋白质有着更高的吸收率和消化率(Smirnova等,2000)。益生菌在发酵过程中,通过自身的代谢活动,可以将纤维素和木质素等结构性纤维转化为吸收利用效率更高的低分子碳水化合物,从而降低试验组NDF和ADF水平。此外,本研究中,添加益生菌组的乙酸和丙酸含量显著高于其他组,尤其在额外补充酿酒酵母菌时,都显著高于其他两组,导致这样的结果的原因可能是酿酒酵母菌在发酵早期消耗氧气,促进其他产乙酸和丙酸等厌氧菌的增殖,加速发酵产物乙酸和丙酸的产生,这与Shao等(2002)研究结果一致。
4 结论
添加复合益生菌发酵,可以提高TMR的有氧稳定性,显著延长其贮存时间。综合霉菌毒素、营养成分、乙酸和丙酸品质指标,乳酸菌、枯草芽孢杆菌、蜡样芽孢杆菌、米曲霉和酵母菌复合物对TMR贮存品质的改善效果更好。

