西南地区男/女儿童血清抗米勒管激素水平医学参考值范围的建立*
邱喻兰,刘 杉
(重庆医科大学附属儿童医院核医学科/国家儿童健康与疾病临床医学研究中心/儿童发育疾病研究教育部重点实验室/儿科学重庆市重点实验室,重庆 400014)
抗米勒管激素(AMH)是转化因子β超家族(TGF-β)成员之一、相对分子质量为140 kDa的同型二聚体糖蛋白,其基因位于人类19号染色体短臂上19p 13.3[1]。在胎儿时期,AMH由未成熟的支持细胞(SC)分泌,对男性胎儿性别分化发育中的米勒管生理退化非常重要。AMH参与睾丸的发育和功能,影响男性生殖器官发育[2-3]。血清AMH水平在多种疾病的病理过程中有变化,例如男性假两性畸形持久米勒管永存综合征(PMDS)、雄激素不敏感综合征(AIS)、先天性促性腺功能减退症(HH)、隐睾病、精索静脉曲张等[4]。此外,对AMH进行评估可以预测男性青春期的临床发作,不需要重复进行临床检查或促性腺激素释放激素兴奋试验(GnRH试验)[5-6]。
在女性中,AMH由初级和小窦卵泡的颗粒细胞产生。这些卵泡来自胎儿后期的整个生殖期,通过卵泡成熟的自分泌和旁分泌调节因子[2]。由于残余卵泡池的大小取决于小窦卵泡,而小窦卵泡数量随时间递减,因此,女性血清中AMH水平呈特别的变化轨迹:在整个生育期逐渐递减,在绝经期急剧下降直至无法检测。这使得AMH可作为卵巢储备减少的一个临床监测指标[7]。女性血清中AMH的波动与多种病理情况相关。例如,多囊卵巢综合征(PCOS)的病理生理与过多的卵泡细胞会使AMH水平增加;特纳综合征患者的血清AMH水平极低,因其卵巢功能不全、卵泡加速丧失所致;AMH还在颗粒细胞肿瘤和辅助生殖技术(ART)领域有临床应用[8]。
目前,国内临床实验室所用的AMH检测参考区间大多数为成人版本[9-11],尚未建立男/女童各年龄段的血清AMH参考区间。不同地区、不同人群生理特征不同,正常值参考区间也不同。因此,有必要建立符合本地区临床的儿童血清AMH参考区间。本研究旨在建立西南地区不同年龄段男/女儿童血清AMH水平的参考区间,为临床提供可靠的诊疗预后依据。
1 资料与方法
1.1 一般资料
选取2020年4月至2022年1月健康体检儿童(0~16岁)的血清标本,经筛查后最终纳入269例合格儿童的血清AMH值。按照各年龄段,将儿童分为:男新生儿(≤28 d,n=20)、婴儿(>28 d至1岁,n=20)、幼儿(>1~3岁,n=21)、学龄前(>3~6岁,n=25)、学龄期(>6~10岁,n=29)和青春期(>10~16岁,n=25),女新生儿(n=20)、婴儿(n=20)、幼儿(n=22)、学龄前(n=23)、学龄期(n=23)和青春期(n=26)。纳入标准:(1)健康体检儿童;(2)儿保新生儿。排除标准:(1)有严重疾病,如肿瘤、癌症等;(2)有内分泌疾病,如甲状腺问题、糖尿病等;(3)有生长发育疾病,如矮小症、生长激素缺乏症等;(4)有严重感染性疾病,如甲型肝炎、乙型肝炎、获得性免疫缺陷综合征、梅毒、脓毒血症等;(5)性发育异常,如性早熟、小阴茎、隐睾、两性畸形、性别发育障碍等;(6)有其他综合征,如特纳综合征、多囊卵巢综合征等;(7)有其他系统疾病,如泌尿系统、呼吸系统、皮肤、自身免疫性疾病等。本研究经医学伦理委员会批准。
1.2 方法
采用新产业全自动化学发光免疫分析仪MAGLUMI X8进行检测。排除脂血、溶血等不合格标本,经离心后分离血清保存于-20 ℃冰箱中备用。采用化学发光免疫分析法测定血清AMH水平。
1.3 统计学处理
采用SPSS 19.0软件分析数据,Spearman相关系数分析年龄与血清AMH水平之间的相关性。采用ANOVA检验分析各年龄段计数资料的差异。正态分布的计量资料采用95%置信区间(95%CI)表示参考值范围;非正态分布的计量资料采用百分位数(P2.5,P97.5)表示参考范围。P<0.05表示差异有统计学意义。
2 结 果
2.1 性别与AMH水平的相关性分析
采用Spearman相关系数分析性别与AMH水平的相关性,男(r=-0.711)、女(r=0.347)均与AMH水平具有相关性(P<0.05)。
2.2 各年龄段AMH水平均值水平
结果显示,男新生儿的AMH水平呈正态分布,平均水平为83.47 ng/mL;女新生儿的AMH水平呈非正态分布,平均水平为0.14 ng/mL,中位水平为0.049 ng/mL。男婴儿、幼儿、学龄前、学龄期及青春期的AMH平均水平分别为123.13、145.84、105.88、71.16、26.70 ng/mL,其中男青春期AMH水平呈非正态分布(中位水平为20.60 ng/mL),其余各年龄段呈正态分布;女婴儿、幼儿、学龄前、学龄期及青春期的AMH水平呈正态分布,平均水平分别为1.58、1.85、2.53、3.16、2.76 ng/mL。各年龄段健康体检儿童血清AMH水平医学参考范围,见表1。
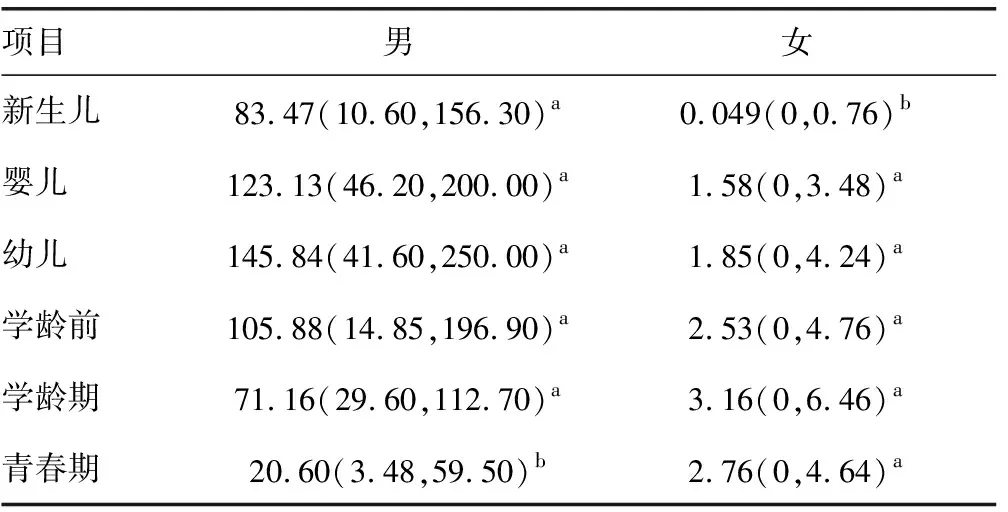
表1 健康体检儿童血清AMH水平医学参考范围(ng/mL)
2.3 AMH水平各年龄段频数分布
男童血清AMH水平各年龄段频数分布比较,差异有统计学意义(P<0.001)。男新生儿与婴儿、学龄前与幼儿、学龄前与学龄期、学龄期与青春期比较,差异均有统计学意义(P=0.002 2、0.009 3、0.002 1、0.000 1);男婴儿与幼儿比较,差异无统计学意义(P=0.129 5)。女童血清AMH水平各年龄段频数分布比较,差异有统计学意义(P<0.001)。女新生儿与婴儿、幼儿与学龄前、学龄前与学龄期、学龄期与青春期比较,差异均无统计学意义(P=0.511 9、0.067 3、0.606 4、0.386 6)。各年龄段结果分布,见图1。
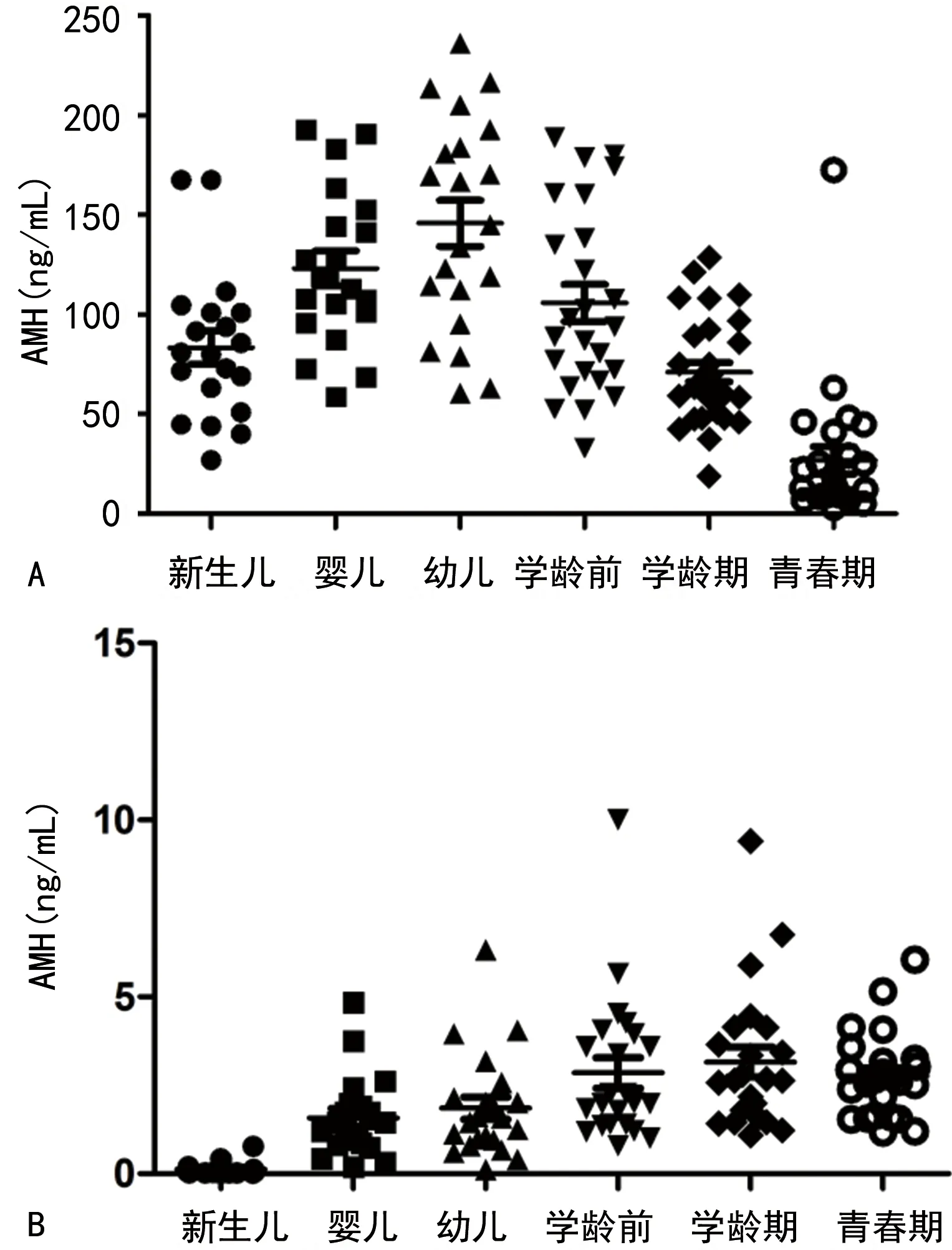
A:男童;B:女童。
3 讨 论
AMH是男性胎儿米勒管生理退化的必需物质。由于AMH是男性睾丸中SC的产物,在接受睾丸治疗的儿童中,AMH阳性检测可作为隐睾和性发育障碍中存在睾丸的证据[12-13]。男婴血清AMH水平在出生后1个月迅速上升,大约在6个月时达到峰值,随后在儿童时期缓慢下降,到青春期下降至低水平[3],这与本研究结果一致。本研究中,男婴儿期、幼儿、学龄前、学龄期的AMH平均水平分别为123.13、145.84、105.88、71.16 ng/mL,青春期下降至20.60 ng/mL。有研究称,青春期AMH水平下降是由于雄性激素受体(AR)在8岁时便表达于90%的SC细胞,随着下丘脑-垂体-性腺轴逐渐激活,睾丸内睾酮增加[5,14],导致AMH早期下降。因此,AMH可能成为年轻的低促性腺激素性性腺功能减退症(HH)患者在促性腺激素治疗中出现生精反应的一个预测标志物[15]。青春期后,AMH在精浆中的水平高于血清,精液AMH检测可作为促性腺激素治疗结果的预测工具[16]。本研究的数据按年龄分段,可为不同时期的儿童提供相应的正常参考,有助于不同年龄相关疾病的诊断治疗。
在女性中,AMH是由卵巢窦前卵泡和早期窦卵泡的颗粒细胞产生。与促性腺激素、抑制素B不同,血清AMH水平在整个月经周期内和月经周期间维持稳定,故AMH检验不受月经周期影响,AMH水平更便于监测[17]。本研究结果显示,女新生儿的AMH水平极低,平均水平为0.14 ng/mL,中位为0.049 ng/mL;女婴儿、幼儿、学龄前、学龄期、青春期AMH平均水平依次为1.58、1.85、2.53、3.16、2.76 ng/mL,缓慢上升且相对平稳。研究报道,PCOS患者血清AMH水平明显高于正常健康人群,其波动与性激素相关,AMH和性激素联合检测可用来判断卵巢功能状况[18-19]。特纳综合征患者从胎儿开始经历卵泡加速丧失,不可避免地导致不同年龄的卵巢功能不全和不孕,该类患者血清AMH水平极低[20-21]。本研究检测到数十例特纳综合征患者的血清AMH,其水平为0.02 ng/mL甚至低于检测限,本研究的正常参考值可以甄别出低水平的特纳综合征患者。此外,有研究报道,血清AMH和抑制素B水平有助于判断儿童中枢性性早熟进展,对鉴别进展型中枢性性早熟和缓慢进展型中枢性性早熟有一定价值[22]。有研究表明,身高、体重、血压和心率等对AMH的影响较小[10],因此本研究重点关注各年龄段血清AMH水平的参考范围。本研究收集了20例新生儿出生体重,结果显示,新生儿出生体重与其AMH水平并不相关(r=0.09,P=0.716)。由于健康体检新生儿标本收集较困难,有关出生体重与后期性腺发育、AMH水平变化的相关性,还需长期做进一步研究。
综上所述,本研究建立了西南地区各年龄段儿童血清AMH水平正常值参考区间,为男/女童各年龄段提供了正常参考,也为相关疾病提供了诊疗依据。

