免疫检查点抑制剂联合抗血管生成治疗中晚期肝癌安全性和临床效果的meta分析*
鲜 枫,张 弛,许国辉
(1.南充市中心医院肿瘤中心,四川南充 637000;2.电子科技大学医学院,成都 611731;3.四川省肿瘤医院介入科,成都 610042)
肝癌在全球所有恶性肿瘤的发病率居第6位,致死率居第3位[1]。在中国,超过78%的肝癌发生与乙型肝炎病毒感染相关,肝癌成为危害我国居民健康的主要问题之一。肝细胞癌(HCC)患者早期经过手术切除等手段可获得较高的5年生存率,而对于不可切除的晚期肝癌患者,治疗手段较为局限且疗效欠佳[2]。多靶点拮抗剂索拉菲尼和仑伐替尼作为晚期HCC的一线治疗药物,可在一定程度上控制肿瘤进展,但单药的疗效十分有限。近年来,免疫检查点抑制剂(ICIs)的出现为晚期肝癌的治疗提供了新方案。肝脏具有特殊的免疫抑制细胞体系,使其存在固有免疫耐受状态,因此肝癌在发生时会通过多途径导致肿瘤“免疫逃逸”。ICIs通过解除免疫抑制,对肝癌的治疗发挥作用,其中纳武利尤单抗及帕博利珠单抗被多个指南推荐为晚期肝癌二线治疗用药[3-4]。血管生成和免疫逃逸是肝癌发生和发展的两种途径[5],抗血管内皮生长(VEGF)疗法联合ICIs在理论上既可以促进HCC的血管正常化,也可以增强肿瘤免疫反应[6-9]。目前,部分临床研究表明ICIs联合抗血管新生药物可以提高对肝癌的治疗效果,但在该联合方案的疗效及安全性方面尚无一致性结论。本研究为全面评估ICIs联合抗血管药物治疗肝癌的疗效及安全性,对现有使用ICIs联合抗血管药物治疗肝癌的临床研究进行系统评价和荟萃分析,以提供科学依据。
1 资料与方法
1.1 文献纳入及排除标准
纳入标准:(1)分为ICIs联合抗血管生成组和对照组,治疗肝癌患者所开展的随机对照研究或回顾性研究,对照组为ICI单药或抗血管生成单药;(2)经手术或穿刺病理活检证实为原发性HCC;(3)所有研究必须提供无进展生存(PFS)时间、总生存(OS)时间、客观缓解率(ORR)、常见不良反应发生率等以下至少1个研究终点指标,文献中需报告PFS或OS时间及其危险比值(HR)、95%置信区间(95%CI);(4)对于同一作者的研究,仅纳入近期发表或样本量较大、质量较高的研究。排除标准:(1)研究类型未明确说明;(2)无法从文中提取有效结局数据;(3)重复文献;(4)无法获取全文;(5)样本量太小(组中病例数<5例);(6)文献中病例包含非原发性HCC患者或患者同时患有其他恶性肿瘤性疾病;(7)文献来源为综述、会议报告、个案报告等文献;(8)涉及药物不同剂量的自身对照及未设置对照组的研究。
1.2 文献检索
检索Pubmed、Embase、Web of science(WOS)、ClinicalTrails.gov、中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普-中文科技期刊系统数据库(VIP)、万方数据资源系统等数据库及中国临床实验注册中心(ChiCTR)。检索时限为从建库至2022年2月10日。英文检索词:“Liver Cancer”“Hepatocellular Carcinoma”“immune checkpoint inhibitors”“PD L1 Inhibitors”“Molecular Targeted Therapy”“Angiogenesis Inhibitors”“VEGFR targeted therapy”。中文检索词:“肝癌”“免疫检查点抑制剂”“PD-1/PD-L1抑制剂”“分子靶向药”“血管生成抑制剂”“VEGFR抑制剂”“血管内皮生长因子受体拮抗剂”。对检索结果的参考文献做进一步检索,以防漏检。
1.3 数据提取
由两名研究员分别对检索文献进行筛选,并且对文献的一般信息和研究信息进行提取,当存在争议时由通信作者决定是否纳入。文献筛选时先读取文献题目和摘要,在排除明显不相关的文献后,进行全文阅读以确定是否最终纳入。
资料提取的内容包括:(1)纳入研究的基本信息,包括研究题目、研究类型、第一作者、发表时间等;(2)研究对象的基本特征,包括样本总数、入组病例性别构成等;(3)干预的具体方法、随访时间等;(4)所关注的结局指标;(5)文献质量评价所需要的信息。
1.4 文献质量评估
按照Cochrane协作网编辑的“Cochrane偏倚风险评估工具”,按以下6个方面对纳入的研究进行评价:(1)随机分配方法;(2)分配方案隐蔽;(3)盲法;(4)结果数据的完整性;(5)选择性报告研究结果;(6)其他偏倚来源(样本量少、随访偏倚、干预措施偏倚等)。依据偏倚风险评估标准,对以上偏倚做出“低偏倚风险”“不清楚”和“高偏倚风险”判断,利用Rev Man 5.3软件绘制偏倚风险图。如遇到分歧,经两名研究者及通信作者讨论、协商后达成一致。
1.5 统计学处理
采用RevMan 5.3和Stata 14.0软件对提取的数据进行分析。二分类变量采用相对危险度(RR)及其95%CI对合并效应量进行统计分析。采用Mantel-Haenszel法进行分析,检验水准α=0.05。采用χ2检验对各组研究的异质性进行分析,当I2≤50%、P≥0.1时采用固定效应模型分析;当I2>50%、P<0.1时表明研究异质性大,采用随机效应模型分析。当检测到显著异质性时,通过拉贝图、星状图并排除个别研究后进行敏感性分析,以探寻异质性来源。当纳入文献少于3篇时,仅对结果做描述性分析。采用Begg法检测发表偏倚。
2 结 果
2.1 文献检索结果
在所选数据库中,共检索到文献2 656篇,按照纳入、排除标准进行筛选,剔除重复的803篇文献,通过阅读题目、摘要排除meta分析、系统评价、综述及动物实验类文献899篇、研究内容不吻合的文献914篇,阅读全文后最终纳入9篇文献[10-18],文献筛选流程见图1,纳入文献的基本特征见表1。
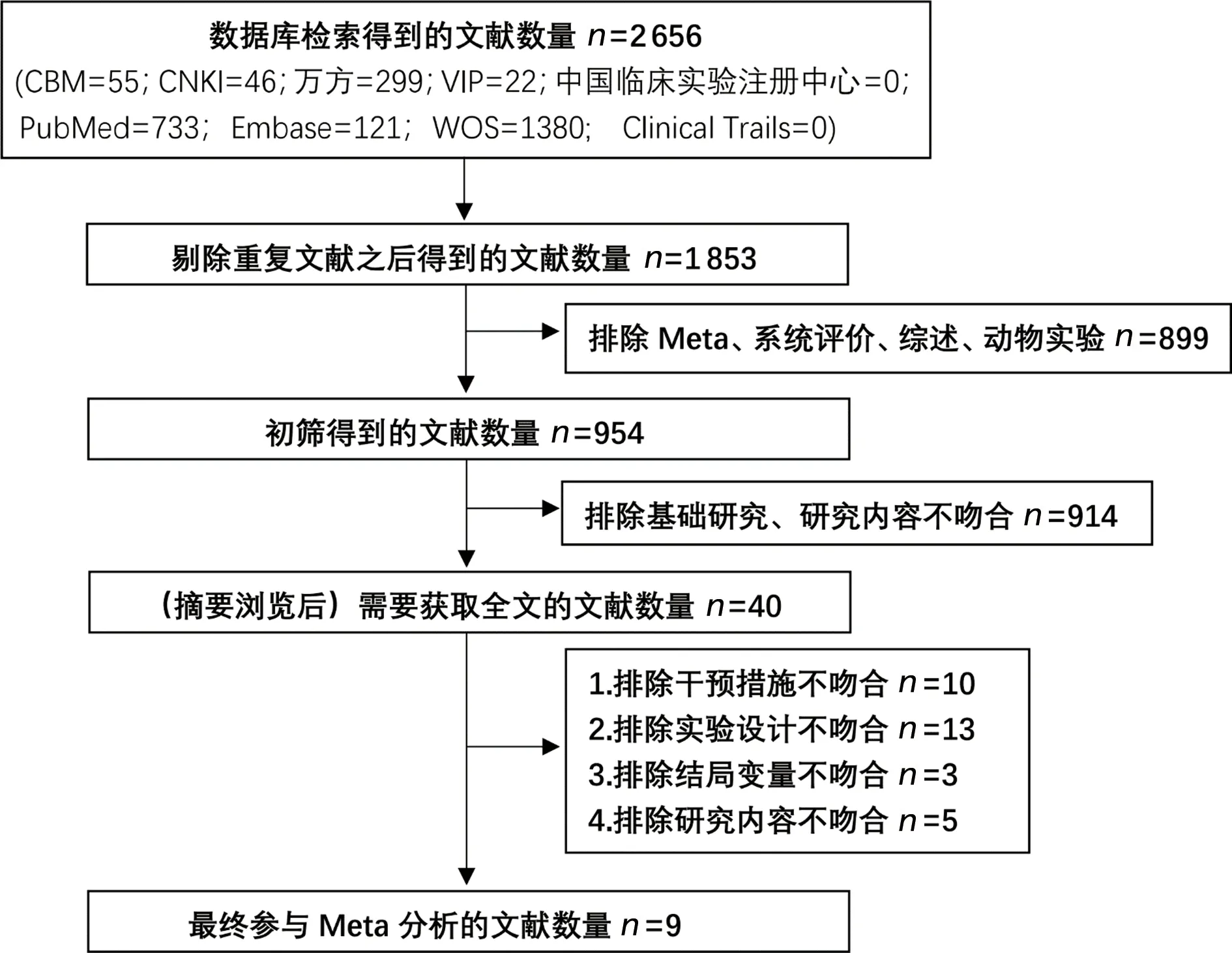
图1 文献筛选流程图
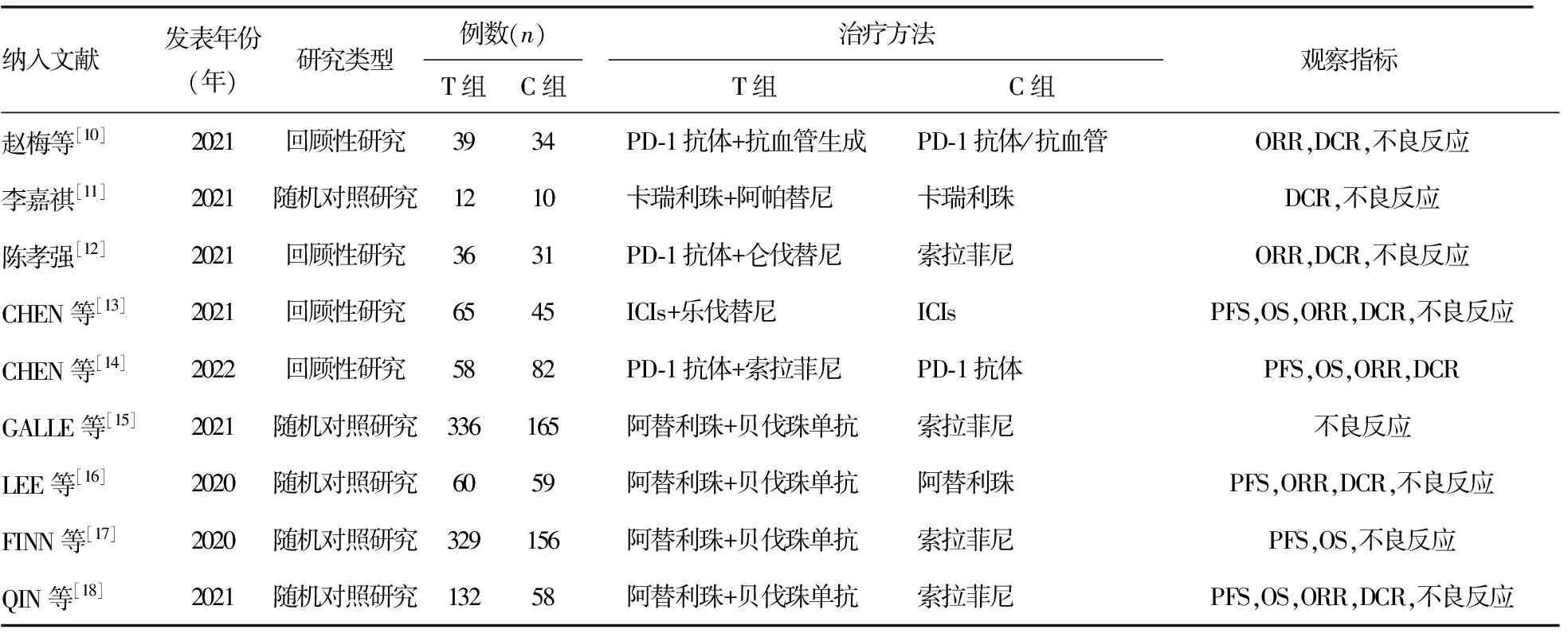
表1 纳入研究的基本特征
2.2 文献质量评估
对纳入的9篇文献进行方法学的质量评价,除其中4篇文献未明确提出是否采用随机分配原则外,其余文献均明确采用了随机分组原则;部分未表明是否采用分配隐藏及双盲。经绘制偏倚风险总结图后提示纳入文献质量整体较高,可用于二次分析,见图2。
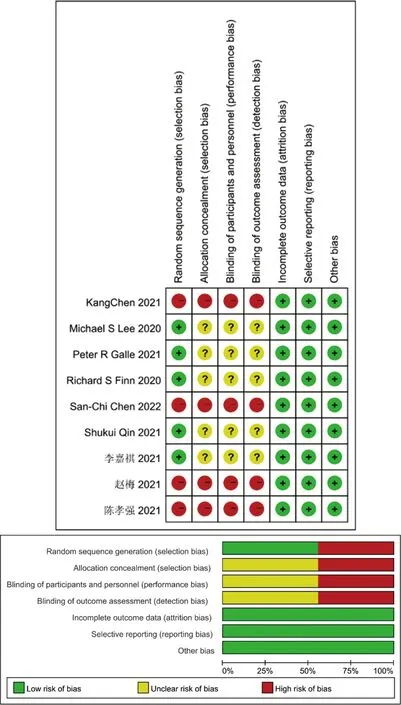
图2 偏倚风险评估图
2.3 疗效指标
2.3.1PFS
共纳入5篇文献[13-14,16-18],经过异质性检验(P=0.46,I2=0%),提示纳入研究文献之间无异质性,选择固定效应合并效应量。结果显示,ICIs联合抗血管生成药治疗晚期肝癌较单药治疗可显著延长患者的PFS(P<0.01),联合治疗组出现疾病进展的风险为对照组的0.46倍(HR=0.46,95%CI=0.36~0.60),见表2。
2.3.2OS
共纳入4篇文献[13-14,17-18],经过异质性检验(P=0.77,I2=0%),提示纳入研究文献之间无异质性,选择固定效应合并效应量。结果显示,ICIs联合抗血管生成药治疗晚期肝癌较单药治疗可显著延长患者的OS时间(P<0.01),联合治疗组出现疾病进展的风险为对照组的0.52倍(HR=0.52,95%CI=0.41~0.64),见表2。
2.3.3DCR
共纳入7篇文献[10-14,16,18],经过异质性检验(P=0.08,I2=47%),提示纳入研究文献之间存在显著异质性,进一步考察拉贝图和星状图(图3、4),结果提示,本研究纳入文献之间存在轻度异质性,选择随机效应合并效应量。结果显示,ICIs联合抗血管生成药治疗晚期肝癌较单药治疗的疾病控制率更高(P<0.01),联合治疗组的疾病控制率为对照组的1.36倍(RR=1.36,95%CI=1.14~1.63),见表2。
Event group 1:各研究中联合治疗组的疾病控制率;Event rate group 2:各研究中对照组的疾病控制率。
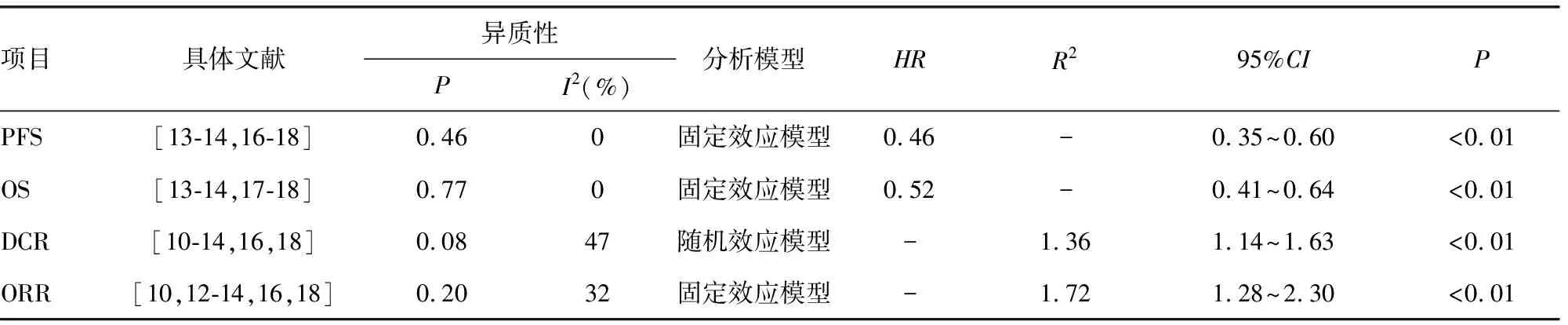
表2 ICIs联合抗血管生成与单药靶向组疗效指标meta分析结果
2.3.4ORR
共纳入6篇文献[10,12-14,16,18],经过异质性检验(P=0.20,I2=32%),选择固定效应合并效应量。结果显示,ICIs联合抗血管生成药治疗晚期肝癌较单药治疗可明显提高ORR(P<0.01),联合治疗组的客观缓解率为对照组的1.72倍(HR=1.72,95%CI=1.28~2.30),见表2。
2.4 安全性指标
2.4.1不良反应总发生率
共纳入4篇文献[10,12,17-18],经过异质性检验(P=0.92,I2=0%),各研究间不存在异质性,采用固定效应合并效应量。结果显示,联合治疗组发生不良反应的风险略低于对照组,但差异无统计学意义(RR=0.99,95%CI=0.95~1.03,P=0.59),见表3。纳入5篇文献[12,14,16-18],行重度不良反应(≥3级)发生率分析,各文献间无异质性(P=0.41,I2=0%),采用固定效应合并效应量。结果显示,联合治疗组中重度不良反应发生率略高于对照组,但差异无统计学意义(RR=1.12,95%CI=0.96~1.30,P=0.14),见表3。综上提示,ICIs联合抗血管治疗方案与单药治疗发生不良反应风险与≥3级不良反应的风险均无明显差异。
2.4.2高血压发生情况
共纳入5篇文献[11-13,16,18],各研究间不存在异质性(P=0.33,I2=13%),采用固定效应合并效应量。结果显示,联合治疗组发生高血压的风险高于对照组,差异有统计学意义(RR=1.58,95%CI=1.14~2.18,P<0.01),见表3)。
2.4.3甲状腺功能减退
共纳入3篇文献[10,12,18],各研究间不存在异质性(P=0.48,I2=0%),采用固定效应合并效应量。结果显示,联合治疗组发生甲状腺功能减退的风险高于对照组,差异有统计学意义(RR=6.79,95%CI=2.31~20.1,P<0.01),见表3。
2.4.4其他不良反应事件
通过亚组分析,在恶心呕吐、乏力、腹泻、皮疹、食欲减退、转氨酶上升等不良反应方面,联合治疗组和对照组之间比较差异均无统计学意义(P>0.05),见表3。
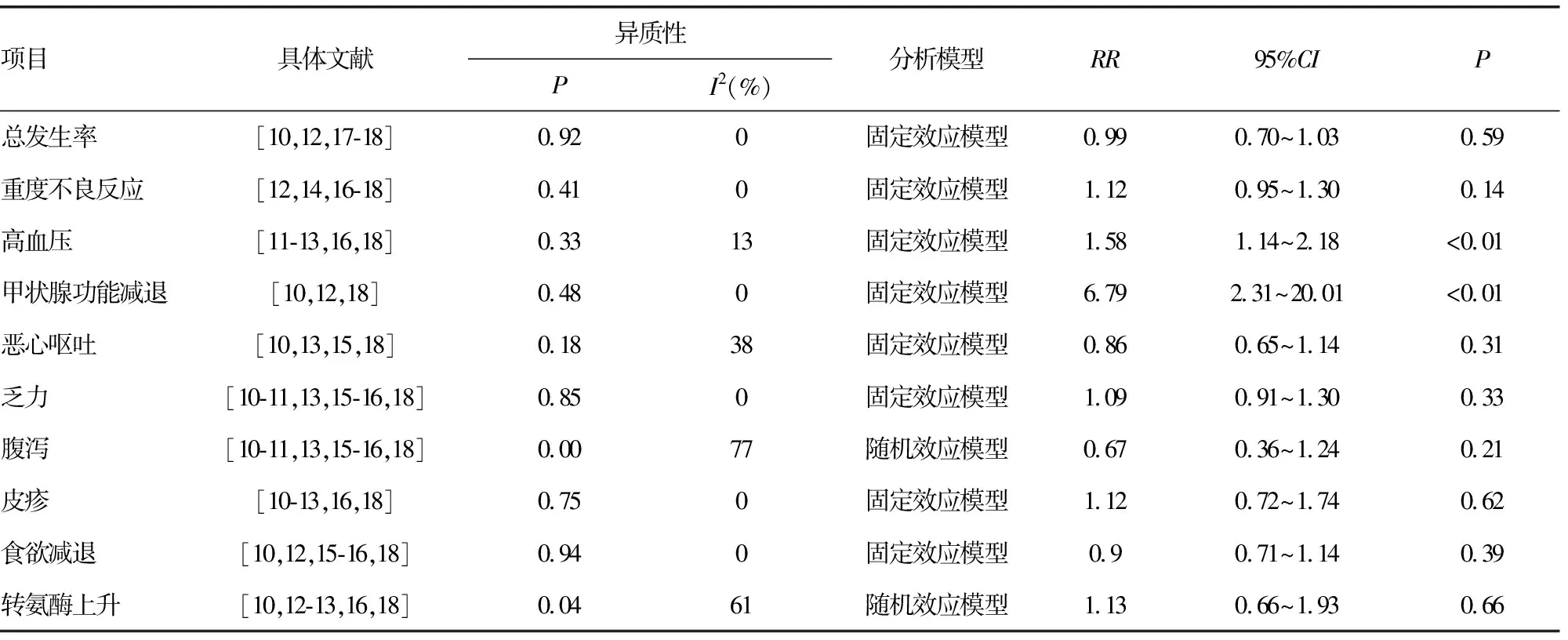
表3 ICIs联合抗血管生成与单药靶向组其他部分不良反应的meta分析结果
3 讨 论
HCC是肝癌最常见的病理类型(占肝癌的80%~90%),其发病隐匿,超过70%的患者无手术指征,以姑息治疗为主[19-20]。索拉非尼、卡博替尼等常被用于一、二线姑息治疗[21],但不能避免耐药的发生。ICIs的开发对HCC治疗具有重大突破。研究显示,纳武利尤单抗和帕博利珠单抗治疗索拉非尼耐药患者的ORR和OS时间分别为15%和1年[4];替西木单抗治疗丙型肝炎相关HCC的ORR达到17.6%,中位PFS时间为6.48个月,且治疗期间丙型肝炎病毒载量降低[22]。尽管显示出部分临床获益,但ICIs单药在一线、二线治疗中的疗效仍欠佳[23-24]。因此,临床将HCC的治疗目光转向了联合用药,抗血管生成和免疫疗法的联合成为焦点。抗血管生成联合ICIs是基于促血管生成因子VEGF-A在肿瘤中的免疫调节作用,抑制VEGF-A表达会导致肿瘤组织内CD8+细胞数量的增加和肿瘤生长减缓[25-27]。
研究证实,VEGF-A在促肿瘤“免疫逃逸”方面具有关键作用,对非小细胞肺癌、肾细胞癌及结直肠癌模型的研究表明,抗VEGF-A可使血管正常化并增加T细胞对肿瘤的浸润[28]。在肾细胞癌模型中,经贝伐珠单抗(抗VEGF)联合阿替利珠单抗(抗PD-L1)治疗后,检测结果显示主要组织相容性复合体(MHC)Ⅰ类、Th1标志物和效应T细胞在肿瘤内的表达增加[29]。
本次纳入评价的文献中,联合用药组的PFS、OS时间均显著长于对照组,这与合并后的效应量一致,提示ICIs联合抗血管药物可以显著改善HCC患者的预后。各纳入文献均展示了良好的疾病控制率,仅部分研究[12]显示联合用药组的ORR虽优于对照组,但差异无统计学意义(P>0.05),经合并效应量后得出ICIs联合抗血管药物治疗HCC可以显著提高DCR和ORR,这与ZUCMAN-ROSSI等[30]及KUDO等[31]的研究结果一致。试验过程中,部分结果显示联合用药组的不良反应发生率高于对照组,但经过效应量合并后显示,两者间的总不良反应发生率及胃肠道反应、皮疹、食欲减退、肝功能损伤、严重不良反应发生率差异均无统计学意义(P>0.05),但联合用药组的高血压、甲状腺功能减退发生率显著高于对照组,可能是因为ICIs和抗血管药物均会导致血压升高及甲状腺功能损伤,这与相关研究观察到的不良反应发生情况一致[30-32]。本研究结果表明,ICIs联合抗血管生成治疗HCC可改善患者预后、提高疾病控制率,但需密切防控高血压、甲状腺功能减退的发生。研究对于纳入的文献进行了严格筛查,尽可能减少偏倚的发生,但本研究仍存在纳入研究较少、纳入研究随访时间较短的缺陷,需多中心、大样本量研究进一步证实。
综上所述,ICIs联合抗血管生成治疗是不可切除或中晚期肝癌的一种有效治疗方式,且在一线治疗中疗效明显优于索拉非尼单药,有望延长复发性肝癌患者的PFS时间,打破治疗困局,为患者治疗方案的选择开辟新途径。

